2. 天津市胸科医院病理科 300222;
3. 天津市胸科医院心血管外科 300222
2. Department of Pathology, Tianjin Chest Hospital, Tianjin 300222, China;
3. Department of Cardiovascular Surgery, Tianjin Chest Hospital, Tianjin 300222, China
心肌梗死(myocardial infarction,MI)是冠状动脉粥样硬化性心脏病的一种类型。近年来我国心血管疾病死亡率仍呈明显上升趋势,且主要由缺血性心脏病死亡增加所致[1]。虽然经皮冠状动脉介入及冠状动脉旁路移植术等的应用使心肌梗死的短期病死率有所下降,但心肌组织缺血损伤及缺血再灌注损伤仍然无法逆转,因此探寻心肌梗死后的病理机制,寻找新的治疗靶点一直是心血管疾病研究的热点。
血管内皮生长因子(vascular endothelial growth factor, VEGF)是体内重要的活性物质,通过与其受体结合而发挥生物学作用,具有促进血管内皮细胞增生、新生血管形成的作用。VEGF家族包括:VEGF-A、胎盘生长因子、VEGF-B、VEGF-C、VEGF-D、VEGF-E及蛇毒血管内皮生长因子,其中VEGF165是VEGF-A的一个亚型,作用广泛[2]。近年来研究发现,VEGF可以显著增加梗死缺血的心肌组织血管生成[3];增加微血管密度,抑制急性期细胞因子的释放,但不能改善心脏功能[4]。目前关于VEGF基因治疗缺血性心肌病的临床研究所取得的结论并不一致[5]。推测VEGF很可能在心肌梗死治疗中发挥双重作用,一方面促进新生血管生成,改善局部缺血;另一方面也增加血管的通透性,诱发炎性细胞聚集;VEGF还可能增加基质金属蛋白酶活性,影响损伤后重塑[6]。组织基质金属蛋白酶抑制剂(tissue inhibitor of metalloproteinase, TIMP)是内源性基质金属蛋白酶(matrix metalloproteases,MMPs)的抑制剂,包括TIMP-1、TIMP-2、TIMP-3、TIMP-4四个亚型。TIMP-1主要通过抑制MMP2/9活性,调控细胞外基质的平衡,参与心室重塑[7]。目前联合VEGF165和TIMP-1基因过表达对心肌梗死的作用尚未见报道。本研究应用重组腺病毒Ad-hVEGF165和重组腺病毒Ad-hTIMP-1联合感染心肌梗死大鼠,观察其对心肌梗死的作用并探讨其可能机制。
1 材料与方法 1.1 主要试剂及仪器Ad-hVEGF165、Ad-hTIMP-1及Ad-Track由天津市心血管病研究所制备。RNA抽提试剂盒(大连宝生物工程有限公司)。M-MLV逆转录酶(Promega公司,美国)。实时荧光定量PCR引物(北京奥科鼎盛生物科技有限公司,表 1)。SYBR® Premix Ex TaqTM(Takara公司,日本)。hVEGF165兔单克隆抗体(Epitomics公司,美国,稀释比例1∶100)。hTIMP-1兔单克隆抗体(Abcam公司,美国,稀释比例1∶200)。Bax兔单克隆抗体(Epitomics公司,美国,稀释比例1∶500)。Caspase-3兔单克隆抗体抗体(Abcam公司,美国,稀释度比例1∶300)。Bcl-2兔单克隆抗体(CST公司,美国,稀释比例1∶400)。小动物呼吸机(SAR-1000,CWE公司,美国)。超声心动仪(SequoiaslZ型,ACCUSON公司,美国)。实时荧光定量PCR仪(7500,ABI公司,美国)。
| 基因名称 | 引物序列 | 片段大小(bp) | 退火温度(℃) |
| Bax | 正向:5’-CCAAGAAGCTGAGCGAGTGTCTC-3’反向:5’-AGTTGCCATCAGCAAACATGTCA-3’ | 199 | 60 |
| Caspase-3 | 正向:5’-AGC ACT GGA ATG TCA GCT CGC-3’反向:5’-CAGGTCCACAGGTCCGTTCG-3’ | 237 | 60 |
| Bad | 正向:5’-CAGATCCCAGAGTTTGAGCC-3’反向:5’-GTCTCCATAGTCCCAGCGC-3’ | 188 | 62 |
| Bcl-2 | 正向:5’-GGAGCGTCAACAGGGAGATG-3’反向:5’-GCAGGTCTGCTGACCTCACTTG-3’ | 257 | 60 |
| GAPDH | 正向:5’- ACAAAGTGGACATTGTTGCC-3’反向:5’-AAACATGGTGGTGAAGACGC-3’ | 238 | * |
| 注:Bax为Bcl-2相关X蛋白,Caspase-3为半胱氨酸天冬氨酸蛋白酶3,Bad为Bal-xl/Bcl-2相关死亡促进因子,Bcl-2为B细胞淋巴瘤/白血病-2,GAPDH为磷酸甘油醛脱氢酶。*指退火温度与目的基因一致 | |||
健康雄性清洁级Wistar大鼠30只,8周龄,体质量250~300 g,购自中国人民解放军军事医学科学院实验动物中心,许可证号:SCXK-(军)2007-004。本研究中关于动物的处置和操作符合动物实验福利与伦理的基本要求。实验动物于温度18~25℃,湿度40%~60%,12 h明暗交替,标准鼠料,自由进食、水,饲养1周后,行冠状动脉左前降支结扎致心肌梗死造模手术及假手术。手术日大鼠称重,2 mL/kg混合麻醉剂(氯胺酮复合咪唑安定2∶1)腹腔注射,2 mg/kg阿托品肌肉注射,待大鼠出现肌力下降、软瘫等麻醉反应后,固定于动物手术台上。常规备皮。四肢皮下连接电极,监测术中心电、心率变化,记录术前、结扎即刻、结扎后10 min心电图。气管插管,连接小动物呼吸机,调整呼吸频率70次/min,潮气量7~8 mL,呼吸比1∶2。常规消毒,胸骨左侧0.5 cm处纵行切口,上至两前肢连线,下至第5肋间,以止血钳钝性分离皮下组织、深浅筋膜、胸大肌与前锯肌,暴露左侧肋骨和肋间肌,钝性分离第四、五肋间肌进胸,弯钳横、纵方向扩大创口,剪破心包,左手挤压,右手以止血钳协助扩张胸壁创口,将心脏挤出胸腔,于肺动脉圆锥和左心耳交界,左心耳下缘5 mm处,以5-0无创缝合针穿过约1/3~1/2层心肌。以心电图出现ST段弓背抬高,Q波或T波倒置,局部心肌变白为结扎成功标志。迅速将心脏送回胸腔,增加潮气量至10 mL,挤压胸腔,排出残留空气,关闭胸腔,逐层缝合肌肉、皮肤。动物恢复自主呼吸后,撤除呼吸机,拔掉气管插管。肌肉注射青霉素20万单位预防感染。假手术组只穿线不结扎,余同模型组。
1.3 实验动物分组及给药方法24只心肌梗死大鼠,用随机数字表法分为4组,Ad-hVEGF165与Ad-hTIMP-1联合感染组(hVEGF165-hTIMP-1组),Ad-hVEGF165感染组(Ad-hVEGF165组),Ad-hTIMP-1感染组(Ad-hTIMP-1组),空载病毒对照组(Ad-Track组),每组6只;另6只大鼠为假手术对照组(Sham组)。hVEGF165-hTIMP-1组在冠脉结扎10~15 min后,再次撑开胸腔,暴露心脏,以结扎点位中心,直径5 mm,微量注射器四点注射Ad-VEGF165(0.5×1010 VP/100 μL,50 μL)与Ad-hTIMP-1(0.5×1010 VP/100 μL,50 μL)混合病毒生理盐水稀释液,共100 μL,每点25 μL。Ad-hVEGF165组、Ad-hTIMP-1组及Ad-Track组以相同方式注射相应病毒生理盐水稀释液1×1010 VP/100 μL,共100 μL。Sham组未予任何处理。实验动物于相同条件饲养4周。
1.4 超声心动图检测4周后实验动物行超声心动图检测。大鼠称重,氯胺酮复合咪唑安定(2∶1)混合麻醉剂20 μL/kg腹腔注射麻醉,仰卧位固定,胸部备皮。探头频率8.0 MHz,图像深度2.5 cm,双盲法专人检测。于胸骨旁左室长轴面,M型超声图像测量左室舒张末期内径(left ventricular end diastolic dimension,LVEDD)、左室收缩末期内径(left ventricular end systolic dimension,LVESD),每一指标均取3个连续心动周期的平均值。机器自动计算出左室射血分数(left ventricular ejection fraction,LVEF)、左室短轴缩短率(left ventricular fractional shortening,LVFS)。
1.5 实验动物标本留存超声心动图检测后,处死实验动物,迅速分离心脏,沿大血管根部剪断,预冷生理盐水清洗,滤纸吸干。取部分心肌组织,-80℃保存,行分子生物学检测;部分心脏组织10%中性福尔马林固定,行病理学检测。
1.6 实时荧光定量PCR检测称取心肌梗死区域心肌组织60~70 mg,严格按照RNA抽提试剂盒操作,提取心肌组织总RNA,逆转录,获得cDNA。GenBank上查找相关基因序列,按照引物设计原则设计引物序列,见表 1。反应体系(20 μL):2×SYBR Green Mix 10 μL,ROXⅡ0.4 μL,5 μmol/L上下游引物各0.5 μL,ddH2O 7.6 μL,cDNA 1.0 μL。反应条件:95℃ 30 s;95℃ 5 s,60℃ 34 s,40个循环;融解曲线分析。采用2-ΔΔCt计算凋亡相关因子mRNA相对表达量。
1.7 免疫组织化学检测实验动物心脏组织取材后,经固定、包埋、切片,行免疫组织化学染色。常规脱腊;高压锅修复150℃,7 min;5% BSA 37℃,封闭40 min;一抗4℃过夜;DAB法显色。组织切片中胞质染为淡黄色至棕褐色为阳性细胞。以染色强度结合阳性细胞百分比对染色结果行半定量分析。染色强度以多数细胞呈现的颜色计分:无着色记0分,淡黄色记1分,棕黄色记2分,棕褐色记3分。取5个400高倍视野,每个高倍视野下计数100个同类细胞阳性细胞百分数,计算染色强度与阳性细胞百分比分值乘积。
1.8 统计学方法应用SPSS 16.0统计软件,对计量资料先行正态性检验,计量资料均采用均数±标准差(Mean±SD)表示,多组间均数比较采用单因素方差分析,两两比较采用LSD-t检验,以P < 0.05为差异有统计学意义。
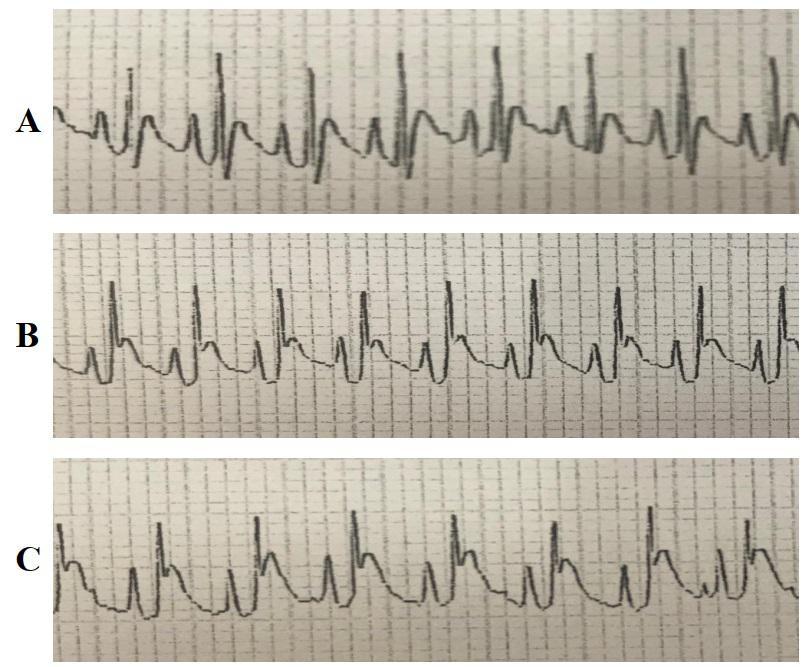
2 结果 2.1 心肌梗死大鼠心电图检测结果心电图显示,与手术前比较,冠状动脉前降支结扎即刻心率减慢,QRS波群间期延长,R峰峰值降低,ST段抬高,与T波融合。冠状动脉前降支结扎后10 min,与结扎即刻心电图无明显改变。见图 1。
|
| A:手术前;B:结扎即刻;C:结扎后10 min 图 1 心肌梗死大鼠心电图变化 Fig 1 Changes of electrocardiogram in rats with myocardial infarction |
|
|
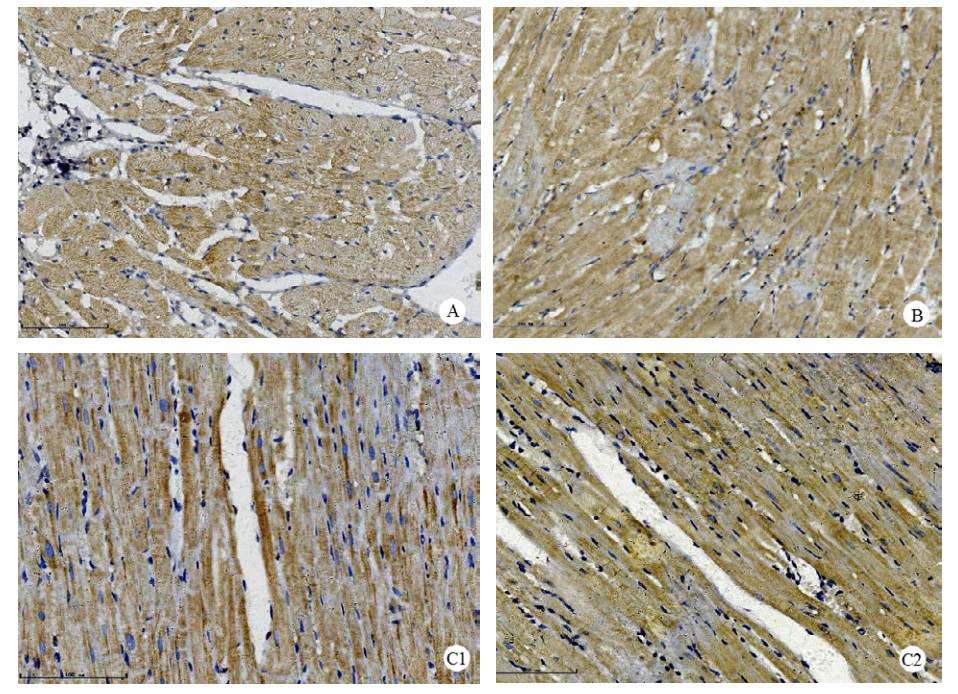
心肌组织注射重组腺病毒Ad-hVEGF165和/或Ad-hTIMP-1后,Ad-hVEGF165组在大鼠心肌细胞胞浆内可见hVEGF165的阳性颗粒(图 2A);Ad-hTIMP-1组在大鼠心肌细胞胞浆内可见hTIMP-1的阳性颗粒(图 2B)。hVEGF165-hTIMP-1组大鼠心肌组织两张连续切片,一张行hVEGF165免疫组化染色,心肌细胞胞浆内可见hVEGF165的阳性颗粒(图 2C1);另一张行hTIMP-1免疫组化染色,心肌细胞胞浆内可见hTIMP-1的阳性颗粒(图 2C2)。
|
| A:Ad-hVEGF165组hVEGF165;B:Ad-hTIMP-1组hTIMP-1;C1:hVEGF165-hTIMP-1组hVEGF165;C2:hVEGF165-hTIMP-1组hTIMP-1 图 2 大鼠心肌组织hVEGF165和(或)hTIMP-1蛋白免疫组化染色图(× 200) Fig 2 Immunohistochemical staining graphs of hVEGF165 and/or hTIMP-1 protein in myocardial tissueofrats(×200) |
|
|
单因素方差分析表明,hVEGF165-hTIMP-1组、Ad-hVEGF165组、Ad-hTIMP-1组、Ad-Track组及Sham组间超声心动图检测LVEF、LVFS差异有统计学意义(P < 0.05),HR、LVEDD及LVESD差异无统计学意义(P > 0.05)。与Sham组比较,Ad-Track组HR、LVEDD、LVESD增加(P < 0.05),LVEF、LVFS显著降低(P < 0.01);Ad-hVEGF165组LVEF、LVFS降低(P < 0.05)。与Ad-Track组比较hVEGF165-hTIMP-1组LVEF、LVFS升高(P < 0.05),LVEDD、LVESD降低(P < 0.05)。与Ad-hVEGF165组比较,hVEGF165-hTIMP1组LVEF、LVFS升高(P < 0.05),见表 2。
| 组别 | HR(次/min) | LVEDD(mm) | LVESD(mm) | LVEF(%) | LVFS(%) |
| Sham组 | 433.16±17.86 | 6.20±0.45 | 4.06±0.70 | 72.78±5.44 | 37.20±4.71 |
| Ad-Track组 | 480.83±24.09a | 6.88±0.44a | 4.85±0.42b | 62.70±3.17b | 29.52±1.88b |
| Ad-hVEGF165组 | 462.33±33.10 | 6.50±0.55 | 4.50±0.55 | 64.65±4.00a | 30.95±2.57a |
| Ad-hTIMP-1组 | 456.17±31.17 | 6.37±0.49 | 4.30±0.41 | 66.33±8.01 | 32.40±6.04 |
| hVEGF165-hTIMP-1组 | 450.83±56.08 | 6.22±0.39c | 4.13±0.23c | 71.50±6.23de | 36.17±5.27 ce |
| F值 | 1.476 | 2.027 | 2.629 | 3.782 | 3.422 |
| P值 | 0.239 | 0.123 | 0.058 | 0.015 | 0.023 |
| 注:HR为心率;LVEDD为左室舒张末期内径,LVESD为左室收缩末期内径,LVEF为左室射血分数,LVFS为左室短轴缩短率。与Sham组比较,aP < 0.05,bP < 0.01;与Ad-Track组比较,cP < 0.05,dP < 0.01;与Ad-hVEGF165组比较,eP < 0.05 | |||||
单因素方差分析实时荧光定量PCR结果显示hVEGF165-hTIMP-1组、Ad-hVEGF165组、Ad-hTIMP-1组、Ad-Track组及Sham组之间心肌组织Bax、Caspase-3、Bcl-2 mRNA表达差异有统计学意义(P < 0.05)。与Sham组比较,Ad-Track组心肌组织Bax(P < 0.01)、Caspase-3(P < 0.01)及Bad(P < 0.05)mRNA表达增高,Bcl-2 mRNA表达显著降低(P < 0.01);Ad-hTIMP-1组心肌组织Bax(P < 0.01)、Caspase-3(P < 0.05)mRNA表达增高。与Ad-Track组比较,hVEGF165-hTIMP-1组、Ad-hTIMP-1组心肌组织Bax、Caspase-3、Bad mRNA表达均降低(P < 0.05),Bcl-2 mRNA表达均升高(P < 0.05);Ad-hVEGF165组心肌组织Bax、Bad mRNA表达均降低(P < 0.05),Bcl-2 mRNA表达均升高(P < 0.05)。hVEGF165-hTIMP-1组心肌组织Bax、Caspase-3 mRNA表达较Ad-hVEGF165组降低(P < 0.05)。hVEGF165-hTIMP-1组、Ad-hVEGF165组、Ad-hTIMP-1组、Ad-Track组及Sham组之间心肌组织Bad mRNA表达差异无统计学意义(P > 0.05)。见表 3。
| 组别 | Bax | Caspase3 | Bad | Bcl-2 |
| Sham组 | 0.91 ± 0.31 | 0.92 ± 0.50 | 1.00 ± 0.37 | 1.07 ± 0.41 |
| Ad-Track组 | 5.09 ± 1.65b | 1.89 ± 0.55b | 2.89±0.32a | 0.49 ± 0.06b |
| Ad-hVEGF165组 | 3.24±2.05bc | 1.56 ± 0.45a | 1.16±0.34c | 0.84±0.14c |
| Ad-hTIMP-1组 | 2.51±0.89d | 1.20 ± 0.33c | 1.14±0.25c | 0.85±0.23c |
| hVEGF165-hTIMP-1组 | 1.24±0.89de | 0.95 ± 0.12de | 0.93±0.29c | 1.02±0.40d |
| F值 | 8.964 | 5.490 | 1.913 | 3.822 |
| P值 | < 0.01 | 0.003 | 0.140 | 0.015 |
| 注:Bax为Bcl-2相关X蛋白,Caspase-3为半胱氨酸天冬氨酸蛋白酶3,Bad为Bal-xl/Bcl-2相关死亡促进因子,Bcl-2为B细胞淋巴瘤/白血病-2。与Sham组比较,aP < 0.05,bP < 0.01;与Ad-Track组比较,cP < 0.05,dP < 0.01;与Ad-hVEGF165组比较,eP < 0.05 | ||||
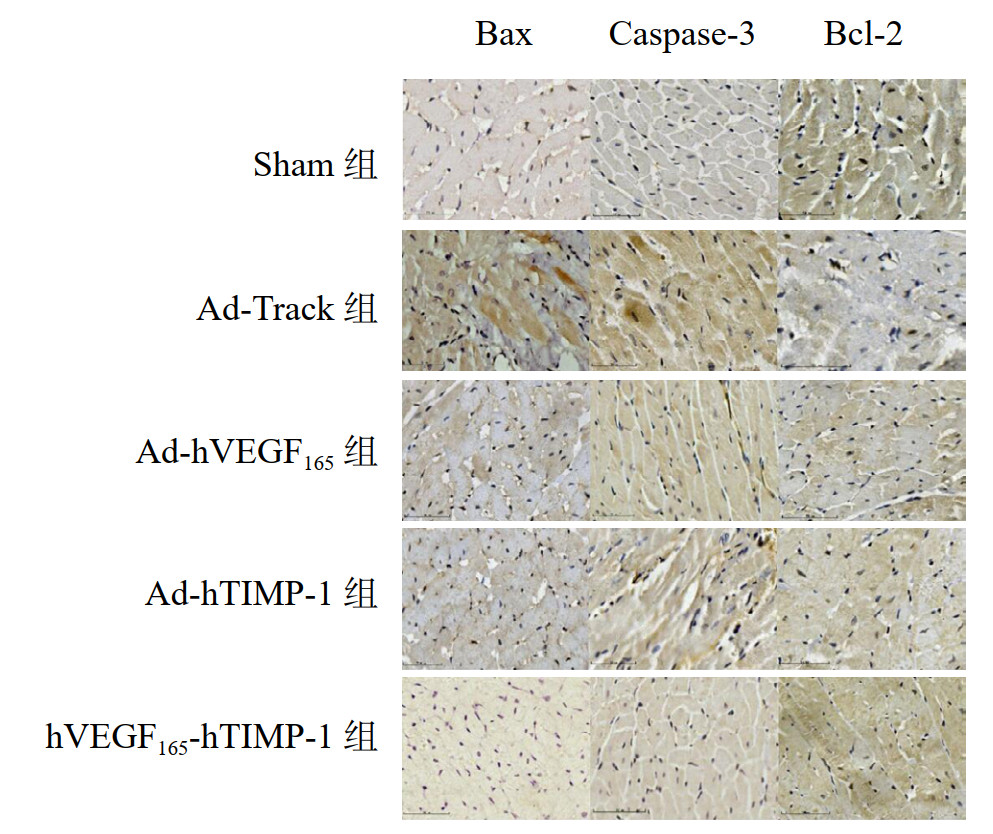
免疫组化结果显示,Ad-hVEGF165组、Ad-hTIMP-1组及Ad-Track组Bax和Caspase-3蛋白表达均显著高于Sham组(P < 0.01);hVEGF165-hTIMP-1组、Ad-hVEGF165组及Ad-hTIMP-1组Bax和Caspase-3蛋白表达显著低于Ad-Track组(P < 0.01);hVEGF165-hTIMP-1组Bax和Caspase-3蛋白表达显著低于Ad-hVEGF165组和Ad-hTIMP-1组(P < 0.01),与Sham组差异无统计学意义。Ad-hVEGF165组、Ad-hTIMP-1组及Ad-Track组Bcl-2蛋白表达低于Sham组(P < 0.05);hVEGF165-hTIMP-1组、Ad-hVEGF165组及Ad-hTIMP-1组Bcl-2蛋白表达显著高于Ad-Track组(P < 0.01);hVEGF165-hTIMP-1组Bcl-2蛋白表达高于Ad-hVEGF165组和Ad-hTIMP-1组(P < 0.05),与Sham组差异无统计学意义(P > 0.05)。见图 3、表 4。
|
| Bax为Bcl-2相关X蛋白,Caspase-3为半胱氨酸天冬氨酸蛋白酶3,Bcl-2为B细胞淋巴瘤/白血病-2 图 3 各组大鼠心肌组织凋亡相关蛋白免疫组化染色图(× 200) Fig 3 Immunohistochemical staining graphsof apoptosis-related proteins in myocardial tissue of rats in each group (× 200) |
|
|
| 组别 | Bax | Caspase-3 | Bcl-2 |
| Sham组 | 0.44 ± 0.09 | 0.32 ± 0.04 | 2.01 ± 0.12 |
| Ad-Track组 | 1.92 ± 0.17b | 1.86 ± 0.24b | 0.24 ± 0.04b |
| Ad-hVEGF165组 | 1.32±0.10bc | 1.30 ± 0.13bc | 1.36±0.22bc |
| Ad-hTIMP-1组 | 1.26±0.14bc | 1.17 ± 0.10bc | 1.54±0.17ac |
| hVEGF165-hTIMP-1组 | 0.59±0.12cdf | 0.48 ± 0.11acdf | 1.97±0.47cde |
| F值 | 113.645 | 99.219 | 40.712 |
| P值 | < 0.01 | < 0.01 | < 0.01 |
| 注:Bax为Bcl-2相关X蛋白,Caspase-3为半胱氨酸天冬氨酸蛋白酶3,Bcl-2为B细胞淋巴瘤/白血病-2。与Sham组比较,aP < 0.05,bP < 0.01;与Ad-Track组比较,cP < 0.01;与Ad-hVEGF165组比较,dP < 0.01;与Ad-hTIMP1组比较,eP < 0.05,fP < 0.01 | |||
本研究应用Ad-hVEGF165与Ad-hTIMP-1联合感染心肌梗死大鼠,4周后应用超声心动图检测各组大鼠心脏功能,发现hVEGF165-hTIMP-1组LVEF、LVFS较Ad-Track组及Ad-hVEGF165组升高,提示Ad-hVEGF165与Ad-hTIMP-1联合应用能够改善心肌梗死大鼠的心脏收缩功能。本研究还发现Ad-hVEGF165与Ad-hTIMP-1联合治疗心肌梗死大鼠可抑制促凋亡蛋白Bax和Caspase-3的表达,促进抗凋亡蛋白Bcl-2的表达,且效果优于单独给予Ad-hVEGF165或Ad-hTIMP-1。
研究证实,心肌梗死后早期心肌细胞即发生凋亡反应[8],凋亡反应在心肌梗死的病理过程中发挥重要作用[9]。细胞凋亡与心梗后梗死区域面积、左室重塑程度及心梗后早期心衰的发展均密切相关[10]。细胞凋亡主要有两个起始途径:外部途径(死亡受体介导途径)和内部途径(线粒体介导途径),最后均会激活终末途径,从而引发细胞凋亡级联反应。其中线粒体途径在诱导细胞凋亡中发挥较为重要的作用[11]。Bcl-2家族是调控线粒体途径凋亡的关键蛋白家族,该家族包括多种相互拮抗的蛋白,促凋亡蛋白有Bax、Bad、Bak等;抗凋亡蛋白有Bcl-2、Bcl-xl等,这两组Bcl-2家族蛋白之间的平衡决定了细胞内环境的稳定性。Caspases-3是细胞凋亡终末途径的重要蛋白[12]。研究发现VEGF不仅具有促进血管内皮细胞增生、迁移、形成新生血管的作用,亦具有抗凋亡作用。Friehs等[13]报道,心包注射VEGF165可以改善心力衰竭大鼠心肌收缩功能,促进毛细血管生长,减少细胞凋亡。Yin等[14]发现,急性心肌梗死大鼠心肌注射VEGF165 cDNA可以显著抑制心肌细胞p53、Fas和Bax蛋白的表达,增加Bcl-2蛋白的表达。此外,Chen等[15]报道腺病毒介导过表达hVEGF165可以显著抑制多柔比星诱导的心肌细胞凋亡反应,降低Caspase-3表达,增加Bcl-2的表达,并且提出VEGF165可能是通过激活Akt/NF-κB/Bcl-2信号通路发挥抗凋亡作用的。TIMP-1同样具有多种生物活性,除了抑制MMP的作用外,近年来研究发现TIMP-1还具有调节细胞增殖生长、抗血管形成、抗凋亡的作用。研究报道TIMP-1可以抑制作用足以阻止X射线诱导的毛细血管细胞凋亡反应[16]。Xi等[17]报道TIMP-1可能通过TIMP-1/CD44/PTEN/AKT信号通路抑制成骨细胞增殖、分化和细胞凋亡反应。目前TIMP-1对于心肌组织细胞凋亡作用的研究很少。本研究将Ad-hTIMP-1和Ad-hVEGF165共同注射于大鼠心梗区域,观察两者的相互作用。结果显示联合感染后促凋亡因子Bax、Caspase-3的表达均低于单独使用hVEGF165或hTIMP-1。
综上所述,联合hVEGF165和hTIMP-1基因过表达可改善大鼠心肌梗死后心脏收缩功能,其机制可能与抑制心肌细胞凋亡,减少促凋亡因子Bax和Caspase-3,增加抑制凋亡因子Bcl-2表达有关,且hVEGF165和hTIMP-1联合应用可能具有协同作用。一方面VEGF165与TIMP-1两者均有抑制凋亡的作用,二者可能通过共同的AKT信号途径而达到协同抗凋亡作用;另一方面TIMP-1可能抑制了由VEGF165诱发的炎性反应,也抵消了VEGF增加MMP活性的作用,从而发挥了更强的治疗心肌梗死的效果。但两者相互作用的具体机制仍待进一步研究。
利益冲突 所有作者均声明不存在利益冲突
| [1] | 刘明波, 王文, 周脉耕. 2004-2010年中国心血管病死亡流行趋势分析[J]. 中华流行病学杂志, 2013, 10(34): 985-988. DOI:10.3760/cma.j.issn.0254-6450.2013.10.010 |
| [2] | Takahashi H, Shibuya M. The vascular endothelial growth factor (VEGF)/VEGF receptor system and its role under physiological and pathological conditions[J]. Clin Sci, 2005, 109(3): 227-241. DOI:10.1042/cs20040370 |
| [3] | Zou J, Fei Q, Xiao H, et al. VEGF-A promotes angiogenesis after acute myocardial infarction through increasing ROS production and enhancing ER stress-mediated autophagy[J]. J Cell Physiol, 2019, 234(10): 17690-17703. DOI:10.1002/jcp.28395 |
| [4] | Uitterdijk A, Springeling T, van Kranenbur M, et al. VEGF165A microsphere therapy for myocardial infarction suppresses acute cytokine release and increases microvascular density but does not improve cardiac function[J]. Am J Physiol Heart Circ Physiol, 2015, 309(3): H396-H406. DOI:10.1152/ajpheart.00698.2014 |
| [5] | Giacca M, Zacchigna S. VEGF gene therapy: therapeutic angiogenesis in the clinic and beyond[J]. Gene Ther, 2012, 19(6): 622-629. DOI:10.1038/gt.2012.17 |
| [6] | 韦方, 耿庆山, 张斌, 等. 转血管内皮生长因子基因对血管损伤后重塑的影响及机制探讨[J]. 中华病理学杂志, 2002, 31(5): 436-439. DOI:10.3760/j.issn:0529-5807.2002.05.013 |
| [7] | Laronha H, Caldeira J. Structure and function of human matrix metalloproteinases[J]. Cells, 2020, 9(5): 1076. DOI:10.3390/cells9051076 |
| [8] | Ma H, Liu S, Xiong Y, et al. PET imaging of cardiomyocyte apoptosis in a rat myocardial infarction model[J]. Apoptosis, 2018, 23(7/8): 396-407. DOI:10.1007/s10495-018-1463-x |
| [9] | Smit M, Coetzee AR, Lochner A. The pathophysiology of myocardial ischemia and perioperative myocardial infarction[J]. J Cardiothorac Vasc Anesth, 2020, 34(9): 2501-2512. DOI:10.1053/j.jvca.2019.10.005 |
| [10] | Teringova E, Tousek P. Apoptosis in ischemic heart disease[J]. J Transl Med, 2017, 15(1): 87. DOI:10.1186/s12967-017-1191-y |
| [11] | Edlich F. BCL-2 proteins and apoptosis: Recent insights and unknowns[J]. Biochem Biophys Res Commun, 2018, 500(1): 26-34. DOI:10.1016/j.bbrc.2017.06.190 |
| [12] | Singh R, Letai A, Sarosiek K. Regulation of apoptosis in health and disease: the balancing act of BCL-2 family proteins[J]. Nat Rev Mol Cell Biol, 2019, 20(3): 175-193. DOI:10.1038/s41580-018-0089-8 |
| [13] | Friehs I, Barillas R, Vasilyev NV, et al. Vascular endothelial growth factor prevents apoptosis and preserves contractile function in hypertrophied infant heart[J]. Circulation, 2006, 114(1 suppl): Ⅰ290-Ⅰ295. DOI:10.1161/circulationaha.105.001289 |
| [14] | Yin RX, Yang DZ, Wu H, et al. Intramyocardial injection of vascular endothelial growth factor gene improves cardiac performance and inhibits cardiomyocyte apoptosis[J]. Eur J Heart Fail, 2007, 9(4): 343-351. DOI:10.1016/j.ejheart.2006.10.007 |
| [15] | Chen T, Zhou G, Zhu Q, et al. Overexpression of vascular endothelial growth factor 165 (VEGF165) protects cardiomyocytes against doxorubicin-induced apoptosis[J]. J Chemother, 2010, 22(6): 402-406. DOI:10.1179/joc.2010.22.6.402 |
| [16] | Vorotnikova E, Tries M, Braunhut S. Retinoids and TIMP1 prevent radiation-induced apoptosis of capillary endothelial cells[J]. Radiat Res, 2004, 161(2): 174-184. DOI:10.1667/rr3107 |
| [17] | Xi Y, Huang H, Zhao Z, et al. Tissue inhibitor of metalloproteinase 1 suppresses growth and differentiation of osteoblasts and differentiation of osteoclasts by targeting the AKT pathway[J]. Exp Cell Res, 2020, 389(2): 111930. DOI:10.1016/j.yexcr.2020.111930 |
 2021, Vol. 30
2021, Vol. 30




