脓毒症发生时,肠黏膜屏障功能最易受损,容易发生肠道菌群及内毒素移位,导致患者感染加重,甚至启动多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS),导致死亡[1], 因此保护肠道屏障功能是防治脓毒症的重点。研究表明[2],肠黏膜屏障功能受损与炎症反应密切相关,高迁移率族蛋白B1(high mobility group box 1,HMGB1)是一种晚期炎症介质[3],可诱导晚期糖基化终末产物受体(receptor for advanced glycation end-products, RAGE)、Toll样受体(toll-like receptor,TLR)2/4、核因子κB(nuclear factor kappa-B,NF-κB)等炎症因子释放导致多器官功能损伤,但其在脓毒症肠黏膜屏障损伤中的作用及机制仍需进一步探讨。人结肠腺癌细胞(Caco-2细胞)可以在体外构建单层肠上皮细胞,是目前研究肠道通透性最常用的方法。本研究以脂多糖(lipopolysaccharide,LPS)建立体外肠上皮屏障功能损伤模型,观察肠上皮屏障功能损伤、肠道HMGB1及下游核转录因子NF-κB的表达,进一步探讨脓毒症时肠黏膜屏障损伤发病机制。
1 材料与方法 1.1 实验材料DMEM高糖培养基(美国Corning公司),胎牛血清(美国Corning公司),Transwell小室(美国Corning公司),EVOM细胞电阻仪(美国WPI公司);LPS(美国Sigma公司),丙酮酸乙酯(EP)(美国Sigma公司),FITC-右旋糖酐(美国Sigma公司);兔抗人Occludin单克隆抗体(美国Abcam公司),兔抗鼠HMGB1,NF-κB单克隆抗体(美国Abcam公司);GoTag qPCR Master Mix荧光定量染料法预混液(美国Promega公司);引物序列由上海生工生物工程有限公司提供。Caco-2细胞株购自中国科学院昆明动物所细胞库,实验在云南大学附属医院中心实验室完成。
1.2 Caco-2细胞培养Caco-2细胞用含20%胎牛血清、100 U/mL青霉素、100 U/mL链霉素的DMEM培养液,在37℃,5%CO2及饱和湿度培养箱中培养,每日倒置显微镜观察细胞两次,隔天换新鲜培养液一次,待细胞生长至80%密度时,开始传代,也可按照实验需要消化细胞传代培养。
1.3 Caco-2细胞单层上皮屏障模型的建立取对数生长期的Caco-2细胞,将200 μL细胞悬液接种于Transwell-24小室内,外室内加600 μL培养液,接种后1周内每48 h换液,l周以后每24 h换液,每天在倒镜显微镜下观察小室内细胞生长状况,定期用EVOM细胞电阻仪检测小室底层细胞TEER值(具体操作方法参照仪器说明书),当TEER值稳定达到500 Ω•cm2以上时[4],可认为模型建立成功。
1.4 实验分组当Caco-2细胞单层上皮屏障模型的建立时,将其分为对照组,LPS组,LPS+EP组,对照组加入等容量的DMEM高糖培养,LPS和EP的处理浓度分别为100 μg/mL、50μg/mL。
1.5 Caco-2细胞肠屏障跨上皮电阻(TEER)测定将Caco-2细胞在Transwell-24孔小室内培养,应用跨膜电阻仪自隔日测定TEER值,当TEER值稳定达到500 Ω•cm2以上时,给予以上分组及处理,分别于处理后12、24、48、72 h用EVOM电阻仪测量各组TEER值,选取Transwell小室三个不同方向的点,检测该点的TEER,每点重复测3次,取平均值即为该样品的TEER值,结果以Ω•cm表示(具体操作方法参照仪器说明书)。
1.6 Caco-2细胞单层通透性FITC-右旋糖酐通透率的检测同上述将Caco-2细胞在Transwell-24孔小室内培养,TEER值达500 Ω·cm 2后分别给予以上分组及处理,于37 ℃温箱中孵育24 h。将小室中的培养液吸出,无菌PBS润洗3次,向内室中加入100 μL的FITC-右旋糖酐(1 g/L),外室中加入无菌PBS。避光置于培养箱中孵育1 h,1 h后在外室取样100 μL于黑色96孔板中,实用酶标仪检测FITC的荧光强度值。
1.7 蛋白免疫印迹技术(Western blot)检测Occludin、HMGB1、NF-κB蛋白表达将Caco-2细胞接种到6孔板中,带细胞融合达80%时,分别给予以上分组及处理,24 h用细胞裂解液提取细胞蛋白,BCA法检测蛋白浓度。蛋白经SDS-PAGE电泳,转膜,5%的脱脂奶粉封闭1 h,加入相应的一抗(抗Occludin、抗HMGB1、抗NF-κB抗体)稀释液,4℃过夜孵育,TBST洗膜后,加入辣根过氧化物酶标记的二抗稀释液室温孵育2 h,化学发光法进行显影。β-actin作为内参,运用Image-J软件测量条带的灰度值,进行数据统计分析。
1.8 实时聚合酶链式反应(RT-PCR)检测Occludin、HMGB1、NF-κB mRNA表达将培养的Caco-2细胞制成单细胞悬液,细胞计数后以1×106个/mL密度均匀接种于6孔板,2 mL/孔。细胞融合达80 %时,分别给予以上分组及处理,培养24 h后用Trizol试剂法提取细胞总RNA。按照用逆转录试剂盒逆转录成cDNA,RT-PCR仪上扩增。引物序列为:Occludin引物正向:5’-CTTCCTCTGAGTGCTGGGTG-3’,反向:5’-TACGCAGGAGTGGAAACTCG-3’;HMGB引物正向:5’-CTTTTGTCCACACACCCTGC-3’,向:5’-CCCATGGTGTGACAGAATTG-3’;NF-κB引物正向:5’-AACGCGTCCAACCTGAAGAT-3’,向:5’-TGTCTGTGAACATCCGTGGG-3’;2-ΔΔCt法对基因表达量进行相对定量。
1.9 统计学方法应用SPSS 21.0软件进行统计学处理。计量资料以均数±标准差(Mean±SD)表示,多组间比较采用单因素方差分析,组间两两比较采用t检验,以P < 0.05为差异有统计学意义。
2 结果 2.1 Caco-2细胞形态学倒置显微镜下可见对照组细胞贴壁良好,均匀分布,形态规则呈铁丝网状,漂浮细胞少,换液后消除,见图 1A。LPS组较对照组细胞数目显著减少,分布不均匀,细胞形态不规则,部分区域有缺失空洞形成,沿孔洞边缘有片状单层细胞飘起,培养液浑浊,漂浮细胞多,见图 1B。LPS+EP组较LPS组细胞数量多,漂浮细胞较少,折光性较好,培养液较清,见图 1C。
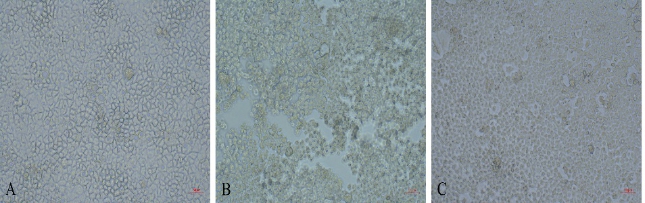
|
| 图 1 各组Caco-2细胞24 h形态图(100×) Fig 1 Caco-2 cell images after 24 h of treament in each group(100×) |
|
|
对照组TEER值随时间的变化趋势不明显,LPS组及LPS+EP组各时间段随着时间的推移,TEER值明显减少,变化趋势相同,LPS组较LPS+EP组下降趋势更明显,说明LPS+EP组随肠黏膜屏障有保护作用。各时间点上两组间比较,与对照组相比,LPS组12、24、48、72 h TEER值明显减少,差异有统计学意义(P < 0.01),与LPS组比较,LPS+ EP组12、24、48、72 h TEER值增加(P < 0.01)。见表 1。
| 组别 | TEER值(Ω·cm2) | ||||
| 0 h | 12 h | 24 h | 48 h | 72 h | |
| 对照组 | 522.22±22.93 | 514.22±12.59 | 521.65±13.35 | 523.99±8.18 | 491.21±6.72 |
| LPS组 | 424.53±10.45 | 304.96±9.69a | 276.21±7.82a | 206.64±15.85a | 156.33±10.8a |
| LPS+EP组 | 533.31±9.45b | 519.00±5.66 b | 504.69±8.57 b | 453.65±10.74b | 385.28±7.57b |
| 注:与对照组同时间段比较,aP < 0.05;与LPS组同时间段比较,bP < 0.05;TEER,跨上皮电阻 | |||||
与对照组相比,LPS组24 h时FITC-右旋糖酐通透率明显增加,差异有统计学意义(P < 0.01);与LPS组比较,LPS+EP组24 h时FITC-右旋糖酐通透率明显减少,差异有统计学意义(P < 0.01),见表 2。
| 组别 | PF(24 h) |
| 对照组 | 1.04±0.06 |
| LPS组 | 2.58±0.07a |
| LPS+EP组 | 1.23±0.11b |
| 注:与对照组比较,aP < 0.05;与LPS组比较,bP < 0.05 | |
与对照组相比,LPS组Occludin蛋白及mRNA表达减少,HMGB1、NF-κB蛋白及mRNA表达明显增加,差异均有统计学意义(P < 0.01);与LPS组比较,Occludin蛋白及mRNA表达明显增加,HMGB1、NF-κB蛋白及mRNA表达减少,差异均有统计学意义(P < 0.01),见表 3、图 2。
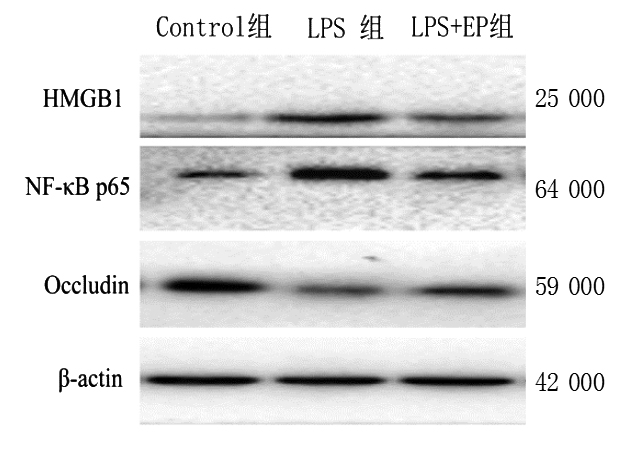
|
| Occludin为缝隙连接蛋白,HMGB1为高迁移率族蛋白B1,NF-κB p65为核因子-κB 图 2 各组Caco-2细胞HMGB1、NF-κB、Occludin蛋白的表达 Fig 2 The relative protein expression levels of Occludin, HMGB1, NF-κB in Caco-2 cells of each group |
|
|
与对照组相比,LPS组Occludin mRNA表达减少,HMGB1、NF-κB mRNA表达水平明显增加,差异均有统计学意义(P < 0.05);与LPS组比较,LPS+ EP组Occludin mRNA表达明显增加,HMGB1、NF-κB mRNA表达水平减少,差异均有统计学意义(P < 0.05),见表 4。
| 组别 | HMGB1 | NF-κB | Occludin |
| 对照组 | 0.253±0.009 | 0.526±0.039 | 1.078±0.051 |
| LPS组 | 0.772±0.031a | 1.212±0.063a | 0.643±0.041a |
| LPS+EP组 | 0.482±0.053ab | 0.783±0.043ab | 0.825±0.046ab |
| 注:与对照组比较,aP < 0.05;与LPS组比较,bP < 0.05 | |||
| 组别 | HMGB1 | NF-κB | Occludin |
| 对照组 | 1.054±0.028 | 1.039±0.013 | 1.033±0.017 |
| LPS组 | 2.519±0.136a | 3.592±0.169a | 0.559±0.046a |
| LPS+EP组 | 1.804±0.029ab | 2.286±0.373ab | 0.824±0.046ab |
| 注:与对照组比较,aP < 0.05;与LPS组比较,bP < 0.05 | |||
脓毒症时,肠屏障功能最易受损,而肠屏障功能受损后所导致的菌群移位又可加重脓毒症的发生发展,因此如何维持肠屏障功能的正常已成为危重症领域研究的热点[5-7]。脓毒症时炎症细胞因子在肠黏膜屏障损伤中具有重要作用,HMGB1作为一种晚期炎症细胞因子,因出现时间晚且持续时间长,可能成为潜在干预目标[4, 8]。目前研究表明,HMGB1可释放到胞外,发挥促炎因子的功能,其表达增加可影响肠黏膜生物屏障功能[9-10],但具体机制仍不清楚。本研究以Caco-2细胞为研究对象,以LPS构建体外单层肠上皮细胞损伤模型,建模成功后研究其肠屏障的损伤是否与“晚期”炎症因子HMGB1及下游信号分子NF-κB表达有关,旨在为脓毒症肠屏障功能损伤的治疗提供新的思路。
本研究选用的Caco-2细胞系在体外培养条件下可以分化形成单层的细胞,表达成熟的上皮细胞的形态和功能,是目前研究肠道通透性最常用和最成功的方法[11-12]。Caco-2细胞单层上皮屏障建立前需要对模型进行完整性评价,常用的指标是检测TEER值,不同实验条件下Caco-2细胞测得的TEER值差别较大,本实验参考Natoli等[4]构建Caco-2细胞肠上皮转运模型,当TEER值稳定在 > 500 Ω•cm2,可认为肠上皮单层细胞模型构建成功。因此本实验Caco-2细胞单层上皮模型的TEER值达到500 Ω•cm2,可认为肠上皮模型构建成功。此外FITC-右旋糖酐通过率也是检测Caco-2细胞单层屏障功能变化的敏感指标。TEER值的降低和FITC-右旋糖酐增高,提示对物质的通透性升高,肠上皮屏障完整性破坏。本实验中LPS处理后,Caco-2单层细胞屏障的TEER值降低,FITC-右旋糖酐通过率显著增高,提示Caco-2单层细胞屏障受到了的损伤,且随着时间的延长损伤有加重的趋势(时间依赖性)。而在LPS处理同时加入HMGB1的抑制剂丙酮酸乙酯时TEER值增加,FITC-右旋糖酐通过率明显减少,说明HMGB1的抑制剂能改善LPS对肠上皮屏障完整性的有害刺激,具有保护作用。肠黏膜上皮屏障主要由上皮细胞及其周围的紧密连接所组成。紧密连接(tight junction,TJ)是构成上皮细胞屏障功能最重要的结构,而Occludin蛋白是紧密连接结构中目前了解最为清楚的跨膜蛋白,Occludin蛋白的缺失可引起肠上皮屏障通透性的增高,因此Occludin蛋白是检测紧密连接损伤的常用指标[13]。本实验结果显示,LPS能显著降低Caco-2细胞内Occludin蛋白及mRNA的表达,HMGB1的抑制剂丙酮酸乙酯能改善LPS引起的Occludin蛋白和mRNA的表达。说明LPS可导致细胞间紧密连接结构破坏,而丙酮酸乙酯对LPS诱导的Caco-2细胞间紧密连接结构破坏具有保护作用。
脓毒症时产生的大量炎症细胞因子介导了肠黏膜屏障损伤。HMGB1作为一种晚期炎症介质参与了脓毒症的发病过程,是脓毒症促炎细胞因子反应网络的中心环节,其表达增加与脏器功能损害密切相关。HMGB1分泌到细胞外发挥促炎作用,主要是通过与其受体(TLR2/4、RAGE)结合,激活下游信号通路,促进NF-κB核内转移,诱导一系列炎症细胞因子,如TNF-α、IFN-γ、IL-1β、IL-2、IL-6、IL-8等释放,促进炎症级联反应,最终介导肠黏膜的损伤[14-17]。因此抑制或阻断HMGB1-NF-κB信号通路,可以保护肠黏膜屏障功能免受损伤。丙酮酸乙酯是HMGB1的抑制剂,能有效减少脓毒症小鼠血液中HMGB1浓度,并可明显抑制NF-κB的活化,从而发挥抗炎等作用。近年来的研究表明,丙酮酸乙酯可明显改善脓毒症所致的肠屏障功能的损伤[18-19]。本实验结果显示,LPS组HMGB1蛋白及mRNA表达水平明显增高,而LPS加EP组抑制了HMGB1的表达,提示HMGB1可能在脓毒症肠屏障功能损伤中发挥关键作用。此外,本研究结果进一步显示,LPS组除了高表达HMGB1外,其下游信号分子NF-κB蛋白及mRNA水平亦较对照组明显升高,而HMGB1抑制剂丙酮酸乙酯组NF-κB表达水平明显减少,提示脓毒症时HMGB1的高表达可促进其下游信号分子NF-κB的激活,进而发挥炎症级联反应,促进肠黏膜的损伤,丙酮酸乙酯能显著逆转HMGB及其信号分子NF-κB的表达,改善肠黏膜屏障功能,对脓毒症肠黏膜损伤具有保护作用。
综上所述,脓毒症时肠上皮屏障完整性受损,肠细胞间紧密连接蛋白表达减少,其机制可能与炎症因子HMGB1表达上调促进其下游信号分子NF-κB的激活有关。因此,HMGB1有望成为治疗脓毒症肠道功能障碍的新的靶点。
利益冲突 所有作者均声明不存在利益冲突
| [1] | Berg RD. Bacterial translocation from the gastrointestinal tract[J]. Adv Exp Med Biol, 1999, 473: 11-30. DOI:10.1007/978-1-4615-4143-1_2 |
| [2] | Cho W, Koo JY, Park Y, et al. Treatment of sepsis pathogenesis with high mobility group box protein 1-regulating anti-inflammatory agents[J]. J Med Chem, 2017, 60(1): 170-179. DOI:10.1021/acs.jmedchem.6b00954 |
| [3] | Wang H, Yang H, Tracey KJ. Extracellular role of HMGB1 in inflammation and sepsis[J]. J Intern Med, 2004, 255(3): 320-331. DOI:10.1111/j.1365-2796.2003.01302.x |
| [4] | Natoli M, Leoni BD, D'Agnano I, et al. Good Caco-2 cell culture practices[J]. Toxicol in Vitro, 2012, 26(8): 1243-1246. DOI:10.1016/j.tiv.2012.03.009 |
| [5] | Bischoff SC, Barbara G, Buurman W, et al. Intestinal permeability: a new target for disease prevention and therapy[J]. BMC Gastroenterol, 2014, 14: 189. DOI:10.1186/s12876-014-0189-7 |
| [6] | Cheng J, Wei Z, Liu X, et al. The role of intestinal mucosa injury induced by intra-abdominal hypertension in the development of abdominal compartment syndrome and multiple organ dysfunction syndrome[J]. Crit Care, 2013, 17(6): R283. DOI:10.1186/cc13146 |
| [7] | 刘丹, 刘伟, 王晓, 等. 脓毒症患者肠屏障功能损伤的临床研究[J]. 中华急诊医学杂志, 2018, 27(7): 785-789. DOI:10.3760/cma.j.issn.1671-0282.2018.07.015 |
| [8] | Xiu G, Sun J, Li X, et al. The role of HMGB1 in BMSC transplantation for treating MODS in rats[J]. Cell Tissue Res, 2018, 373(2): 395-406. DOI:10.1007/s00441-018-2823-0 |
| [9] | Manti S, Cuppari C, Tardino L, et al. HMGB1 as a new biomarker of celiac disease in children: a multicenter study[J]. Nutrition, 2017, 37: 18-21. DOI:10.1016/j.nut.2016.12.011 |
| [10] | Huang L, Zhang D, Han W, et al. High-mobility group box-1 inhibition stabilizes intestinal permeability through tight junctions in experimental acute necrotizing pancreatitis[J]. Inflamm Res, 2019, 68(8): 677-689. DOI:10.1007/s00011-019-01251-x |
| [11] | Angelis ID, Turco L. Caco-2 cells as a model for intestinal absorption[J]. Curr Protoc Toxicol, 2011, Chapter 20: Unit20.6. DOI:10.1002/0471140856.tx2006s47 |
| [12] | Sambuy Y, De Angelis I, Ranaldi G, et al. The Caco-2 cell line as a model of the intestinal barrier: influence of cell and culture-related factors on Caco-2 cell functional characteristics[J]. Cell Biol Toxicol, 2005, 21(1): 1-26. DOI:10.1007/s10565-005-0085-6 |
| [13] | Buckley A, Turner JR. Cell biology of tight junction barrier regulation and mucosal disease[J]. Cold Spring Harb Perspect Biol, 2018, 10(1): a029314. DOI:10.1101/cshperspect.a029314 |
| [14] | Ulloa L, Messmer D. High-mobility group box 1 (HMGB1) protein: friend and foe[J]. Cytokine Growth Factor Rev, 2006, 17(3): 189-201. DOI:10.1016/j.cytogfr.2006.01.003 |
| [15] | Guo SH, Al-Sadi R, Said HM, et al. Lipopolysaccharide causes an increase in intestinal tight junction permeability in vitro and in vivo by inducing enterocyte membrane expression and localization of TLR-4 and CD14[J]. Am J Pathol, 2013, 182(2): 375-387. DOI:10.1016/j.ajpath.2012.10.014 |
| [16] | Xiu GH, Zhou X, Li XL, et al. Role of bone marrow mesenchymal stromal cells in attenuating inflammatory reaction in lipopolysaccaride-induced acute kidney injury of rats associated with TLR4-NF-κB signaling pathway inhibition[J]. Ann Clin Lab Sci, 2018, 48(6): 743-750. |
| [17] | 修光辉, 熊伟, 尹云玉, 等. HMGB1-RAGE/TLRs-NF-kB信号通路在骨髓间充质干细胞移植治疗内毒素致凝血功能障碍大鼠中的作用[J]. 中华危重病急救医学, 2018, 30(9): 6-11. DOI:10.3760/cma.j.issn.2095-4352.2018.09.003 |
| [18] | 詹剑勇, 梅冰, 王美堂, 等. 丙酮酸乙酯对脓毒症大鼠肠黏膜屏障功能保护作用的研究[J]. 中国急救医学, 2009, 29(12): 1105-1108. DOI:10.3969/j.issn.1002-1949.2009.12.014 |
| [19] | Karabeyoğlu M, Unal B, Bozkurt B, et al. The effect of ethyl pyruvate on oxidative stress in intestine and bacterial translocation after thermal injury[J]. J Surg Res, 2008, 144(1): 59-63. DOI:10.1016/j.jss.2007.02.050 |
 2021, Vol. 30
2021, Vol. 30




