缺血性脑卒中是急诊常见病、多发病,具有高发病率、高致残率和高复发率等临床特点[1]。尽管针对缺血性脑卒中的基础研究较多,但其机制尚不完全清楚,其中炎症反应在其发病机制研究中占据重要地位[2]。近年来,大量研究表明CARD9做为先天免疫应答和炎症反应中重要的衔接蛋白,参与人类和小鼠的宿主免疫防御病原微生物过程[3-5]。同时,亦有研究证实CARD9能够识别内源性危险信号,作为多种受体通路的重要媒介物,介导NF-κB等炎症信号通路活化,调节下游炎症因子的产生[6],在关节[7]、心肌[8]、胰腺[9]等部位非感染性炎症中发挥调节作用。CARD9是否参与缺血性脑损伤炎症反应的发生发展尚未得到证实,本研究旨在明确CARD9与缺血性脑损伤炎症反应的相关性。
1 材料与方法 1.1 试剂和试剂盒RIPA裂解液(CST公司,美国)、BCA蛋白浓度测定试剂盒(Thermo Scientific公司,美国)、(CARD9、NF-κBp65、p-NF-κBp65、β-actin)兔抗小鼠单抗(abcam公司,英国)、山羊抗兔二抗(Cell Signaling Technology公司,美国)、蛋白显影液(杭州弗德生物科技有限公司,杭州);Trizol试剂(Invitrogen公司,美国)、RNA酶抑制剂(索莱宝生物技术有限公司,北京)、SuperScript Ⅲ Reverse Transcriptase试剂盒(Invitrogen公司,美国)、SYBR Ex Taq试剂盒(Takara公司,日本);TNF-ɑ、IL-lβ和IL-6 ELISA试剂盒(Abcam公司,英国)。
1.2 实验分组及模型制作24只SPF级健康雄性BALB/c小鼠,体质量25~30 g(由湖南斯莱克景达实验动物有限公司提供,许可证号:SCXK(湘)2016-0002),随机(随机数字法)分为假手术组、缺血3 h组、缺血6 h组、缺血12 h组,每组6只。缺血组小鼠采用线栓法制作永久性大脑中动脉阻塞(pMCAO)模型,禁食12 h,自由饮水,10 %水合氯醛腹腔注射麻醉(3 mL/kg)并固定,去除颈部毛发、消毒、铺无菌巾后正中切开,体式显微镜(Leica公司,德国)下逐层分离,找到颈内、外动脉。结扎右侧颈总动脉近心端,颈总动脉远心端打一假结,用微小动脉夹阻断血流。在颈总动脉两结之间切开,插入线栓(广州佳灵生物技术有限公司,广州),去掉动脉夹,沿颈内动脉缓慢进入大脑前动脉起始段,进入深度约10 mm,遇到阻力即刻停止,结扎远心端假结缝线,缝合皮肤后小鼠复苏毯复苏,清醒后回笼,常规饮食饮水。假手术组仅分离动脉和神经,不予以动脉栓塞。本研究动物实验过程均遵循国家和国际动物实验原则。
1.3 脑组织取材缺血组小鼠于缺血预定时间点3、6、12 h采用提拉断颈法处死,假手术组于手术操作完成后30 min处死断头,沿枕骨大孔剪开颅骨,微型止血钳剥离两侧顶固以及其他骨质,离断脑组织底部的视神经后用弯止血钳伸至颅底,将完整的脑组织翘起,即刻放置于覆盖无菌纱布的冰袋上,继续操作除去小脑和脑干,分离出右侧大脑组织,用于蛋白印迹测定及ELISA检测等。
1.4 Western blot检测脑组织CARD9及NF-κB蛋白表达取适量右侧脑组织,加入RIPA裂解液后充分研磨,然后在4 ℃以12 000 r/min离心10 min。使用BCA试剂盒法测量测定样品蛋白浓度后,将蛋白质与SDS上样缓冲液混合,100 ℃下煮沸15 min。将蛋白质在10 % SDS-PAGE凝胶中分离,然后转移到PVDF膜中。在室温下用5 %脱脂乳封闭90 min后,用抗CARD9(1 : 1 000)、抗p65NF-κB(1 : 1 000)、抗p-p65NF-κB(1 : 1 000)和抗β-actin(1 : 1 000)抗体4 ℃孵育过夜。然后,加入山羊抗兔二抗(1 : 5 000)在室温下孵育1 h。用TBST洗涤后,使用ECL显影并使用图像分析系统分析条带灰度值。
1.5 RT-PCR检测脑组织炎症因子TNF-α、IL-1β和IL-6 mRNA表达取适量右侧脑组织,加入Trizol孵育5 min,提取总RNA,反转录按SuperScript Ⅲ Reverse Transcriptase试剂盒说明操作,以β-actin为内参照,使用SYBR Ex Taq试剂盒来检测基因的表达含量,结果以TNF-ɑ、IL-1β、IL-6表达量与β-actin表达量的比值表示。相关引物信息如下:
| TNF-α-Forward Primer | 5’ -CCTCTCTCTAATCAGCCCTCTG-3’ |
| TNF-α-Reverse Primer | 5’ -GAGGACCTGGGAGTAGATGAG-3’ |
| IL-1β-Forward Primer | 5’-ATGATGGCTTATTACAGTGGCAA-3’ |
| IL-1β-Reverse Primer | 5’ -GTCGGAGATTCGTAGCTGGA-3’ |
| IL-6-Forward Primer | 5’ -ACTCACCTCTTCAGAACGAATTG-3’ |
| IL-6-Reverse Primer | 5’ -CCATCTTTGGAAGGTTCAGGTTG-3’ |
| β-actin-Forward Primer | 5’ -AGCGAGCATCCCCCAAAGTT-3’ |
| β-actin-Reverse Primer | 5’ -GGGCACGAAGGCTCATCATT-3’ |
取适量右侧脑组织,加入RIPA裂解液后充分研磨,然后在4 ℃以12 000 r/min离心10 min,取上清液,采用ELISA法测定脑组织TNF-ɑ、IL-1β、IL-6含量,严格按ELISA试剂盒说明书操作。
1.7 统计学方法采用SPSS 21.0软件进行分析,计量资料若服从正态分布则以均值±标准差(Mean±SD)表示,两组间样本比较采用独立样本t检验,采用Pearson相关分析比较CARD9与炎症因子之间的相关性。以P < 0.05认为差异有统计学意义。
2 结果 2.1 CARD9表达情况及NF-κB活性改变Western blot结果显示,与假手术组相比(0.325±0.011),缺血3 h(0.462±0.019)、6 h(0.735±0.036)和12 h组(0.903±0.024)中CARD9表达均升高,差异有统计学意义(t=2.017, P=0.036; t=4.645, P=0.003; t=7.1829, P=0.001);与缺血6 h组相比,缺血3 h和12 h组中CARD9表达分别降低和升高,差异有统计学意义(t=2.833, P=0.031;t=2.145, P=0.035)。NF-κB活性采用目前学界常用的p-NF-κBp65/NF-κBp65来说明,与假手术组相比(0.227±0.016),缺血3 h(0.316±0.017)、6 h(0.445±0.021)和12 h组(0.671±0.039)中NF-κB活性均升高,差异有统计学意义(t=1.975, P=0.041; t=2.518, P=0.016; t=3.032, P=0.008);与缺血6 h组相比,缺血3 h和12 h组中NF-κB活性分别降低和升高,差异有统计学意义(t=2.256, P=0.032; t=2.935, P=0.009)。提示CARD9表达及NF-κB活性在脑组织缺血12 h内随时间升高。见图 1和表 1。
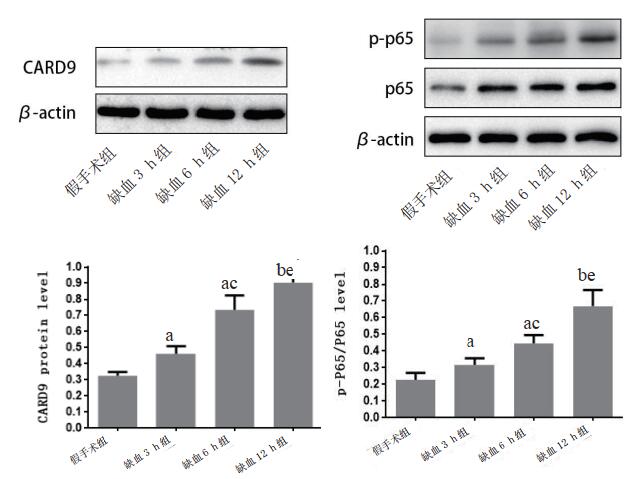
|
| 与假手术组比较,aP < 0.05、bP < 0.01;与缺血3 h组比较,cP < 0.05;与缺血6 h组比较,dP < 0.05,eP < 0.01 图 1 各组CARD9表达和NF-κB活化情况 Fig 1 The CARD9 and p-p65/p65NF-κB levels in each group |
|
|
| 分组 | CARD9 | p-p65/p65 |
| 假手术组 | 0.325±0.011 | 0.227±0.016 |
| 缺血3 h组 | 0.462±0.019a | 0.316±0.017a |
| 缺血6 h组 | 0.735±0.036bc | 0.445±0.021ac |
| 缺血12 h组 | 0.903±0.024bd | 0.671±0.039be |
| 注:与假手术组比较,aP < 0.05,bP < 0.01;与缺血3 h组比较,cP < 0.05;与缺血6 h组比较,dP < 0.05,eP < 0.01 | ||
RT-PCR结果显示,与假手术组相比(1.000±0.025),缺血3 h(2.107±0.217)、6 h(2.493±0.258)和12 h组(4.272±0.313)的TNF-ɑ mRNA相对表达量均升高,差异有统计学意义(t=3.254, P=0.008; t=3.976, P=0.005; t=6.789, P=0.002);与缺血6 h组相比,缺血3 h和12 h组中TNF-ɑ mRNA相对表达量分别降低和升高,差异有统计学意义(t=2.196, P=0.027;t=3.488, P=0.004)。与假手术组相比(0.995±0.018),缺血3 h(2.043±0.178)、6 h(4.192±0.257)和12 h组(6.333±0.350)的IL-lβ mRNA相对表达量均升高,差异有统计学意义(t=3.087, P=0.009; t=5.036, P=0.005; t=7.185, P=0.001);与缺血6 h组相比,缺血3 h和12 h组中IL-lβ mRNA相对表达量分别降低和升高,差异有统计学意义(t=3.247, P=0.008; t=3.351, P=0.007)。与假手术组相比(1.003±0.027),缺血3 h(2.153±0.146)、6 h(4.245±0.389)和12 h组(6.222±0.465)的IL-6 mRNA相对表达量均升高,差异有统计学意义(t=3.175, P=0.008; t=4.649, P=0.005; t=7.275, P=0.001);与缺血6 h组相比,缺血3 h和12 h组中IL-6 mRNA相对表达量分别降低和升高,差异有统计学意义(t=3.576, P=0.003;t=3.187, P=0.006)。提示TNF-ɑ、IL-1β和IL-6 mRNA表达在脑组织缺血12 h内随时间升高。见表 2和图 2。
| 分组 | TNF-ɑ | IL-1β | IL-6 |
| 假手术组 | 1.000±0.025 | 0.995±0.018 | 1.003±0.027 |
| 缺血3 h组 | 2.107±0.217a | 2.043±0.178a | 2.153±0.146a |
| 缺血6 h组 | 2.493±0.258ab | 4.192±0.257ac | 4.245±0.389ac |
| 缺血12 h组 | 4.272±0.313ae | 6.333±0.350ae | 6.222±0.465ae |
| 注:与假手术组比较,aP < 0.01;与缺血3 h组比较,bP < 0.05,cP < 0.01;与缺血6 h组比较,dP < 0.05,eP < 0.01 | |||
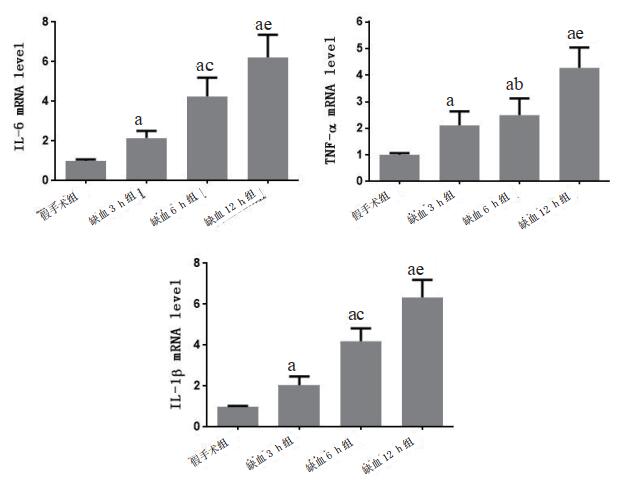
|
| 与假手术组比较,aP < 0.01;与缺血3 h组比较,bP < 0.05,cP < 0.01;与缺血6 h组比较,dP < 0.05,eP < 0.01 图 2 各组炎症因子mRNA的相对表达情况 Fig 2 The relative expression of inflammatory factors mRNA in each group |
|
|
ELISA结果显示,与假手术组相比(0.53±0.06)ng/g,缺血3 h(1.06±0.10)ng/g、6 h(1.47±0.15)ng/g和12 h组(2.78±0.18)ng/g的TNF-ɑ表达均升高,差异有统计学意义(t=2.994, P=0.009; t=4.547, P=0.004; t=6.856, P=0.001);与缺血6 h组相比,缺血3 h和12 h组中TNF-ɑ表达分别降低和升高,差异有统计学意义(t=2.806, P=0.009;t=3.155, P=0.008)。与假手术组相比(0.55±0.07)ng/g,缺血3 h(1.01±0.11)ng/g、6 h(2.13±0.16)ng/g和12 h组(3.09±0.18)ng/g的IL-lβ表达均升高,差异有统计学意义(t=2.862, P=0.009; t=5.217, P=0.003; t=6.958, P=0.001);与缺血6 h组相比,缺血3 h和12 h组中达到高峰IL-lβ表达分别降低和升高,差异有统计学意义(t=3.017, P=0.007; t=2.916, P=0.009)。与假手术组相比(1.99±0.18)ng/g,缺血3 h(4.10±0.41)ng/g、6 h(8.54±0.84)ng/g和12 h组(11.56±0.96)ng/g的IL-6表达均升高,差异有统计学意义(t=4.092, P=0.006; t=6.790, P=0.002; t=6.998 P=0.001);与缺血6 h组相比,缺血3 h和12 h组中IL-6表达分别降低和升高,差异有统计学意义(t=4.085, P=0.003; t=2.965, P=0.008)。提示TNF-ɑ、IL-1β和IL-6在脑组织缺血12 h内随时间升高。见表 3和图 3。
| 分组 | TNF-ɑ | IL-1β | IL-6 |
| 假手术组 | 0.53±0.06 | 0.55±0.07 | 1.99±0.18 |
| 缺血3 h组 | 1.06±0.10a | 1.01±0.11a | 4.10±0.41a |
| 缺血6 h组 | 1.47±0.15ab | 2.13±0.16ab | 8.54±0.84ab |
| 缺血12 h组 | 2.78±0.18ac | 3.09±0.18ac | 11.56±0.96ac |
| 注:与假手术组比较,aP < 0.01;与缺血3 h组比较,bP < 0.01;与缺血6 h组比较,cP < 0.01 | |||
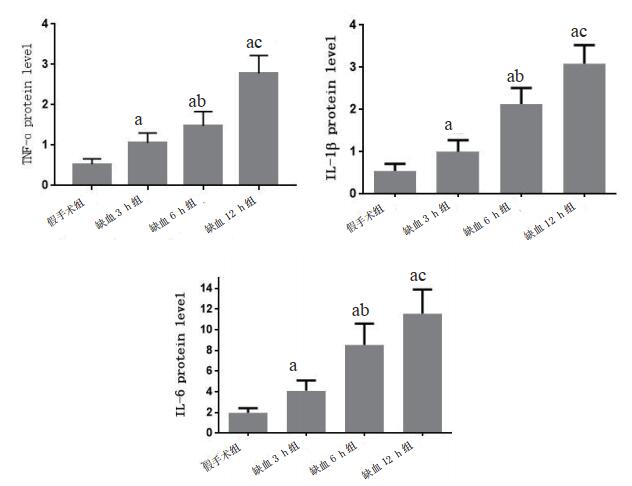
|
| 与假手术组比较,aP < 0.01;与缺血3 h组比较,bP < 0.01;与缺血6 h组比较,cP < 0.01。 图 3 各组炎症因子表达情况 Fig 3 The expression of inflammatory factors in each group |
|
|
将各组CARD9与NF-κB活性(p-p65/p65)、炎症因子TNF-ɑ、IL-1β、IL-6蛋白表达结果分别绘制散点图后,发现两两之间存在线性趋势,结果见图 4,因此进行Pearson相关分析,结果显示CARD9与NF-κB活性、TNF-ɑ、IL-1β、IL-6均存在正相关(r=0.894, P=0.001; r=0.747, P=0.008; r=0.810, P=0.001, r=0.773, P=0.007)。
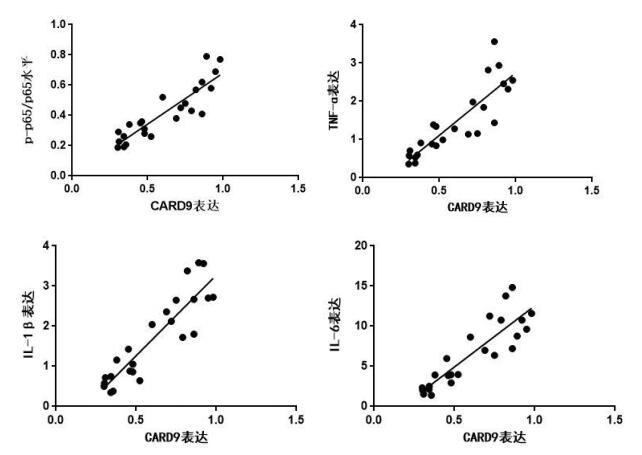
|
| 图 4 CARD9表达与NF-κB活性、炎症因子表达变化散点图 Fig 4 Scatterplot of CARD9 and p-p65/p65NF-κB, inflammatory factors |
|
|
缺血性脑损伤中涉及的病理生理机制包括血流中断后导致能量衰减继发的兴奋性毒性损伤、自由基损伤、梗死周边区去极化、炎症反应以及凋亡基因激活等[10],它们在缺血脑组织中呈现时间、空间上的动态过程,部分环节互为因果,彼此重叠并相互联系,形成恶性循环,最终导致细胞凋亡或坏死[11-12]。炎症反应作为缺血性脑损伤最重要的病理生理机制之一[2],在急性脑缺血早期即表现为多种炎性细胞浸润、细胞因子释放以及炎性信号通路活化[13-14]。
课题组在前期研究工作中已熟练建立pMCAO模型,并且通过脑水肿测定、TTC染色及尼氏体染色等方法验证造模成功[15],本研究旨在通过构建小鼠pMCAO模型明确CARD9与脑缺血后炎症反应是否相关。CARD9在结构上包含着2个功能区,具有胱天蛋白酶募集和蛋白质寡聚化功能[16],作为中间衔接蛋白为细胞膜上模式识别受体(pattern recognition receptors,PRRs)和下游细胞内应答之间提供连接[17]。来自损伤或坏死细胞产生的内源性危险信号,如细胞因子、热休克蛋白、胞外基质降解产物等物质激活PRR,进一步激活CARD9,CARD9通过CARD-CARD相互作用募集B细胞淋巴瘤/白血病-10(B cell lymphoma/leukemia-10, BCL-10)和黏膜相关淋巴组织转运蛋白1(mucosa associated lymphoid tissue transporters-1, MALT1),结合形成CARD9-BCL-10-MALT1(CBM)复合体[18],激活NF-κB、丝裂原活化蛋白激酶等炎症信号通路,促进巨噬细胞产生释放炎症因子[19]。前期研究证实随缺血时间延长,脑损伤程度加重[15],在小鼠急性胰腺炎研究中发现,CARD9表达量不仅随时间升高,还与病情严重程度呈正相关[9]。本研究亦显示小鼠缺血性脑损伤后CARD9上调,12 h内表达逐渐升高,呈一定的时间依赖性。
脑缺血后数小时内神经系统巨噬细胞-小胶质细胞被激活,24 h达到高峰,梗死周边区尤为明显,激活的小胶质细胞可诱导神经细胞坏死或凋亡[20],研究证明在此过程中神经毒性因子TNF-α、IL-1β和IL-6等侵及梗死区周围正常神经元,扩大脑梗死体积,加重缺血性脑损伤[21-22]。本研究发现,小鼠缺血性脑损伤后NF-κB信号通路活化水平与CARD9蛋白表达呈正相关,趋势保持一致。NF-κB处在炎症反应的中央地位,对炎症基因的表达和调控起着协调作用,当细胞处于静息状态时,细胞质中NF-κB和其抑制蛋白IκB结合,此时NF-κB不具备调节基因转录能力。在急性疾病或应激等状态下,抑制蛋白IκB被其激酶IKK降解,从而导致NF-κB和IκB分离,NF-κB则迅速转移至细胞核内,激活多种下游炎症基因的转录。同时,本研究发现,作为NF-κB炎性信号通路下游炎症因子TNF-α、IL-1β和IL-6 mRNA及蛋白表达亦在缺血后12 h内表达逐渐升高,且与CARD9表达呈正相关。CARD9与炎性信号通路及炎症因子之间的关系在大量感染性和非感染性炎症疾病中得到验证,本研究亦初步印证与其相符,提示CARD9蛋白可能在缺血性脑损伤后NF-κB信号通路介导的炎症反应中发挥一定的调控作用。推测CARD9激活上调可能与上述机制有关,神经元缺血缺氧受损后,小胶质细胞激活,内源性配体激活启动PRR,通过激活CARD9形成CBM复合体介导下游NF-кB等炎性信号通路,促进炎症因子释放,参与脑缺血后的炎症反应。
利益冲突 所有作者均声明不存在利益冲突
| [1] | Ojaghihaghighi S, Vahdati SS, Mikaeilpour A, et al. Comparison of neurological clinical manifestation in patients with hemorrhagic and ischemic stroke[J]. World J Emerg Med, 2017, 8(1): 34-38. DOI:10.5847/wjem.j.1920-8642.2017.01.006 |
| [2] | Vidale S, Consoli A, Arnaboldi M, et al. Postischemic inflammation in acute stroke[J]. J Clin Neurol, 2017, 13(1): 1. DOI:10.3988/jcn.2017.13.1.1 |
| [3] | Jia XM, Tang B, Zhu LL, et al. CARD9 mediates Dectin-1-induced ERK activation by linking Ras-GRF1 to H-Ras for antifungal immunity[J]. J Exp Med, 2014, 211(11): 2307-2321. DOI:10.1084/jem.20132349 |
| [4] | Whibley N, Jaycox JR, Reid D, et al. Delinking CARD9 and IL-17: CARD9 protects against candida tropicalis infection through a TNF-α-dependent, IL-17-independent mechanism[J]. J Immunol, 2015, 195(8): 3781-3792. DOI:10.4049/jimmunol.1500870 |
| [5] | Sancho D, Reis e Sousa C. Signaling by myeloid C-type lectin receptors in immunity and homeostasis[J]. Ann Rev Immunol, 2012, 30(1): 491-529. DOI:10.1146/annurev-immunol-031210-101352 |
| [6] | Zhao XQ, Zhu LL, Chang Q, et al. C-type lectin receptor dectin-3 mediates trehalose 6, 6'-dimycolate (TDM)-induced Mincle expression through CARD9/Bcl10/MALT1-dependent nuclear factor (NF)-κB activation[J]. J Biol Chem, 2014, 289(43): 30052-30062. DOI:10.1074/jbc.M114.588574 |
| [7] | Arya R, Del Rincon I, Farook VS, et al. Genetic variants influencing joint damage in Mexican Americans and European Americans with rheumatoid arthritis[J]. Genet Epidemiol, 2015, 39(8): 678-688. DOI:10.1002/gepi.21938 |
| [8] | Li YB, Liang PF, Jiang BM, et al. CARD9 inhibits mitochondria-dependent apoptosis of cardiomyocytes under oxidative stress via interacting with Apaf-1[J]. Free Radic Biol Med, 2019, 141: 172-181. DOI:10.1016/j.freeradbiomed.2019.06.017 |
| [9] | Yang ZW, Meng XX, Zhang C, et al. CARD9 gene silencing with siRNA protects rats against severe acute pancreatitis: CARD9-dependent NF-κB and P38MAPKs pathway[J]. J Cell Mol Med, 2017, 21(6): 1085-1093. DOI:10.1111/jcmm.13040 |
| [10] | Zhong CK, Zhu ZB, Wang AL, et al. Multiple biomarkers covering distinct pathways for predicting outcomes after ischemic stroke[J]. Neurology, 2019, 92(4): e295-e304. DOI:10.1212/WNL.0000000000006717 |
| [11] | Yuan M, Yan DY, Xu FS, et al. Effects of sepsis on hippocampal volume and memory function[J]. World J Emerg Med, 2020, 11(4): 223-230. DOI:10.5847/wjem.j.1920-8642.2020.04.004 |
| [12] | Xiong YY, Manwani B, Fisher M. Management of acute ischemic stroke[J]. Am J Med, 2019, 132(3): 286-291. DOI:10.1016/j.amjmed.2018.10.019 |
| [13] | Terao Y, Ohta H, Oda A, et al. Macrophage inflammatory protein-3alpha plays a key role in the inflammatory cascade in rat focal cerebral ischemia[J]. Neurosci Res, 2009, 64(1): 75-82. DOI:10.1016/j.neures.2009.01.017 |
| [14] | Mo Y, Sun YY, Liu KY. Autophagy and inflammation in ischemic stroke[J]. Neural Regen Res, 2020, 15(8): 1388-1396. DOI:10.4103/1673-5374.274331 |
| [15] | Fu L, Huang L, Cao CS, et al. Inhibition of AMP-activated protein kinase alleviates focal cerebral ischemia injury in mice: Interference with mTOR and autophagy[J]. Brain Res, 2016, 1650: 103-111. DOI:10.1016/j.brainres.2016.08.035 |
| [16] | Hsu YM, Zhang YL, You Y, et al. The adaptor protein CARD9 is required for innate immune responses to intracellular pathogens[J]. Nat Immunol, 2007, 8(2): 198-205. DOI:10.1038/ni1426 |
| [17] | Hara H, Ishihara C, Takeuchi A, et al. The adaptor protein CARD9 is essential for the activation of myeloid cells through ITAM-associated and Toll-like receptors[J]. Nat Immunol, 2007, 8(6): 619-629. DOI:10.1038/ni1466 |
| [18] | Lu HY, Biggs CM, Blanchard-Rohner G, et al. Germline CBM-opathies: From immunodeficiency to atopy[J]. J Allergy Clin Immunol, 2019, 143(5): 1661-1673. DOI:10.1016/j.jaci.2019.03.009 |
| [19] | Ye LJ, Zhou XC, Yin XJ, et al. CARD9 downregulation suppresses the growth of oral squamous cell carcinoma by regulating NF-κB[J]. Oral Dis, 2019, 25(8): 1886-1896. DOI:10.1111/odi.13157 |
| [20] | 杨帆, 李旭声, 李娅, 等. 高压环境对BV2小胶质细胞TNF-α和IL-1β表达的影响[J]. 中华急诊医学杂志, 2019, 28(12): 1507-1510. DOI:10.3760/cma.j.issn.1671-0282.2019.12.009 |
 2021, Vol. 30
2021, Vol. 30




