脓毒症休克是重症监护室(intensive care unit, ICU)常见的急危重症及首要死亡原因,因其发病率、病死率居高不下,已成为危重症医学研究领域的热点和难点[1-3]。因此,如何寻找一个准确可靠的临床指标,便于判断脓毒症休克患者住院期间的预后,从而提高救治成功率,仍是目前临床医生面临的重大挑战。近年来研究发现,危重症患者常伴有不同程度的内分泌系统功能紊乱,是影响临床预后的重要影响因素[4],甲状腺激素与脓毒症患者病情严重程度的关系越来越受到重视[5]。但脓毒症休克患者早期甲状腺激素水平的变化,与住院期间病死率的关系尚未见相关报道。为此,本研究对收治本院ICU的脓毒症休克患者早期甲状腺激素水平进行回顾性分析研究,旨在探讨其对脓毒症休克患者住院期间预后的预测价值,为临床合理干预提供理论依据。
1 资料与方法 1.1 病例选择采用回顾性研究方法,选择2014年12月至2019年12月入住南京医科大学附属南京医院ICU的脓毒症休克患者,所入选患者均符合脓毒症3.0诊断标准[6]。排除标准:①ICU住院超过30 d;②放弃治疗及临床资料不完整患者;③年龄 < 18岁;④存在甲状腺基础疾病或自身免疫性疾病;⑤下丘脑-垂体疾病或内分泌代谢疾病;⑥近1个月内使用过糖皮质激素或干扰甲状腺功能药物治疗。
1.2 研究分组根据收治ICU的脓毒症休克患者住院治疗期间是否死亡为观察节点,分为存活组与死亡组。
1.3 伦理学本研究经南京医科大学附属南京医院伦理委员会批准,且所有临床检测指标均获得患者同意或其直系亲属的授权(伦理审批号:KY20201102-03)。
1.4 研究方法记录患者的一般资料,包括性别、年龄、基础疾病(高血压、糖尿病、冠心病、脑梗死)、感染部位(呼吸系统、泌尿系统、血流、腹部及其他)、ICU住院时间、机械通气时间、入院时平均动脉压(mean arterial pressure, MAP)及急性生理学与慢性健康状况评分II(acute physiology and chronic health status score II, APACHE Ⅱ)。所有患者入住ICU 24 h内抽取静脉血送检,采用i2000SR全自动化学发光免疫分析仪(雅培爱尔兰诊断公司,试剂由雅培公司配套提供)测定血清三碘甲状腺原氨酸(triiodothyronine, T3)、甲状腺素(thyroxine, T4)、游离T3(free triiodothyronine, FT3)、游离T4(free thyroxine, FT4)及促甲状腺激素(thyroid stimulating hormone, TSH)水平,为保证T3与FT3单位的一致性,以T3*1000/FT3作为T3/FT3的比值。试剂的配制和操作步骤均严格按照说明书进行,该仪器的甲状腺激素参考值范围如下:TSH (0.35~4.94) mIU/L,T3 (0.89~2.44) nmol/L,FT3 (2.63~5.7) pmol/L,T4 (62.68~150.84) nmol/L,FT4 (9.0~19.0) pmol/L。
1.5 统计学方法使用SPSS 19.0统计软件进行统计学分析。采用Kolmogorov-Smirnov法对计量资料进行正态性检验,符合正态分布的计量资料以均数±标准差(Mean ± SD)表示,采用独立样本t检验,非正态分布的计量资料以中位数(四分位数)[M(QL, QU)]表示,采用Mann-Whitney U检验。计数资料采用χ2检验。相关性分析采用Spearman相关分析。将筛选出的影响因素纳入Logistic回归模型,分析影响脓毒症休克患者ICU住院期间预后的危险因素,并绘制受试者工作特征(receiver operating characteristic, ROC)曲线及Kaplan-Meier生存曲线分析甲状腺激素与ICU住院病死率的关系。Kaplan-Meier生存曲线组间对比采用Log-Rank检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 患者基本临床资料根据脓毒症3.0的诊断标准,共入选168例脓毒症休克患者,其中放弃治疗及资料不全者14例,基础存在甲状腺疾病及严重免疫性疾病者5例,年龄 < 18岁者2例,住院时间超30 d者5例,近1个月内使用过糖皮质激素或干扰甲状腺功能药物治疗7例,下丘脑-垂体疾病2例,最终133例患者纳入分析,分为存活组和死亡组。其中存活组87例,男性53例,女性34例,(72.38±9.64)岁;死亡组46例,男性34例,女性12例,平均(74.57±8.57)岁。入组患者中呼吸系统感染44例,泌尿系统感染19例,血流感染8例,腹部感染(包括腹腔感染、腹膜炎、胆系感染)57例,其他感染(皮肤软组织、椎旁脓肿及未明确部位的)5例。两组患者性别、年龄、机械通气时间、MAP、基础疾病及感染部位等基线资料均差异无统计学意义(均P > 0.05),而ICU住院时间及APACHE Ⅱ评分差异有统计学意义(P < 0.05),见表 1。
| 指标 | 存活组(n=87) | 死亡组(n=46) | t / Z / χ2值 | P值 |
| 男/女(n) | 53/34 | 34/12 | 2.245 | 0.134 |
| 年龄(岁,x±s) | 72.38 ± 9.64 | 74.57 ± 8.57 | -1.292 | 0.199 |
| 机械通气时间(d) | 4(2, 5) | 4(2,7) | -0.649 | 0.516 |
| ICU住院时间(d) | 9.00(4.00, 13.00) | 4.00(2.00, 10.25) | -3.160 | 0.002 |
| MAP(mmHg) | 70.62 ±16.67 | 67.56 ± 16.57 | 1.008 | 0.315 |
| APACHE Ⅱ(分) | 27.21 ± 7.01 | 30.28 ± 6.67 | -2.390 | 0.018 |
| PCT(ng/mL) | 16.27(5.31, 35.10) | 16.87(5.52, 35.29) | -0.253 | 0.800 |
| 感染部位(例) | 1.154 | 0.886 | ||
| 呼吸系统 | 28 | 16 | ||
| 泌尿系统 | 14 | 5 | ||
| 血流 | 6 | 2 | ||
| 腹部 | 36 | 21 | ||
| 其他 | 3 | 2 | ||
| 基础疾病(例) | 0.394 | 0.941 | ||
| 冠心病 | 23 | 18 | ||
| 高血压 | 41 | 26 | ||
| 糖尿病 | 18 | 14 | ||
| 脑梗死 | 27 | 18 |
两组患者TSH、T4及FT4指标比较,差异无统计学意义(均P > 0.05),死亡组患者T3、FT3及T3/FT3均明显低于存活组[(FT3(pmol/L):1.73(1.54, 2.52)vs. 1.32(0.94, 1.54),T3(nmol/L):0.70(0.56, 0.79)vs. 0.33(0.25, 0.43),T3/FT3:318.18(299.44, 448.05)vs. 250.00(192.31, 313.92)],见表 2。
| 指标 | 存活组(n=87) | 死亡组(n=46) | t / Z值 | P值 |
| TSH(mIU/L) | 0.57(0.23, 1.29) | 0.37(0.19, 0.98) | -1.19 | 0.235 |
| FT3(pmol/L) | 1.73(1.54, 2.52) | 1.32(0.94, 1.54) | -5.94 | 0.000 |
| FT4(pmol/L) | 12.21(10.14, 13.54) | 12.33(10.22, 13.26) | -0.72 | 0.474 |
| T3(nmol/L) | 0.70(0.56, 0.79) | 0.33(0.25, 0.43) | -9.28 | 0.000 |
| T4(nmol/L) | 67.44(62.73, 75.30) | 74.93(55.75, 83.03) | -1.41 | 0.159 |
| T3/FT3 | 318.18 (299.44, 448.05) | 250.00(192.31, 313.92) | -5.30 | 0.000 |
以APACHE Ⅱ评分为标准,T3、FT3的水平与脓毒症休克患者病情严重程度呈负相关关系(FT3:r = -0.246, P = 0.004;T3:r = - 0.24,P = 0.006;均P < 0.05),见表 3。
| 指标 | FT3 | FT4 | T3 | T4 | T3/FT3 | TSH |
| r值 | -0.25 | -0.07 | -0.24 | -0.05 | -0.06 | -0.06 |
| P值 | 0.004 | 0.442 | 0.006 | 0.557 | 0.490 | 0.486 |
将APACHE Ⅱ评分、T3、FT3及T3/FT3作为自变量,将是否生存作为因变量,采用二分类Logistic回归分析模型进行统计,结果显示T3、FT3及T3/FT3均是影响脓毒症休克患者入住ICU期间预后的独立危险因素(FT3:OR=6.533, 95% CI: 0.687 ~ 62.157,P = 0.012; T3: OR= 0.529,95% CI: 0.372 ~ 0.975, P = 0.000; T3/FT3: OR= 1.719, 95% CI: 1.007 ~ 1.931, P = 0.002),见表 4。
| 指标 | β值 | Sx (S.E.) | Wald | P值 | OR值 | 95% CI | |
| 下限 | 上限 | ||||||
| APACHE Ⅱ(分) | 0.159 | 0.035 | 20.793 | 0.000 | 1.173 | 1.095 | 1.256 |
| FT3(pmol/L) | 1.877 | 1.149 | 2.667 | 0.012 | 6.533 | 0.687 | 62.157 |
| T3(nmol/L) | -0.637 | 0.182 | 12.220 | 0.000 | 0.529 | 0.372 | 0.975 |
| T3/FT3 | 0.019 | 0.006 | 9.451 | 0.002 | 1.719 | 1.007 | 1.931 |
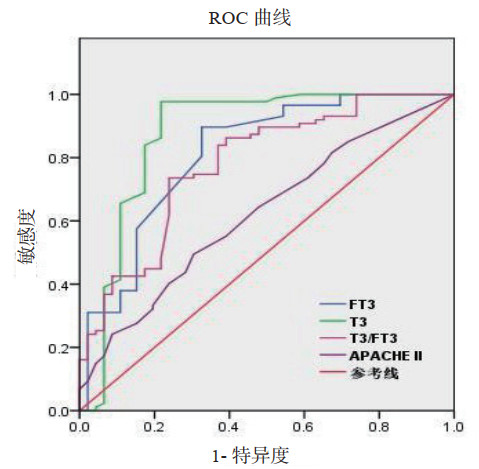
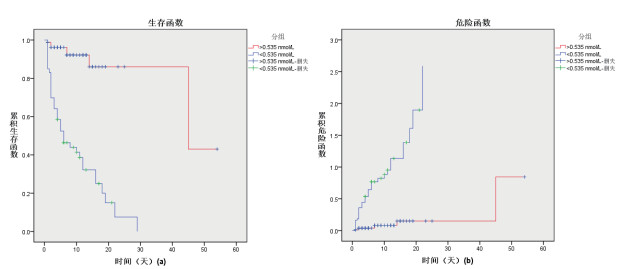
ROC曲线分析APACHE Ⅱ评分、T3、FT3及T3/FT3指标对脓毒症休克患者短期预后均有一定的预测价值。T3的ROC曲线下面积(AUC)为0.874,95% CI为0.794~0.954(P = 0.000),优于FT3(AUC=0.812,95% CI 0.731~0.894;P = 0.000)、T3/FT3(AUC=0.780,95% CI 0.696~0.863;P = 0.000)和APACHE Ⅱ评分(AUC =0.622,95% CI 0.524~0.720;P = 0.021)。其中,T3预测脓毒症休克患者ICU住院期间生存情况的最佳截断值为0.535 nmol/L,敏感度为83.9%,特异度为82.6%。进一步以T3的ROC分析获取的截断值0.535 nmol/L将脓毒症休克患者分为T3≥0.535 nmol/L组和T3 < 0.535 nmol/L组,使用Log-Rank检验分析生存曲线及风险函数,结果提示:T3≥0.535 nmol/L组的ICU期间病死率显著低于T3 < 0.535 nmol/L组(χ2 = 50.852,P = 0.000)见图 1、2,表 5。
|
| 图 1 甲状腺激素预测脓毒症休克患者住院期间预后的ROC曲线 Fig 1 The ROC curve of thyroid hormone predicting the prognosis of patients with septic shock in ICU |
|
|
|
| 图 2 T3≥0.535 nmol/L与<0.535 nmol/L两组患者的Kaplan-Meier生存曲线及风险曲线分析 Fig 2 Kaplan-Meier survival curve and risk curve analysis of patients with septic shock with T3≥0.535 nmol/L and T3 < 0.535 nmol/L |
|
|
| 指标 | AUC | 截断值 | 敏感度 | 特异性 | P值 | 95% CI | |
| 下限 | 上限 | ||||||
| APACHE Ⅱ(分) | 0.622 | 25.50 | 0.761 | 0.402 | 0.021 | 0.524 | 0.720 |
| FT3(pmol/L) | 0.812 | 1.475 | 0.897 | 0.674 | 0.000 | 0.731 | 0.894 |
| T3(nmol/L) | 0.874 | 0.535 | 0.839 | 0.826 | 0.000 | 0.794 | 0.954 |
| T3/FT3 | 0.780 | 250.45 | 0.897 | 0.522 | 0.000 | 0.696 | 0.863 |
脓毒症休克由于病情进展快,且疾病初期表现不具有特异性。因此,美国PIRO概念早期即提倡使用容易检测的生物学指标,便于临床医生及时评估脓毒症休克患者病情的严重程度及判断其预后[7]。重症感染可引起血清甲状腺激素水平的下降,而不伴有甲状腺功能减退的表现,称为正常甲状腺病态综合征,以低T3综合征最为多见,且甲状腺激素水平下降程度与感染性疾病的严重程度关系密切[8-9]。其中,APACHE Ⅱ评分系统由于纳入的参数众多,可综合评估重症患者的病情变化,是目前ICU评估危重症病情严重程度最常用的工具[10]。本研究发现,脓毒症休克死亡组患者血清FT3、T3水平均明显低于存活组。同时,以APACHE Ⅱ评分作为参考标准进行的相关性分析发现,FT3、T3与APACHE Ⅱ评分呈负相关关系,即血清T3、FT3水平越低,APACHE Ⅱ评分越高,脓毒症休克患者的ICU住院期间预后越差,提示血清T3及FT3水平降低是预测脓毒症休克患者病情危重及预后不良的可靠指标,这与尹小燕等[11]的研究结果一致。并且,本研究中纳入的133例脓毒症休克患者,在收住ICU治疗期间的总病死率为34.59%(46/133),与目前相关研究报道一致[12-13]。本研究中死亡组患者的APACHE Ⅱ评分明显高于存活组,这一结果也验证了APACHE Ⅱ评分与病情严重程度的增加导致病死率升高相关。本研究中发现脓毒症休克患者甲状腺功能显著低于正常水平,可能与以下因素有关:(1)炎症因子:重症感染时机体释放的炎症因子抑制下丘脑-垂体-甲状腺轴功能,并降低1型脱碘酶活性和细胞核T3受体的结合能力,均可导致T3水平下降[14];(2)缺血缺氧:脓毒症休克时机体缺血缺氧,血液重新分布影响甲状腺功能的正常生理功能,抑制甲状腺激素的合成与释放,使T3、FT3合成减少[15];(3)营养状况:脓毒症休克患者常伴有营养状态低下,血浆蛋白水平降低,从而影响甲状腺激素与甲状腺球蛋白结合;(4)应激因素:脓毒症休克时应激状态抑制肝脏产生甲状腺激素结合蛋白,影响甲状腺激素的结合,导致其浓度下降[16]。
本研究发现APACHE Ⅱ、FT3、T3及T3/FT3是影响脓毒症休克患者ICU住院期间死亡的独立危险因素。利用ROC曲线进一步分析显示,在预测脓毒症休克患者ICU住院期间死亡的预后方面,FT3、T3及FT3/T3三者均具有良好的预测价值,其中以T3预测价值最佳,其最佳截断值是0.535 nmol/L,敏感度为83.9%,特异性为82.6%。这提示临床医生可通过监测脓毒症休克患者入院早期甲状腺激素水平,尤其是FT3、T3水平的变化,评估ICU住院治疗期间可能出现的不良预后,便于及时进行干预,努力降低ICU住院病死率。
值得注意的是,本研究中两组患者机械通气时间差异无统计学意义,可能与本研究将有创及无创通气时间均纳入研究有关。同时还发现,存活组患者ICU住院时间显著高于死亡组,这可能由于死亡组患者入院时各脏器损害程度更严重,而存活组患者由于反复感染无法脱离呼吸机、生命体征不稳定无法行专科治疗等因素,导致存活组ICU住院时间更长。
本研究为单中心回顾性研究,研究所纳入的病例数仍相对不足,且未能动态监测治疗期间甲状腺激素水平的变化趋势。此外,纳入研究的所有患者均未进行甲状腺激素替代治疗,且目前针对危重症合并低T3综合征患者,是否进行甲状腺激素替代治疗仍存在一定争论[17],临床上需进一步研究。
利益冲突 所有作者均声明不存在利益冲突
| [1] | 陈振英, 何小军. 2018中国脓毒症研究发展蓝皮书及未来展望[J]. 中华急诊医学杂志, 2019, 28(10): 1332-1334. DOI:10.3760/cma.j.issn.1671-0282.2019.10.032 |
| [2] | Yuan M, Yan DY, Xu FS, et al. Effects of Sepsis on hippocampal volume and memory function[J]. World J Emerg Med, 2020, 11(4): 223-230. DOI:10.5847/wjem.j.1920-8642.2020.04.004 |
| [3] | Kim MH, Ahn JY, Song JE, et al. Correction: The C-reactive protein/albumin ratio as an independent predictor of mortality in patients with severe sepsis or septic shock treated with early goal-directed therapy[J]. PLoS One, 2019, 14(11): e0225620. DOI:10.1371/journal.pone.0225620 |
| [4] | Lee S, Farwell AP. Euthyroid sick syndrome[J]. Compr Physiol, 2016, 6(2): 1071-1080. DOI:10.1002/cphy.c150017 |
| [5] | 钱风华, 吴祎, 朱责力, 等. 脓毒症早期血清甲状腺激素水平与病情程度相关性的研究[J]. 中国急救医学, 2014, 34(8): 673-675. DOI:10.3969/j.issn.1002-1949.2014.08.001 |
| [6] | Singer M, Deutschman CS, Seymour CW, et al. The third international consensus definitions for sepsis and septic shock (Sepsis-3)[J]. JAMA, 2016, 315(8): 801-810. DOI:10.1001/jama.2016.0287 |
| [7] | Levy MM, Fink MP, Marshall JC, et al. 2001 SCCM/ESICM/ACCP/ATS/SIS international Sepsis definitions conference[J]. Crit Care Med, 2003, 31(4): 1250-1256. DOI:10.1097/01.CCM.0000050454.01978.3B |
| [8] | 李莉, 吴彩军. 危重症患者低T3综合征研究进展[J]. 中国急救医学, 2019, 39(2): 165-169. DOI:10.3969/j.issn.1002-1949.2019.02.019 |
| [9] | van den Berghe G. Non-thyroidal illness in the ICU: a syndrome with different faces[J]. Thyroid, 2014, 24(10): 1456-1465. DOI:10.1089/thy.2014.0201 |
| [10] | 桑珍珍, 高杰, 贾春梅, 等. 肝动脉阻力指数联和血清miRNA-122a对脓毒症休克合并肝损伤的诊断及预后价值[J]. 中华急诊医学杂志, 2020, 29(2): 193-198. DOI:10.3760/cma.j.issn.1671-0282.2020.02.0013 |
| [11] | 尹小燕, 乔建瓯. 甲状腺激素、降钙素原和C-反应蛋白对脓毒症患者病情及预后评估的价值[J]. 中华实验和临床感染病杂志, 2016, 10(2): 162-165. DOI:10.3877/cma.j.issn.1674-1358.2016.02.007 |
| [12] | 张清, 李春盛. 急诊脓毒症严重程度各标记物的比较[J]. 中华急诊医学杂志, 2019, 28(2): 163-169. DOI:10.3760/cma.j.issn.1671-0282.2019.02.007 |
| [13] | Chambers KA, Park AY, Banuelos RC, et al. Outcomes of severe Sepsis and septic shock patients after stratification by initial lactate value[J]. World J Emerg Med, 2018, 9(2): 113-117. DOI:10.5847/wjem.j.1920-8642.2018.02.005 |
| [14] | 王剑, 郭晋平, 吕广欣. 危重症患者血清甲状腺激素水平变化及意义[J]. 山东医药, 2016, 56(12): 83-85. DOI:10.3969/j.issn.1002-266X.2016.12.031 |
| [15] | 王秀梅, 宋丽洁, 张金红. 正常甲状腺病态综合征[J]. 中国急救复苏与灾害医学杂志, 2013, 8(6): 564-566. |
| [16] | Han G, Ren JN, Liu S, et al. Nonthyroidal illness syndrome in enterocutaneous fistulas[J]. Am J Surg, 2013, 206(3): 386-392. DOI:10.1016/j.amjsurg.2012.12.011 |
| [17] | 詹峰, 宋维, 陈文腾, 等. 小剂量左旋甲状腺素干预严重脓毒症合并正常甲状腺功能病态综合征患者疗效观察[J]. 中国急救医学, 2017, 37(2): 105-108. DOI:10.3969/j.issn.1002-1949.2017.02.003 |
 2021, Vol. 30
2021, Vol. 30




