脓毒症为重症监护室常见的急危重症,表现为全身系统的炎症反应,临床上具有较高的致死率,且近年来发病呈不断上升趋势[1]。肺脏由于其特有的解剖及生理学特点,成为了脓毒症发病过程中最早且最易受损伤的器官,因此脓毒症患者常并发呼吸衰竭,需要机械辅助通气治疗[2],对于脓毒症机械通气患者如何更好的预防呼吸机相关性肺炎(ventilator-associated pneumonia,VAP)的发生与患者的预后密切相关。同时脓毒症患者常合并肠道菌群失调及紊乱,加重了感染及不良预后的发生[3]。益生菌一方面被证实可以改善肠道菌群失衡,另一方面可以调节免疫功能、炎症反应等,进而改善危重症患者的预后[4],但是其在脓毒症机械通气患者尤其是在预防VAP发生中的作用尚未见报道。本文主要研究探讨了益生菌强化治疗在脓毒症机械通气患者中的临床应用。
1 资料与方法 1.1 基线资料选取2017年07月至2018年12月入住本院ICU的脓毒症机械通气患者共128例,记录两组患者的性别、年龄、入院24 h内APACHEⅡ评分、乳酸水平、原发病情况等。该研究通过本院伦理委员会批准(伦理审批号:2018-SR-036),并与家属签订知情同意。
1.2 纳入和排除标准① 符合2014脓毒症指南中的相关诊断标准;②年龄>18岁,<80岁;③需行机械通气治疗,且通气时间>48 h;④经过伦理委员会通过并签署知情同意书;排除标准:①合并其他严重脏器功能不全例如肝衰竭、肾衰竭、恶性心律失常、急性心心肌梗死;②胃肠道功能衰竭、肠梗阻患者;③既往严重肺部疾患;④数据资料不全或丢失的患者。
1.3 方法本研究为前瞻性的单中心随机(随机数字法)对照研究,采用数字化随机方法将符合纳入和排除标准的患者分为益生菌组和对照组,两组患者均于入院后24~72 h内留置鼻胃管行肠内营养治疗,肠内营养制剂均来自纽迪希亚公司,以恒温、持续且均匀的方式泵入,开始以20~25 mL/h,如患者可以耐受没有出现严重的腹泻、胃潴留、呕吐等,可逐渐提高泵注速度,48~72 h增加至60~85 mL/h;益生菌组在对照组基础上予以每日双歧杆菌三联活菌散(公司:上海信谊药厂有限公司;国药准字S10970105;规格每袋含药粉1 g,含活菌数分别应不低于1.0×107CFU),每次3包,每天3次。
1.4 临床观察指标以气管插管行机械通气后28 d为观察点,统计两组患者的VAP、菌血症、病死率,机械通气时间、ICU住院时间情况,其中VAP诊断符合2018版中国成人医院获得性肺炎与呼吸机相关性肺炎诊断和治疗指南[5],血培养阳性患者判断为合并菌血症。
1.5 统计学方法数据经SPSS25.0统计学软件综合统计分析。计量资料以均数±标准差(Mean ± SD)表示,定量资料比较采用成组t检验或单因素方差分析。计数资料通过非参数Mann-Whitney U检验分析,二元资料通过Fisher's精确检验分析。利用Log-Rank test以及COX比例风险模型分析益生菌是否可以降低VAP发病。以P<0.05为差异有统计学意义。
2 结果 2.1 基线资料比较通过纳入和排除标准,最终纳入的患者共94例,其中益生菌组患者46例,对照组患者48例,两组患者的性别、年龄比较差异无统计学意义(P>0.05);进一步比较APACHEⅡ评分、原发病情况以及入科时乳酸水平发现两组患者差异无统计学意义(P>0.05),两组具有可比性,见表 1。
| 指标 | 对照组 | 益生菌组 | t/χ2值 | P值 |
| n | 48 | 46 | ||
| 年龄(岁) | 64.35±7.89 | 62.52±8.25 | 1.76 | 0.087 |
| 性别(男/女) | 29/19 | 30/16 | 1.43 | 0.231 |
| APACHEII评分(分) | 21.25±3.45 | 20.46±3.18 | 1.48 | 0.147 |
| 原发病,n(%) | ||||
| 呼吸系统 | 22(45.83) | 20(43.48) | 2.52 | 0.112 |
| 腹腔 | 8(16.67) | 9(19.57) | 3.42 | 0.065 |
| 皮肤软组织 | 3(6.25) | 2(4.35) | 3.09 | 0.078 |
| 泌尿系统 | 10(20.83) | 11(23.91) | 2.04 | 0.150 |
| 其他 | 3(6.25) | 4(8.70) | 1.56 | 0.212 |
| 乳酸(mmol/L) | 6.7±2.13 | 6.9±2.40 | 1.19 | 0.244 |
与对照组比较,益生菌组患者的VAP发病率、菌血症的发病率明显低于对照组,差异有统计学意义(χ2=4.763,P=0.029;χ2=4.438,P=0.035);两组患者28 d病死率、ICU住院时间比较差异无统计学意义(χ2=2.02,P=0.167;t=2.16,P=0.038)。通过比较两组机械通气时间发现,益生菌组的机械通气时间短于对照组(t=1.29,P=0.208),见表 2。
| 指标 | 对照组 | 益生菌组 | t/χ2值 | P值 |
| n | 48 | 46 | ||
| VAP(n,%) | 23(47.92) | 18(39.13) | 4.763 | 0.029 |
| 菌血症(n,%) | 4(8.33) | 3(6.52) | 4.438 | 0.035 |
| 病死率(n,%) | 3(6.25) | 3(6.52) | 2.02 | 0.167 |
| 机械通气时间(d) | 15.50±4.46 | 14.27±3.98 | 2.16 | 0.038 |
| ICU住院时间(d) | 23.36±4.47 | 19.17±3.19 | 1.29 | 0.208 |
通过Log-Rank test分析显示益生菌组的无VAP时间明显长于对照组,差异有统计学意义(P<0.05),见图 1;通过校正APACHEⅡ评分、年龄后,COX比例风险模型分析示对于28 d VAP发病益生菌干预组与对照组的RR值分别为0.18(95% CI:0.12~0.74,P=0.025)和0.21(95% CI:0.19~0.95,P=0.042)。
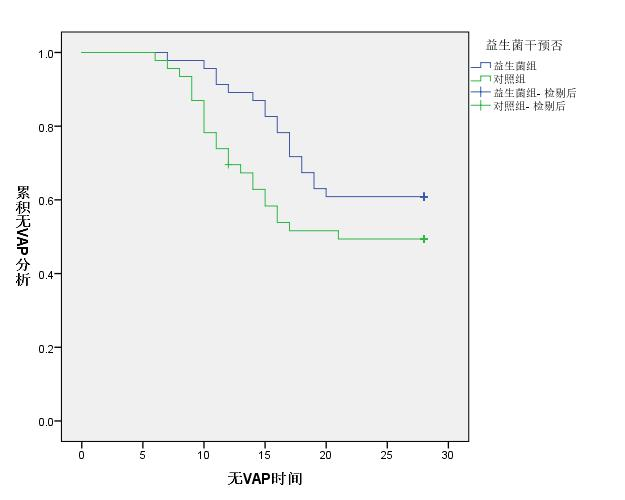
|
| 图 1 Log-Rank分析结果 Fig 1 The Log-Rank analysis results |
|
|
脓毒症为机体对感染的反应失调而导致危及生命的器官功能障碍,为ICU常见的重症感染,对于伴有呼吸衰竭需行有创机械通气治疗患者而言,早期脱机拔管及降低VAP发病率为治疗脓毒症患者的关键,能够改善患者的预后[6]。肠道为人体中最大的“储菌库”和“内毒素库”,人体正常健康情况下肠黏膜具有完整严密的屏障功能,但是对于危重患者肠黏膜屏障功能受损或衰竭时,肠内病原菌或内毒素可经肠道移位而导致肠源性感染[7]。大量研究证实益生菌有助于平衡危重患者肠内菌群,减少菌群移位,除此之外对于减轻全身炎症反应及调节免疫功能具有一定作用[8]。而益生菌对于脓毒症机械通气患者VAP发生情况的相关研究报道国内尚罕见,本文主要研究探讨了益生菌强化治疗在降低脓毒症机械通气患者VAP中的应用。
本文研究结果发现与健康对照组比较,益生菌强化治疗能够降低脓毒症机械通气患者VAP的发病率,除此之外能够降低患者菌血症发生率及缩短患者的机械通气时间。进一步通过Log-Rank test以及COX比例风险模型分析显示益生菌干预能够降低脓毒症机械通气患者的VAP发生。相关研究证实脓毒症患者肠道内的益生菌数量例如双歧杆菌是明显下降的,尤其在全身炎症反应综合征患者中下降呈持续性,且脓毒症患者的肠道菌群失调以及益生菌数量的下降加重了患者其他部位的感染并增加了病死率[8]。对肠道菌群进行调节干预在危重症领域越来越受到重视。目前临床上关于益生菌对VAP预防作用也有相关报道,作用机制与多方面因素相关,一方面益生菌能够促进机体产生抗菌肽物质,刺激免疫球蛋白的产生,抗氧化应激以及抑制NF-kB等炎症信号通路,从而对机体产生免疫调节及抑制炎症反应[9-11];另一方面益生菌能够调节肠道菌群从而减少菌群移位,例如目前多项研究证实了益生菌能够减少机械通气患者口咽部及胃部细菌的定植[12],结合本文研究结果益生菌的给予能够降低患者菌血症的发生,推测与益生菌抑制胃肠道菌群移位可能存在一定相关性。对于脓毒症患者常伴有全身系统的炎症反应综合征,益生菌下降较其他危重患者更甚,因此对于维持肠道菌群稳定及补充益生菌显得尤其重要,而不同时期给予危重症患者益生菌给效果也是有所差异的,本文为机械通气后24~72 h内尽早给予,相关研究也证实了早期给予益生菌较晚期给予更能够增加有机酸例如丁酸等的含量,可进一步促进肠道上皮的生长代谢、抗感染以及维持免疫平衡,并能较晚期缩短患者的住院时间[13-15]。Fukuda等[16]在大鼠模型中证实双歧杆菌能够通过三磷酸腺苷结合盒型碳水化合物转运体产生醋酸盐而防止菌群移位。Shimizu等[17]研究证实益生菌能够保持肠道菌群以及有机酸尤其是醋酸盐的稳定,醋酸盐和乳酸盐浓度的升高有助于抑制肠道内毒素的产生,使内皮细胞连接紧密,从而防止肠道内菌群移位,减少了呼吸机相关性肺炎的发病率。虽然目前大量文献报道了益生菌对于呼吸道或是肺部感染的益处,但是具体机制、益生菌种类以及安全性等有待于进一步明确,也有相关研究报道结果呈阴性,例如Zeng等[18]通过一项随机对照研究发现益生菌给予不能降低危重症患者VAP发生率以及抗生素使用时间、ICU住院时间。因此关于益生菌对呼吸机相关性肺炎的研究仍需要进一步多中心、大规模的随机对照研究[19]。
利益冲突 所有作者均声明不存在利益冲突
| [1] | Mira JC, Gentile LF, Mathias BJ, et al. Sepsis pathophysiology, chronic critical illness, and persistent inflammation-immunosuppression and catabolism syndrome[J]. Crit Care Med, 2017, 45(2): 253-262. DOI:10.1097/CCM.0000000000002074 |
| [2] | von Bahr V, Hultman J, Eksborg S, et al. Long-term survival in adults treated with extracorporeal membrane oxygenation for respiratory failure and sepsis[J]. Crit Care Med, 2017, 45(2): 164-170. DOI:10.1097/CCM.0000000000002078 |
| [3] | 刘丹, 刘伟, 王晓红, 等. 脓毒症患者肠屏障功能损伤的临床研究[J]. 中华急诊医学杂志, 2018, 27(7): 785-789. DOI:10.3760/cma.j.issn.1671-0282.2018.07.015 |
| [4] | Rinaldi E, Consonni A, Guidesi E, et al. Gut microbiota and probiotics: novel immune system modulators in myasthenia gravis?[J]. Ann N Y Acad Sci, 2018, 1413(1): 49-58. DOI:10.1111/nyas.13567 |
| [5] | 中华医学会呼吸病学分会感染学组. 中国成人医院获得性肺炎与呼吸机相关性肺炎诊断和治疗指南(2018年版)[J]. 中华结核和呼吸杂志, 2018, 41(4): 255-280. DOI:10.3760/cma.j.issn.1001-0939.2018.04.006 |
| [6] | Gotts JE, Matthay MA. Sepsis: pathophysiology and clinical management[J]. BMJ, 2016: i1585. DOI:10.1136/bmj.i1585 |
| [7] | Vitetta L, Saltzman ET, Thomsen M, et al. Adjuvant probiotics and the intestinal microbiome: enhancing vaccines and immunotherapy outcomes[J]. Vaccines (Basel), 2017, 5(4): E50. DOI:10.3390/vaccines5040050 |
| [8] | Sánchez B, Delgado S, Blanco-Míguez A, et al. Probiotics, gut microbiota, and their influence on host health and disease[J]. Mol Nutr Food Res, 2017, 61(1). DOI:10.1002/mnfr.201600240 |
| [9] | Hedin C, Whelan K, Lindsay JO. Evidence for the use of probiotics and prebiotics in inflammatory bowel disease: a review of clinical trials[J]. Proc Nutr Soc, 2007, 66(3): 307-315. DOI:10.1017/S0029665107005563 |
| [10] | Ganji-Arjenaki M, Rafieian-Kopaei M. Probiotics are a good choice in remission of inflammatory bowel diseases: a meta analysis and systematic review[J]. J Cell Physiol, 2018, 233(3): 2091-2103. DOI:10.1002/jcp.25911 |
| [11] | Heshmati J, Farsi F, Shokri F, et al. A systematic review and meta-analysis of the probiotics and synbiotics effects on oxidative stress[J]. J Funct Foods, 2018, 46: 66-84. DOI:10.1016/j.jff.2018.04.049 |
| [12] | 万有栋, 朱瑞雪, 潘新亭, 等. 脓毒性休克患者肠道微生态变化临床研究[J]. 中华急诊医学杂志, 2019, 28(3): 350-355. DOI:10.3760/cma.j.issn.1671-0282.2019.03.014 |
| [13] | Marsella R, Santoro D, Ahrens K. Early exposure to probiotics in a canine model of atopic dermatitis has long-term clinical and immunological effects[J]. Vet Immunol Immunopathol, 2012, 146(2): 185-189. DOI:10.1016/j.vetimm.2012.02.013 |
| [14] | Hashemi A, Villa CR, Comelli EM. Probiotics in early life: a preventative and treatment approach[J]. Food Funct, 2016, 7(4): 1752-1768. DOI:10.1039/c5fo01148e |
| [15] | Vitetta L, Saltzman ET, Thomsen M, et al. Adjuvant probiotics and the intestinal microbiome: enhancing vaccines and immunotherapy outcomes[J]. Vaccines (Basel), 2017, 5(4): E50. DOI:10.3390/vaccines5040050 |
| [16] | Fukuda S, Toh H, Hase K, et al. Bifidobacteria can protect from enteropathogenic infection through production of acetate[J]. Nature, 2011, 469(7331): 543-547. DOI:10.1038/nature09646 |
| [17] | Shimizu K, Yamada T, Ogura H, et al. Synbiotics modulate gut microbiota and reduce enteritis and ventilator-associated pneumonia in patients with sepsis: a randomized controlled trial[J]. Crit Care, 2018, 22(1): 239. DOI:10.1186/s13054-018-2167-x |
| [18] | Zeng J, Wang CT, Zhang FS, et al. Effect of probiotics on the incidence of ventilator-associated pneumonia in critically ill patients: a randomized controlled multicenter trial[J]. Intensive Care Med, 2016, 42(6): 1018-1028. DOI:10.1007/s00134-016-4303-x |
| [19] | Virk HS, Wiersinga WJ. Current place of probiotics for VAP[J]. Crit Care, 2019, 23(1): 46. DOI:10.1186/s13054-019-2325-9 |
 2021, Vol. 30
2021, Vol. 30




