2 广东省人民医院急危重症医学部,广州 510080
2 Department of Emergency and Critical Care Medicine, Guangdong Provincial People's Hospital, Guangzhou 510080, China
新生儿脓毒症严重威胁患儿生存和健康,常常造成其远期的神经功能障碍[1-2]。脓毒症新生儿远期神经功能障碍主要包括认知功能缺陷、精神分裂症、智力障碍、抑郁和焦虑等[3-4]。目前许多研究发现这类患儿的病理特征为脑室周边白质损伤(PWMD),其主要表现为小胶质细胞、星形胶质细胞活化和轴突的低髓鞘化[5]。星形胶质细胞是脑内最丰富的细胞类型。在脑损伤过程中,星形胶质细胞会发生向反应性星形胶质细胞的剧烈转变,活化后的星形胶质细胞不仅会释放炎症因子,还可能失去正常的神经营养功能而影响周围其他神经细胞发育的正常微环境导致神经结构及功能异常[6-7]。褪黑素是松果体分泌的一种吲哚类神经内分泌激素具有抗炎、抗氧化应激、抗凋亡等生物学作用[1, 8-9]。而对脓毒症新生儿PWMD是否具有治疗作用及机制是什么?目前尚不清楚。因此本实验通过LPS建立脓毒症新生鼠模型,探讨褪黑素对脓毒症新生鼠脑内星形胶质细胞活化及其焦虑样行为的影响,为进一步探讨褪黑素治疗新生儿脓毒症远期神经功能障碍的相关机制提供理论依据。
1 材料与方法 1.1 动物新生SD乳鼠(P1d)在广东省医学实验动物中心SPF级动物房饲养。将新生乳鼠随机(随机数字法)分为对照组、脓毒症组、褪黑素组。脓毒症组乳鼠腹腔注射一次LPS(1 mg/kg);褪黑素组腹腔注射一次LPS 0.5 h后连续28 d腹腔注射MEL(10 mg/kg)。P28d给药结束后,P29d进行动物行为学检测。
1.2 主要试剂脂多糖(Sigma,美国);褪黑素(Sigma);褪黑素受体抑制剂(abcam,英国);GFAP抗体(ab7260);TNF-α抗体(ab1793);NF-κB p65抗体(ab16502);NF-κB pp65抗体(ab76302);GAPDGH抗体(ab9485)。Anti-rabbit IgG(7074S)、Anti-mouse IgG(7076S)、Anti-rabbit IgG (ab150077)和Anti-mouse IgG荧光二抗(ab150116)购于abcam公司。引物设计与合成、逆转录试剂盒及荧光定量试剂盒购于日本TaKaRa公司。
1.3 旷场实验24只动物(每组8只)在测定房间适应环境30 min后,进行旷场实验。手提P29d大鼠尾部,将动物放入旷场中央位置,视频记录5 min内动物的活动,包括各区域活动时间、各区域路程、总路程。每完成一只动物,清理箱子里的粪便,酒精擦拭以消除气味对下只动物的影响。旷场实验1次/ d,连续进行3 d。
1.4 原代星形胶质细胞培养及干预原代星形胶质细胞纯化培养:SD乳鼠(P1d)酒精消毒后取脑,显微镜下剔除脑血管膜,分离出皮层,剪碎后用0.125%胰酶37℃消化10 min,胎牛血清终止消化。使用200目滤网过滤细胞悬液,离心(1 000 r/min,5 min),弃上清液,收集细胞并接种于预先包被多聚赖氨酸的75 cm2培养瓶中。培养基为含10%胎牛血清的DMEM/F12,在37℃恒温培养箱中培养。1周后,将瓶底覆盖的细胞进行传代纯化。本实验采取第3代细胞进行后续实验。将纯化星形胶质细胞分为CON组、LPS组(1 μg/mL)、LPS+MEL(100 nmol/mL)组和LPS+MEL+LUZ(10 nmol/mL)四组。
1.5 免疫荧光染色组织免疫荧光:麻醉3 d、7 d两组动物后,暴露胸腔,经心尖部插管灌注固定后取脑,恒冷箱切片机制片。PBS缓冲液洗涤后用10%驴血清室温封闭2 h,GFAP(1:300)、TNF-α(1:100)4℃孵育过夜;复温后PBS洗涤,488山羊抗兔IgG、594山羊抗小鼠IgG室温避光孵育1 h。抗荧光淬灭封片剂(含DAPI)染核封片后置于荧光显微镜下拍照观察。
细胞免疫荧光:制作星形胶质细胞玻璃爬片,干预结束后去除培养基,PBS浸洗3次;4%多聚甲醛固定爬片15 min;5%BSA(含0.2% Triton X-100)室温封闭45 min;GFAP(1:300)、TNF-α(1:100)4℃孵育过夜;荧光二抗室温避光孵育1 h。封片剂染核封片后置于荧光显微镜下观察拍照。
1.6 Western Blot检测总蛋白提取试剂盒提取各组动物胼胝体组织、星形胶质细胞总蛋白。采用BCA法测定总蛋白浓度,配平后100℃蛋白变性10 min;聚丙烯酰胺凝胶电泳,转膜和封闭,分别用GFAP(1:1 000)、TNF-α(1:1 000);NF-κB p65(1:1 000);NF-κB pp65(1:1 000);GAPDGH(1:5 000)4℃孵育过夜;室温孵育二抗1 h后,ECL发光液显影,应用Image J图像分析软件进行分析。
1.7 实时荧光定量PCRTrizol法提取CON组、LPS组、LPS+MEL组星形胶质细胞总RNA,使用RNA逆转录试剂盒获得各组相应的cDNA。随后根据荧光定量PCR试剂盒说明书进行qRT-PCR扩增。引物序列为GDNF-F:CAGAGGGAAAGGTCGCAGAGG, GDNF-R:TAGCCCAAACCCAAGTCAGTG; BDNF-F:CGATGCCAGTTGCTTTGTCTTC, BDNF-R:AAGTTCGGCTTTGCTCAGTGG; GAPDH- F:GTGCCAGCCTCGTCTCATAG,GAPDH-R:AGAGAAGGCAGCCCTGGTAA。PCR反应条件:95℃预变性30 s; 95℃变性5 s; 60℃退火30 s, 共40个循环。
1.8 统计学方法采用SPSS 25.0进行统计分析,计量资料采用均数±标准差(Mean±SE)表示。多组间比较采用单因素和双因素方差分析(LSD-t检验);采用Graph Pad Prism软件作图。以P<0.05为差异有统计学意义。
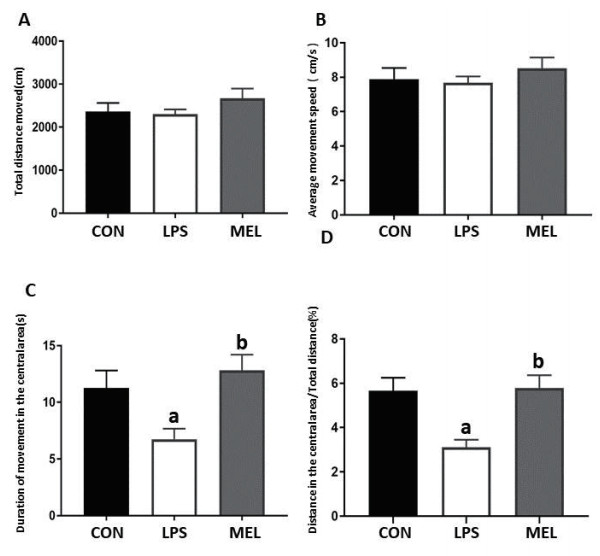
2 结果 2.1 各组大鼠旷场实验结果比较造模后28 d采用旷场实验对三组大鼠进行行为学测试。对照组、LPS组、褪黑素组三组大鼠在旷场实验中活动总路程、平均速度比较,差异无统计学意义(F值分别为1.185、0.616;均P>0.05)(图 1A、B );各组中央区活动时间、中央路程/总路程与对照组相比,差异有统计学意义(F值分别为5.892、8.660;均P<0.05)。与对照组相比,LPS组中央区活动时间显著降低(P<0.05);与LPS组比较,褪黑素组可显著延长中央区活动时间(P<0.05)(图 1C)。LPS组与对照组比较,中央路程/总路程显著降低(P<0.01);而褪黑素组与LPS组比较,中央路程/总路程显著延长(P<0.01)(图 1D)。
|
| 与CON组比较,a P < 0.05;与LPS组比较,b P < 0.05 图 1 褪黑素对脓毒症幼鼠远期焦虑样行为的影响(n=8) Fig 1 The effect of melatonin on the long-term anxiety-like behavior of septic neonatal rats(n=8) |
|
|
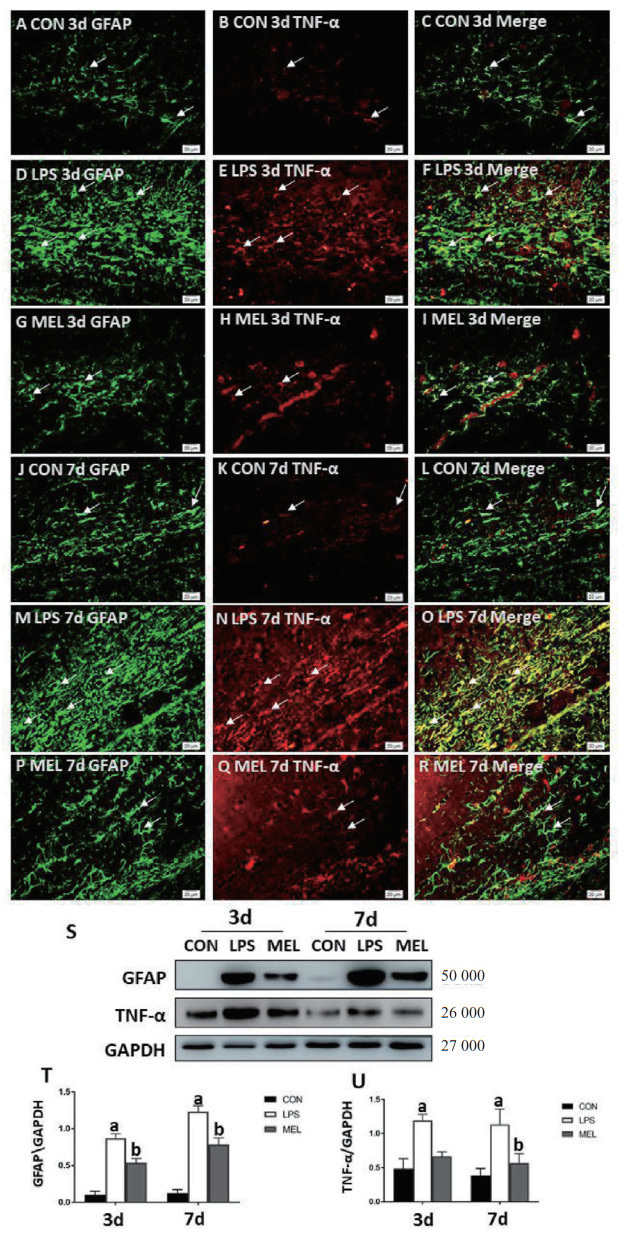
采用免疫荧光染色和Western Blot法观察褪黑素对LPS诱导星形胶质细胞的活化作用。与对照组比较,LPS组大鼠3 d、7 d时胼胝体星形胶质细胞胞体明显增大,突起肥大,GFAP阳性细胞数目明显增加;与LPS组比较,褪黑素组GFAP+细胞数目明显减少(见图 2A-R)。Western Blot结果显示LPS组3 d、7 d胼胝体GFAP蛋白水平较对照组明显升高, 而褪黑素可抑制LPS诱导的GFAP蛋白水平升高(F=101.3,均P<0.05)(见图 2S, T)。
|
| 与CON组比较,a P < 0.05;与LPS组比较,b P < 0.05 图 2 褪黑素对脓毒症幼鼠胼胝体内GFAP和TNF-α表达的影响(n=3) Fig 2 The effect of the melatonin on the expression level of GFAP and TNF-α in corpus callosum of septic neonatal rats(n=3) |
|
|
Western Blot结果显示LPS组3 d、7 d胼胝体内TNF-α蛋白表达较对照组明显升高,褪黑素组TNF-α表达较LPS组明显下降(F=15.23,均P<0.05)(见图 2S, R)。免疫荧光结果显示:TNF-α可与GFAP共定位表达,与对照组比较,LPS组GFAP+/TNF-α+阳性细胞数目明显增多;与LPS组GFAP+/TNF-α+阳性细胞数目比较,褪黑素组明显减少(见图 2A-R)。
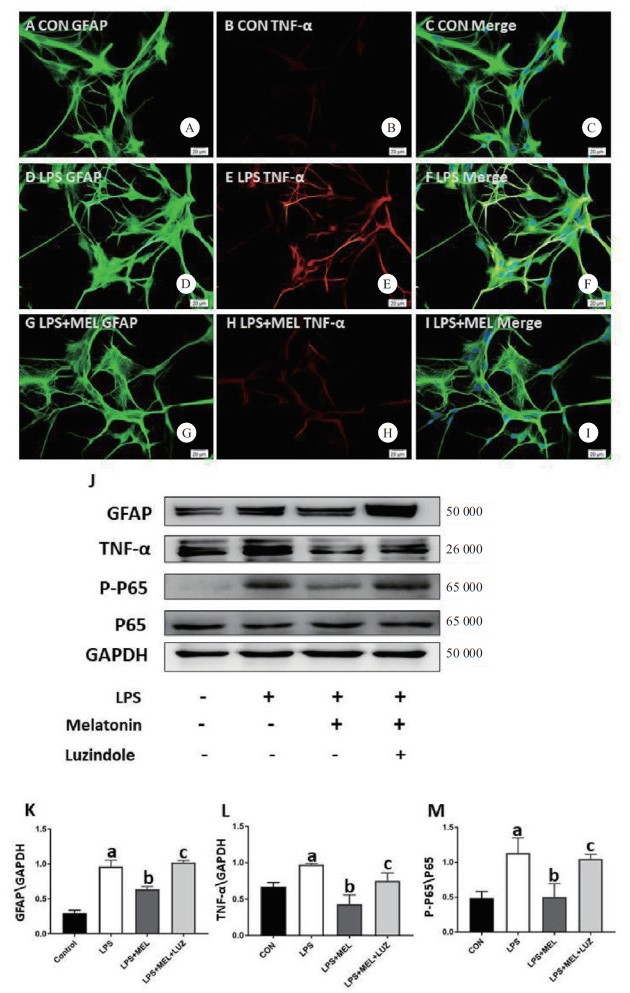
2.4 褪黑素对LPS诱导的星形胶质细胞GFAP、TNF-α、p-NF-κBp65、NF-κBp65蛋白表达的影响Western Blot结果显示:与对照组比较,LPS处理原代星形胶质细胞24 h后,GFAP、TNF-α、p-NF-κBp65表达明显升高,褪黑素干预后LPS组GFAP、TNF-α、p-NF-κBp65表达下降,此作用可被褪黑素受体抑制剂阻断(F值分别为37.83、6.314、4.81;均P<0.05)。(见图J-M)。免疫荧光结果显示:LPS干预星形胶质细胞TNF-α表达升高,褪黑素干预后TNF-α表达下降,此作用可被褪黑素受体抑制剂阻断(见图A-I)。
|
| 与CON组比较,a P < 0.05;与LPS组比较,b P < 0.05;与LPS+MEL组比较,cP<0.05 图 3 褪黑素对LPS诱导星形胶质细胞表达GFAP和TNF-α的影响(n=3) Fig 3 The effect of melatonin on GFAP and TNF-α expression in primary astrocytes stimulated by LPS |
|
|
|
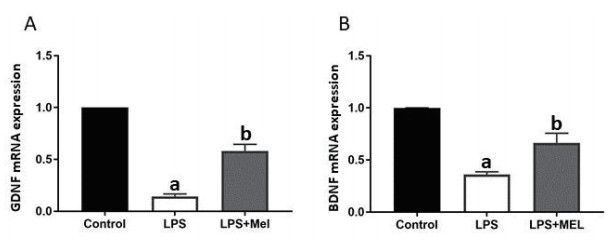
| 与CON组比较,a P < 0.05;与LPS组比较,b P < 0.05 图 4 褪黑素对LPS诱导星形胶质细胞GDNF和BDNF mRNA表达的影响(n=3) Fig 4 The effect of melatonin on mRNA expression of GDNF and BDNF in primary astrocytes stimulated by LPS |
|
|
荧光定量PCR结果显示:与对照组比较,LPS组原代星形胶质细胞GDNF、BDNF mRNA表达明显下降,褪黑素干预后LPS组原代星形胶质细胞GDNF、BDNF mRNA表达升高(F值分别为117.6、32.91;P<0.05)。
3 讨论脂多糖(LPS)诱导的神经炎症在中枢神经系统疾病发生发展中发挥着重要作用。本研究使用LPS腹腔注射制备脓毒症动物模型, 模拟临床中新生儿脓毒症脑损伤的病理生理特点。这种脓毒症幼鼠成年后易出现运动、认知功能障碍[1]。旷场实验是基于大鼠的趋避性,用于研究大鼠自发活动行为、焦虑行为的重要行为学实验[10]。本实验发现LPS组大鼠总路程和平均速度较对照组均差异无统计学意义,说明两者自发活动差异无统计学意义。LPS组大鼠中央区域活动时间和中央路程/总路程占比较对照组显著降低,提示其焦虑水平较高。神经炎症是导致脓毒症幼鼠后期焦虑的重要原因之一[11],研究证实腹腔注射LPS后,星形胶质细胞迅速活化,释放大量炎症因子如TNF-α、IL-1β引起神经功能障碍[12]。星形胶质细胞在中枢神经系统调节体液平衡和神经递质代谢,促进突触的形成,参与血脑屏障的构建等[13-14];而星形胶质细胞活化后不仅丧失了促进突触的形成、神经元的存活和生长等正常功能,还可诱导少突胶质细胞凋亡[7]。GFAP是星形胶质细胞活化的标志物[15]。腹腔注射LPS3 d、7 d后,大鼠胼胝体内GFAP和TNF-α蛋白表达水平升高;通过免疫荧光共定位发现星形胶质细胞可与TNF-α荧光共定位,提示腹腔注射LPS3 d、7 d后脓毒症大鼠胼胝体内存在大量活化的星形胶质细胞并分泌TNF-α。
褪黑素,松果体分泌的一种吲哚类神经内分泌激素, 对生物的昼夜节律、衰老、免疫反应、氧化应激等均有调节作用[16-17]。本研究发现褪黑素可以增加LPS组大鼠中央区域活动时间和中央路程/总路程占比,表明褪黑素可改善脓毒症新生鼠的远期焦虑样行为。本实验结果显示褪黑素能明显抑制脓毒症大鼠胼胝体星形胶质细胞的激活,减少TNF-α表达,提示褪黑素改善炎症诱导的焦虑样行为,其机制可能是通过抑制星形胶质细胞活化,进而减轻神经炎症反应。
接下来通过体外实验对褪黑素改善脓毒症新生鼠远期焦虑样行为机制做了初步探讨。研究表明,在LPS刺激下,原代星形胶质细胞明显活化,褪黑素干预可降低LPS诱导的GFAP、TNF-α蛋白表达,而此作用可被褪黑素受体抑制剂所阻断。同时,本实验还检测到褪黑素可显著抑制p-NF-κB p65蛋白的表达。NF-κB p65蛋白是一种广泛存在于真核细胞中的转录因子,NF-κB p65活化诱导大量促炎因子的转录,如TNF-α、IL-1β等[18-19]。值得注意的是Lian通过敲除IκBα获得NF-κB持续活化的转基因鼠(NCKO)的IκBα蛋白和mRNA下降水平几乎与选择性敲除星形胶质细胞IκBα鼠(GCKO)的下降水平一致,表明NF-κB信号通路可能主要定位在星形胶质细胞[20]。因此, 褪黑素可能通过NF-κB途径抑制星形胶质细胞活化和TNF-α表达, 发挥神经保护作用。此外,活化星形胶质细胞相比静息态星形胶质细胞,丧失了分泌神经营养因子的重要功能[7]。GDNF、BDNF是能促进神经元生长、分化和存活的神经营养因子。有研究证实脓毒症动物大脑中GDNF、BDNF显著降低并伴有认知功能显著降低, 从而导致脓毒症相关性脑病症状[21]。本研究发现,在LPS刺激下,原代星形胶质细胞神经营养因子GDNF、BDNF mRNA表达降低;而褪黑素可以提高GDNF、BDNF mRNA的表达,发挥神经保护用。
利益冲突 所有作者均声明不存在利益冲突
| [1] | Comim CM, Bussmann RM, Simão SR, et al. Experimental neonatal Sepsis causes long-term cognitive impairment[J]. Mol Neurobiol, 2016, 53(9): 5928-5934. DOI:10.1007/s12035-015-9495-5 |
| [2] | Strunk T, Inder T, Wang XY, et al. Infection-induced inflammation and cerebral injury in preterm infants[J]. Lancet Infect Dis, 2014, 14(8): 751-762. DOI:10.1016/S1473-3099(14)70710-8 |
| [3] | Dubner SE, Dodson CK, Marchman VA, et al. White matter microstructure and cognitive outcomes in relation to neonatal inflammation in 6-year-old children born preterm[J]. Neuroimage Clin, 2019, 23: 101832. DOI:10.1016/j.nicl.2019.101832 |
| [4] | Jiang NM, Cowan M, Moonah SN, et al. The impact of systemic inflammation on neurodevelopment[J]. Trends Mol Med, 2018, 24(9): 794-804. DOI:10.1016/j.molmed.2018.06.008 |
| [5] | Back SA. White matter injury in the preterm infant: pathology and mechanisms[J]. Acta Neuropathol, 2017, 134(3): 331-349. DOI:10.1007/s00401-017-1718-6 |
| [6] | Ryan SM, Nolan YM. Neuroinflammation negatively affects adult hippocampal neurogenesis and cognition: can exercise compensate?[J]. Neurosci Biobehav Rev, 2016, 61: 121-131. DOI:10.1016/j.neubiorev.2015.12.004 |
| [7] | Liddelow SA, Guttenplan KA, Clarke LE, et al. Neurotoxic reactive astrocytes are induced by activated microglia[J]. Nature, 2017, 541(7638): 481-487. DOI:10.1038/nature21029 |
| [8] | Morabito R, Remigante A, Marino A. Melatonin protects band 3 protein in human erythrocytes against H2O2-induced oxidative stress[J]. Molecules, 2019, 24(15): E2741. DOI:10.3390/molecules24152741 |
| [9] | Sinha B, Wu QF, Li W, et al. Protection of melatonin in experimental models of newborn hypoxic-ischemic brain injury through MT1 receptor[J]. J Pineal Res, 2018, 64(1). DOI:10.1111/jpi.12443 |
| [10] | 王维刚, 刘震泽, 吴文婷, 等. 旷场实验在小鼠行为分析中的应用[J]. 中国细胞生物学学报, 33(11): 1191-1196. |
| [11] | Khan A, Shal B, Naveed M, et al. Matrine ameliorates anxiety and depression-like behaviour by targeting hyperammonemia-induced neuroinflammation and oxidative stress in CCl4 model of liver injury[J]. Neurotoxicology, 2019, 72: 38-50. DOI:10.1016/j.neuro.2019.02.002 |
| [12] | Zhang F, Zhang JG, Yang W, et al. 6-Gingerol attenuates LPS-induced neuroinflammation and cognitive impairment partially via suppressing astrocyte overactivation[J]. Biomedecine Pharmacother, 2018, 107: 1523-1529. DOI:10.1016/j.biopha.2018.08.136 |
| [13] | Abbott NJ, Rönnbäck L, Hansson E. Astrocyte-endothelial interactions at the blood-brain barrier[J]. Nat Rev Neurosci, 2006, 7(1): 41-53. DOI:10.1038/nrn1824 |
| [14] | Ballabh P, Braun A, Nedergaard M. The blood-brain barrier: an overview: structure, regulation, and clinical implications[J]. Neurobiol Dis, 2004, 16(1): 1-13. DOI:10.1016/j.nbd.2003.12.016 |
| [15] | 李民涛, 董健, 崔守永. 神经生物标志物用于轻度创伤性脑损伤诊断的研究进展[J]. 中华急诊医学杂志, 28(9): 1171-174. DOI:10.3760/cma.j.issn.1671-0282.2019.09.027 |
| [16] | Magri F, Sarra S, Cinchetti W, et al. Qualitative and quantitative changes of melatonin levels in physiological and pathological aging and in centenarians[J]. J Pineal Res, 2004, 36(4): 256-261. DOI:10.1111/j.1600-079X.2004.00125.x |
| [17] | 吴先龙, 蔡旗旗, 应盼 , 等. 褪黑激素通过抑制NF-κB介导的炎症改善肝脏缺血-再灌注损伤的实验研究[J]. 中华急诊医学杂志, 29(10): 1590-1594. DOI:10.3760/cma.j.issn.1671-0282.2020.12.016 |
| [18] | 宋来新, 张长城, 王婷, 等. 淫羊藿总黄酮通过抑制MAPK/NF-κB信号通路减轻自然衰老大鼠脑组织炎症反应[J]. 中国药理学通报, 2017, 33(1): 84-90. |
| [19] | Ge Y, Huang M, Ma YF. The effects of microRNA-34a regulating Notch-1/NF-κB signaling pathway on lipopolysaccharide-induced human umbilical vein endothelial cells[J]. World J Emerg Med, 2017, 8(4): 292-296. DOI:10.5847/wjem.j.1920-8642.2017.04.008 |
| [20] | Lian H, Yang L, Cole A, et al. NFκB-activated astroglial release of complement C3 compromises neuronal morphology and function associated with Alzheimer's disease[J]. Neuron, 2015, 85(1): 101-115. DOI:10.1016/j.neuron.2014.11.018 |
| [21] | Ji MH, Xia DG, Zhu LY, et al. Short-and long-term protective effects of melatonin in a mouse model of Sepsis-associated encephalopathy[J]. Inflammation, 2018, 41(2): 515-529. DOI:10.1007/s10753-017-0708-0 |
 2021, Vol. 30
2021, Vol. 30




