急性肾损伤(acute kidney injury,AKI)是一组以肾小球滤过率(glomerular filtration rate,GFR)突然下降为特征的异质性疾病,其主要并发症包括容量过负荷、电解质紊乱、尿毒症等[1]。成年患者的AKI发病率为21.6%,大约10%需要肾脏替代治疗[2],严重影响患者的生存及生活质量。目前AKI主要以血肌酐(serum creatinine,SCr)和尿量作为诊断及分期标准[3-4],但具有一定的局限性[5]。SCr升高落后于GFR下降,且受年龄、性别、体质量、肌肉代谢、稀释效应及药物等多种因素影响[6-7]。尿量容易受药物、容量状态等因素影响。多种生化指标包括中性粒细胞明胶酶相关脂质运载蛋白(neu-trophil gelatinase-associated lipocalin, NGAL)、可溶性血栓调节蛋白(soluble thrombomdulin, sTM)[8]以及肾损伤分子-1(kidney injury molecule-1, KIM-1)[9]等可帮助评估AKI,但这些生化指标无法即刻检测,尚不能在临床广泛应用。有研究显示肾动脉阻力指数(renal resistive index,RRI)和肾能量多普勒超声(power Doppler ultrasound,PDU)半定量评分可帮助评估肾脏灌注情况[10-12],且操作简单,越来越广泛地应用于危重患者的床旁评估。PDU评分和RRI可床旁短时间内同时获得,这两种指标联合可能具有良好的应用前景。Contti等[11]发现RRI和肾PDU半定量评分的联合指标对肾移植患者移植肾功能延迟恢复的预测价值优于RRI和PDU半定量评分单独的预测价值。
目前认为脓毒症相关AKI的病理生理学机制为脓毒症以及炎症反应所释放的可溶性中分子物质的毒性作用所致,而肾脏血流可正常甚至增加[13-15]。临床研究发现,RRI和PDU评分对脓毒症相关AKI的预测价值均较差,而在急性心力衰竭患者中的预测价值较好[16]。因此本研究选取了三种RRI和PDU半定量评分联合方式,分别在非脓毒症危重患者及急性心力衰竭患者中探讨这三种联合方式对发生AKI 3期的预测价值。
1 资料与方法 1.1 一般资料本研究为单中心前瞻性观察性研究,纳入2018年1月至2019年8月于沧州市中心医院急诊重症监护室(intensive care unit,ICU)住院的非脓毒症危重患者作为研究对象。排除标准:⑴年龄<18岁;⑵存活时间<24h;⑶孕妇;⑷存在脓毒症;⑸尿路梗阻导致的肾功能不全;⑹慢性肾衰竭需要长期透析治疗;⑺AKI恢复期;⑻腹胀明显导致超声显示不清;⑼腹腔内压(膀胱内压)>15 mmHg(1 mmHg=0.133kPa);⑽肾动脉狭窄及心律失常不适宜应用RRI;⑾无法识别肾内动脉而无法获取RRI;⑿住院期间放弃治疗。
本研究获沧州市中心医院伦理委员会批准(批准文号:2017-078-01)。
AKI诊断标准依据2012年"改善全球肾脏病预后组织"(Kidney Disease:Improving Global Outcomes,KDIGO)制定的AKI诊断分期标准[17]。以入ICU前一个月内SCr最低水平为基线肌酐水平。如基线肌酐水平无法获得,通过肾脏疾病饮食调整(modification of diet in renal disease,MDRD)公式假设GFR为75mL·min-1·(1.73m2)-1计算而得[18]。公式如下(SCr的单位为mg/dL):GFR [mL·min-1·(1.73m2)-1] = 186×SCr-1.154× [年龄(岁)]-0.203×0.742(为女性)×1.233(为中国人)。
1.2 研究方法记录患者的性别、年龄、体质量指数、合并症、主要诊断等一般资料;记录入ICU 6h内的动脉血乳酸、SCr、尿量、是否应用机械通气、是否应用血管活性药物等信息;入ICU 24h后评估急性生理学与慢性健康状况(acute physiology and chronic health evaluation,APACHE)-Ⅱ评分及序贯器官衰竭(sequential organ failure assessment,SOFA)评分;于入ICU第5天依据KDIGO标准进行肾功能评估,按肾功能情况将患者分为AKI 3期组(入ICU 5d内进展为AKI 3期)和AKI 0-2期组(未发生AKI或发生AKI 1或2期)。入住ICU 28d记录连续性肾脏替代治疗(continuous renal replacement therapy,CRRT)应用情况及病死率。
1.3 RRI及肾PDU评分测定入ICU 6h内、血流动力学相对稳定平均动脉压(mean arterial pressure,MAP)维持在65mmHg以上时完成肾脏超声检查。所有超声检查均由熟练掌握重症超声检查技术的医生进行。大多数患者于右侧肾脏测量。所使用医学超声仪为CX30及HD15(Philips Healthcare,Bothell,WA,USA)。
RRI的测量方法:使用凸阵探头,二维超声模式下于腹部后外侧获取肾脏长轴切面,用彩色多普勒定位一条叶间动脉进行脉冲多普勒检查,测量收缩期峰流速(peak systolic velocity,PSV)及舒张末期最低流速(end-diastolic velocity,EDV),计算RRI=(PSV-EDV)/PSV,3次测量后取平均数。
肾PDU半定量法的操作方法:使用凸阵探头,于腹部后外侧扫查获取肾脏长轴切面,用能量多普勒观察肾血流灌注情况,获得最佳的血流图像后保存以备离线分析。图像采用0~3分4级法行PDU评分[19]:0分为检查不到肾脏血管;1分为肾门可见少许血管;2分为大部分肾实质内可见叶间动脉;3分为整个肾脏可见肾血管显像至弓状动脉水平。
进行肾脏超声检查同时记录患者的心率、MAP、脉压差、氧合指数、机械通气应用情况及血管活性药物应用情况等。
1.4 RRI和PDU评分联合指标本研究选取了三种RRI和PDU评分联合方式,①RRI-RDU/10:参照Contti等[11]研究中RRI和PDU半定量评分的联合方式,为RRI值与PDU半定量评分的1/10相减所得;②RRI/PDU:研究表明PDU评分与RRI具有负相关性[20-21],RRI的水平随着PDU评分的降低而升高,因此选用RRI与PDU评分的比值作为两者联合的一种方式,通过RRI除以PDU评分得出;③RRI+PDU是通过logistic回归分析得出的RRI与PDU评分对发生AKI 3期的联合预测概率。
1.5 统计学方法采用SPSS 26.0统计软件进行统计学处理。计量资料进行正态性检验,符合正态性分布的以均数±标准差(Mean±SD)表示,不符合正态性分布的以中位数(四分位数)[M(QL, QU)]表示;计数资料以频数(率)表示。符合正态分布的计量资料两组间比较采用独立样本t检验;不符合正态分布的计量资料两组间比较采用Mann-Whiney秩和检验。计数资料两组间比较采用卡方检验。通过logistic回归得出RRI与PDU评分对AKI 3期的联合预测概率(即RRI+PDU)。通过绘制受试者工作特征(receiver operator characteristic,ROC)曲线分别评估RRI、PDU评分、RRI-PDU/10、RRI/PDU及RRI+PDU对AKI 3期的预测价值。使用Delong检验方法比较每个预测因子之间ROC曲线下面积(AUC)的差异。ROC曲线分析采用Medcalc软件。以P<0.05为差异有统计学意义。
2 结果 2.1 入选患者的一般情况入选入住ICU的危重患者209例,按照排除标准排除不符合本研究要求的病例99例,包括入院24h内死亡患者15例,住院期间放弃治疗者10例,存在心律失常不宜使用RRI者4例,因无法识别肾内动脉而无法获取RRI者9例,腹腔内高压者2例,脓毒症患者59例,最终有110例非脓毒症危重患者入组分析。其中急性心力衰竭患者63例(63/110,57.3%),多发伤患者15例(15/110,13.6%),慢性阻塞性肺疾病(COPD)患者8例(8/110,7.3%),其他病因患者24例(24/110,21.8%)。63例急性心力衰竭患者中,38例为急性心肌梗死后心力衰竭,2例为急性心肌炎,23例为慢性心力衰竭急性发作(其中20例为陈旧心肌梗死或者缺血性心肌病,1例为瓣膜性心脏病,1例为高血压心脏病,1例为扩张性心肌病)。肾功能评估情况如下:非脓毒症危重患者中,无AKI 51例,AKI 1期21例,AKI 2期11例,AKI 3期27例;急性心力衰竭患者中,无AKI 21例,AKI 1期15例,AKI 2期7例,AKI 3期20例。
2.2 不同AKI分期组间一般资料比较在非脓毒症患者及急性心力衰竭患者中,年龄、性别、合并高血压及合并糖尿病在AKI 0~2期及AKI 3期两组间差异无统计学意义(P>0.05);AKI 3期组的APACHEⅡ评分、SOFA评分、动脉乳酸水平、机械通气比例、应用血管活性药物比例及28d病死率明显高于AKI 0~2期组(P<0.05),见表 1。
| 组别 | 例数 | 男性(例,%) | 年龄(岁) | 合并高血压(例,%) | 合并糖尿病(例,%) | APACHEⅡ评分 |
| 非脓毒症患者 | ||||||
| 所有分期 | 110 | 72(65.5) | 64(48, 73) | 47(42.7) | 27(24.5) | 20(11, 25) |
| AKI 0~2期 | 83 | 53(63.9) | 62(48, 73) | 33(39.8) | 18(21.7) | 17(10, 24) |
| AKI 3期 | 27 | 19(70.4) | 66(55, 73) | 14(51.9) | 9(33.3) | 27(20, 33)b |
| χ2/Z值 | 0.382 | -1.018 | 1.217 | 1.492 | -3.701 | |
| P值 | 0.536 | 0.306 | 0.270 | 0.222 | <0.01 | |
| 急性心力衰竭患者 | ||||||
| 所有分期 | 63 | 43(68.3) | 69(60, 74) | 36(57.1) | 20(31.7) | 21±9 |
| AKI 0~2期 | 43 | 29(67.4) | 69(56, 74) | 24(55.8) | 13(30.2) | 18±8 |
| AKI 3期 | 20 | 14(70.0) | 69(64, 77) | 12(60.0) | 7(35.0) | 28±8b |
| χ2/Z/t值 | 0.041 | -0.436 | 0.098 | 0.143 | -4.870 | |
| P值 | 0.839 | 0.663 | 0.755 | 0.705 | <0.01 | |
| 组别 | 例数 | SOFA评分 | 乳酸(mmol/L) | 机械通气(例,%) | 血管活性药(例,%) | 28d病死率(例,%) |
| 非脓毒症患者 | ||||||
| 所有分期 | 110 | 8(3, 11) | 2.8(1.7, 5.5) | 77(70.0) | 61(55.5) | 19(17.3) |
| AKI 0~2期 | 83 | 6(2, 9) | 2.7(1.5, 4.7) | 54(65.1) | 40(48.2) | 10(12.0) |
| AKI 3期 | 27 | 11(10, 15)b | 4.2(1.8, 11.6)a | 23(85.2)a | 21(77.8)b | 9(33.3)a |
| χ2/Z值 | -4.721 | -2.053 | 3.929 | 7.219 | 5.056 | |
| P值 | <0.01 | 0.040 | 0.047 | 0.007 | 0.025 | |
| 急性心力衰竭患者 | ||||||
| 所有分期 | 63 | 8(4, 11) | 2.7(1.9, 6.3) | 49(77.8) | 43(68.3) | 12(19.0) |
| AKI 0~2期 | 43 | 6(3, 8) | 2.4(1.5, 3.8) | 30(69.8) | 25(58.1) | 4(9.3) |
| AKI 3期 | 20 | 13(10, 16)b | 5.5(2.3, 11.7)b | 19(95.0)a | 18(90.0)a | 8(40.0)a |
| χ2/Z值 | -4.670 | -2.889 | 5.028 | 6.395 | 6.471 | |
| P值 | <0.01 | 0.004 | 0.025 | 0.011 | 0.011 | |
| 注:不符合正态分布的计量资料以中位数(四分位数)表示;计数资料以频数(率)表示。AKI为急性肾损伤,APACHE Ⅱ评分为急性生理学与慢性健康状况Ⅱ评分,SOFA评分为序贯器官衰竭评分;与AKI 0~2期组比较,aP<0.05,bP<0.01 | ||||||
在非脓毒症患者及急性心力衰竭患者中,AKI 3期组的肌酐、RRI、RRI-PDU/10、RRI/PDU、RRI+PDU及应用CRRT比例均明显高于AKI 0~2期组(P<0.05);而尿量和PDU评分明显低于AKI 0~2期组(P<0.05),见表 2。
| 组别 | 例数 | 肌酐(μmol/L) | 尿量(mL/h) | RRI | PDU评分 | ||||
| 非脓毒症患者 | |||||||||
| 所有分期 | 110 | 111(76, 150) | 50(20, 100) | 0.648(0.579, 0.717) | 2(2, 3) | ||||
| AKI 0~2期 | 83 | 97(69, 129) | 70(40, 100) | 0.625(0.556, 0.686) | 3(2, 3) | ||||
| AKI 3期 | 27 | 159(119, 302)b | 15(0, 30)b | 0.733(0.651, 0.760)b | 1(1, 2)b | ||||
| χ2/Z值 | -5.106 | -5.817 | -4.734 | -6.149 | |||||
| P值 | <0.01 | <0.01 | <0.01 | <0.01 | |||||
| 急性心力衰竭患者 | |||||||||
| 所有分期 | 63 | 119(87, 159) | 40(20, 80) | 0.652(0.571, 0.723) | 2(1, 3) | ||||
| AKI 0~2期 | 43 | 106(70, 138) | 50(30, 100) | 0.630(0.520, 0.686) | 2(2, 3) | ||||
| AKI 3期 | 20 | 150(121, 262)b | 15(0, 30)b | 0.737(0.699, 0.760)b | 1(1, 2)b | ||||
| χ2/Z/t值 | -3.404 | -4.471 | -4.379 | -5.584 | |||||
| P值 | 0.01 | <0.01 | <0.01 | <0.01 | |||||
| 组别 | 例数 | RRI-PDU/10 | RRI/PDU | RRI+PDU | CRRT(例,%) | ||||
| 非脓毒症患者 | |||||||||
| 所有分期 | 110 | 0.428(0.294, 0.527) | 0.311(0.200, 0.379) | 0.138(0.014, 0.346) | 26(23.6) | ||||
| AKI 0~2期 | 83 | 0.353(0.271, 0.456) | 0.230(0.194, 0.328) | 0.032(0.012, 0.177) | 4(4.8) | ||||
| AKI 3期 | 27 | 0.557(0.515, 0.655)b | 0.636(0.372, 0.755)b | 0.629(0.319, 0.829)b | 22(81.5)b | ||||
| χ2/Z值 | -6.210 | -6.453 | -6.439 | 66.335 | |||||
| P值 | <0.01 | <0.01 | <0.01 | <0.01 | |||||
| 急性心力衰竭患者 | |||||||||
| 所有分期 | 63 | 0.452(0.300, 0.540) | 0.326(0.217, 0.605) | 0.099(0.002, 0.646) | 21(33.3) | ||||
| AKI 0~2期 | 43 | 0.359(0.264, 0.456) | 0.232(0.190, 0.328) | 0.005(0, 0.107) | 3(7.0) | ||||
| AKI 3期 | 20 | 0.606(0.528, 0.659)b | 0.706(0.436, 0.759)b | 0.934(0.540, 0.977)b | 18(90.0)b | ||||
| χ2/Z值 | -5.715 | -5.863 | -5.863 | 42.342 | |||||
| P值 | <0.01 | <0.01 | <0.01 | <0.01 | |||||
| 注:不符合正态分布的计量资料以中位数(四分位数)表示;计数资料以频数(率)表示。AKI为急性肾损伤,RRI为肾动脉阻力指数,PDU为能量多普勒超声,CRRT为连续肾脏替代治疗;与AKI 0~2期组比较,aP<0.05,bP<0.01 | |||||||||
以入住ICU 5d内发生AKI 3期为阳性定义为1,分别绘制非脓毒症和急性心力衰竭患者中RRI、PDU评分、RRI-PDU/10、RRI/PDU及RRI+PDU预测AKI 3期的ROC曲线。
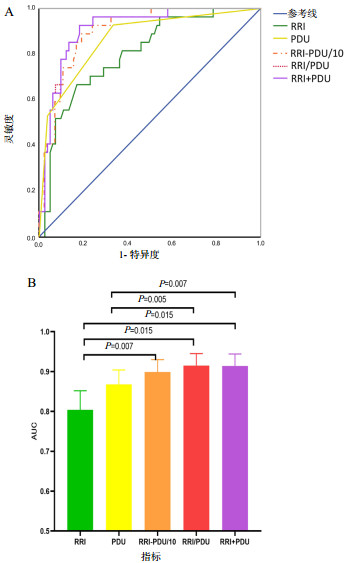
在非脓毒症患者中,RRI/PDU(AUC=0.915,95%CI:0.846~0.959,P<0.01)及RRI+PDU(AUC=0.914,95%CI:0.845~0.959,P<0.01)对AKI 3期的预测价值最高,且两者与RRI(AUC=0.804,95%CI:0.718~0.874,P<0.01)和PDU评分(AUC=0.868,95%CI:0.791~0.925,P<0.01)间均差异有统计学意义(均P<0.05)。RRI/PDU预测AKI 3期的最佳临界值为0.355,灵敏度为92.6%,特异度为81.9%,约登指数为0.745。RRI-PDU/10(AUC=0.899,95%CI:0.827~0.948,P<0.01)对AKI 3期的预测价值亦优于RRI和PDU评分,但较RRI/PDU和RRI+PDU略差,仅RRI与RRI-PDU/10之间差异有统计学意义(P<0.05),见表 3及图 1。
| 指标 | AUC | P值 | AUC的95%CI | 临界值 | 灵敏度(%) | 特异度(%) | 约登指数 |
| 非脓毒症患者 | |||||||
| RRI | 0.804 | <0.01 | 0.718~0.874 | >0.709 | 66.7 | 83.1 | 0.498 |
| PDU | 0.868 | <0.01 | 0.791~0.925 | ≤1 | 66.7 | 92.8 | 0.594 |
| RRI-PDU/10 | 0.899 | <0.01 | 0.827~0.948 | >0.502 | 88.9 | 80.7 | 0.696 |
| RRI/PDU | 0.915 | <0.01 | 0.846~0.959 | >0.355 | 92.6 | 81.9 | 0.745 |
| RRI+PDU | 0.914 | <0.01 | 0.845~0.959 | >0.256 | 92.6 | 81.9 | 0.745 |
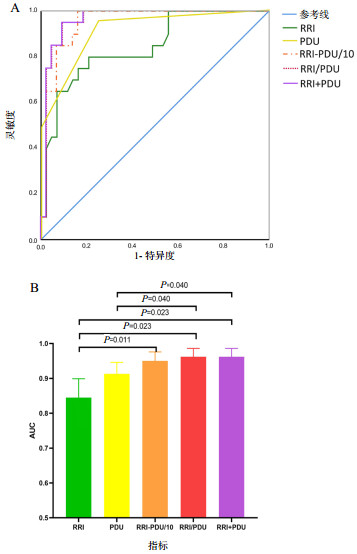
| 急性心力衰竭患者 | |||||||
| RRI | 0.845 | <0.01 | 0.731~0.924 | >0.690 | 80.0 | 79.1 | 0.591 |
| PDU | 0.913 | <0.01 | 0.814~0.969 | ≤1 | 75.0 | 95.3 | 0.704 |
| RRI-PDU/10 | 0.950 | <0.01 | 0.864~0.989 | >0.502 | 100.0 | 83.7 | 0.837 |
| RRI/PDU | 0.962 | <0.01 | 0.880~0.994 | >0.360 | 95.0 | 90.7 | 0.857 |
| RRI+PDU | 0.962 | <0.01 | 0.880~0.994 | >0.309 | 95.0 | 90.7 | 0.857 |
| 注:AKI为急性肾损伤,AUC为曲线下面积,95%CI为95%可信区间,PDU为能量多普勒超声,RRI为肾动脉阻力指数 | |||||||
|
| RRI为肾动脉阻力指数,PDU为能量多普勒超声,AKI为急性肾损伤,ROC曲线为受试者工作特征曲线,AUC为曲线下面积,RI-PDU/10为RRI值与PDU评分的1/10相减所得,RRI/PDU为RRI与PDU评分的比值,RRI+PDU为通过logistic回归分析得出的RRI与PDU评分对AKI 3期的联合预测概率 图 1 非脓毒症患者中,RRI、PDU评分、RRI-PDU/10、RRI/PDU及RRI+PDU预测发生AKI 3期的ROC曲线(A)及各指标AUC的比较(B) Fig 1 Receiver operator characteristic curves reflecting the diagnostic performance of RRI, PDU score, RRI-PDU/10, RRI/PDU and RRI+PDU in predicting acute kidney injury stage 3 in nonseptic critically ill patients (A) and comparison of the AUC of each indicator (B) |
|
|
在急性心力衰竭患者中,RRI/PDU(AUC=0.962,95%CI:0.880~0.994,P<0.01)及RRI+PDU(AUC=0.962,95%CI:0.880~0.994,P<0.01)对AKI 3期的预测价值亦最高,且两者与RRI(AUC=0.845,95%CI:0.731~0.924,P<0.01)和PDU评分(AUC=0.913,95%CI:0.814~0.969,P<0.01)间均差异有统计学意义(均P<0.05)。RRI/PDU预测AKI 3期的最佳临界值为0.360,灵敏度为95.0%,特异度为90.7%,约登指数为0.857。RRI-PDU/10(AUC=0.950,95%CI:0.864~0.989,P<0.01)对AKI 3期的预测价值亦优于RRI和PDU评分,但较RRI/PDU和RRI+PDU略差,仅RRI与RRI-PDU/10之间差异有统计学意义(P<0.05),见表 3及图 2。
|
| RRI为肾动脉阻力指数,PDU为能量多普勒超声,AKI为急性肾损伤,ROC曲线为受试者工作特征曲线,AUC为曲线下面积,RI-PDU/10为RRI值与PDU评分的1/10相减所得,RRI/PDU为RRI与PDU评分的比值,RRI+PDU为通过logistic回归分析得出的RRI与PDU评分对AKI 3期的联合预测概率 图 2 急性心力衰竭患者中,RRI、PDU评分、RRI-PDU/10、RRI/PDU及RRI+PDU预测发生AKI 3期的ROC曲线(A)及各指标AUC的比较(B) Fig 2 Receiver operator characteristic curves reflecting the diagnostic performance of RRI, PDU score, RRI-PDU/10, RRI/PDUand RRI+PDU in predicting acute kidney injury stage 3 in patients with acute heart failure (A) and comparison of the AUC of each indicator (B) |
|
|
本研究发现,RRI对非脓毒症患者发生AKI 3期具有预测价值。RRI来源于肾内动脉(段/叶间动脉)的多普勒频谱,指肾内动脉舒张末期最低流速相对于最大收缩期血流速减少的百分比,其测量取样的准确性不取决于超声波角度(因测量误差在公式的分子和分母上会同等下降而互相抵消),越来越广泛地应用于临床。研究表明,RRI对围手术期[22]、ICU危重患者[23]及肾移植患者[24]的肾功能不全具有早期预测价值。然而,近期研究发现,心脏大手术患者手术结束时的RRI值对AKI的预测价值较差[25]。一项纳入351例危重患者的前瞻性研究发现RRI早期预测持续性AKI的表现较差(AUC=0.58,95%CI:0.52~0.64)[26]。RRI不仅仅是肾脏损害的特异性指标,而是一个受多种因素如年龄[27]、动脉硬化[28]、肾内及全身血流动力学因素[29]等影响的综合参数,可能会削弱其对AKI的预测价值。
本研究发现,PDU评分对非脓毒症患者发生AKI 3期具有预测价值。PDU是利用血液中红细胞的能量来显示血流信号,不受血流方向及血流与声束夹角的影响。PDU在血液流动相对缓慢的器官或区域更有价值,如青春期前睾丸、胎盘和肾皮质。研究发现,肾PDU与侵入性肾血流量测量密切相关[30-31]。近期临床研究发现肾PDU半定量评分有助于预测肾移植术后移植肾功能延迟恢复[11]及危重患者AKI的严重程度及预后[32]。然而,PDU评分具有下列局限性:①受增益及彩色标尺大小等因素影响;②具有明显的软组织闪光现象,结果可能受到呼吸运动的影响;③肥胖、腹部胀气、肠管扩张、体位变动困难的患者在ICU中很常见,这些因素可能会在一定程度上影响PDU评分的结果;④半定量评分是分级指标,具有一定的主观性。
RRI及PDU评分均具有局限性而使其在临床应用中受限,而这两个参数均可在床旁短时间内同时获得。因此,本研究联合RRI和PDU评分进行分析发现,RRI/PDU、RRI-PDU/10和RRI+PDU三种联合方式对AKI 3期的预测价值均优于单独RRI或PDU评分。三种联合指标中,RRI/PDU与RRI+PDU表现最好,而RRI-PDU/10表现稍逊。因RRI+PDU需通过统计学方法获得,计算过程复杂,且需要同时比对RRI及PDU评分两种指标的临界值,临床应用较繁琐,不易于推广应用。而RRI/PDU计算及使用简便,易于临床推广应用。
另外,本研究发现,RRI、PDU评分、RRI/PDU、RRI-PDU/10和RRI+PDU对AKI 3期的预测价值在急性心力衰竭患者中均略优于非脓毒症患者中。急性心力衰竭发生AKI病理生理机制可能与肾脏前向灌注不足以及静脉淤血超过肾脏的自行调节机制并导致恶性循环相关[33]。因此,急性心力衰竭患者中,肾脏灌注不足以及静脉淤血进一步导致肾灌注下降,均引起肾PDU评分减低;而除肾实质损伤外,心输出量下降后静脉淤血引起肾静脉压升高也可导致RRI进一步升高,这可能是RRI和PDU评分及两者的联合指标在急性心力衰竭患者中表现更优的原因。
本研究存在一定的局限性:①慢性肾脏疾病往往伴有RRI升高。本研究将慢性肾衰竭作为排除标准以尽量减少该影响。②本研究在通过积极临床干预使血压维持在正常水平后再进行肾脏超声检查以尽量减少血流动力学状态对RRI及PDU评分结果的影响。③本研究设计未采用盲法。④本研究样本量较小,尤其是急性心力衰竭患者。
综上所述,RRI和PDU评分的联合指标可有效预测非脓毒症患者发生AKI 3期,尤其在急性心力衰竭患者中表现更优。RRI/PDU对AKI 3期的预测价值以及实用价值最好,值得临床推广应用。
利益冲突 所有作者均声明不存在利益冲突
| [1] | Seymour CW, Liu VX, Iwashyna TJ, et al. Assessment of clinical criteria for sepsis: for the third international consensus definitions for Sepsis and septic shock (Sepsis-3)[J]. JAMA, 2016, 315(8): 762-774. DOI:10.1001/jama.2016.0288 |
| [2] | Susantitaphong P, Cruz DN, Cerda J, et al. World incidence of AKI: a meta-analysis[J]. Clin J Am Soc Nephrol, 2013, 8(9): 1482-1493. DOI:10.2215/cjn.00710113 |
| [3] | Hoste EA, Clermont G, Kersten A, et al. RIFLE criteria for acute kidney injury are associated with hospital mortality in critically ill patients: a cohort analysis[J]. Crit Care, 2006, 10(3): R73. DOI:10.1186/cc4915 |
| [4] | 陈胜龙, 陈纯波. 重症患者急性肾损伤的早期诊断与风险预测[J]. 中华急诊医学杂志, 2017, 26(9): 983-985. DOI:10.3760/cma.j.issn.1671-0282.2017.09.001 |
| [5] | Mataloun S, Machado F, Senna A, et al. Incidence, risk factors and prognostic factors of acute renal failure in patients admitted in an intensive care unit[J]. Crit Care, 2003, 7(3): 1. DOI:10.1186/cc2241 |
| [6] | Yohannes S, Chawla LS. Evolving practices in the management of acute kidney injury in the ICU (Intensive Care Unit)[J]. Clin Nephrol, 2009, 71(6): 602-607. DOI:10.5414/cnp71602 |
| [7] | 池锐彬, 邹启明, 李超锋, 等. 不同时刻血肌酐水平对危重症患者急性肾损伤预后的影响[J]. 中华急诊医学杂志, 2019, 28(9): 1083-1087. DOI:10.3760/cma.j.issn.1671-0282.2019.09.005 |
| [8] | 姜洁, 吕菁君, 叶璐, 等. 可溶性血栓调节蛋白及中性粒细胞明胶酶相关脂质运载蛋白早期预测脓毒症相关急性肾损伤的临床研究[J]. 中华急诊医学杂志, 2020, 29(4): 533-540. DOI:10.3760/cma.j.issn.1671-0282.2020022.007-1 |
| [9] | Xie YY, Wang Q, Wang CL, et al. High urinary excretion of kidney injury molecule-1 predicts adverse outcomes in acute kidney injury: a case control study[J]. Crit Care, 2016, 20: 286. DOI:10.1186/s13054-016-1455-6 |
| [10] | Schnell D, Darmon M. Bedside Doppler ultrasound for the assessment of renal perfusion in the ICU: advantages and limitations of the available techniques[J]. Crit Ultrasound J, 2015, 7(1): 1-4. DOI:10.1186/s13089-015-0024-6 |
| [11] | Contti MM, Garcia PD, Kojima CA, et al. Quantified power Doppler as a predictor of delayed graft function after renal transplantation[J]. Int Urol Nephrol, 2015, 47(2): 405-412. DOI:10.1007/s11255-014-0896-6 |
| [12] | 付优, 何聪, 白银箱, 等. 肾阻力指数联合中心静脉压预测脓毒性休克患者发生急性肾损伤的价值[J]. 中华危重病急救医学, 2020, 32(4): 473-477. DOI:10.3760/cma.j.cn121430-20191014-00062 |
| [13] | Dellepiane S, Marengo M, Cantaluppi V. Detrimental cross-talk between sepsis and acute kidney injury: new pathogenic mechanisms, early biomarkers and targeted therapies[J]. Crit Care, 2016, 20: 61. DOI:10.1186/s13054-016-1219-3 |
| [14] | Langenberg C, Wan L, Egi M, et al. Renal blood flow in experimental septic acute renal failure[J]. Kidney Int, 2006, 69(11): 1996-2002. DOI:10.1038/sj.ki.5000440 |
| [15] | 杨乐天, 赵宇亮, 付平. 脓毒症急性肾损伤的发病机制与诊治进展[J]. 中华肾脏病杂志, 2019, 35(9): 706-710. DOI:10.3760/cma.j.issn.1001-7097.2019.09.012 |
| [16] | Zhi HJ, Zhao J, Nie S, et al. Semiquantitative power Doppler ultrasound score to predict acute kidney injury in patients with sepsis or cardiac failure: a prospective observational study[J]. J Intensive Care Med, 2019: 885066619887333. DOI:10.1177/0885066619887333 |
| [17] | Khwaja A. KDIGO clinical practice guidelines for acute kidney injury[J]. Nephron Clin Pract, 2012, 120(4): c179-c184. DOI:10.1159/000339789 |
| [18] | 全国eGFR课题协作组. MDRD方程在我国慢性肾脏病患者中的改良和评估[J]. 中华肾脏病杂志, 2006, 22(10): 589-595. DOI:10.3760/j.issn:1001-7097.2006.10.002 |
| [19] | Barozzi L, Valentino M, Santoro A, et al. Renal ultrasonography in critically ill patients[J]. Crit Care Med, 2007, 35(Suppl): S198-S205. DOI:10.1097/01.ccm.0000260631.62219.b9 |
| [20] | Turetschek K, Nasel C, Wunderbaldinger P, et al. Power Doppler versus color Doppler imaging in renal allograft evaluation[J]. J Ultrasound Med, 1996, 15(7): 517-522. DOI:10.7863/jum.1996.15.7.517 |
| [21] | Akl A, Dawood A, Shebel H, et al. Power Doppler sonography in early renal transplantation: Does it differentiate acute graft rejection from acute tubular necrosis?[J]. Saudi J Kidney Dis Transpl, 2014, 25(4): 733. DOI:10.4103/1319-2442.134948 |
| [22] | Cherry AD, Hauck JN, Andrew BY, et al. Intraoperative renal resistive index threshold as an acute kidney injury biomarker[J]. J Clin Anesth, 2020, 61: 109626. DOI:10.1016/j.jclinane.2019.109626 |
| [23] | Darmon M, Schortgen F, Vargas F, et al. Diagnostic accuracy of Doppler renal resistive index for reversibility of acute kidney injury in critically ill patients[J]. Intensive Care Med, 2011, 37(1): 68-76. DOI:10.1007/s00134-010-2050-y |
| [24] | Bellos I, Perrea DN, Kontzoglou K. Renal resistive index as a predictive factor of delayed graft function: a meta-analysis[J]. Transplant Rev, 2019, 33(3): 145-153. DOI:10.1016/j.trre.2019.03.003 |
| [25] | Regolisti G, Maggiore U, Cademartiri C, et al. Renal resistive index by transesophageal and transparietal echo-Doppler imaging for the prediction of acute kidney injury in patients undergoing major heart surgery[J]. J Nephrol, 2017, 30(2): 243-253. DOI:10.1007/s40620-016-0289-2 |
| [26] | Darmon M, Bourmaud A, Reynaud M, et al. Performance of Doppler-based resistive index and semi-quantitative renal perfusion in predicting persistent AKI: results of a prospective multicenter study[J]. Intensive Care Med, 2018, 44(11): 1904-1913. DOI:10.1007/s00134-018-5386-3 |
| [27] | Ponte B, Pruijm M, Ackermann D, et al. Reference values and factors associated with renal resistive index in a family-based population study[J]. Hypertension, 2014, 63(1): 136-142. DOI:10.1161/hypertensionaha.113.02321 |
| [28] | Calabia J, Torguet P, Garcia I, et al. The relationship between renal resistive index, arterial stiffness, and atherosclerotic burden: the link between macrocirculation and microcirculation[J]. J Clin Hypertens, 2014, 16(3): 186-191. DOI:10.1111/jch.12248 |
| [29] | Di Nicolò P, Granata A. Renal resistive index: not only kidney[J]. Clin Exp Nephrol, 2017, 21(3): 359-366. DOI:10.1007/s10157-016-1323-3 |
| [30] | Durick JE, Winter TC, Schmiedl UP, et al. Renal perfusion: pharmacologic changes depicted with power Doppler US in an animal model[J]. Radiology, 1995, 197(3): 615-617. DOI:10.1148/radiology.197.3.7480728 |
| [31] | Kuwa T, Cancio LC, Sondeen JL, et al. Evaluation of renal cortical perfusion by noninvasive power Doppler ultrasound during vascular occlusion and reperfusion[J]. J Trauma, 2004, 56(3): 618-624. DOI:10.1097/01.ta.0000075331.21241.80 |
| [32] | 陈秀凯, 黄立锋, 王小亭, 等. 能量多普勒超声对急性肾损伤的评估价值[J]. 中华医学杂志, 2012, 92(47): 3354-3357. DOI:10.3760/cma.j.issn.0376-2491.2012.47.013 |
| [33] | McCullough PA, Kellum JA, Haase M, et al. Pathophysiology of the cardiorenal syndromes: executive summary from the eleventh consensus conference of the Acute Dialysis Quality Initiative (ADQI)[J]. Contrib Nephrol, 2013, 182: 82-98. DOI:10.1159/000349966 |
 2021, Vol. 30
2021, Vol. 30




