血管内皮细胞功能障碍是脓毒症的特征性表现,内毒素大量释放可直接损伤内皮细胞,导致通透性增加、细胞脱落与凋亡、血管舒张、组织灌注不足、休克等,最终导致多脏器功能衰竭甚至死亡,致死率达50%~70%[1-2]。因此,保持血管内皮细胞稳定性,调节内皮细胞通透性,维持血管正常舒缩状态,是保护脏器功能,降低脓毒症致死率的重要途径之一。
血管内皮细胞释放的一氧化氮(nitric oxide,NO),对于调节血管通透性、维持血流量和舒张状态起到至关重要的作用。脓毒症时,NO增加可引起血管内皮细胞舒张,伴随血管通透性升高、血压下降[3]。有研究证实,应用一氧化氮合酶(NO生成限速酶)抑制剂L-N-硝基精氨酸甲酯(L-N-nitroarginine methyl ester,L-NAME)可降低组织中NO水平,抑制血管舒张功能,纠正低血压状态,同时还可通过调节半胱氨酸天冬氨酸蛋白酶-3(caspase-3)水平改善凋亡[4-6],但在此过程中细胞通透性是否随之改善尚不清楚。此外,犬尿氨酸(kynurenine,Kyn)是近年来发现的内皮源性舒张因子[7],且与脓毒症密切相关,其作用和NO相似,因此推测Kyn生成的限速酶抑制剂是否也与血管内皮细胞通透性和凋亡相关。
吲哚胺-2, 3-双加氧酶(indoleamine 2, 3-dioxygenase, IDO)是Kyn生成的关键酶,而1-甲基色氨酸(1-methyltryptophan,1-MT)是IDO的抑制剂,已被证实可降低脓毒症时细胞凋亡,但机制及作用靶点尚不清晰[8]。本研究旨在观察脂多糖(lipopolysaccharide,LPS)刺激人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)后,其通透性及凋亡的变化,探索1-MT能否通过对LPS刺激的内皮细胞通透性和凋亡的改善而发挥对脓毒症的保护作用。
1 材料与方法 1.1 主要实验器材与试剂主要实验器材由南京医科大学附属苏州科技城医院临床研究所提供。HUVECs从江苏齐氏生物科技有限公司订购。LPS、1-MT购自美国Sigma公司;兔一抗caspase-3、DNA修复酶多聚二磷酸腺苷核糖聚合酶-1(DNA repair enzyme polyadenylate ribose polymerase-1,PARP-1)、p120连环(p120concatemer,p120ctn)、血管内皮钙粘蛋白(vascular endothelial cadherin,VE-cadherin)购自美国proteintech公司,鼠抗兔二抗以及内参GAPDH购自美国Santa Cruz Biotechnology公司;色氨酸(tryptophan,Trp)及Kyn从大连美仑生物技术有限公司订购。高效液相色谱仪为日本岛津公司生产,实验地点为苏州科技大学环境科学与工程学院。
1.2 细胞培养HUVECs细胞置于DMEM高糖培养基,37℃、5% CO2恒温箱中培养。
1.3 实验分组取生长状态良好的HUVECs,用新鲜培养液重新悬浮细胞,细胞密度约为l×105个/mL,将细胞悬液铺于6孔板内,进行细胞爬片,待细胞贴壁牢固后加入适量的培养液。待细胞融合后,弃去培养基,PBS清洗2遍,随后将细胞分为三组:PBS对照组、LPS组和1-MT组。LPS组和1-MT组分别加入终浓度为1 μ g/mL的LPS,PBS组中加入含等体积PBS的培养液作为对照,此外,1-MT组同时加入终浓度为1mmol/L的1-MT。最后,以上三组分别孵育2、4、6和8h,收集细胞蛋白及细胞培养上清液,后者1000r/min离心10min,分装标记后置于-20℃保存备用。
1.4 检测指标 1.4.1 Western blot各组细胞经处理8h后提取总蛋白,加入上样缓冲液后100℃煮沸10min。使用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),再转移至聚偏二氟乙烯膜上,5%脱脂奶粉液封闭1h,加入一抗工作液(1:5000)4℃孵育过夜;磷酸三乙醇胺缓冲液洗膜10min,清洗3次;加入二抗工作液(1:5000)室温孵育1h,TBST洗涤3次,每次10min;使用电化学发光试剂盒显影,成像系统测定灰度值,目的蛋白表达量=目的蛋白灰度值/ GAPDH灰度值。
1.4.2 高效液相色谱法(high performance liquid chromatography,HPLC)检测Kyn和Trp水平色谱柱为YWG-C18(250mm × 4.6mm,粒径大小为10 μ m);流动相为乙酸钠-乙腈溶液(24.8mmol/L乙酸钠,乙酸调pH值为4.0)为90:10;流速为1.0mL/min;Trp荧光激发波长285nm,发射波长365nm;Kyn紫外检测波长360nm;柱温为室温。取100 μL细胞培养上清液于EP管内,加入等体积5%高氯酸溶液,于漩涡振荡器上混匀30s,室温静置15min以充分沉淀蛋白质。最后26750 r/min离心5min,将上清液转入另一EP管内,取20 μ L上清液进样分析。
1.5 统计学方法采用SPSS 21.0统计学软件进行数据分析。计量资料以均数±标准差(Mean±SD)表示,均经方差齐性检验和正态性检验,多组间比较采用单因素方差分析,组间两两比较用LSD-t检验。以P<0.05为差异有统计学意义。采用Graphpad Prism 6.0软件作图。
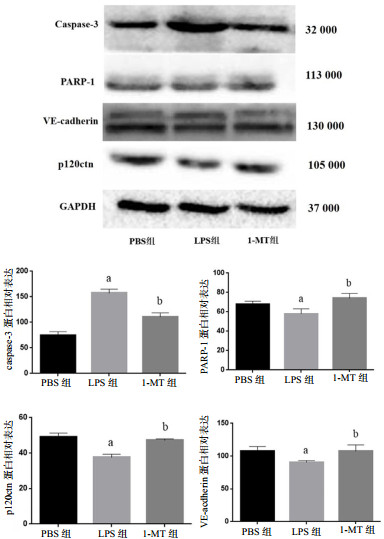
2 结果 2.1 1-MT可调节细胞通透性及凋亡蛋白的表达与PBS组相比,LPS组caspase-3表达显著增高,而p120ctn、VE-cadherin及抗凋亡蛋白PARP-1水平显著降低(P<0.05)。与LPS组比,1-MT组caspase-3表达显著降低;相反地,p120ctn、VE-cadherin及PARP-1表达显著升高(P<0.05)。PBS组相比较,1-MT组caspase-3、p120ctn、VE-cadherin及PARP-1蛋白水平未见明显变化(P>0.05),而caspase-3表达升高(P=0.001),见图 1。
|
| 图 1 各组HUVECs蛋白表达水平比较 Fig 1 Comparison of HUVECs protein expression at different groups |
|
|
Kyn回归方程:Y=1.0162 X+0.6909,Trp回归方程:Y=0.1241 X-0.0132,Kyn与Trp的线性范围分别为0.02~40.00 μ mol/L和0.20~100.00 μ mol/L,检测限分别为0.036 μ mol/L和0.045 μ mol/L,保留时间分别为4.51min和6.02min。Kyn与Trp的日内变异度和日间变异度均小于4.6%。
与PBS组相比较,LPS组Kyn水平于2、4、6及8h显著升高,而不同时间点IDO活性表达显著增高(P<0.05)。与LPS组比较,1-MT组IDO活性在不同时间点均下降,而Kyn浓度降低。见表 1~2。
| 组别 | 2h | 4h | 6h | 8h |
| PBS组 | 61.58±1.57 | 61.32±2.34 | 61.11±1.76 | 59.81±2.96 |
| LPS组 | 65.15±1.09a | 70.40±2.72a | 74.72±3.02a | 83.18±3.76a |
| 1-MT组 | 60.82±1.76b | 59.55±2.50b | 59.80±2.19b | 59.65±2.61b |
| A vs B P值 | 0.027 | 0.005 | <0.01 | <0.01 |
| B vs C P值 | 0.012 | 0.002 | <0.01 | <0.01 |
| A vs C P值 | 0.558 | 0.425 | 0.525 | 0.952 |
| 注:与PBS组比较,aP<0.05;与LPS组比较,bP<0.05;A为PBS组,B为LPS组,C为1-MT组 | ||||
| 组别 | 2h | 4h | 6h | 8h |
| PBS组 | 3.77±0.14 | 3.74±0.18 | 3.78±0.16 | 3.65±0.22 |
| LPS组 | 4.07±0.12a | 4.28±0.16a | 4.56±0.27a | 5.08±0.33a |
| 1-MT组 | 3.80±0.15b | 3.64±0.19b | 3.65±0.19b | 3.63±0.22b |
| A vs B P值 | 0.035 | 0.01 | 0.004 | 0.001 |
| B vs C P值 | 0.049 | 0.004 | 0.002 | <0.01 |
| A vs C P值 | 0.817 | 0.518 | 0.469 | 0.894 |
| 注:与PBS组比较,aP<0.05;与LPS组比较,bP<0.05;A为PBS组,B为LPS组,C为1-MT组 | ||||
脓毒症是机体对严重感染反应失调,最终导致的危及生命的脏器功能障碍[9]。严重感染激活炎症反应并释放大量炎症因子,导致血管内皮细胞损伤、通透性增加和循环功能障碍,最终引起多器官功能衰竭。国内外研究表明,脓毒症患者的血管内皮细胞结构及功能障碍直接影响预后,但其机制缺乏统一定论[10-13]。
血管内皮细胞释放NO,可调节血管通透性、维持血流量和舒张状态。脓毒症期间产生大量NO,NO增加可引起血管内皮细胞舒张,伴随血管通透性升高、血压下降[14]。L-NAME可抑制血管舒张功能,纠正低血压状态,同时还可改善凋亡,但在此过程中细胞通透性是否随之改善尚不清楚。Kyn是内皮源性舒张因子,作用和NO类似,而且与脓毒症的发展密切相关,因此笔者猜想Kyn抑制剂1-MT可能也与脓毒症时内皮细胞通透性相关,亦可降低细胞凋亡。
IDO是Kyn生成的关键酶,催化Trp转化为Kyn。多项研究证实,IDO与脓毒症、神经系统疾病、糖尿病、癌症、肾病等多种疾病相关[15-19],目前IDO抑制剂作为极具潜能的药物日益受到广泛关注[20]。有关于脓毒症的研究指出1-MT可降低脓毒症细胞凋亡,但凋亡的具体机制及作用靶点尚不清楚。Caspase-3是凋亡通路上的关键基因,多用于凋亡机制的相关研究。本研究结果提示,LPS组caspase-3蛋白表达显著增高,抗凋亡蛋白PARP-1水平显著降低,1-MT干预后凋亡相关蛋白caspase-3水平显著降低,而PARP-1水平相应升高,提示1-MT可以降低LPS诱导的细胞凋亡作用,主要机制为下调caspase-3蛋白表达,同时提高抗凋亡蛋白PARP-1的表达。
VE-cadherin是一种严格调控的蛋白质复合物,是细胞间粘附连接的主要成分,可阻止白细胞外移和血管渗漏。VE-cadherin从细胞膜移向细胞内,细胞间隙随之增大,最终导致通透性增加[21]。而VE-cadherin的这种移动通常可被另一种蛋白阻止,即p120ctn,p120ctn与VE-cadherin结合并使后者稳定在细胞膜上。当脓毒症发生时,释放的大量炎症因子可使p120ctn与VE-cadherin发生解离,细胞间紧密连接破坏,通透性增加,血管内皮细胞舒张,继而导致低血压或休克。Kyn在脓毒症时被激活[7],作为众多细胞因子中的一种,是否也对p120ctn与VE-cadherin解离发挥作用,目前尚未此研究。
本研究观察到1-MT可通过改善炎症状态下细胞间连接而达到调节血管通透性的作用。LPS刺激血管内皮细胞,使IDO活性升高,IDO催化Trp转化为Kyn,故Kyn水平显著增高,同时发现p120ctn和VE-cadherin水平呈下降趋势。Zhang等[22]报道,LPS刺激血管内皮细胞后,VE-cadherin发生细胞内吞作用,VE-cadherin水平下降,最终导致内皮细胞通透性增加,这与本研究的结果相一致。IDO抑制剂1-MT干预后IDO活性和Kyn浓度在不同时间点均有下降,说明1-MT可以快速降低脓毒症状态下IDO活性,使Kyn生成减少。同时,本研究发现1-MT组的p120ctn和VE-cadherin水平显著升高,提示1-MT可以对抗LPS导致的p120ctn、VE-cadherin水平下降,改善细胞间紧密连接,从而进一步改善细胞间的通透性。
综上所述,本研究发现,LPS刺激下的HUVECs细胞间连接受损,通透性改变,诱导细胞凋亡,而1-MT可降低舒张因子Kyn的水平,改善炎症反应时细胞间连接状态,调节内皮细胞通透性,降低内毒素诱导的细胞凋亡。本研究从细胞通透性和凋亡层面阐述了脓毒症的发展规律,为继续探讨脓毒症病理生理机制提供了理论依据。
利益冲突 所有作者均声明不存在利益冲突
| [1] | 魏伏, 张丹, 罗丽, 等. 乌司他丁抑制TNF-α诱导血管内皮细胞高通透性的研究[J]. 中华急诊医学杂志, 2016, 25(3): 320-324. DOI:10.3760/cma.j.issn.1671-0282.2016.03.013 |
| [2] | Kazune S, Piebalga A, Strike E, et al. Impaired vascular reactivity in Sepsis – a systematic review with meta-analysis[J]. Amsad, 2019, 4(1): 151-161. DOI:10.5114/amsad.2019.86754 |
| [3] | Russell JA, Rush B, Boyd J. Pathophysiology of septic shock[J]. Crit Care Clin, 2018, 34(1): 43-61. DOI:10.1016/j.ccc.2017.08.005 |
| [4] | 李树铁, 张立民, 赵自刚, 等. 一氧化氮在休克血管低反应性发生机制中的作用[J]. 中国老年学杂志, 2015, 35(16): 4693-4695. DOI:10.3969/j.issn.1005-9202.2015.16.136 |
| [5] | Luo R, Chen X, Ma H, et al. Myocardial caspase-3 and NF-κB activation promotes calpain-induced septic apoptosis: The role of Akt/ENOS/NO pathway[J]. Life Sci, 2019, 222: 195-202. DOI:10.1016/j.lfs.2019.02.048 |
| [6] | Liang B, Su J. Inducible nitric oxide synthase (iNOS) mediates vascular endothelial cell apoptosis in grass carp reovirus (GCRV)-induced hemorrhage[J]. Int J Mol Sci, 2019, 20(24): 6335. DOI:10.3390/ijms20246335 |
| [7] | Wang YY, Zhao J, Tan LF, et al. Bone marrow mesenchymal stem cells alleviate extracellular kynurenine levels, as detected by high-performance liquid chromatography[J]. Inflammation, 2015, 38(4): 1450-1457. DOI:10.1007/s10753-015-0119-z |
| [8] | Hoshi M, Osawa Y, Ito H, et al. Blockade of indoleamine 2, 3-dioxygenase reduces mortality from peritonitis and Sepsis in mice by regulating functions of CD11b+ peritoneal cells[J]. Infect Immun, 2014, 82(11): 4487-4495. DOI:10.1128/iai.02113-14 |
| [9] | 刘宁, 江智毅, 聂垚, 等. 丙酮酸乙酯对脂多糖刺激下人肾小管上皮细胞线粒体动力学的影响[J]. 中华危重病急救医学, 2019, 31(12): 1501-1505. DOI:10.3760/cma.j.issn.2095-4352.2019.12.013 |
| [10] | 中国医疗保健国际交流促进会急诊医学分会中华医学会急诊医学分会中国医师协会急诊医师分会中国人民解放军急救医学专业委员会. 中国脓毒症早期预防与阻断急诊专家共识[J]. 中华急诊医学杂志, 2020, 29(7): 885-895. DOI:10.3760/cma.j.issn.1671-0282.2020.07.001 |
| [11] | 张清, 李春盛. 急诊脓毒症严重程度各标志物的比较[J]. 中华急诊医学杂志, 2019, 28(2): 163-169. DOI:10.3760/cma.j.issn.1671-0282.2019.02.007 |
| [12] | 柴云飞, 雷黎明, 李鹏, 等. 血管内皮细胞损伤与脓毒症休克的相关性[J]. 实用医学杂志, 2017, 33(15): 2529-2532. DOI:10.3969/j.issn.1006-5725.2017.15.027 |
| [13] | Yao B, Liu DW, Chai WZ, et al. Microcirculation dysfunction in endotoxic shock rabbits is associated with impaired S-nitrosohemoglobin-mediated nitric oxide release from red blood cells: a preliminary study[J]. Intensive Care Med Exp, 2019, 7(1): 1. DOI:10.1186/s40635-018-0215-0 |
| [14] | 邬明杰, 郑霞. 辛伐他汀纳米粒通过调节诱导型一氧化氮合酶/内皮型一氧化氮合酶系统对小鼠脓毒症相关急性肺损伤的影响[J]. 中华危重症医学杂志(电子版), 2018, 11(6): 393-399. DOI:10.3877/cma.j.issn.1674-6880.2018.06.007 |
| [15] | Kumar MP, Mamidala E, Al-Ghanim KA, et al. Evaluation of the andrographolides role and its indoleamine 2, 3-dioxygenase inhibitory potential and attendant molecular mechanism against STZ-induced diabetic rats[J]. Saudi J Biol Sci, 2020, 27(2): 713-719. DOI:10.1016/j.sjbs.2019.12.007 |
| [16] | Du LS, Xing ZK, Tao BB, et al. Both IDO1 and TDO contribute to the malignancy of gliomas via the Kyn–AhR–AQP4 signaling pathway[J]. Sig Transduct Target Ther, 2020, 5: 10. DOI:10.1038/s41392-019-0103-4 |
| [17] | Zhou QH, Han H, Lu JB, et al. Up-regulation of indoleamine 2, 3-dioxygenase 1 (IDO1) expression and catalytic activity is associated with immunosuppression and poor prognosis in penile squamous cell carcinoma patients[J]. Cancer Commun, 2020, 40(1): 3-15. DOI:10.1002/cac2.12001 |
| [18] | Liu KH, Yang YY, Chen YY, et al. The therapeutic effect of dendritic cells expressing indoleamine 2, 3-dioxygenase (IDO) on an IgA nephropathy mouse model[J]. Int Urol Nephrol, 2020, 52(2): 399-407. DOI:10.1007/s11255-019-02365-1 |
| [19] | Comim CM, Freiberger V, Ventura L, et al. Inhibition of indoleamine 2, 3-dioxygenase 1/2 prevented cognitive impairment and energetic metabolism changes in the Hippocampus of adult rats subjected to polymicrobial Sepsis[J]. J Neuroimmunol, 2017, 305: 167-171. DOI:10.1016/j.jneuroim.2017.02.001 |
| [20] | 王倩. IDO小分子抑制剂的临床研究进展[J]. 上海医药, 2020, 41(3): 76-79. |
| [21] | Lee WL, Slutsky AS. Sepsis and endothelial permeability[J]. N Engl J Med, 2010, 363(7): 689-691. DOI:10.1056/nejmcibr1007320 |
| [22] | Zhang Y, Zhang L, Li Y, et al. Different contributions of clathrin-and caveolae-mediated endocytosis of vascular endothelial cadherin to lipopolysaccharide-induced vascular hyperpermeability[J]. PLoS One, 2014, 9(9): e106328. DOI:10.1371/journal.pone.0106328 |
 2021, Vol. 30
2021, Vol. 30




