重症急性胰腺炎(sever acute pancreatitis,SAP)是由多种病因导致的胰脏严重炎症反应并伴有器官功能障碍持续超过48h,病死率高达30%~50%[1]。研究显示,SAP的发生可能与胰腺腺泡细胞线粒体功能障碍引起的细胞自噬(autophagy)紊乱有关[2]。细胞自噬紊乱参与胰酶的活化,并促进胰腺的炎症反应[3]。自噬不仅参与SAP的炎性调节及胰蛋白酶原的活化,还与SAP严重程度及预后密切相关[4]。哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)的代谢可调节并抑制细胞自噬活性,是调控自噬平衡的主要途径[3-6]。红景天苷(salidroside,Sal)除了具有广泛的抗炎、抗氧化[7]等药理活性,还能降低SAP早期胰酶活性[8]、调节细胞自噬水平[9-11]。本研究拟通过建立SAP大鼠模型,探讨红景天苷对SAP大鼠胰腺细胞自噬的影响及其可能的作用机制。
1 材料与方法 1.1 实验动物雄性Wistar大鼠,体质量(250~280)g,由兰州大学医学实验动物中心[生产许可证:SCXK(甘)2013-0002]提供。动物购入后在兰州三爱堂医院(中国人民解放军第一医院)饲养并开展实验,饲养条件为温度(21±1)℃、相对湿度(45±5)%,维持12h的暗/光循环并自由摄取食水。本动物实验设计和实施过程符合实验动物伦理要求。
1.2 主要试剂与设备牛磺胆酸钠(Sigma公司,美国),红景天苷(Spring & Autum),anti-LC3B(Abcam,美国),anti-mTOR(Proteintech,中国),anti-p-mTOR(CST,美国),anti-anti-NF-κB(Abcam,美国),anti-GAPDH(Abcam,美国),山羊抗兔IgG(辣根过氧化物酶标记)(Abcam,美国),蛋白提取试剂盒(Biosharp,中国)、ELISA试剂盒(上海江莱实业股份有限公司)。酶标仪(上海净信科技有限公司),光学显微镜(甘肃津衡称重设备有限公司),电动匀浆器(上海正慧工贸有限公司)。
1.3 造模、分组干预与标本收集将已经禁食12h的健康雄性Wistar大鼠从鼠笼中取出,以1mL/100g的剂量腹腔注射3.5%水合氯醛,待1~3min大鼠达到良好的麻醉状态,将其固定于实验操作板上,腹部备皮、碘伏消毒、铺无菌洞巾,于腹正中线上行纵行切口约2cm,切开皮肤后明显可见腹白线,再沿腹白线纵行切开肌层后进入腹腔,根据解剖结构依次找到胃-胃大弯-幽门-十二指肠,用双手大拇指与食指将十二指肠轻轻提起,在白炽灯下仔细辨认位于十二指肠降段肠壁内潜行的十二指肠乳头隆起部位,用4号头皮针于乳头隆起部位的对侧肠壁穿刺进入十二指肠肠腔内,再用消毒后的胰胆管PE插管从穿刺部位进入胰胆管,进入的深度以2cm为宜,用两枚无创血管夹分别夹闭贴近十二指肠管壁处的胆胰管和肝门处胰管。连接微量注射泵,以0.1mL/min的速度向胰管内逆行注射5%牛胆酸钠0.1mL/100g,注射完毕后缓慢撤泵,拔掉胰胆管PE插管,用预热的生理盐水浸润过的无菌纱布覆盖暴露在腹腔外的部分十二指肠和胰腺组织约3min,并观察胰腺变化:可见胰腺组织严重水肿、充血、局部出血等表现,说明造模成功。此时将裸露在外的部分十二指肠和胰腺还纳至腹腔,消毒并逐层缝合。术后腹腔注射3mL/100g的预热生理盐水以补充损失的体液。最后将大鼠放回笼中,自由饮水、禁食。
健康、清洁的雄性Wistar大鼠50只,随机(随机数字法)分为5组,每组10只。包括假手术组(Sham组)、重症急性胰腺炎组(SAP组)、红景天苷15mg/kg治疗组(Sal 15组)、红景天苷30mg/kg治疗组(Sal 30组)和红景天苷60mg/kg治疗组(Sal 60组)。每组均在术前以1mL/100g的剂量经腹腔注射3.5%水合氯醛至适于实验的麻醉状态后进行实验操作。每组具体干预措施见表 1。其中红景天苷溶液配制方法为:秤取10mg红景天苷粉末溶于1mL无菌生理盐水得到10mg/mL的红景天苷溶液。
| 组别 | 干预措施 |
| Sham组 | 仅予以胰管内逆行注射生理盐水0.1mL/100g |
| SAP组 | 胰管内逆行注射5%牛胆酸钠溶液0.1mL/100g |
| Sal 15组 | 在SAP组基础上于术后2h腹腔注射红景天苷15mg/kg |
| Sal 30组 | 在SAP组基础上于术后2h腹腔注射红景天苷30mg/kg |
| Sal 60组 | 在SAP组基础上于术后2h腹腔注射红景天苷60mg/kg |
| 注:Sham为假手术,SAP为重症急性胰腺炎,Sal为红景天苷 | |
每组大鼠均于术后24h分别于右心室采血用于检测血清淀粉酶(amylase, AMY)活性和血浆TNF-α水平;待处死后收集胰脏组织,部分采用4%多聚甲醛固定用于病理学观察,部分冻存于-80℃用于后续检测LC3、mTOR和p65蛋白表达水平。
1.4 统计学方法采用SPSS 24.0进行统计学分析。计量资料以均数±标准差(Mean±SD)表示。组间比较采用单因素方差分析(one-way ANOVA)。组间两两比较,先行Levene检验方差齐性,若满足则采用最小显著性差异(LSD)法,否则采用Games-Howell法校正。以P<0.05为差异有统计学意义。
2 结果 2.1 各组大鼠血清AMY及TNF-α变化如表 2所示,与Sham组比较,SAP组和Sal各组大鼠血清AMY活性均明显升高,差异有统计学意义(P<0.05);经造模后红景天苷溶液干预,Sal各组AMY活性较SAP组均明显下降(P<0.05),且以Sal 60组下降最明显;AMY活性变化在Sal各组间差异均有统计学意义(P<0.05)。
| 组别 | AMY(U/L) | TNF-α(pg/mL) |
| Sham组 | 1598±38 | 24.9±1.3 |
| SAP组 | 8958±499a | 45.6±1.2a |
| Sal 15组 | 6341±331abc | 33.8±0.9ac |
| Sal 30组 | 4378±292abc | 30.5±1.0abc |
| Sal 60组 | 3801±292abc | 28.1±0.9abc |
| 注:与Sham组比较,aP<0.05;与SAP组比较,bP<0.05;Sal各组组间两两比较,cP<0.05 | ||
与Sham组比较,SAP组和Sal各组大鼠血浆TNF-α水平均显著升高,差异有统计学意义(P<0.05);经造模后红景天苷溶液干预,Sal 30、Sal 60组TNF-α水平较SAP组均显著下降(P<0.05),且以Sal 60组下调最明显,而Sal 15组差异无统计学意义(P>0.05);TNF-α水平变化在Sal各组间差异均有统计学意义(P<0.05)。
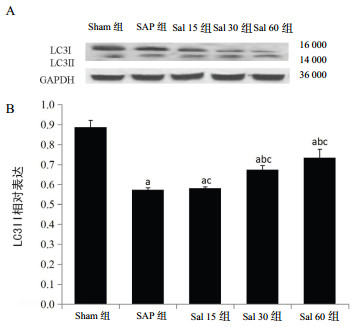
2.2 各组大鼠LC3蛋白的表达水平LC3蛋白表达的Western blot检测结果见图 1A,LC3Ⅱ蛋白的相对表达如图 1B所示。与Sham组相比,SAP组和Sal各组LC3Ⅱ的蛋白相对表达水平明显下调,差异有统计学意义(P<0.05);经红景天苷溶液干预,Sal 30组和Sal 60组LC3Ⅱ蛋白的相对表达水平较SAP组显著上调(P<0.05),且以Sal 60组上调最明显,而Sal 15组与SAP组比较,差异无统计学意义(P>0.05);LC3Ⅱ表达水平变化在Sal各组间差异有统计学意义(P<0.05)。
|
| A:LC3蛋白印迹图;B:LC3 Ⅱ的相对表达;与Sham组比较,aP<0.05;与SAP组比较,bP<0.05;Sal各组间两两比较,cP<0.05 图 1 各组大鼠胰腺组织LC3蛋白的表达水平 Fig 1 The expression of pancreatic tissue protein LC3 in each group of rats |
|
|
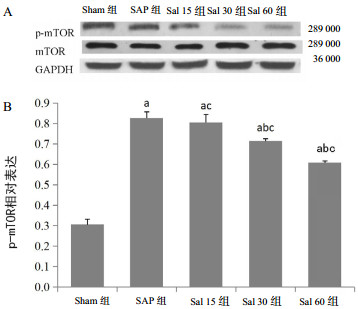
mTOR蛋白表达的Western blot检测结果见图 2A,p-mTOR相对表达如图 2B所示。与Sham组相比,SAP组和Sal各组p-mTOR蛋白相对表达水平明显上调,差异有统计学意义(P<0.05);经红景天苷干预,Sal 30、Sal 60组的p-mTOR相对表达水平较SAP组显著下调,差异有统计学意义(P<0.05),且以Sal 60组下调最明显,而Sal 15组差异无统计学意义(P>0.05);p-mTOR表达水平变化在Sal各组间差异有统计学意义(P<0.05)。
|
| A:mTOR蛋白印迹图;B:p-mTOR的相对表达;与Sham组比较,aP<0.05;与SAP组比较,bP<0.05;Sal各组间两两比较,cP<0.05 图 2 各组大鼠胰腺组织蛋白mTOR的表达水平 Fig 2 The expression of pancreatic tissue protein mTOR in each group of rats |
|
|
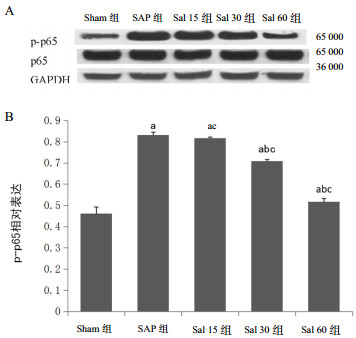
p65蛋白表达的Western blot检测结果见图 3A,p-p65相对表达如图 3B所示。与Sham组相比,SAP组和Sal各组p-p65蛋白的相对表达水平明显上调,差异有统计学意义(P<0.05);经红景天苷干预后,Sal 30组和Sal 60组蛋白p-p65表达水平较SAP组显著下降(P<0.05),且以Sal 60组下调最明显,而Sal 15组与SAP组比较差异无统计学意义(P>0.05);p-p65水平变化在Sal各组间差异有统计学意义(P<0.05)。
|
| A:P65蛋白印迹图;B:p-p65的相对表达;与Sham组比较,aP<0.05;与SAP组比较,bP<0.05;Sal各组间两两比较,cP<0.05 图 3 各组大鼠胰腺组织蛋白p65蛋白表达水平 Fig 3 The expression of p65 protein in pancreas in each group of rats |
|
|
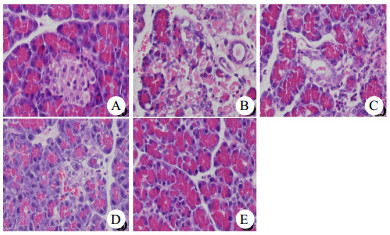
HE染色后光学显微镜下具体表现如图 4所示,Sham组胰腺组织结构基本正常,伴少量炎症细胞浸润;SAP组胰腺间质重度水肿,实质结构严重破坏,胰岛及周围胰腺组织出血,大量炎症细胞浸润、组织坏死、脂肪液化;Sal 15组胰腺间质重度水肿,大部分实质结构紊乱,少量出血,大量炎症细胞浸润伴坏死物质形成;Sal 30组胰腺间质中度水肿,部分实质结构紊乱,大量炎症细胞浸润,部分坏死物质形成;Sal 60组胰腺间质轻度水肿,实质结构基本清晰,少量炎症细胞浸润。
|
| A为Sham组;B为SAP组;C为Sal 15组;D为Sal 30组;E为Sal 60组 图 4 各组大鼠胰腺组织HE染色(×200) Fig 4 HE staining of pancreatic tissue in each group (×200) |
|
|
自噬是一种将细胞内受损的细胞器和大分子物质运送至溶酶体进行降解的细胞“清除”过程,是细胞对外来刺激做出的防御反应,受生长因子、营养素、能量供应、细胞因子和感染等多种自噬信号的调节[12]。生理条件下,细胞内出现双层膜结构并包裹多余的蛋白质和细胞器形成自噬小体,最后与溶酶体融合形成自噬溶酶体,将内容物降解为氨基酸和游离脂肪酸供细胞再利用[13]。当细胞发生感染等各类应激时,损伤相关分子模式(damageassociated molecµlar patterns,DAMP)和病原体相关分子模式(pathogen associated molecµlar patterns,PAMP)通过Toll样受体(toll-like receptor,TLR)4或TLR9激活核因子κB(nuclear factor kappa-B,NF-κB)、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)等信号通路诱导自噬相关蛋白的表达,或通过Akt/mTOR通路诱导自噬的激活[14],从而执行细胞清除功能。研究显示,低水平自噬通过清除细胞内受损的蛋白质和细胞器及病原体而促进细胞生存;而过度和长期的自噬上调使得必需蛋白质和细胞器的破坏超过一定的阈值,最终导致细胞死亡[15]。
mTOR是一种调节细胞生长和代谢的丝氨酸/苏氨酸蛋白激酶,通过整合来自营养素和生长因子通路的输入信号来调节细胞营养和能量供应,通过细胞应激和生长因子信号传导以调节蛋白质合成和自噬活性[16]。mTOR通路是调节细胞存亡相关的关键通路,涉及多种细胞过程,主要包括细胞自噬[17]。该通路主要通过mTOR的磷酸化水平来影响自噬蛋白LC3的表达。研究表明,mTOR的代谢可调节并抑制自噬[5-6]。具体表现为:当细胞遭遇感染、缺血-再灌注损伤等各类应激时,炎症因子分泌增加,mTOR通路接收炎症信号后被激活,蛋白mTOR呈现为磷酸化状态,即p-mTOR,从而抑制细胞自噬活性。结合本研究胰腺组织mTOR蛋白的表达水平显示,SAP组和Sal各组mTOR蛋白相对表达水平较Sham组显著上调(P<0.05),而相应组中LC3Ⅱ表达水平下降(P<0.05)。表明发生SAP时,mTOR-自噬通路确实发生了改变,mTOR磷酸化水平p-mTOR上调、LC3Ⅱ表达下调,引起细胞自噬活性明显下降。这一结果可能与SAP时炎症因子的释放有关。而经红景天苷干预,Sal 30组与Sal 60组中p-mTOR的相对表达水平较SAP组显著下降,且以Sal 60组为著(P<0.05)。这也与胰腺组织LC3Ⅱ的表达结果(P<0.05)相吻合。由此表明红景天苷可能呈剂量依赖性地通过抑制mTOR-自噬通路,增强胰腺细胞的自噬活性,发挥胰腺保护作用,且以Sal 60组的剂量保护作用最有效。
此外,大量炎症介质参与SAP的发生发展,如促炎细胞因子TNF-α、白介素6(Interleukin,IL-6)[11, 18]等。研究显示,TNF-α的过度表达与NF-κB的表达水平显著相关[13]。现已经证明通过抑制NF-κB通路可以提高牛磺胆酸诱导的胰腺炎大鼠的存活率[19]。NF-κB通常是一种以非磷酸化状态广泛存在于真核细胞质中的转录因子蛋白。当细胞受到外来刺激如感染等,NF-κB参与调控炎症信号的主要亚基p65被激活后转移至细胞核内,进而引起TNF-α等炎症因子的释放及细胞炎性损伤[20]。根据本研究中胰腺组织蛋白p65的表达水平显示,SAP组和Sal各组p-p65蛋白相对表达水平较Sham组显著上调(P<0.05),这与大鼠血浆TNF-α含量变化一致。表明炎症介质p65、TNF-α确实参与了SAP的发生。而经造模后红景天苷干预,Sal 30组与Sal 60组中p-p65的相对表达水平较SAP组显著下降,其中以Sal 60组下降最明显(P<0.05),这也与血浆TNF-α含量变化一致。由此表明SAP时p65会在一定水平上被激活呈磷酸化状态p-p65,促进下游炎症因子TNF-α的释放,造成胰脏的炎性损伤。而应用红景天苷干预后,p-p65相对表达水平下调、TNF-α的释放也相应减少,且以Sal 60组变化为著(P<0.05)。综合以上结果提示应用红景天苷可能呈剂量依赖性地抑制NF-κB/TNF-α通路的激活水平,减少胰腺的炎性损伤,发挥保护作用,且以Sal 60组的剂量保护作用最有效。
本实验仍然存在不足:①由于本实验未设计自噬抑制剂组,因此尚不能明确红景天苷主要通过抑制炎症因子释放还是诱导细胞自噬而发挥保护作用。②有研究显示红景天苷可以降低急性胰腺炎早期血清胰酶水平,这可能与细胞自噬有关;还有报道称NF-κB/TNF-α与自噬调节有关,因此本研究尚无法解释这一实验结果。③细胞自噬水平可以通过电子透射镜下观察自噬小体的形成来更加直观地判断,但是由于实验经费有限,故尚未做相关实验设计。④由于对实验技术和相关指标检测条件的掌握有限,本研究尚未进一步检测mTOR上游通路中的关键蛋白如PI3K/AKT等。
综上所述,本实验已证明红景天苷可以通过抑制炎症因子释放和诱导细胞自噬活性,发挥对SAP大鼠胰脏的保护作用,且在实验设计的红景天苷治疗剂量范围内,其保护作用与治疗剂量成正比。因此,在此实验基础上关于红景天苷在SAP中的治疗作用机制仍有待进一步研究。
利益冲突 所有作者均声明不存在利益冲突
| [1] | Banks PA, Bollen TL, Dervenis C, et al. Classification of acute pancreatitis: 2012: revision of the Atlanta classification and definitions by international consensus[J]. Gut, 2013, 62(1): 102-111. DOI:10.1136/gutjnl-2012-302779 |
| [2] | Iwahashi K, Hikita H, Makino Y, et al. Autophagy impairment in pancreatic acinar cells causes zymogen granule accumulation and pancreatitis[J]. Biochem Biophys Res Commun, 2018, 503(4): 2576-2582. DOI:10.1016/j.bbrc.2018.07.018 |
| [3] | Gukovskaya AS, Gukovsky I, Algül H, et al. Autophagy, inflammation, and immune dysfunction in the pathogenesis of pancreatitis[J]. Gastroenterology, 2017, 153(5): 1212-1226. DOI:10.1053/j.gastro.2017.08.071 |
| [4] | Hashimoto D, Ohmuraya M, Hirota M, et al. Involvement of autophagy in trypsinogen activation within the pancreatic acinar cells[J]. J Cell Biol, 2008, 181(7): 1065-1072. DOI:10.1083/jcb.200712156 |
| [5] | Hoque R, Farooq A, Ghani A, et al. Lactate reduces liver and pancreatic injury in toll-like receptor- and inflammasome-mediated inflammation via GPR81-mediated suppression of innate immunity[J]. Gastroenterology, 2014, 146(7): 1763-1774. DOI:10.1053/j.gastro.2014.03.014 |
| [6] | Neri LM, Cani A, Martelli AM, et al. Targeting the PI3K/Akt/mTOR signaling pathway in B-precursor acute lymphoblastic leukemia and its therapeutic potential[J]. Leukemia, 2014, 28(4): 739-748. DOI:10.1038/leu.2013.226 |
| [7] | 孙安琪, 颜天华, 巨修练. 红景天苷药理作用及分子机制的研究进展[J]. 时珍国医国药, 2018, 29(6): 1440-1443. DOI:10.3969/j.issn.1008-0805.2018.06.059 |
| [8] | 李杰清, 牛桂芬, 孙健波. 红景天苷在急性坏死性胰腺炎缺血病理过程中的作用研究[J]. 实用药物与临床, 2015, 18(3): 301-304. DOI:10.14053/j.cnki.ppcr.201503014 |
| [9] | Li T, Xu K, Liu Y. Anticancer effect of salidroside reduces viability through autophagy/PI3K/Akt and MMP-9 signaling pathways in human bladder cancer cells[J]. Oncol Lett, 2018, 16(3): 3162-3168. DOI:10.3892/ol.2018.8982 |
| [10] | Liu ZB, Li XS, Simoneau AR, et al. Rhodiola rosea extracts and salidroside decrease the growth of bladder cancer cell lines via inhibition of the mTOR pathway and induction of autophagy[J]. Mol Carcinog, 2012, 51(3): 257-267. DOI:10.1002/mc.20780 |
| [11] | Tang QQ, Fang MY. Effect of SB203580 on pathologic change of pancreatic tissue and expression of TNF-α and Il-1β in rats with severe acute pancreatitis[J]. Pancreatology, 2013, 13(4): S31-S33. DOI:10.1016/j.pan.2013.07.146 |
| [12] | Ashford TP, Porter KR. Cytoplasmic components in hepatic cell lysosomes[J]. J Cell Biol, 1962, 12(1): 198-202. DOI:10.1083/jcb.12.1.198 |
| [13] | Deretic V, Saitoh T, Akira S. Autophagy in infection, inflammation and immunity[J]. Nat Rev Immunol, 2013, 13(10): 722-737. DOI:10.1038/nri3532 |
| [14] | Gukovsky I, Pandol SJ, Mareninova OA, et al. Impaired autophagy and organellar dysfunction in pancreatitis[J]. J Gastroenterol Hepatol, 2012, 27(Suppl 2): 27-32. DOI:10.1111/j.1440-1746.2011.07004.x |
| [15] | Hsieh YC, Athar M, Chaudry IH. When apoptosis meets autophagy: deciding cell fate after trauma and Sepsis[J]. Trends Mol Med, 2009, 15(3): 129-138. DOI:10.1016/j.molmed.2009.01.002 |
| [16] | Ma XM, Blenis J. Molecular mechanisms of mTOR-mediated translational control[J]. Nat Rev Mol Cell Biol, 2009, 10(5): 307-318. DOI:10.1038/nrm2672 |
| [17] | Vanhaesebroeck B, Guillermet-Guibert J, Graupera M, et al. The emerging mechanisms of isoform-specific PI3K signalling[J]. Nat Rev Mol Cell Biol, 2010, 11(5): 329-341. DOI:10.1038/nrm2882 |
| [18] | Gregoric P, Sijacki A, Stankovic S, et al. SIRS score on admission and initial concentration of IL-6 as severe acute pancreatitis outcome predictors[J]. Hepatogastroenterology, 2010, 57(98): 349-353. |
| [19] | Satoh A, Shimosegawa T, Fujita M, et al. Inhibition of nuclear factor-kappaB activation improves the survival of rats with taurocholate pancreatitis[J]. Gut, 1999, 44(2): 253-258. DOI:10.1136/gut.44.2.253 |
| [20] | Yamamoto M, Takeda K. Current views of toll-like receptor signaling pathways[J]. Gastroenterol Res Pract, 2010, 2010: 240365. DOI:10.1155/2010/240365 |
 2021, Vol. 30
2021, Vol. 30




