2 中部战区总医院急诊科,武汉 430070;
3 武汉市中医医院重症医学科 430000;
4 襄阳市中心医院急诊科 441021;
5 浙江大学医学院附属第二医院急诊科,杭州 310009
2 Department of Emergency Medicine, Hankou Branch of Central Theater General Hospital, Wuhan 430070, China;
3 Department of Intensive Care Unit, Wuhan Hospital of Traditional Chinese Medicine, Wuhan 430000, China;
4 Department of Emergency Medicine, Xiangyang Central Hospital, Xiangyang 441021, China;
5 Department of Emergency Medicine, Second Affiliated Hospital, Zhejiang University School of Medicine, Hangzhou 310009, China
影响心肺复苏(cardiopulmonary resuscitation, CPR)后患者生存率和预后的主要因素在于脑损伤。迄今为止,唯一被临床证实可发挥神经保护作用、改善缺血缺氧性脑病的心肺复苏治疗策略只有亚低温。但由于其可导致较多的并发症,临床上并未被广泛应用[1-2],所以寻找新的复苏治疗策略是临床迫切需要解决的课题。
迷走神经电刺激(vagus nerve stimulation, VNS)在临床上主要应用于难治性癫痫与耐药性抑郁症患者的治疗,通过可植入性装置对迷走神经进行电刺激,其在疼痛、记忆功能障碍、颅脑损伤、脑缺血等领域均显示出了很好的疗效。笔者前期研究发现VNS可通过胆碱能抗炎途径改善CPR后大鼠的预后[3],提示VNS作为一种新的复苏策略有着较好的临床应用前景,但是有关VNS在CPR中的应用时机及机制均尚未阐明。考虑临床上在复苏后一定时间窗内给予VNS治疗更加符合实际情况,因此本研究通过构建大鼠CPR模型,比较心脏骤停(cardiac arrest, CA)前VNS处理和自主循环恢复(return of spontaneous circulation, ROSC)后不同时间段VNS处理在改善CPR大鼠预后方面的疗效差异,探索VNS在复苏中的最佳作用时机。
1 材料与方法 1.1 实验动物准备健康雄性Sprague Dawley(SD)大鼠,体质量(350±20)g,购自湖北省实验动物研究中心(动物检疫合格号:SCXK2015-0018)。所有动物用标准饲料饲养在啮齿动物设施中。术前12 h禁食,可自由饮水。通过腹膜内注射戊巴比妥钠(45 mg/kg)麻醉。气管插管并连接呼吸机(ALC-V8S,上海奥尔科特生物技术有限公司,中国)行机械通气,呼吸参数设置为潮气量6.5 mL/kg,呼吸频率为70次/min,吸入氧体积分数(FiO2)为21%。将聚乙烯导管(PE50,RWD,中国)插入左股动脉和静脉,并间歇地用含有2.5 U/mL肝素的生理盐水溶液冲洗以测量动脉血压和建立静脉输液途径。使用BL-420F生物机能实验系统(成都泰盟软件有限公司,中国)记录动脉血压和心电图。使用加热灯维持肛温(36.5±0.5)℃。本研究获取华中科技大学医学伦理委员会的批准(【2019】伦审字(S2387)号),遵循动物实验伦理和福利原则。
1.2 实验动物分组将大鼠随机(随机数字法)分配到以下五组:⑴假手术组(SHAM组,n=5),仅对大鼠行麻醉、气管插管、股动静脉置管、迷走神经游离等基础操作,不诱导CA和CPR,不进行VNS;⑵CPR组(n=12),通过诱导心室颤动建立大鼠CA模型并进行CPR;⑶CA前组(PRE组,n=12),诱颤开始前予右侧VNS 30 min(刺激参数:1.2 ms、4 Hz、6 V);⑷ROSC后5 min组(POST5组,n=12),ROSC 5 min后予右侧VNS 30 min(刺激参数同上);⑸ROSC后30 min组(POST30组,n=12),ROSC 30 min后予右侧VNS 30 min(刺激参数同上)。
1.3 实验模型与干预VNS的实施:小心游离大鼠颈部区域右侧颈部迷走神经;在全身麻醉和机械通气下,将电极勾住右侧迷走神经,通过BL-420F生物机能实验系统调控电刺激,刺激参数为波宽1.2 ms,频率4 Hz,强度6 V,时长30 min。刺激部位通过无菌纱布与周围组织隔离。
采用改良经皮心外膜电刺激诱导心室颤动方法建立大鼠CA模型[4],诱导室颤前,停止机械通气。以波幅1 ms,频率50 Hz,强度1~3 mA连续单刺激电流通过针灸针刺激心外膜3 min,诱发心室颤动,成功标准为动脉血压迅速降至25 mmHg(1 mmHg=0.133 kPa)以下,动脉搏动波形消失,心电图表现心室颤动。诱导CA 6 min后开始CPR,机械通气调整频率为100次/min,吸入纯氧,胸外按压频率为200次/min。将CPR后平均动脉压维持在60 mmHg以上至少10 min作为ROSC的指标。CPR期间,每2 min注射一次肾上腺素(20 μg/kg,远大医药公司,中国)和电除颤(Zoll M系列除颤器,ZOLL,英国),10 min后未能ROSC则放弃抢救。4 h后取出所有导管,并缝合手术伤口。后续放回饲养笼观察至72 h。
1.4 观察指标全程监测实验动物的心电图及血压。分别于ROSC后24、48和72 h,进行神经功能缺损评分(0~500分;0为正常,500为死亡或脑死亡)[5]。观察每组大鼠的72 h存活率。于ROSC后72 h,用戊巴比妥钠150 mg/kg予安乐死并获取脑组织,进行如下检测:⑴TUNEL染色检测大脑皮质区细胞凋亡,使用TUNEL试剂盒(11684817910,罗氏公司,德国),将组织切片置于200倍光镜下观察,每组3个视野统计凋亡细胞数和总细胞数。凋亡阳性细胞呈现棕黄色碎点核,凋亡阳性率=凋亡细胞数/总细胞计数×100%;⑵免疫荧光检测大脑皮质区α7烟碱型乙酰胆碱受体(α7 subunit-containing nicotinic acetylcholine receptor, α7nAChR)表达,将石蜡切片脱石蜡并在EDTA抗原修复缓冲液中的微波炉中进行抗原修复。置于3%过氧化氢溶液中,在室温下避光孵育10 min。洗涤干燥。向每个切片中加入约50 μL稀释的ɑ7nAChR一抗(1:50,sc-58607,Santa Cruz,美国)并在4 ℃下孵育过夜。第二天洗涤后加入相应二抗(1:50,SA00007-7,三鹰,中国)37 ℃温育50 min。洗涤后,加入DAPI染色剂显示细胞核。盖上盖玻片,在激光扫描共聚焦显微镜(Olympus FV3000,Olympus Corporation,日本)下以400倍放大倍数观察。
1.5 统计学方法使用SPSS 17.0进行统计分析。符合正态分布的计量资料采用均数±标准误(Mean±SEM)表示。组间比较使用单因素方差分析(ANOVA),并使用Bonferroni进行多重比较;生存率计算使用Kaplan-Meier分析并进行Log-rank检验。以P < 0.05为差异有统计学意义。
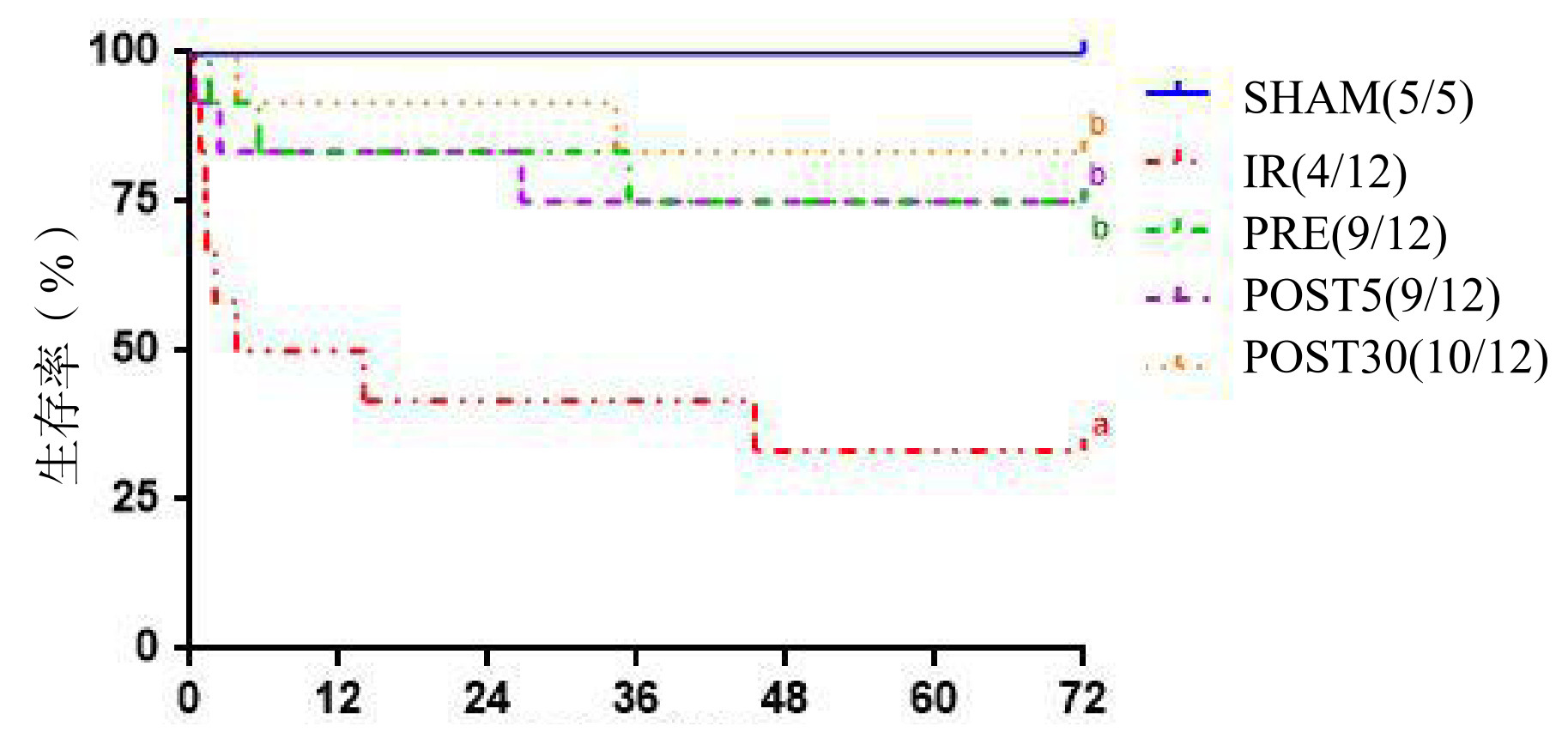
2 结果 2.1 CA前VNS处理和ROSC后VNS处理均提高大鼠ROSC后72 h生存率在ROSC后72 h观察期内,SHAM组所有大鼠均存活;与CPR组(4/12)相比,CA前VNS处理PRE组(9/12)、CA后VNS处理POST5组(9/12)与POST30组(10/12)大鼠复苏后72 h生存率均显著改善(P < 0.05,图 1),而且VNS前处理和后处理组鼠复苏后72 h生存率的差异无统计学意义。
|
| 与SHAM组比较,aP < 0.05;与CPR组比较,bP < 0.05 图 1 各组大鼠Kaplan-Meier生存曲线 Fig 1 Kaplan-Meier survival curves of rats in each group |
|
|
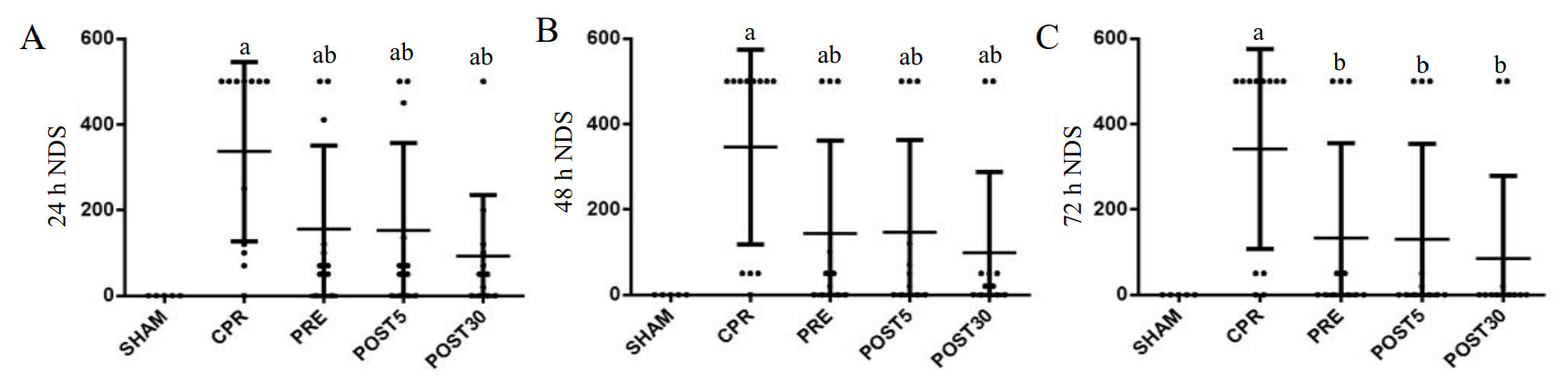
在ROSC后的24、48以及72 h评估各组大鼠的神经功能缺损评分。与SHAM组相比,CPR组大鼠的神经功能皆明显受损(P < 0.05)。与CPR组相比,PRE组、POST5组和POST30组在三个时间段中的神经功能缺损评分都明显减低,提示无论是VNS前处理还是后处理都有较好的脑复苏疗效(P < 0.05),而且VNS各组间差异无统计学意义,见图 2。
|
| A:ROSC后第24小时NDS;B:ROSC后第48小时NDS;C:ROSC后第72小时NDS;黑点表示各个体的值,水平横线表示组的中值。与SHAM组比较,aP < 0.05;与CPR组比较,bP < 0.05 图 2 各组大鼠神经功能缺损评分(NDS)情况 Fig 2 Neurological deficit score (NDS) of rats in each group |
|
|
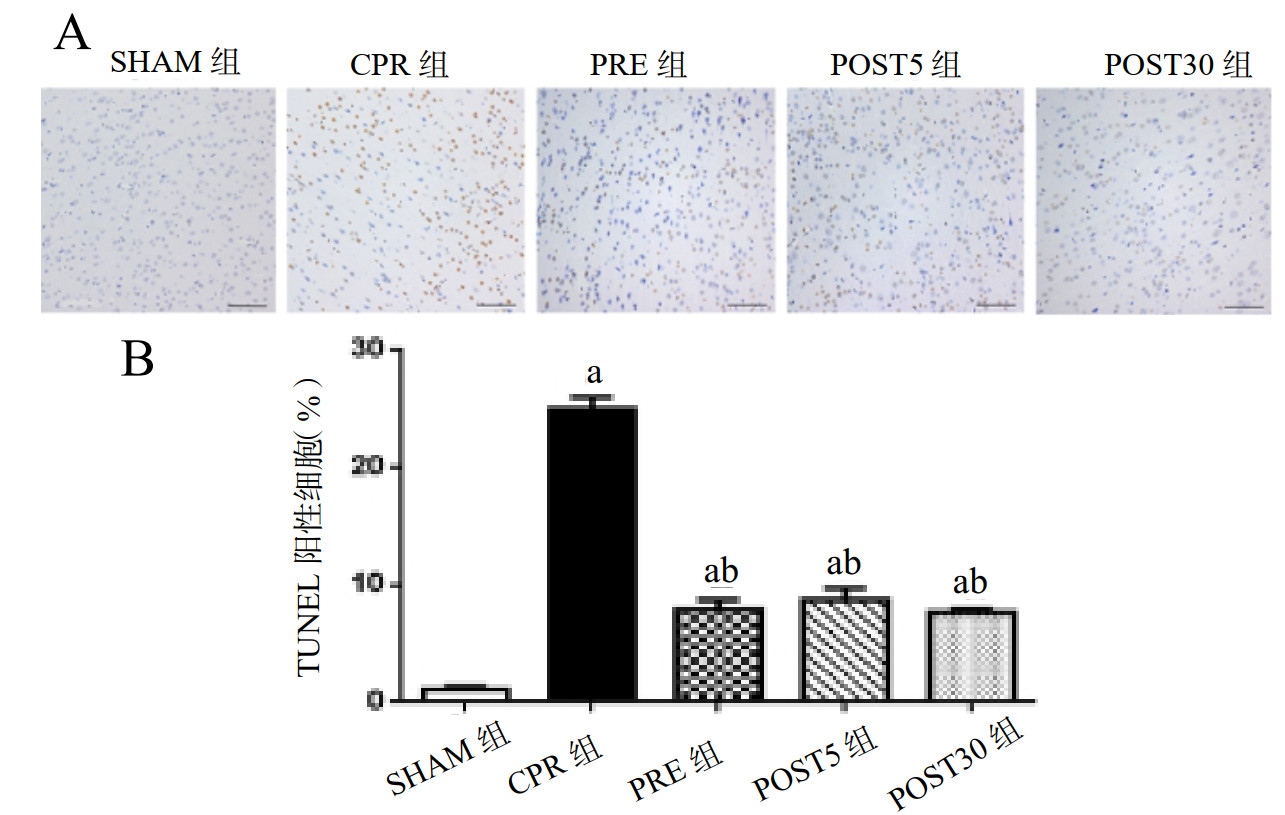
为进一步评估VNS脑复苏作用的机制,本研究中把复苏72 h后大鼠脑组织切片行TUNEL染色,观察各组脑皮质细胞的凋亡情况。结果发现经历CPR的各组大鼠的脑皮质凋亡阳性细胞占视野内总细胞的比例皆有所增高(P < 0.05),以CPR组凋亡最明显。经过VNS前处理或者后处理的组别凋亡阳性率明显降低,但VNS各组间差异无统计学意义,见图 3。
|
| A:TUNEL染色,放大倍数×200,标尺=100 μm;B:TUNEL阳性细胞所占百分比;与SHAM组比较,aP < 0.05;与CPR组比较,bP < 0.05 图 3 各组大鼠脑皮质区凋亡情况 Fig 3 Apoptosis in cortical areas of rats in each group |
|
|
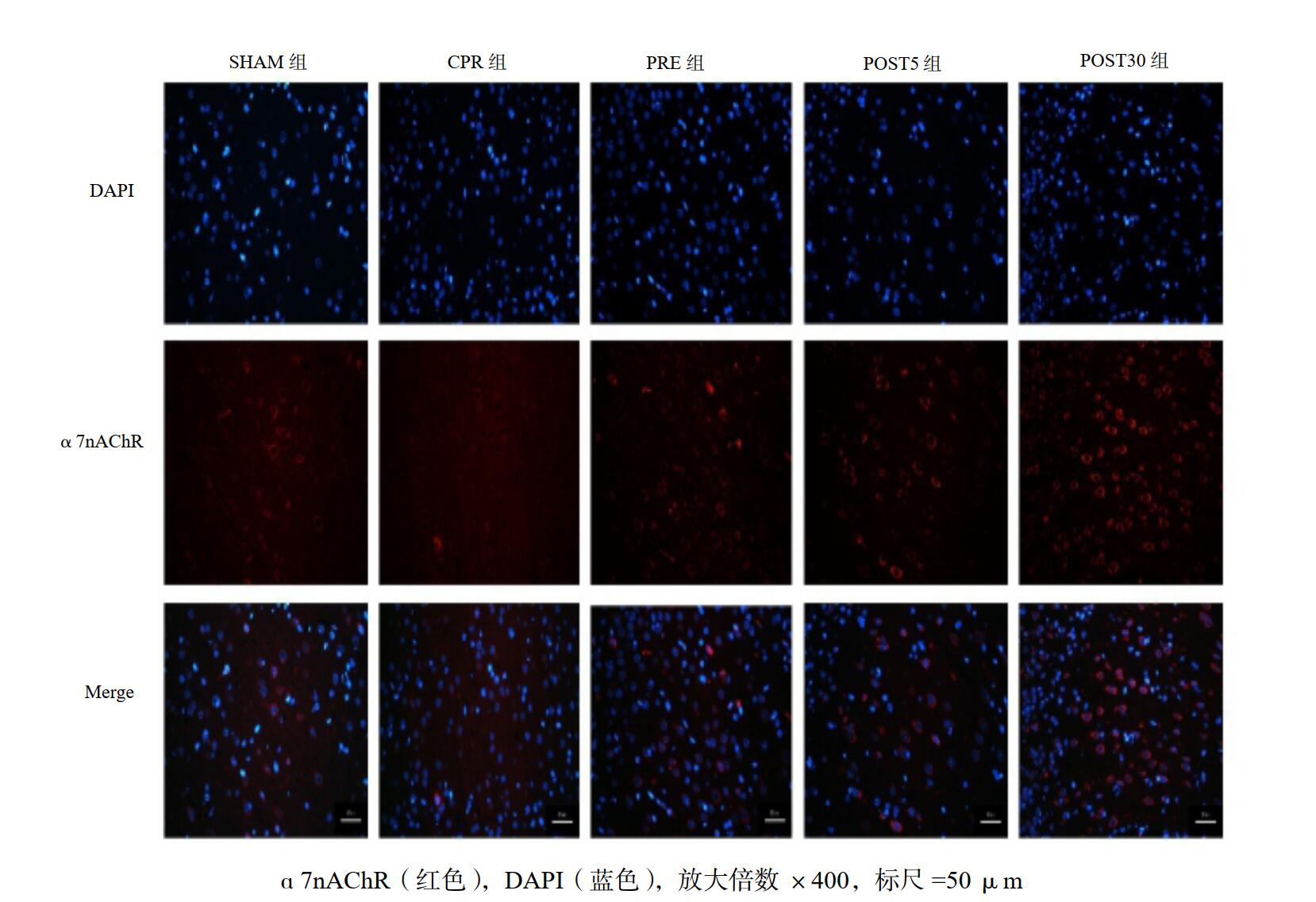
由于在前期实验中发现VNS通过胆碱能抗炎通路发挥主要作用,而胆碱能抗炎通路通过α7nAChR介导,因此本研究对脑组织切片进行了免疫荧光染色,观察VNS前处理或后处理对脑组织中α7nAChR的表达差异。结果发现CPR组脑皮质的α7nAChR表达减弱,而VNS前、后处理组α7nAChR表达明显增加(图 4),提示VNS可以促进α7nAChR表达在复苏后的重建。
|
| 图 4 各组大鼠脑皮质区α7nAChR免疫荧光染色 Fig 4 Immunofluorescence staining of α7nAChR in cerebral cortex of rats in each group |
|
|
本研究结果发现不论CA前VNS处理或者ROSC后VNS处理均可显著提高ROSC后大鼠72 h生存率和神经功能,减少大脑皮质神经细胞凋亡,并上调α7nAChR的表达。更为重要的是本研究观察到ROSC后5 min与30 min VNS治疗对改善ROSC大鼠的预后的差异无统计学意义。考虑到临床真实情况,在患者ROSC后30 min内给予VNS治疗更加符合实际,这也为VNS转化应用于临床复苏提供了可能。
现已证实,CA/CPR后全身缺血-再灌注(ischemia-reperfusion, I/R)损伤是导致ROSC后患者生存率低的关键因素[6]。ROSC后躯体的I/R损伤激活了炎症免疫反应和凝血功能异常,最终导致多组织器官功能障碍而表现为复苏后综合征。而研究发现的“胆碱能抗炎通路”则为干预I/R炎症免疫损伤提供了一个新的思路[7]。胆碱能抗炎通路是指迷走神经的传出信号(可通过脑网络控制)通过巨噬细胞和其他细胞上依赖于α7nAChR的途径来抑制细胞因子的产生,即迷走神经来源的胆碱能信号发挥了影响细胞因子合成的神经调节作用,以限制免疫应答强度从而减轻炎症反应[8]。
α7nAChR作为配体门控离子通道型受体,既存在于众多免疫细胞,如中性粒细胞、单核细胞和巨噬细胞,也是哺乳动物中枢神经系统中分布最丰富的烟碱型乙酰胆碱受体亚型之一。已有大量实验证明胆碱能抗炎通路的激活是VNS减轻心、脑等重要脏器I/R损伤的重要机制[9-10]。有研究发现ROSC后3 d的小鼠海马组织乙酰胆碱酯酶、乙酰胆碱转移酶和囊泡乙酰胆碱转运蛋白mRNA的水平明显下调,炎症因子水平升高,提示胆碱能抗炎通路在ROSC后小鼠体内处于抑制状态,这为VNS应用于CPR奠定了重要的理论基础[11]。笔者前期研究发现VNS对CPR大鼠预后的改善作用取决于α7nAChR的表达,因为使用α7nAChR拮抗剂甲基牛扁亭柠檬酸盐(methyllycaconitine citrate, MLA)消除了其有益效应[3]。本研究进一步发现CPR后大鼠脑内α7nAChR表达下调,而VNS可以重建α7nAChR表达,这从另一个角度也证实了VNS改善CPR预后的机制与恢复和激活胆碱能抗炎通路密切相关。
有研究发现α7nAChR激活调节的不仅是炎症,也涉及抗凋亡效应。已证实对局灶性脑I/R的大鼠行VNS处理,VNS可能通过激活α7nAChR/Akt信号传导途径发挥抗凋亡作用[12]。在犬心肌I/R模型中,VNS可通过提高Bcl-2蛋白表达,降低Bax蛋白表达来发挥抗心肌细胞凋亡效应[13]。这些研究提示VNS对I/R损伤的治疗作用是多方面的。本研究中也发现VNS对CPR所诱导的I/R损伤具有较好的保护作用,体现在VNS处理组大鼠脑组织凋亡神经细胞显著减少,相应的VNS处理后大鼠72 h神经系统缺损评分也得到显著改善。
本研究中最为关键的结果是无论是CA前VNS处理,还是ROSC后VNS处理,大鼠ROSC后72 h生存率均得到显著改善,而且ROSC后30 min VNS处理的大鼠生存率与CA前VNS处理、ROSC后5 min VNS处理相比,差异无统计学意义,这提示VNS即使在ROSC后30 min内给予,也能够取得较好的效果。已有研究发现心肌经过长时间I/R损伤会导致迷走神经传出轴突的功能完全中断,缺血部位乙酰胆碱释放被部分抑制,提示VNS后处理存在有效干预时间窗[14]。在大鼠心肌梗死模型中,有研究者通过使用α7nAChR激动剂PNU282987来探索其发挥抗心肌I/R损伤效应的最佳时机,发现PNU282987后处理对炎症细胞因子的抑制作用较缺血预处理强,再灌注30 min时实施PNU282987后处理保护效果最佳[15];另有研究者比较不同时机的VNS处理在动物模型上的保护效应,发现在心肌缺血15 min时行VNS为较适宜的时机,可能与其较早干预再灌注期间室性心律失常的发生有关[16]。本研究中的CPR模型采用CA 6 min后复苏的大鼠模型,这是经过前期大量实验摸索出来较为稳定的CPR动物模型,ROSC成功率高,本次实验发现VNS后处理组具有较好的治疗效果,提示这种干预可以较好保存迷走神经传出功能。然而,如果延长大鼠CA时间,一方面将降低大鼠复苏成功率,另一方面VNS处理是否仍然具有一定的疗效,还需要进一步研究证实。
综上所述,本研究证实对于CA 6 min后CPR的大鼠模型,ROSC后30 min内应用VNS后处理具有较好的疗效,其机制可能与激活α7nAChR表达介导的抗炎和抗凋亡等多重效应有关。
利益冲突 所有作者均声明不存在利益冲突
| [1] | Abella BS, Rhee JW, Huang K, et al. Induced hypothermia is underused after resuscitation from cardiac arrest: a current practice survey[J]. Resuscitation, 2005, 64(2): 181-186. DOI:10.1016/j.resuscitation.2004.09.014 |
| [2] | 心脏骤停后目标温度管理共识专家组. 心脏骤停后目标温度管理专家共识[J]. 中华急诊医学杂志, 2016, 25(8): 1000-1006. DOI:10.3760/cma.j.issn.1671-0282.2016.08.006 |
| [3] | Sun P, Wang J, Zhao S, et al. Improved outcomes of cardiopulmonary resuscitation in rats treated with vagus nerve stimulation and its potential mechanism[J]. Shock, 2018, 49(6): 698-703. DOI:10.1097/shk.0000000000000962 |
| [4] | 舒婷婷, 张瑜涵, 梁利彩, 等. 改良经皮心外膜电刺激建立大鼠心脏骤停模型[J]. 中华急诊医学杂志, 2018, 27(5): 513-517. DOI:10.3760/cma.j.issn.1671-0282.2018.05.011 |
| [5] | Ye S, Weng Y, Sun S, et al. Comparison of the durations of mild therapeutic hypothermia on outcome after cardiopulmonary resuscitation in the rat[J]. Circulation, 2012, 125(1): 123-129. DOI:10.1161/circulationaha.111.062257 |
| [6] | Neumar RW, Nolan JP, Adrie C, et al. Post-cardiac arrest syndrome: epidemiology, pathophysiology, treatment, and prognostication. A consensus statement from the International Liaison Committee on Resuscitation (American Heart Association, Australian and New Zealand Council on Resuscitation, European Resuscitation Council, Heart and Stroke Foundation of Canada, InterAmerican Heart Foundation, Resuscitation Council of Asia, and the Resuscitation Council of Southern Africa); the American Heart Association Emergency Cardiovascular Care Committee; the Council on Cardiovascular Surgery and Anesthesia; the Council on Cardiopulmonary, Perioperative, and Critical Care; the Council on Clinical Cardiology; and the Stroke Council[J]. Circulation, 2008, 118(23): 2452-2483. DOI: 10.1161/circulationaha.108.190652. |
| [7] | Borovikova LV, Ivanova S, Zhang MH, et al. Vagus nerve stimulation attenuates the systemic inflammatory response to endotoxin[J]. Nature, 2000, 405(6785): 458-462. DOI:10.1038/35013070 |
| [8] | Tracey KJ. Physiology and immunology of the cholinergic antiinflammatory pathway[J]. J Clin Investig, 2007, 117(2): 289-296. DOI:10.1172/JCI30555 |
| [9] | Calvillo L, Vanoli E, Andreoli E, et al. Vagal stimulation, through its nicotinic action, limits infarct size and the inflammatory response to myocardial ischemia and reperfusion[J]. J Cardiovasc Pharmacol, 2011, 58(5): 500-507. DOI:10.1097/fjc.0b013e31822b7204 |
| [10] | Sun Z, Baker W, Hiraki T, et al. The effect of right vagus nerve stimulation on focal cerebral ischemia: an experimental study in the rat[J]. Brain Stimul, 2012, 5(1): 1-10. DOI:10.1016/j.brs.2011.01.009 |
| [11] | Norman GJ, Morris JS, Karelina K, et al. Cardiopulmonary arrest and resuscitation disrupts cholinergic anti-inflammatory processes: a role for cholinergic 7 nicotinic receptors[J]. J Neurosci, 2011, 31(9): 3446-3452. DOI:10.1523/jneurosci.4558-10.2011 |
| [12] | Jiang Y, Li LL, Liu B, et al. Vagus nerve stimulation attenuates cerebral ischemia and reperfusion injury via endogenous cholinergic pathway in rat[J]. PLoS One, 2014, 9(7): e102342. DOI:10.1371/journal.pone.0102342 |
| [13] | Chen M, Zhou X, Yu L, et al. Low-level vagus nerve stimulation attenuates myocardial ischemic reperfusion injury by antioxidative stress and antiapoptosis reactions in canines[J]. J Cardiovasc Electrophysiol, 2016, 27(2): 224-231. DOI:10.1111/jce.12850 |
| [14] | Kawada T, Yamazaki T, Akiyama T, et al. Disruption of vagal efferent axon and nerve terminal function in the postischemic myocardium[J]. Am J Physiol Heart Circ Physiol, 2002, 283(6): H2687-H2691. DOI:10.1152/ajpheart.00291.2002 |
| [15] | 熊军. α7nAChR激动剂后处理对大鼠在体心肌缺血-再灌注损伤的保护作用及机制的实验研究[D].北京: 北京协和医学院, 2011. |
| [16] | 王强, 薛富善, 程怡, 等. 不同时机迷走神经电刺激后处理对大鼠心肌缺血再灌注损伤的影响[J]. 中华麻醉学杂志, 2013, 33(7): 887-891. DOI:10.3760/cma.j.issn.0254-1416.2013.07.029 |
 2021, Vol. 30
2021, Vol. 30




