急性有机磷中毒(acute organophosphate poisoning,AOPP)是我国农村地区较常见的急性中毒之一。有机磷通过与胆碱酯酶(cholinesterase,ChE)结合,使ChE分解乙酰胆碱(acetylcholine, ACh)的功能丧失,导致大量ACh蓄积,从而出现一系列中毒症状[1-2]。主要表现为毒蕈碱样、烟碱样及中枢神经系统症状,对机体造成严重损伤。门静脉气体栓塞的发生十分罕见[3],常出现在肠缺血或坏死、腹腔脓肿等疾病后,有时会出现于腹腔镜气腹手术后[4],该病起病急,恶化迅速,患者病死率极高[5]。2019年1月,本院收治1例急性有机磷中毒后并发门静脉气体栓塞患者,现报道如下。
1 资料与方法患者男,74岁,误服“水胺硫磷”13+ h急诊入院,患者误服水胺硫磷约100 mL,于外院予以洗胃、阿托品、解磷定等治疗后急诊转入本院。既往“高血压”病史10+年,未规律服药,“脑梗死”病史2+年,左侧肢体较对侧肌力稍下降。否认糖尿病,冠心病病史,否认肝炎病史,否认药物食物过敏史,否认手术外伤史。
体格检查:入院时患者心率77次/min, 呼吸15次/min, 血压105/70 mmHg,经鼻氧饱和度99%(鼻导管吸氧FIO2 33%), 神清,全身可闻及刺鼻农药味,双瞳等大等圆约3 mm,光反应可,呼吸平稳,双肺呼吸音粗,未闻及明显干湿啰音,心律齐,腹稍膨隆,腹软,全腹部无压痛、反跳痛及肌紧张,肠鸣音3次/min,皮肤黏膜稍湿润,全身未见肌束颤动,四肢肌力、肌张力正常,四肢无水肿。
实验室检查:血常规:白细胞13.48×109/L,中性粒细胞12.12×109/L,红细胞4.21×1012/L血红蛋白133 g/L,红细胞压积39.7%,血小板164×109/L,凝血象:凝血酶原时间14.3 s,活化部分凝血活酶时间36.9 s,凝血酶时间14.2 s,D二聚体0.93 FEU,纤维蛋白原4.15 g/L,血生化:胆碱酯酶81 U/L,丙氨酸氨基转氨酶40 U/L,天门冬氨酸氨基转移酶36 U/L,总胆红素14.3 U/L,间接胆红素9.4 U/L,直接胆红素4.9 U/L,肌酐60 μmol/L,肌酸激酶553 U/L,肌酸激酶MB同工酶22 U/L,肌钙蛋白I小于0.01 ng/mL,超敏C反应蛋白17.2 mg/L,降钙素原0.39 ng/mL,乳酸1.8 mmol/,脑利钠肽前体612.8 pg/mL,。血气分析:pH 7.55,PCO2 24.3 mmHg,PO2 122 mmHg。肿瘤标志物、甲功未见异常。
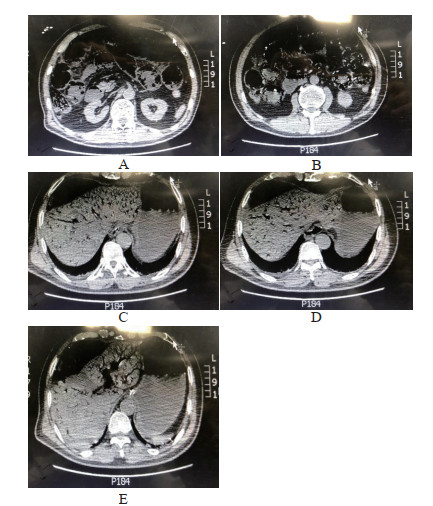
诊治经过及临床转归:入院后再次予以洗胃、导泻、灌肠,予以阿托品、碘解磷定解毒,抑酸护胃、补液促进药物代谢等对症治疗,同时于入院2 h后行血液灌流治疗1次(HA330),血液灌流过程顺利,治疗后复查胆碱酯酶151 U/L,复查肝功、肾功、心肌酶、血气分析等无异常。入院约12 h患者突然出现烦躁不安,心率增快,查体见全腹部膨隆,压痛、反跳痛明显,腹肌紧张,肠鸣音未闻及,床旁彩超提示腹腔内大量气体,完善医患沟通后外出行头胸全腹部CT检查,检查结果示:①双侧基底节区少许腔隙性梗死; ②侧脑室旁脑白质病变; ③脑萎缩; ④左肺上叶下舌段、双肺下叶少量渗出,考虑感染,伴双侧胸腔少量积液; ⑤腹部小肠、升结肠及部分横结肠积气、扩张,肠壁积气(图 1A,B),门静脉系统及下腔静脉系统广泛积气(图 1C,D,E),盆腔少量积液。完善医患沟通后家属表示保守治疗,拒绝进一步治疗措施,拒绝气管插管、有创呼吸机通气、胸外心脏按压等抢救措施,继续予以补液、抗感染、维持内环境等治疗。后患者病情逐渐加重,入院15+ h复查血常规:白细胞13.56×109/L,中性粒细胞11.5×109/L,红细胞5.6×1012/L血红蛋白174 g/L,红细胞压积53.3%,血小板143×109/L,凝血象:凝血酶原时间15.2 s,活化部分凝血活酶时间49.4 s,凝血酶时间15.9 s,D二聚体6.3 FEU,纤维蛋白原5.73 g/L,血生化:胆碱酯酶119 U/L,丙氨酸氨基转氨酶83 U/L,天门冬氨酸氨基转移酶103 U/L,总胆红素16 U/L,间接胆红素10.6 U/L,直接胆红素5.4 U/L,肌酐195.3 μmol/L,肌酸激酶1 356 U/L,肌酸激酶MB同工酶49 U/L,肌钙蛋白I 0.07 ng/mL,超敏C反应蛋白93.4 mg/L,降钙素原23.086 ng/mL,乳酸9.91 mmol/L, 脑利钠肽前体612.8 pg/mL。血气分析:pH 7.10, PCO2 28 mmHg, ,PO2 51 mmHg。。后家属放弃一切治疗,入院21 h后患者死亡。
|
| 图 1 患者CT |
|
|
AOPP中毒的经典机制是酶的抑制,主要是胆碱酯酶的抑制,同时近年来研究发现有机磷(organophosphate)对机体的毒性不单限于胆碱酯酶的抑制,另一个重要机制是有机磷能诱导机体氧化损伤[6-9],机体产生一种活性氧类(oxygen species,ROS)物质,这种物质可直接对机体造成损伤,同时能够介导信号通路,生成炎性介质,加重器官损伤[10-11]。有机磷中毒患者中发生死亡的大多数原因为呼吸衰竭[12],多因为有机磷毒剂相关的急性毒蕈碱作用影响通气和氧合导致死亡。近年来研究[13]发现胃肠功能损伤与有机磷中毒病情的发展和加重密切相关。有机磷中毒后对胃肠道功能的影响在于损伤胃肠道黏膜,造成黏膜萎缩、绒毛缩短和血管通透性增加[14],同时,应用阿托品的过程中药物本身会抑制胃肠道蠕动,不利于毒素排泄,使毒素吸收入血的同时引起炎症反应综合征造成“二次损伤打击”。
门静脉主要收集腹部盆部消化道、脾脏、胰腺和胆囊的静脉血,其属支包括肠系膜上静脉、肠系膜下静脉、脾静脉、胃左右静脉、胃结肠静脉、胆囊静脉及脐周静脉。本例患者服用有机磷时间长,量多,药物浓度高,入院后出现门静脉气体栓塞,考虑以下可能原因:(1)有机磷药物直接损伤胃肠道黏膜,导致肠道功能抑制,患者出现麻痹性肠梗阻,肠腔内大量积气,同时肠道黏膜血管通透性增加,肠道内气体穿过血管壁进入毛细血管,最后汇流至门静脉,发生门静脉气体栓塞; (2)有机磷药物及“二次损伤打击”共同作用于肠道,炎症反应使肠道黏膜及肠壁严重受损,导致部分肠坏死,肠腔内气体透壁进入肠系膜静脉,导致门静脉气体栓塞; (3)药物破坏肠道内菌群结构,肠道内产气菌群移位进入肠黏膜静脉产气,发生气体栓塞。
急性有机磷中毒后并发门静脉气体栓塞十分罕见。同时,门静脉气体栓塞的发生十分突然和严重,临床症状缺乏特异性,极易被临床医师忽略发生严重后果。因此,预防措施十分重要。首先,抢救有机磷中毒患者的首要措施是清除胃肠道内毒素,反复洗胃及导泻是重要的治疗手段之一,毒素的导泻效果直接影响抢救效果[19]。一般胃内容物排空时间为4~6 h,经8~12 h排至结肠,因此,早期应用导泻剂效果更佳,一般在中毒后12 h内,而本例患者入院时已服用毒物13+ h,可能是导致肠道损伤严重的原因之一。同时,阿托品作用于毒蕈碱型受体(M受体),逆转毒蕈碱样症状,自20世纪50年代使用,疗效毋庸置疑,目前国内普遍采取反复短时间隔直接静脉推注阿托品达到早期阿托品化,但接受阿托品治疗过程中,药物本身会抑制肠道蠕动不利于毒素排除,因此,在使用阿托品的同时避免二次伤害是临床治疗有机磷的重要环节。同时应及时监测肠道功能及肠黏膜损伤程度。本研究病例小肠、结肠明显积气,腹部明显膨隆,并逐渐出现肠道菌群移位导致脓毒血症、感染性休克及多器官功能不全,同时家属最终放弃治疗,无剖腹探查时机。急性有机磷中毒并发门静脉积气在临床上十分少见,其起病隐匿,进展迅速,病死率高,因此,临床医师应重视对肠道内毒物的清除及早期肠道黏膜保护药物的使用,预防发生至关重要。
利益冲突:作者声明无利益冲突。
| [1] | Moshiri M, Darchini-Maragheh E, Balali-Mood M. Advances in toxicology and medical treatment of chemical warfare nerve agents[J]. DARU J Pharm Sci, 2012, 20: 81. DOI:10.1186/2008-2231-20-81 |
| [2] | Hobbiger F. Reactivation of phosphorylated acetylcholinesterase[M]. Berlin, Heidelberg: Springer Berlin Heidelberg, 1963: 921-988. |
| [3] | 江浩. 急腹症影像学[M]. 上海: 上海科学技术出版社, 2006: 115-117. |
| [4] | 刘美峰, 韩小云, 秦薇. 1例腹腔镜下左半肝切除术中并发CO2气体栓塞的急救护理[J]. 中华护理杂志, 2016, 51(11): 1392-1394. |
| [5] | 马利杰, 王胜, 周锋.门静脉气体栓塞一列诊治分析[J/CD].中华危重症医学杂志: 电子版, 2014, 7(5): 365-367. |
| [6] | Guvenç D, Aksoy A, Kursad Y, et al. 3-nitrotyrosine levels in dichlorvos-induced neurotoxicity[J]. Arch Ind Hyg Toxicol, 2014, 65(1): 109-112. DOI:10.2478/10004-1254-65-2014-2416 |
| [7] | Kazi AI, Oommen A. Monocrotophos induced oxidative damage associates with severe acetylcholinesterase inhibition in rat brain[J]. Neuro Toxicology, 2012, 33(2): 156-161. DOI:10.1016/j.neuro.2012.01.008 |
| [8] | Zhang JW, Lv GC, Zhao Y. The significance of the measurement of serum xanthine oxidase and oxidation markers in patients with acute organophosphorus pesticide poisoning[J]. J Int Med Res, 2010, 38(2): 458-465. DOI:10.1177/147323001003800209 |
| [9] | Lukaszewicz-Hussain A. Role of oxidative stress in organophosphate insecticide toxicity – Short review[J]. Pestic Biochem Physiol, 2010, 98(2): 145-150. DOI:10.1016/j.pestbp.2010.07.006 |
| [10] | Zhang JX, Wang XL, Vikash, et al. ROS and ROS-mediated cellular signaling[J]. Oxidative Med Cell Longev, 2016, 2016: 1-18. DOI:10.1155/2016/4350965 |
| [11] | Chai X, Li D, Cao X, et al.ROS-mediated iron overload injures the hematopoiesis of bone marrow by damaging hematopoietic stem/progenitor cells in mice[EB/J]. Sci Rep, 2015.http://www.ncbi.nlm.gov/pmc/articles/PMC4429544/pdf/srep10181.pdf. |
| [12] | 陈浩云. 急性有机磷中毒的临床救治体会[J]. 中国医药指南, 2011, 10: 116-117. |
| [13] | 文武斌, 李红, 王玉华, 等. 丙氨酰谷氨酰胺对重症有机磷中毒患者神经和胃肠功能的影响[J]. 中国药房, 2016, 27(29): 4103-4105. |
| [14] | 杨勇, 杨金莲, 谢智慧. 高压氧干预对急性有机磷中毒大鼠脑组织中缺氧诱导因子-1α表达的影响[J]. 中华物理医学与康复杂志, 2015, 37(5): 332. |
 2020, Vol. 29
2020, Vol. 29




