2 郑州大学第二附属医院ICU,郑州 450003;
3 郑州大学第一附属医院急诊ICU, 郑州 450052;
4 郑州大学第一附属医院外科ICU, 郑州 450052;
5 郑州大学第一附属医院呼吸ICU, 郑州 450052
2 Department of ICU, the Second Affiliated Hospital of Zhengzhou University, Zhengzhou 450003, China;
3 Department of Emergency ICU, the First Affiliated Hospital of Zhengzhou University, Zhengzhou 450052, China;
4 Department of Surgical ICU, the First Affiliated Hospital of Zhengzhou University, Zhengzhou 450052, China;
5 Department of Respiratory ICU, the First Affiliated Hospital of Zhengzhou University, Zhengzhou 450052, China
脓毒症是由感染引起机体免疫反应失调,导致危及生命的多器官功能障碍[1],是急诊科和重症监护病房(intensive care unit, ICU)常见病。脓毒性休克是由脓毒症引起的循环、细胞或代谢异常,病死风险增加的临床状态[1],发病率和病死率高[2-4],成为重症医学科的棘手问题。脓毒症的微生物培养阳性率约70%,其中以革兰阴性杆菌多见[5]。近年来革兰阴性杆菌对碳青霉烯类等药物的耐药形势日益严峻,多黏菌素B (Polymyxin B, PMB)作为最后的治疗方法之一被重新用于临床[6]。
PMB治疗碳青霉烯耐药革兰阴性杆菌(carbapenem-resistant organism, CRO)感染(特别是肺炎克雷伯杆菌、鲍曼不动杆菌、铜绿假单胞菌)[7]的疗效和安全性需要重新评估。近年来国外的研究证明,PMB治疗碳青霉烯耐药肺炎克雷伯杆菌或鲍曼不动杆的疗效较好[8-9],不良反应也比原来减少[10]。但是目前关于PMB在国内应用的临床研究较少,缺乏相关数据。本研究为观察性研究,入选ICU住院的脓毒症患者,探讨PMB对CRO脓毒症患者的有效性及安全性,旨为能够合理应用PMB提供依据,避免PMB耐药菌株的出现。
1 资料与方法 1.1 一般资料采用观察性研究方法。本研究收集了2018年10月1日至2019年6月30日河南省14家医院ICU中因CRO引起的脓毒症静脉应用PMB患者。入选标准:①年龄≥ 14岁;②PMB抗感染治疗≥ 7 d的患者。排除标准:①年龄<14岁;②未用PMB或PMB应用<7 d的患者;③临床资料不完整;④患者或家属不同意。本研究内容符合医学伦理标准,已获得郑州大学第一附属医院科研和临床试验伦理委员会批准(批准号:SS-2019-015)。
1.2 研究方法收集患者的基本资料如性别、年龄、基础疾病,记录患者的感染部位、病原微生物培养结果、住院情况、ICU情况、用PMB 24 h内的动脉血气、血常规、肝肾功能、凝血功能、C-反应蛋白、降钙素原(procalcitonin, PCT)、进行序贯器官衰竭评分(sequential organ failure assessment, SOFA)和急性生理与慢性健康评分Ⅱ (acute physiology and chronic health evaluation, APACHE Ⅱ),机械通气、抗感染治疗方案及使用时间、PMB应用情况和不良反应、28 d随访。
脓毒症定义:由感染引起机体反应失调,导致危及生命的多器官功能障碍综合征[1];诊断标准:感染后24 h内SOFA评分增加≥ 2[1]。脓毒性休克定义:由脓毒症引起的循环、细胞或代谢异常,病死风险增加的临床状态[1];诊断标准:脓毒症患者充分容量复苏后仍存在持续性的低血压,需升压药物维持平均动脉压≥ 65 mmHg且血清乳酸水平>2 mmol/L[1]。急性肾损伤表现为肾功能急性下降[11]。
所有入组患者根据诊断标准分为脓毒性休克组和非休克组,对两组患者进行临床特征、感染指标、SOFA、APACHE Ⅱ、病原菌分布情况、抗感染治疗情况、不良反应及预后的差异进行统计分析。
1.3 统计学方法使用SPSS 21.0统计学软件进行数据处理,正态分布计量资料以均数±标准差(Mean±SD)表示,采用两独立样本t检验;若数据不符合正态分布则用中位数表示,用Mann-Whitney U检验比较;计数资料用百分比表示,两组间采用χ2检验;使用Kaplan-Meier生存分析法描绘两组的生存曲线并用log-rank检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 患者基本情况本研究共纳入98例因感染CRO静脉应用PMB的脓毒症患者,其中脓毒性休克48例,男性77例(78.57%)。两组患者的一般资料比较,在性别、年龄、慢性病史、感染指标如白细胞、C反应蛋白、降钙素原等方面差异均无统计学意义(均P > 0.05)。与非休克组相比,脓毒性休克组的机械通气患者比例更高(72.92% vs 32%,P < 0.05),血小板低(74.63×109/L vs 139.10×109/L,P < 0.05),SOFA评分(10.04 vs 5.72,P < 0.05)和APACHEⅡ评分更高(20.81 vs 14.94,P < 0.05),见表 1。入组患者中有15例病原微生物培养结果为阴性,经验性抗感染治疗。碳青霉烯耐药革兰阴性杆菌的菌种分布上,以肺炎克雷伯杆菌(47.96%)、鲍曼不动杆菌(33.67%)、铜绿假单胞菌(16.33%)最常见。入组患者中40例患者存在多部位感染,以肺部感染最常见(64.29%),血流感染次之(40.82%),术区感染较少见。两组患者的病原微生物分布和感染部位差异无统计学意义(均P > 0.05)。
| 变量 | 总体(n=98) | 脓毒性休克组(n=48) | 非休克组(n=50) | 统计量 | P值 |
| 年龄(岁) | 56 ± 17.07 | 58.79 ± 18.26 | 53.32 ± 15.56 | - 1.594 | 0.114 |
| 男(n,%) | 77 (78.57) | 34 (70.83) | 43 (86) | 3.346 | 0.086 |
| 机械通气(n,%) | 51 (52.04) | 35 (72.92) | 16 (32) | 16.427 | <0.001 |
| 慢性病史(n,%) | |||||
| 糖尿病 | 15 (15.31) | 6 (12.5) | 9 (18) | 0.571 | 0.577 |
| 高血压病 | 44 (44.9 0) | 22 (45.83) | 22 (44) | 0.033 | 1 |
| 脑卒中 | 19 (19.39) | 10 (20.83) | 9 (18) | 0.126 | 0.801 |
| 肿瘤 | 6 (6.12) | 5 (10.42) | 1 (2) | 3.018 | 0.108 |
| 冠心病 | 14 (14.29) | 8 (16.67) | 6 (12) | 0.436 | 0.573 |
| 肝病 | 8 (8.17) | 2 (4.17) | 6 (12) | 2.004 | 0.269 |
| WBC (109/L) | 16.14 ± 7.77 | 17.43 ± 8.80 | 14.93 ± 6.48 | 0.035 | 0.11 |
| PLT (109/L) | 107.52 ± 93.84 | 74.63 ± 61.95 | 139.10 ± 108.05 | 3.604 | <0.001 |
| PCT (ng/ml) | 5 | 6.69 | 2.17 | - 2.500 | 0.012 |
| CRP (μg/L) | 103.55 | 106 | 100.3 | -0.387 | 0.699 |
| SOFA | 7.84 ± 4.28 | 10.04 ± 4.16 | 5.72 ± 3.21 | - 5.776 | <0.001 |
| APACHE Ⅱ | 17.82 ± 7.52 | 20.81 ± 6.36 | 14.94 ± 7.48 | - 4.192 | <0.001 |
| 用PMB前住院天数 | 12 | 11.5 | 12 | -0.629 | 0.529 |
| 用PMB前ICU住院天数 | 8 | 6.5 | 9 | -0.708 | 0.479 |
| 用PMB前抗感染天数 | 10 | 7.5 | 11 | -1.544 | 0.123 |
| MODS(n,%) | 59 (60.20) | 33 (68.75) | 26 (52) | 2.868 | 0.103 |
| 曾用抗菌药物(n,%) | 88 (89.80) | 40 (83.33) | 48 (96) | 4.288 | 0.049 |
| 病原微生物(n,%) | |||||
| 肺炎克雷伯杆菌 | 47 (47.96) | 22 (45.83) | 25 (50) | 0.17 | 0.692 |
| 鲍曼不动杆菌 | 33 (33.67) | 18 (37.50) | 15 (30) | 0.617 | 0.523 |
| 铜绿假单胞菌 | 16 (16.33) | 8 (16.67) | 8 (16) | 0.008 | 1 |
| 其他革兰阴性杆菌 | 7 (7.14) | 5 (10.42) | 2 (4) | 1.52 | 0.264 |
| 培养阴性 | 15 (15.31) | 6 (12.50) | 9 (18) | 0.571 | 0.577 |
| 感染部位(n,%) | |||||
| 肺部感染 | 63 (64.29) | 34 (70.83) | 29 (58) | 1.757 | 0.211 |
| 血流感染 | 40 (40.82) | 22 (45.83) | 18 (36) | 0.98 | 0.411 |
| 腹腔感染 | 9 (9.18) | 5 (10.42) | 4 (8) | 0.171 | 0.738 |
| 术区感染 | 6 (6.12) | 1 (2.08) | 5 (10) | 2.67 | 0.205 |
| WBC:白细胞;PLT:血小板;PCT:降钙素原;CRP: C-反应蛋白;SOFA :序贯器官衰竭评分;APACHE Ⅱ :急性生理与慢性健康评分Ⅱ;PMB:多黏菌素B;ICU:重症监护病房;MODS:多器官功能障碍综合征。 | |||||
脓毒性休克组与非休克组抗感染治疗方案差异无统计学意义, PMB联合碳青霉烯类(27.08% vs 34%,P > 0.05)、PMB联合替加环素和碳青霉烯类(29.17% vs 24%,P > 0.05)常见,见表 2。联合的头孢菌素是头孢哌酮舒巴坦或头孢他啶。15例其他抗感染治疗患者包括PMB联合替加环素、碳青霉烯类和头孢菌素5例,PMB单药治疗3例,PMB联合替加环素基础上联合磷霉素或头孢菌素各2例,PMB联合替加环素和碳青霉烯类基础上再联合磷霉素、PMB联合碳青霉烯类和磷霉素、PMB联合磷霉素和头孢菌素各1例。
| 治疗方案 | 总体(n=98) | 脓毒性休克组(n=48) | 非休克组(n=50) | 统计量 | P值 |
| PMB+碳青霉烯类 | 30 (30.61) | 13 (27.08) | 17 (34) | 0.552 | 0.515 |
| PMB+替加环素+碳青霉烯类 | 26 (26.53) | 14 (29.17) | 12 (24) | 0.335 | 0.649 |
| PMB+替加环 | 10 (10.20) | 7 (14.59) | 3 (6) | 1.969 | 0.195 |
| PMB+头孢菌 | 9 (9.18) | 3 (6.25) | 6 (12) | 0.971 | 0.487 |
| PMB+碳青霉烯+头孢菌(n,%) | 8 (8.16) | 6 (12.50) | 2 (4) | 2.36 | 0.155 |
| 其他治疗方案(n,%) | 15 (15.31) | 5 (10.42) | 10 (20) | 1.735 | 0.263 |
入组患者中16.33%的患者出现了不良反应,脓毒性休克组和非休克组的不良反应发生率差异无统计学意义(22.92% vs 10%,P > 0.05);各种不良反应在两组患者中的差异无统计学意义。7.14%患者出现肾功能损伤,表现为肌酐、尿素氮升高,但无患者需肾替代治疗。6.12%患者出现神经毒性,主要表现为烦躁、乏力、头晕、嗜睡、感觉异常,2例患者表现为呼吸抑制并进行有创性机械通气。其中肾功能损伤、神经毒性和嗜酸性粒细胞升高主要是一过性不良反应。但色素沉着的不良反应为持续存在,其中2例是第3天出现,1例是第7天出现。见表 3。
| 变量 | 总体(n=98) | 脓毒性休克组(n=48) | 非休克组(n=50) | 统计量 | P值 |
| 不良反应(n,%) | 16 (16.33) | 11 (22.92) | 5 (10) | 2. 991 | 0.105 |
| 肾功能损伤 | 7 (7.14) | 6 (12.50) | 1 (2) | 4.07 | 0.057 |
| 神经毒性 | 6 (6.12) | 5 (10.2) | 1 (2) | 3.018 | 0.108 |
| 色素沉着 | 3 (3.06) | 1 (2.08) | 2 (4) | 0.303 | 1 |
| 嗜酸性粒细胞升高 | 7 (7.14) | 3 (6.25) | 4 (8) | 0.095 | 1 |
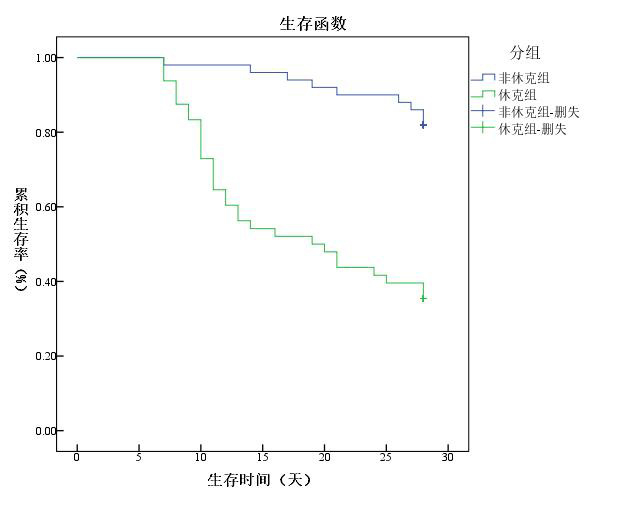
平均PMB治疗时间是11.8 d,脓毒性休克组与非休克组的PMB治疗用药时间差异无统计学意义(12.35 d vs 11.40 d,P > 0.05);脓毒性休克组的住院时间短(34.10 d vs 49.10 d,P < 0.05),入住ICU时间差异无统计学意义(26.40 d vs 27.34 d,P > 0.05)。脓毒性休克组的28 d病死率远高于非休克组(64.58% vs 18%,P < 0.01),ICU病死率(18.75% vs 6%,P > 0.05)和住院病死率(22.92% vs 8%,P > 0.05)差异无统计学意义,见表 4。对28 d病死率进行Kaplan-Meier生存曲线,用PMB治疗至死亡的平均时间,脓毒性休克组为18.73 d,非休克组为26.7 d,差异有统计学意义(P < 0.01)。
|
| 图 1 多黏菌素B治疗碳青霉烯耐药革兰阴性杆菌引起脓毒性休克与非休克患者的生存曲线 Fig 1 Survival curves of polymyxin B in patients with septic shock or sepsis induced by carbapenem-resistant organism |
|
|
| 变量 | 总体(n=98) | 脓毒性休克组(n=48) | 非休克组(n=50) | 统计量 | P值 |
| PMB应用时间(d) | 11.867±5.387 | 12.354±6.570 | 11.40±3.949 | -0.875 | 0.384 |
| ICU住院时间(d) | 26.88±14.504 | 26.40±12.784 | 27.34±16.101 | 0.322 | 0.748 |
| 住院时间(d) | 41.76±26.639 | 34.10±21.713 | 49.10±28.986 | 2.906 | 0.005 |
| 住院病死率(n,%) | 15 (15.31) | 11 (22.92) | 4 (8) | 4.204 | 0.051 |
| ICU病死率(例,%) | 12 (12.24) | 9 (18.75) | 3 (6) | 3.705 | 0.068 |
| 28 d病死率(例,%) | 40 (40.82) | 31 (64.58) | 9 (18) | 21.999 | <0.001 |
本研究结果显示PMB治疗CRO感染的ICU病死率为12%、住院病死率15%、28d病死率40%,低于国内外文献报道的相关研究:美国流行病学研究报道严重脓毒症是主要死亡原因,其中感染性休克的病死率高达50%[2];替加环素治疗CRO引起的肺部感染患者ICU病死率为45.2%[12];PMB联合治疗多重耐药革兰阴性杆菌引起的肺部感染患者的住院病死率为48%[13];国内研究显示,PMB治疗碳青霉烯类耐药的肺炎克雷伯杆菌感染患者病死率为60%[14];巴西人研究PMB治疗多重耐药铜绿假单胞菌引起肺炎患者的住院病死率为74.3%[15]。这可能是由于本研究进行革兰阴性杆菌感染的研究,而不是针对单一菌种或单一部位的感染,也与进行了早期诊断和有效的抗感染治疗有关,即PMB治疗CRO感染有效。
其中脓毒性休克组患者的ICU病死率18.75%、住院病死率22.92%均高于非休克组,但差异无统计学意义;28 d病死率64.58%远高于脓毒症非休克患者。国内研究显示,碳青霉烯类耐药的肺炎克雷伯杆菌感染患者48 h内进行PMB治疗的病死率是43.8%,而延迟用药的病死率高达82.35%[14];意大利人研究产碳青霉烯酶肺炎克雷伯菌的肺炎患者中,感染性休克、经验性抗感染治疗不足是14 d病死率的独立危险因素[16]。Kaplan-Meier生存曲线显示脓毒性休克组患者用PMB治疗至死亡的平均时间为18.73 d,但在非休克组长达26.7 d,从而非休克组的住院时间、ICU住院时间均长于脓毒性休克组,可能与样本量小有关。因此,对CRO的脓毒症患者,可尽早启动PMB治疗,一旦进展为脓毒性休克,病死率高。
CRO的菌种分布以肺炎克雷伯杆菌、鲍曼不动杆菌、铜绿假单胞菌最常见,与其他研究[7, 17]相似。与脓毒症患者相比,脓毒性休克的SOFA评分和APACHE Ⅱ评分高、机械通气更常见,也有相关研究证明这些因素是感染性休克患者预后的独立危险因素[16, 18-20];脓毒性休克的血小板明显降低也是其病死率高的预测因素,血小板持续减少使患者的致残率和病死率升高[21];也有荟萃分析显示低水平高密度脂蛋白与脓毒症的高病死率相关[22],但本研究中未统计相关数据。
既往研究证明PMB联合一种或两种抗菌药物对多重耐药革兰阴性杆菌感染的治疗是有效的[23, 24]。在本观察性研究中以PMB为基础联合碳青霉烯类或/和替加环素最常见,非休克组患者的治疗中以PMB联合碳青霉烯类最常见(34%),脓毒性休克的治疗以PMB联合替加环素和碳青霉烯类最常见(29.17%),但是两组的抗感染治疗比例差异无统计学意义,可能是因为本研究的样本量小。而国内外研究PMB联合阿米卡星、替加环素或碳青霉烯类治疗碳青霉烯类耐药的肺炎雷伯杆菌感染患者[14, 25],30 d病死率高于本研究的28 d病死率,但各联合抗感染治疗方案与病死率无明显相关性。体外研究显示PMB联合磷霉素可快速杀菌,防止多黏菌素或磷霉素耐药菌株的出现[26],但本观察性研究中只有5例是PMB联合碳青霉烯类或/和替加环素的同时联合磷霉素,而无单独联合磷霉素的患者,无法得出PMB联合磷霉素的临床治疗效果。
在本研究中16.33%的患者出现了不良反应,以肾毒性和嗜酸性粒细胞升高常见。其中7例患者伴有两种不良反应。复查血常规时可见7.14%患者出现不同程度的嗜酸性粒细胞升高,停药前均降至正常。本研究中肾毒性发生率为7.14%,低于国外的研究[27-28],肾毒性与剂量和时间无关,可能与年龄有关[27],而本研究中患者平均年龄为56岁;与PMB联合阿米卡星、万古霉素等肾毒性药物有关[28],在本研究中没有联合肾毒性抗菌药物。肾毒性主要表现为肌酐和尿素氮升高,未见蛋白尿、管型尿,没有因肾毒性导致肾替代治疗的患者。神经毒性发生率为6.12%,主要表现为烦躁、乏力、头晕、嗜睡、感觉异常,其中2例患者因出现呼吸抑制进行有创性机械通气;既往研究还报道了部分耳聋、视觉障碍、眩晕、神志不清、幻觉、癫痫、共济失调等神经毒性[10]。3例患者出现色素沉着,而其他研究显示静脉应用PMB后色素沉着发生率为8%~ 15%[29-30],未停止用药,不影响治疗效果,但对患者的生活质量产生一定的影响。
本观察研究有以下不足之处:①虽然采集了多中心的数据,但样本量小;②观察性研究决定了其数据不够完善,缺少病原微生物的清除情况和PMB的血药浓度监测[31];③本研究中采用PMB为基础的联合抗感染治疗方案,但是联合方案不确定,缺乏对照组;④本研究中未统计PMB与非抗菌药物之间的作用。
综上所述,对CRO的脓毒症患者,PMB抗感染治疗安全、有效。CRO感染可增加重症患者的病死率,因此有效的抗菌药物选择至关重要。对CRO的脓毒症患者,可尽早启动PMB治疗,一旦进展为脓毒性休克,病死率高。对于高度怀疑由CRO感染导致的脓毒性休克患者可经验性应用PMB,但应尽快寻找病原学依据,同时避免不必要的经验性治疗,防止多黏菌素耐药菌株的出现。
致谢: 郑州大学第五附属医院呼吸ICU (秦超)、郑州大学第二附属医院呼吸ICU (张长玉)、郑州市人民医院中心ICU (焦宪法)、郑州市第一人民医院医疗集团神经ICU (娄萍)、郑州大学附属郑州中心医院呼吸ICU (高延秋)、河南省胸科医院ICU (宋先荣)、南阳南石医院ICU (王天才)、郑州市金水区总医院ICU (蔡颖)、河南科技大学第一附属医院ICU (张咏梅)、郑州市第七人民医院SICU (郭琳)、南阳市第二人民医院RICU (鞠凤玲)、平顶山市第一人民医院ICU (刘宏)、郑州市颐和医院ICU (冯静)对本研究病例入组做出了贡献;郑州大学第一附属医院急诊医学专业研究生(崔玉青、焦婷婷)对本研究数据收集做出了贡献。在此深表感谢。
利益冲突 所有作者均声明不存在利益冲突。
| [1] | Singer M, Deutschman C S, Seymour C W, et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3)[J]. JAMA, 2016, 315(8): 801. DOI:10.1001/jama.2016.0287 |
| [2] | Mayr FB, Yende S, Angus DC. Epidemiology of severe Sepsis[J]. Virulence, 2014, 5(1): 4-11. DOI:10.4161/viru.27372 |
| [3] | Fleischmann C, Scherag A, Adhikari NKJ, et al. Assessment of global incidence and mortality of hospital-treated Sepsis. Current estimates and limitations[J]. Am J Respir Crit Care Med, 2016, 193(3): 259-272. DOI:10.1164/rccm.201504-0781oc |
| [4] | Pourmand A, Whiteside T, Yamane D, et al. The controversial role of corticosteroids in septic shock[J]. Am J Emerg Med, 2019, 37(7): 1353-1361. DOI:10.1016/j.ajem.2019.04.045 |
| [5] | Vincent JL. International study of the prevalence and outcomes of infection in intensive care units[J]. JAMA, 2009, 302(21): 2323. DOI:10.1001/jama.2009.1754 |
| [6] | Michalopoulos A, Falagas ME. Colistin and polymyxin B in critical care[J]. Crit Care Clin, 2008, 24(2): 377-391. DOI:10.1016/j.ccc.2007.12.003 |
| [7] | 胡必杰, 付强, 王贵强, 等. 中国碳青霉烯耐药革兰阴性杆菌(CRO)感染预防与控制技术指引[J]. 中华医院感染学杂志, 2019, 29(13): 2075-2080. DOI:10.11816/cn.ni.2019-191088 |
| [8] | Liang QQ, Huang M, Xu ZJ. Early use of polymyxin B reduces the mortality of carbapenem-resistant Klebsiella pneumoniae bloodstream infection[J]. Braz J Infect Dis, 2019, 23(1): 60-65. DOI:10.1016/j.bjid.2018.12.004 |
| [9] | Yoon J, Urban C, Terzian C, et al. In vitro double and triple synergistic activities of polymyxin B, imipenem, and rifampin ag ainst multidrug-resistant Acinetobacter baumannii[J]. Antimicrob Agents Chemother, 2004, 48(3): 753-757. DOI:10.1128/aac.48.3.753-757.2004 |
| [10] | Falagas M, Kasiakou S. Toxicity of polymyxins: a systematic review of the evidence from old and recent studies[J]. Crit Care, 2006, 10(1): R27. DOI:10.1186/cc3995 |
| [11] | Kellum JA, Lameir e N, the KDIGO AKI Guideline Work Group F. Diagnosis, evaluation, and management of acute kidney injury: a KDIGO summary (Part 1)[J]. Crit Care, 2013, 17(1): 204. DOI:10.1186/cc11454 |
| [12] | Wu XM, Zhu YF, Chen QY, et al. Tigecycline therapy for nosocomial pneumonia due to carbapenem-resistant gram-negative bacteria in critically ill patie nts who received inappropriate initial antibiotic treatment: a retrospective case study[J]. Biomed Res Int, 2016, 2016: 1-7. DOI:10.1155/2016/8395268 |
| [13] | Sobieszczyk ME. Combination therapy with polymyxin B for the treatment of multidrug-resistant Gram-negative respiratory tract infections[J]. J Antimicrob Chemother, 2004, 54(2): 566-569. DOI:10.1093/jac/dkh369 |
| [14] | Liang QQ, Huang M, Xu ZJ. Early use of polymyxin B reduces the mortality of carbapenem-resistant Klebsiella pneumoniae bloodstream infection[J]. Braz J Infect Dis, 2019, 23(1): 60-65. DOI:10.1016/j.bjid.2018.12.004 |
| [15] | Furtado GHC, D'Azevedo PA, Santos AF, et al. Intravenous polymyxin B for the treatment of nosocomial pneumonia caused by multidrug-resistant Pseudomonas aeruginosa[J]. Int J Antimicrob Agents, 2007, 30(4): 315-319. DOI:10.1016/j.ijantimicag.2007.05.017 |
| [16] | Tumbarello M, Trecarichi EM, De Rosa FG, et al. Infections caused by KPC-producing Klebsiella pneumoniae: differences in therapy and mortality in a multicentre study[J]. J Antimicrob Chemother, 2015, 70(7): 2133-2143. DOI:10.1093/jac/dkv086 |
| [17] | Lertwattanachai T, Montakantikul P, Tangsujaritvijit V, et al. Clinical outcomes of empirical high-dose meropenem in critically ill patients with Sepsis and septic shock: a randomized controlled trial[J]. J Intensive Care, 2020, 8: 26. DOI:10.1186/s40560-020-00442-7 |
| [18] | 杨斌, 王锦权, 陶晓根, 等. 影响感染性休克患者预后高危因素的临床研究[J]. 中华危重病急救医学, 2019, 31(9): 1078-1082. |
| [19] | Uvizl R, Adamus M, Cerny V, et al. Patient survival, predictive factors and disease course of severe sepsis in Czech intensive care units: A multicentre, retrospective, observational study[J]. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub, 2016, 160(2): 287-297. DOI:10.5507/bp.2015.052 |
| [20] | Ho KM, Dobb GJ, Knuiman M, et al. A comparison of admission and worst 24-hour Acute Physiology and Chronic Health Evaluation Ⅱ scores in predicting hospital mortality: a retrospective cohort study[J]. Crit Care, 2006, 10(1): R4. DOI:10.1186/cc3913 |
| [21] | 高红梅, 王兵, 李寅, 等. 重组人血小板生成素治疗脓毒症血小板减少症[J]. 中华急诊医学杂志, 2011, 20(3): 239-243. DOI:10.3760/cma.j.issn.1671-0282.2011.03.005 |
| [22] | Liu S, Liang H, Li H, et al. Effect of low high-density lipoprotein levels on mortality of septic patients: A systematic review and meta-analysis of cohort studies[J]. World J Emerg Med, 2020, 11(2): 109-116. DOI:10.5847/wjem.j.1920-8642.2020.02.008 |
| [23] | Yoon J, Urban C, Terzian C, et al. In vitro double and triple synergistic activities of Polymyxin B, imipenem, and rifampin against multidrug-resistant Acinetobacter baumannii[J]. Antimicrob Agents Chemother, 2004, 48(3): 753-757. DOI:10.1128/aac.48.3.753-757.2004 |
| [24] | 中国研究型医院学会危重医学专业委员会, 中国研究型医院学会感染性疾病循证与转化专业委员会. 多黏菌素临床应用中国专家共识[J]. 中华急诊医学杂志, 2019, 28(10): 1218-1222. |
| [25] | Medeiros GS, Rigatto MH, Falci DR, et al. Combination therapy with polymyxin B for carbapenemase-producing Klebsiella pneumoniae bloodstream infection[J]. Int J Antimicrob Agents, 2019, 53(2): 152-157. DOI:10.1016/j.ijantimicag.2018.10.010 |
| [26] | Bulman ZP, Zhao M, Satlin MJ, et al. Polymyxin B and fosfomycin thwart KPC-producing Klebsiella pneumoniae in the hollow-fibre infection model[J]. Int J Antimicrob Agents, 2018, 52(1): 114-118. DOI:10.1016/j.ijantimicag.2018.02.010 |
| [27] | Ouderkirk JP, Nord JA, Turett GS, et al. Polymyxin B nephrotoxicity and efficacy against nosocomial infections caused by multiresistant gram-negative bacteria[J]. Antimicrob Agents Chemother, 2003, 47(8): 2659-2662. DOI:10.1128/aac.47.8.2659-2662.2003 |
| [28] | Mattos KPH, Gouvêa IR, Quintanilha JCF, et al. Polymyxin B clinical outcomes: A prospective study of patients undergoing intravenous treatment[J]. J Clin Pharm Ther, 2019, 44(3): 415-419. DOI:10.1111/jcpt.12801 |
| [29] | Mattos K P H, Cintra ML, Gouvêa IR, et al. Skin hyperpigmentation following intravenous polymyxin B treatment associated with melanocyte activation and inflammatory process[J]. J Clin Pharm Ther, 2017, 42(5): 573-578. DOI:10.1111/jcpt.12543 |
| [30] | Mattos KP, Lloret GR, Cintra ML, et al. Acquired skin hyperpigmentation following intravenous polymyxin B treatment: a cohort study[J]. Pigment Cell Melanoma Res, 2016, 29(3): 388-390. DOI:10.1111/pcmr.12468 |
| [31] | 杨启文, 马筱玲, 胡付品, 等. 多粘菌素药物敏感性检测及临床解读专家共识[J]. 协和医学杂志, 2020, 11(5): 559-570. |
 2020, Vol. 29
2020, Vol. 29




