体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)可为机体提供肺脏和/或心脏支持,为重症患者原发病治疗争取时间。但在ECMO穿刺实施和运行过程中,可能出现出血、血栓、左室扩张、感染等多种问题及并发症,给治疗带来困难,严重者直接致残甚至致死[1-8]。
随着急救理念与技术逐渐成熟,有效抢救措施位点前移,如心肺复苏联合体外膜氧合(extracorporeal membrane oxygenation during cardiopulmonary resuscitation,ECPR)等救治措施应用时情况紧急,可能在ECMO实施时未获得充分的辅助检查证据。因此,亟需可床旁和即时使用的检查和监测工具。即时超声机器可在有限条件下提供更多证据。在ECMO准备、实施及运行过程中均能发挥重要的作用,可以提高操作安全性,帮助实现目标性治疗和管理[9-12]。为解答以下几个问题:①床旁超声在急诊ECMO患者选择和穿刺过程中能做什么?②床旁超声在VV-ECMO和VA-ECMO运行时监测的内容分别是什么?③床旁超声能否协助ECMO撤离时机选择?④床旁超声对ECMO撤离后需要监测的并发症有哪些?专家组拟制定本推荐意见,梳理床旁超声在ECMO实施中的使用时机和扫查内容,主要供临床参考。
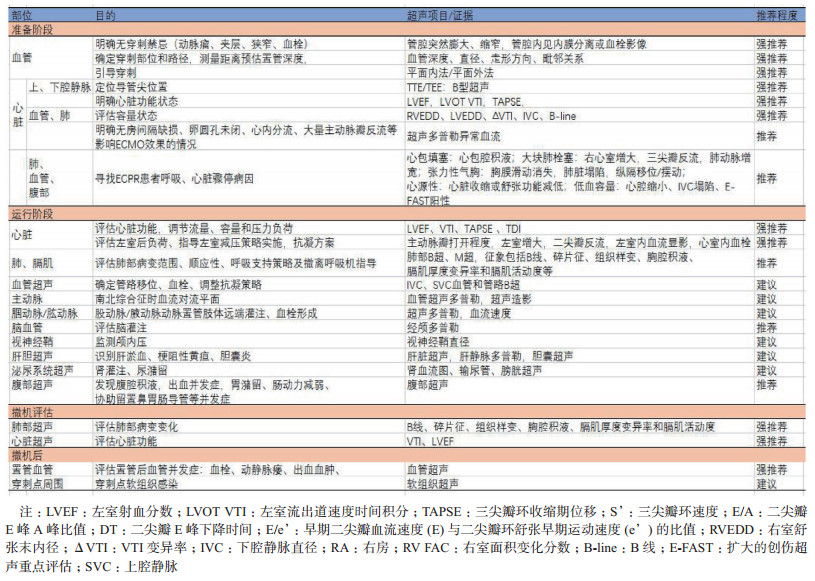
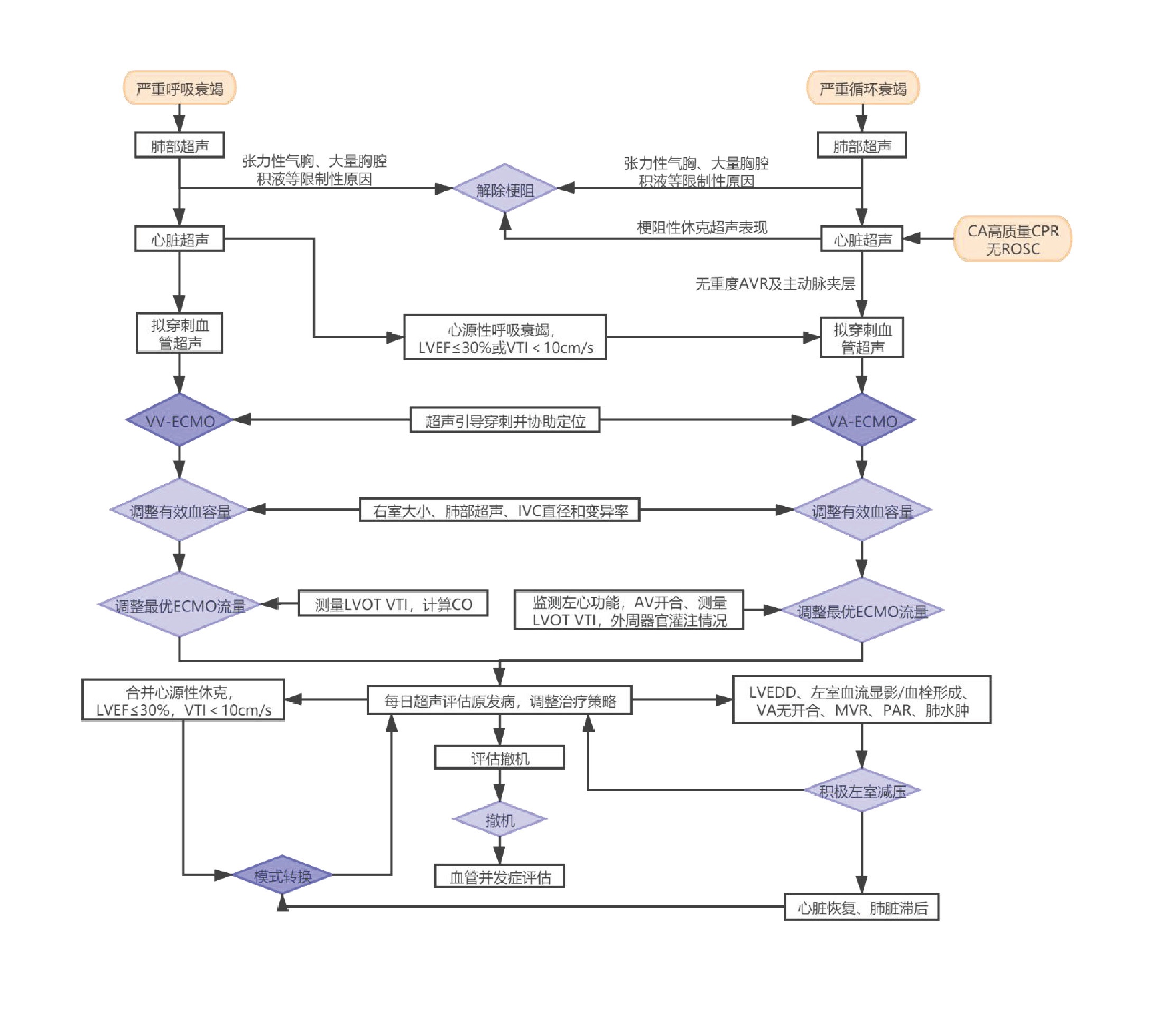
本应用推荐分别从实施前、实施中、撤机时机评估和撤机后监测四个阶段介绍床旁超声的探查项目和意义(图 1、表 1)。
|
| CA:心脏骤停,CPR:心肺复苏,ROSC:恢复自主循环,LVEF:左室射血分数,VTI:左室流出道速度时间积分,VV-ECMO:静脉静脉-体外膜肺氧合,VA-ECMO:静脉动脉-体外膜肺氧合 图 1 ECMO实施超声扫查流程 |
|
|
在ECMO准备阶段,超声扫查的主要内容为心脏、肺脏和血管。如时间充裕可对患者其他脏器进行基础状态床旁超声评估。目的为在即时超声帮助下,对明确呼吸、循环衰竭病因、识别有ECMO救治意义的患者、选择匹配的ECMO模式和制定实施策略等临床决策做出更精准的判断和选择。
1.1 心脏超声① 扫查切面:
常用的胸骨旁、心尖和剑突下经胸扫查点都可选用,建议多切面相互补充。但在ECPR时建议选用不影响按压的剑突下切面。根据临床实际情况,亦可能需要经食道超声协助获得更全面和清晰的信息。
② 观察重点:
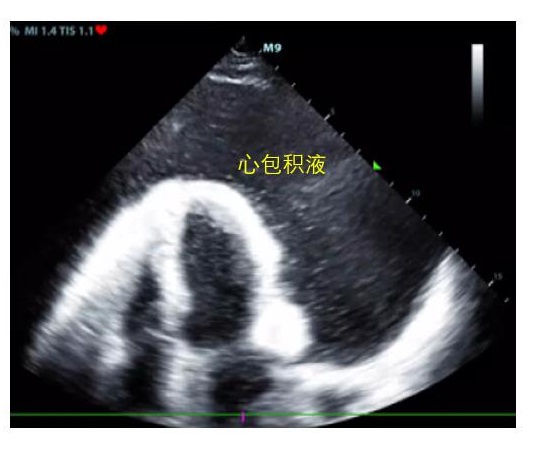
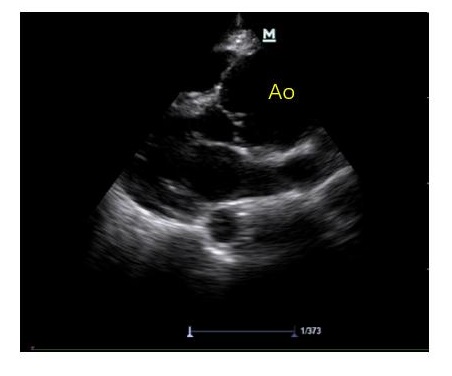
A、心包腔观察有无心包积液,及其引起右心舒张受限、心包填塞导致循环衰竭的超声证据(图 2)。此外,对于心包积液者,需谨慎观察有无主动脉增宽、漂浮的内膜片等夹层证据及心室壁不连续、异常血流通道等心脏破裂超声证据,区别主动脉夹层破裂、心脏破裂等原因引起的心包积血(图 3)。
|
| 心包腔内可见无回声液性暗区 图 2 心包积液超声表现 |
|
|
|
| 可见主动脉(AO)增宽,明显大于左心房 图 3 主动脉夹层超声表现 |
|
|
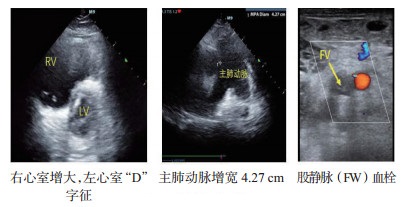
B、心腔大小主要观察左右心比例,右心室内径与左心室内径比值。心腔均明显变小,甚至出现“kiss sign”等超声表现,需评估患者容量状态,在实施ECMO前做好容量准备,以免上机运行后出现干抽、抖管等情况。若右室舒张末内径大于左室舒张末内径者,结合临床并寻找其他直接或间接导致右心压力增加的证据和原因(图 4)。当某一腔室异常增大时,需留意此腔室相关瓣膜功能,并对瓣膜功能进行简单超声评估。
|
| 图 4 肺栓塞超声表现 |
|
|
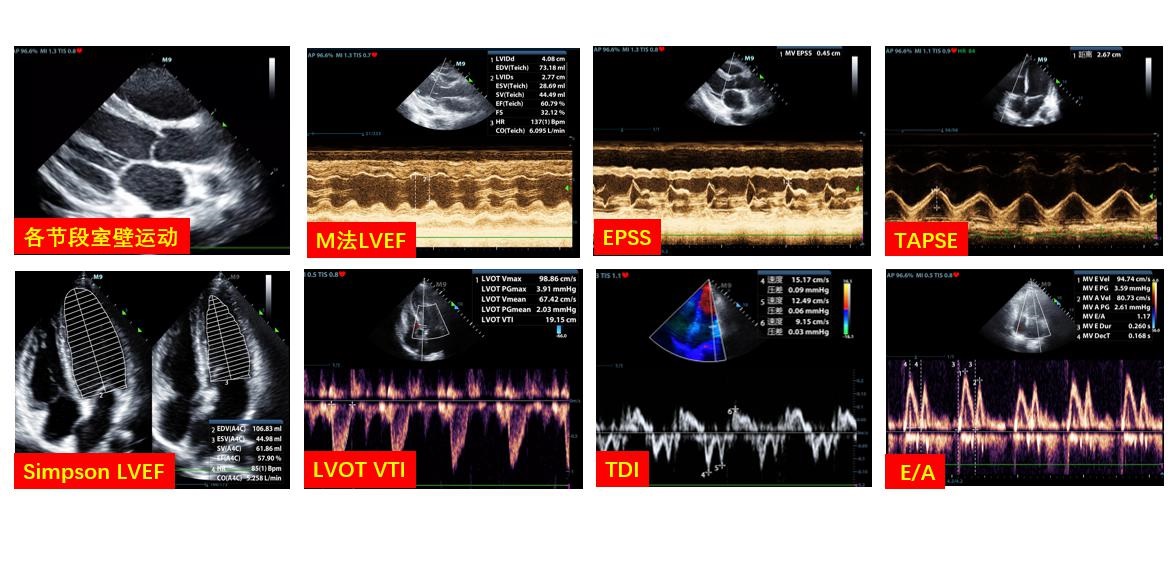
C、心室功能通过观察左右心室收缩协调性、其中无节段室壁运动异常者可通过胸骨旁左室长轴切面测量左室射血分数(left ventricular ejective fraction LVEF),存在室壁运动异常者可通过Simpson法测量LVEF,亦可通过左室流出道测量速度时间积分(Left ventricular outflow tract velocity time integral LVOT VTI)计算每博量及心排出量,测量速度时间积分变异率协助评估患者容量状态;三尖瓣环收缩位移(tricuspid annular plane systolic excusion TAPSE)、右心室面积法可用于评估右心室收缩功能(图 5)。
|
| LVEF:左室射血分数;EPSS:舒张期二尖瓣前叶最大开放点(E点)与室间隔左室面的最小距离;TAPSE:三尖瓣环平面收缩期位移值;LVOT:左室流出道;VTI:速度时间积分;TDI:组织多普勒;E/A:E峰速度与A峰速度比值 图 5 超声评估心脏收缩功能的各类指标 |
|
|
当心电图提示心肌缺血时,比对心肌收缩异常的节段是否与心电图对应导联异常表现相一致,由冠状动脉缺血引起者通常收缩异常的节段与犯罪血管支配灌注区域一致,但在心肌炎、应激性心肌病、脓毒症心肌病、等心肌病变者其节段室壁运动异常通常并不局限于某根冠脉支配的供血区域。
对心功能评估和心排量的测量是VA-ECMO(venoarterial-extracorporeal membrane oxygenation)实施适应证评估指标之一。对呼吸衰竭患者,拟实施ECMO前,患者心功能评估是准确选择模式的前提,避免对心源性呼吸衰竭患者误用VV-ECMO(venovenous- extracorporeal membrane oxygenation)模式,对重症肺部感染引起应激性心肌病、心肌顿抑的患者预测VV-ECMO支持力度及转成VA模式的可能性预估;并且实施准备阶段对心功能及心排量测定可协助个性化制定匹配的ECMO流量,达到理想的氧合效果。
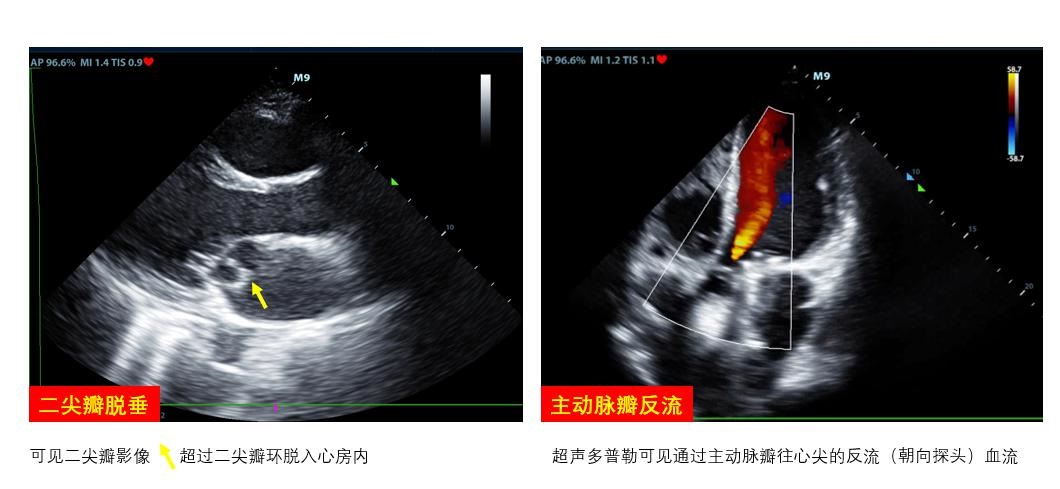
D、瓣膜通过观察瓣膜开合节律和频率评估瓣膜功能及心律失常,二尖瓣开放程度(EPSS)协助评估左心室收缩功能。瓣膜区彩色多普勒超声可评估瓣膜反流、狭窄情况。重度主动脉瓣反流如不能短期内进行外科干预者影响VA-ECMO实施效果(图 6右)。室壁无增厚的右室扩张合并急性三尖瓣、肺动脉瓣反流提示可能存在肺动脉栓塞。呼吸衰竭肺水肿者检查有无二尖瓣脱垂(图 6左)、重度二尖瓣反流。不管是原发还是继发严重瓣膜问题,均可能会在ECMO实施时影响支持效率,因此,建议在ECMO准备阶段筛查瓣膜功能。
|
| 图 6 可能影响ECMO效果的瓣膜病变 |
|
|
E、肺动脉发现右心增大、三尖瓣反流等疑似右心室后负荷增加的证据者,需额外观察肺动脉主干直径、有无血栓,观察肺动脉血流及测量肺动脉瓣反流血流速度等指标,寻找肺栓塞等梗阻性休克证据(图 4)。
F、异物观察心腔内、瓣膜上有无异物(图 7),可协助明确病因并指导进一步治疗。
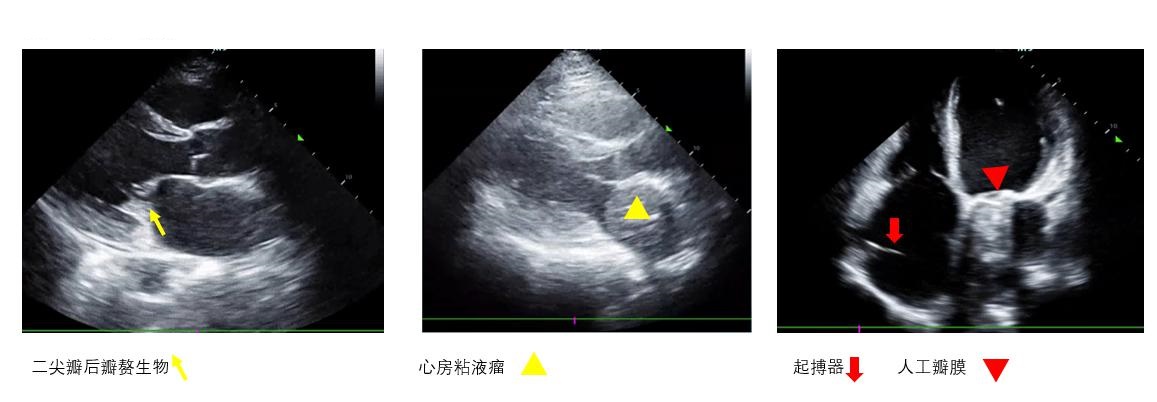
|
| 图 7 心内异物 |
|
|
出现呼吸衰竭的肺部疾病几乎都累及胸膜[13],严重循环衰竭者其肺部也常出现相应异常超声表现,故对拟实施ECMO支持的患者,进行肺部超声扫查与评估。基于肺部超声对于非累及胸膜肺部疾病诊断的局限性,建议情况允许时再行胸部CT或其他检查得到更完整肺部病变信息。
① 扫查部位和切面:结合患者病史、查体,病变特点和检查目的,制定个性化扫查点和扫查策略:如怀疑气胸时,应对非重力依赖部位进行扫查;当考虑胸腔积液、肺水肿时,应着重对重力依赖部位进行探查;当考虑为局限性肺部疾病时,可根据患者查体及其他辅助检查结果进行个性化选择(图 8)。
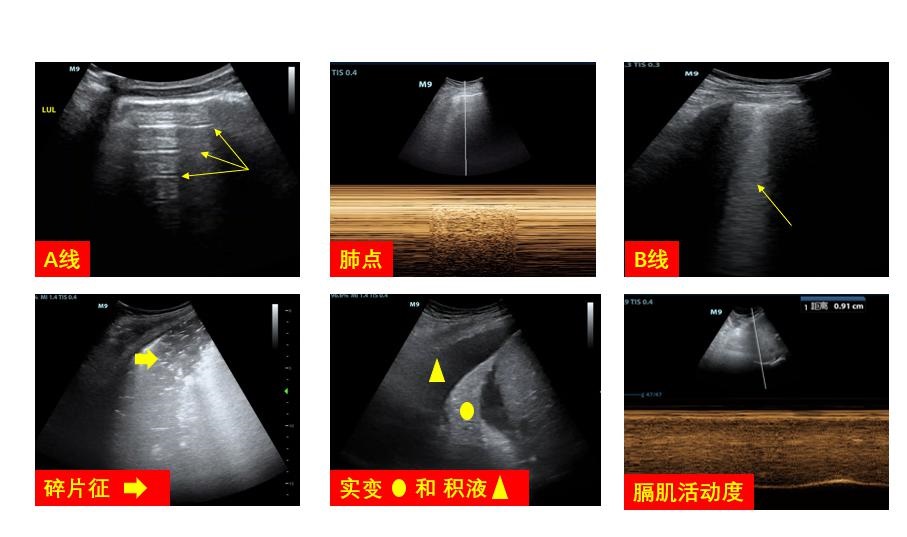
|
| 图 8 肺部超声表现 |
|
|
② 观察重点:
A、胸膜腔对脏层胸膜和壁层胸膜相对运动和其中异常超声征象进行识别,寻找张力性气胸、大量胸腔积血/积液等可能导致呼吸循环衰竭的疾病超声证据。
B、肺脏对肺部进行全面探查,寻找B线、碎片征、组织样征、支气管充气征等异常肺部超声征象出现的位置和范围,协助ECMO实施前肺部评估。对呼吸衰竭患者进行动态连续肺部超声探查可有助于判断肺部病变趋势,协助把握VV-ECMO实施时机。心功能不全者肺部超声扫查可了解肺水肿程度和肺部合并症。因肺部超声的表现与肺内气水比例相关,不能直接断定肺内病变性质,需结合病史判断肺部超声征象的最大可能原因。
C、膈肌膈肌活动度和厚度变异率可协助了解患者自主呼吸强度,协助指导呼吸支持策略选择[13-14]。
1.3 置管血管、穿刺路径和穿刺策略选择① VV-ECMO在行VV-ECMO时,通常选择的外周置管通路为股静脉和颈内静脉,超声探查的内容应包含以下:
A、穿刺可行性评估超声扫查拟穿刺的静脉有无血栓等不宜穿刺的情况。当拟穿刺血管为颈内静脉时,除了评估穿刺侧血管,还建议扫查对侧颈内静脉,避免出现对侧血管血栓而本侧血管穿刺置管后影响颅内回流引起脑水肿等情况。
B、穿刺策略制定拟穿刺静脉和相伴行动脉之间的位置关系、属支汇入情况、目标血管走行方向、寻找最佳穿刺点、制定穿刺方向及放置深度等穿刺策略(图 9)。股静脉穿刺点选择建议尽可能避免与腹股沟距离过近,以防穿刺置管时穿透腹膜或损伤腹腔内组织。尽可能避开大隐静脉汇入点、避免损伤静脉瓣、避免ECMO置管对局部血管的损伤,影响ECMO存活患者的长期生活质量。
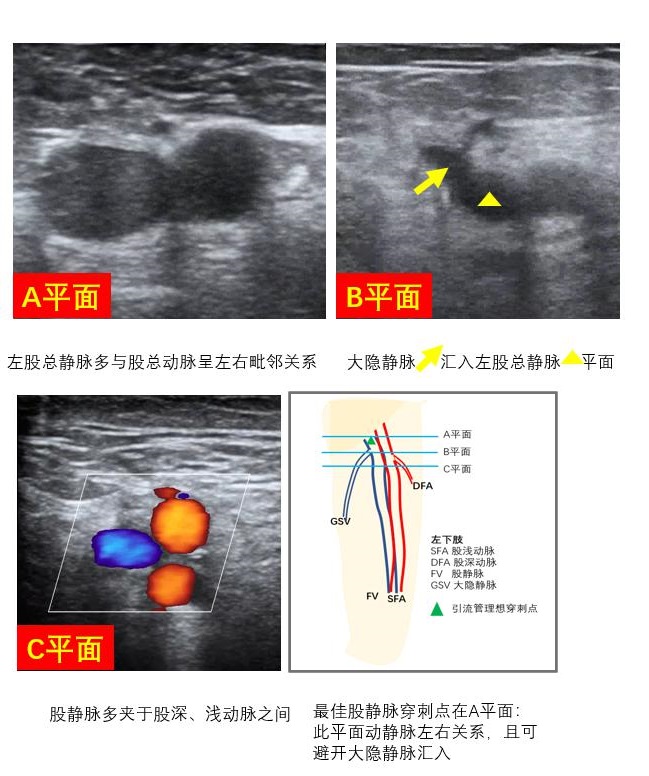
|
| 图 9 静脉置管策略 |
|
|
② VA-ECMO急诊VA-ECMO血管通路的选择通常是股静脉-股动脉途径,其中,静脉超声探查同VV-ECMO。对股动脉和股浅动脉超声探查包含以下内容:
A、不宜穿刺情况拟穿刺动脉穿刺部位及血液回流段血管有严重斑块、钙化、夹层、动脉瘤、动静脉瘘,穿刺点近心端管腔狭窄等(图 10)。若双侧股动脉穿刺均不可行时,可选择右颈总、锁骨下、腋等其他动脉置管通路或中心置管途径进行ECMO支持。
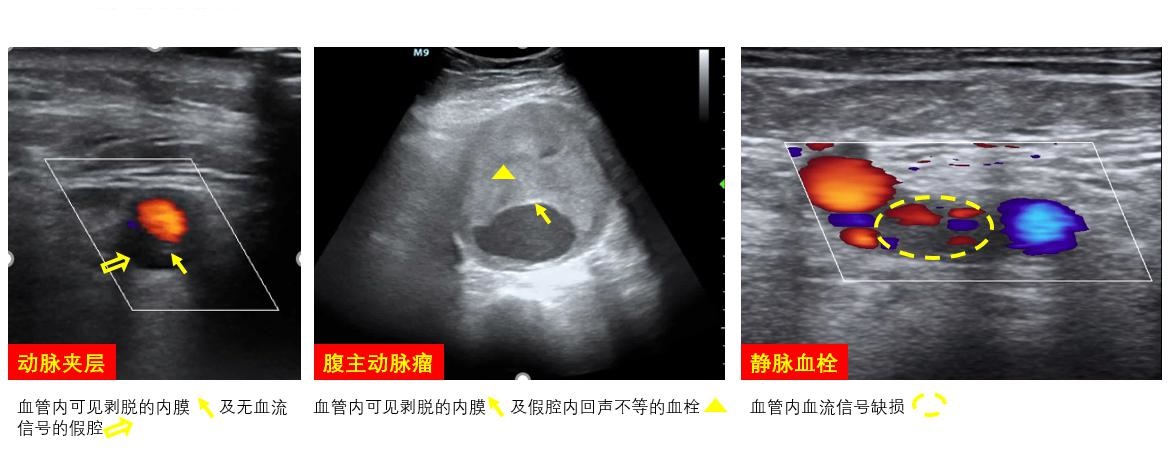
|
| 图 10 不适宜置管的血管病变 |
|
|
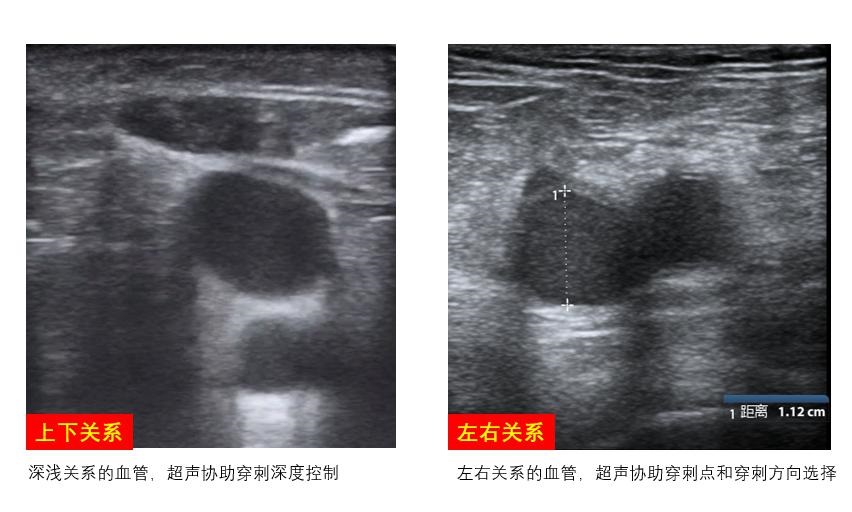
B、最佳穿刺点定位观察拟穿刺动脉与伴行静脉之间的位置关系,寻找最佳穿刺点,若超声发现同侧股动静脉之间的距离较近或呈上下叠加关系,则需考虑引流管和回输管分别左、右双腿放置,避免穿刺置管造成局部血管损伤及其他并发症的发生(图 11)。
|
| 图 11 股动静脉位置关系 |
|
|
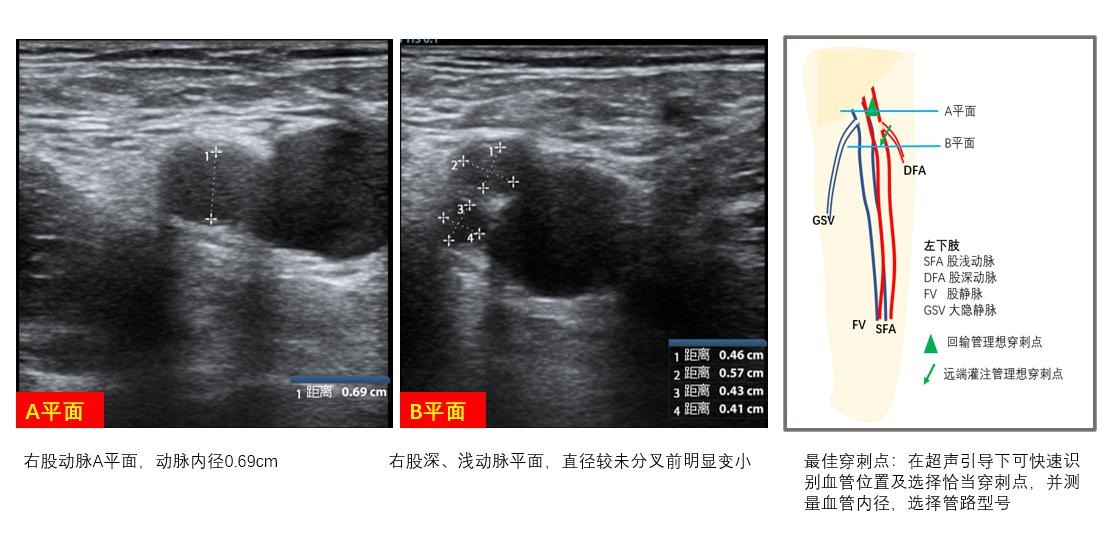
C、动脉直径测量拟置管动脉血管的内径,选择合适的动脉管路型号,并可根据血管内径与拟置入管路外径之间的大小关系预估肢体远端肢体缺血可能,评估远端灌注管放置必要性,并可根据血管具体情况预估置管困难程度制定置管策略,如经皮穿刺、半切开、切开等,做好置管预案(图 12)。
|
| 图 12 动脉置管策略 |
|
|
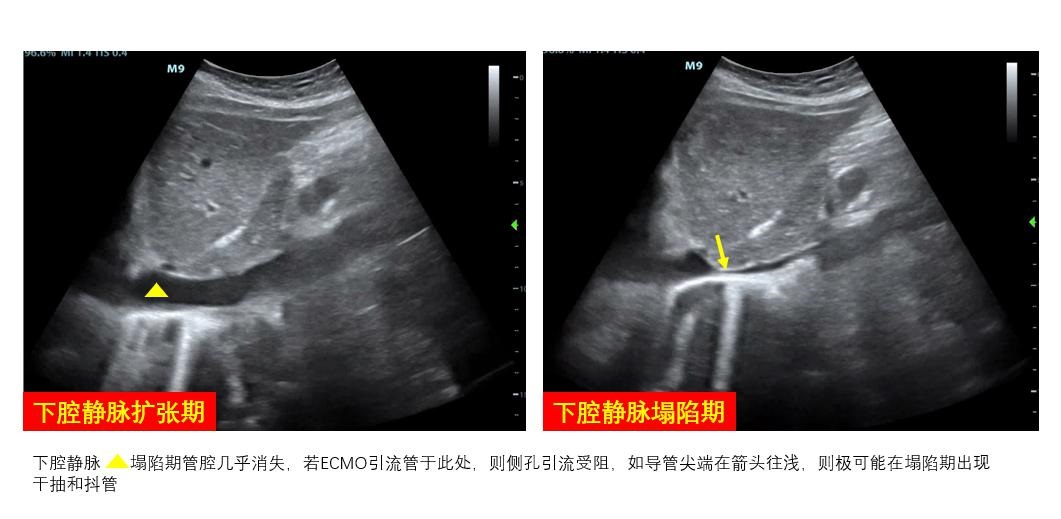
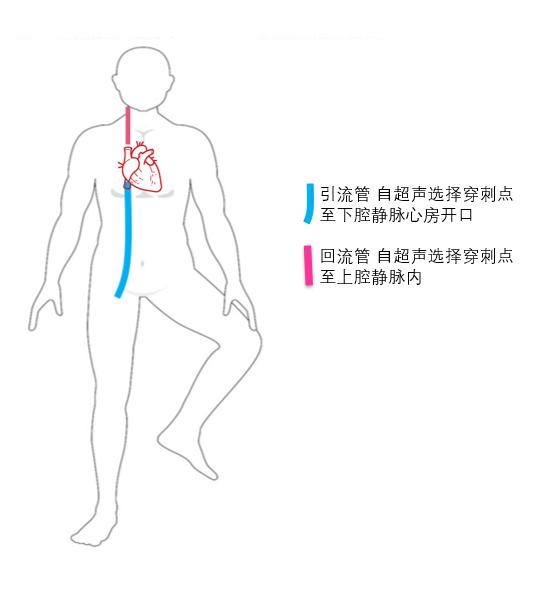
③ 下腔静脉虽然不是直接穿刺部位,但仍建议在ECMO实施前对下腔静脉进行超声扫查。ECMO静脉引流管末端通常置于下腔静脉汇入右心房处,穿刺前对下腔静脉直径和变异率进行测算,有助于对患者容量状态进行评估和准备(图 13),此外,下腔静脉直径易受体位(如俯卧位)、腹腔内压、自主呼吸等影响,导致引流不畅,影响ECMO实施效果。可测量超声制定的拟穿刺点与右心房入口的距离预估静脉管路置管深度(图 14),避免穿刺时管路置入过深,避免心脏刺激和损伤风险及减少VV-ECMO再循环率;也避免置入深度不够,影响引流(图 15),超声可实时直视下调整引流管位置(图 16)。
|
| 图 13 容量状态准备 |
|
|
|
| 图 14 股静脉-颈静脉VV-ECMO管路置入示意图 |
|
|
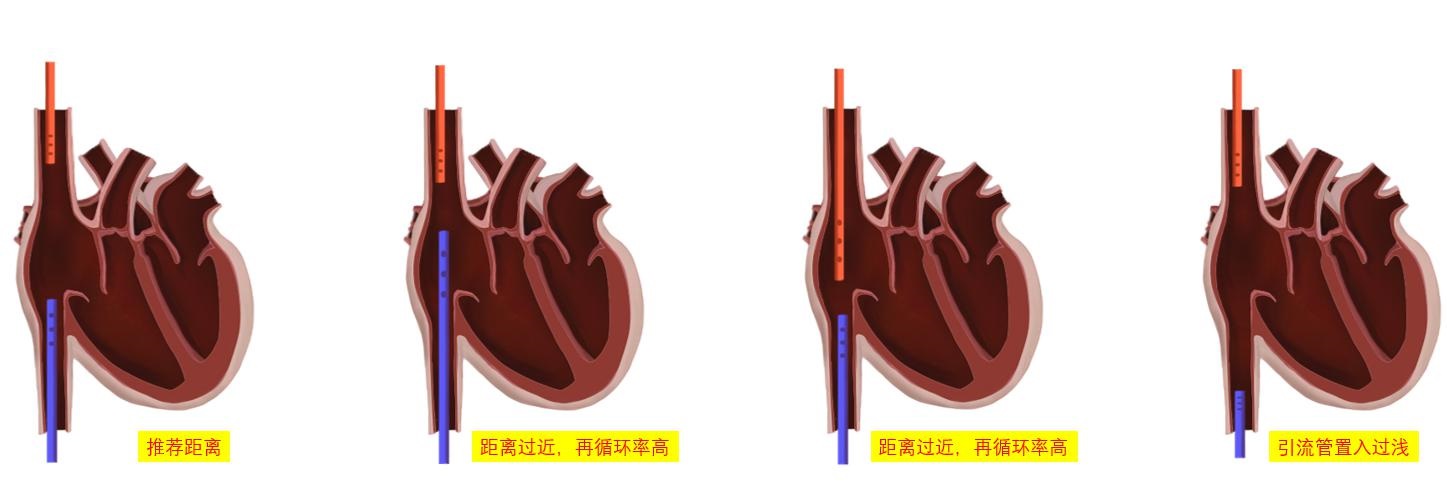
|
| 图 15 VV-ECMO引流管(蓝色)和回输管(红色)的距离 |
|
|
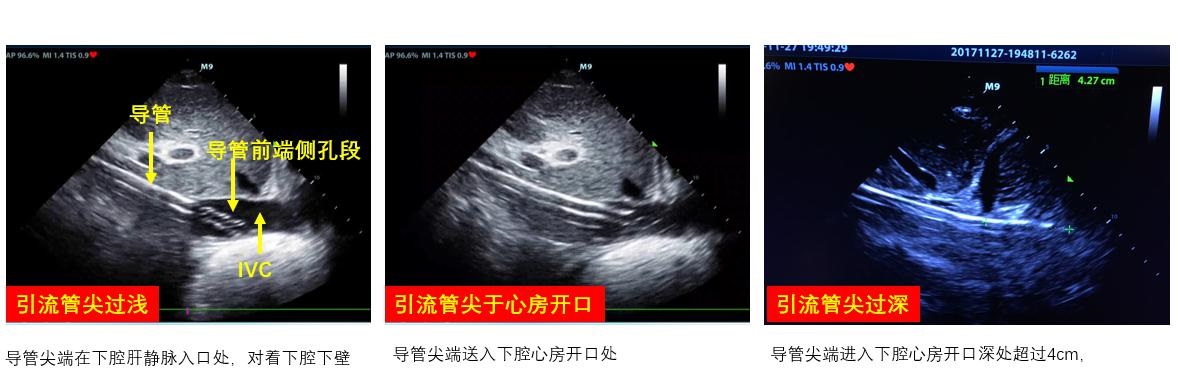
|
| 图 16 超声指导管路位置调整 |
|
|
④ 引导穿刺:ECMO置管应在超声引导下进行,尽最大可能减少试穿和穿刺损伤,减少出血风险。常用的引导方法有平面内法(图 17)和平面外法(图 18)。

|
| 图 17 超声引导穿刺—平面内法 |
|
|
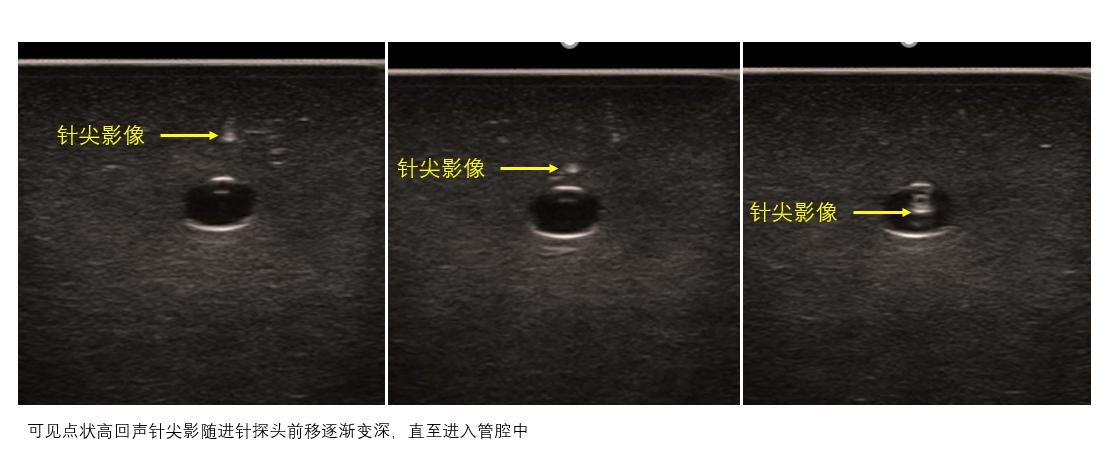
|
| 图 18 超声引导穿刺—平面外法 |
|
|
ECMO实施前阶段超声决策:超声并不是ECMO实施与否的决定指标,但超声证据可以为患者选择、时机、模式、穿刺策略等提供有力可靠的指引,规避风险,提高效率。
实施前阶段推荐意见:
① 拟行ECMO患者,建议超声评估ECMO治疗的适应证与禁忌证;②推荐床旁超声评估影响ECMO流量状态因素,协助制定ECMO治疗策略;③ECMO实施前推荐床旁超声对穿刺血管进行探查,选择最佳置管路径和方式;④经皮穿刺ECMO置管时,建议超声引导下进行;⑤推荐超声确定导管尖端/引流孔的位置,以便获得最佳引流/回流状态;⑥建议床旁超声对ECPR患者进行病因探查。
2 日常监测由于ECMO患者的转运风险和困难程度高于其他重症患者,频繁外出检查不便,且患者氧合及血流动力学受到ECMO血流的影响,诸如CVP、ScvO2、PiCCO等许多监测手段使用受限,在ECMO运行期间,床旁超声起着非常重要且不可替代的作用[15-21]。此外,基于床旁超声的即时性和可重复性,在ECMO运行过程中,患者病情变化、ECMO相关及非相关的并发症,床旁超声可在第一时间获取证据,可用于快速识别和协助处置。因此,推荐使用床旁超声对ECMO患者实施日常监测。
2.1 管路位置ECMO实施过程中,推荐每日常规使用床旁超声对管路位置进行监测(图 16)。若出现病情变化,不能完全确认管路固定良好者需对管路引流部位进行再核实。如在上、下腔置入ECMO管路的VV-ECMO患者中,氧合效果不理想,不能除外再循环比例增加,需对引流和回输管路末端距离进行确认;如使用双腔管时,引流孔和回输孔的位置至关重要,回输孔建议对准三尖瓣入口,则可能还需经食道超声来协助管路位置确定和调整。
2.2 血管对ECMO患者置管血管进行每日常规床旁超声扫查,有助于早期发现操作后血肿、血栓等并发症,以便调整抗凝策略。主动脉血流多普勒形态可协助确定心脏和ECMO血流对流平面。对置管动脉远端肢体的灌注血流进行超声探查,协助明确远端灌注管留置时机和必要性。对已留置侧枝灌注管的远端动脉如股浅动脉、腘动脉、足背动脉等进行血流速连续探测,可协助评估灌注流量大小及变化,及早发现灌注管血栓(图 19)。目前尚无ECMO动脉置管后远端缺血超声预测指标,但仍推荐超声对血管进行每日监测、前后对比,以便早期发现缺血的证据。
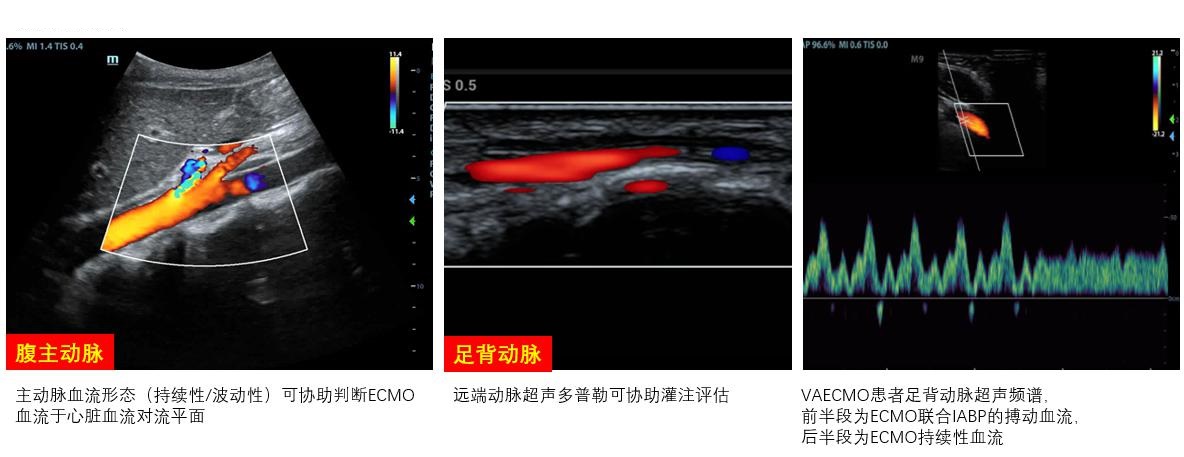
|
| 图 19 血管超声 |
|
|
不论是在VV-ECMO或VA-ECMO运行过程中,利用床旁超声对心脏功能评估及每日监测非常重要。
① 扫查切面:根据患者实际情况选择需要的切面,并需将多切面结合补充,综合评估。可根据需要选择经食道超声心动图检查。
② VV-ECMO 床旁超声通过LVOT VTI和LVOT直径可快速测算出心排血量,从而制定匹配的ECMO流量;并结合血管超声和肺部超声共同对患者有效血容量进行调整,保证氧供;联合机械通气者监测右心舒张末内径,右心收缩功能、三尖瓣反流等肺动脉高压的超声证据,及时发现继发性肺动脉高压。VV-ECMO运行过程中,心脏超声探查发现合并心功能减退时,可更换至VA/VAV支持模式。
③ VA-ECMO 对患者心脏收缩、舒张功能进行评估和监测是确定理想ECMO流量和支持力度的前提。根据患者心脏功能来协助容量管理和流量调节贯穿于整个治疗过程中。
A、左心:观察左心室壁运动情况,测量左心室收缩和舒张功能,评估二尖瓣及主动脉瓣瓣膜功能。对心功能连续、及时评估可协助制定流量支持力度和决定撤机时机。通过连续性监测左室舒张末内径变化、主动脉瓣开合情况,评估左心室后负荷,制定左室减压时机与策略(图 20)。当患者出现心腔内血流显影时,形成血栓风险增加,对心腔进行密切监测,调整抗凝治疗策略,预防心室内血栓形成。
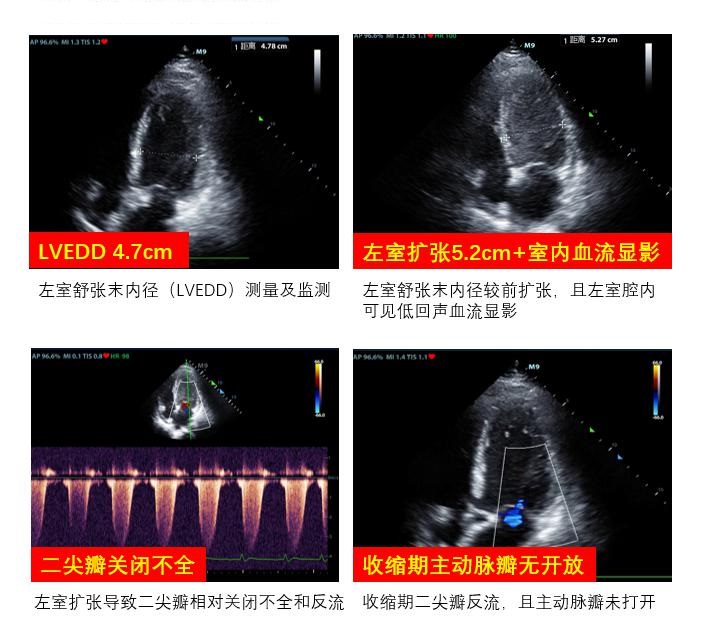
|
| 图 20 左心后负荷超声检测项目 |
|
|
B、右心:右室大小、右心与左心比例可用于评估容量状态和右心后负荷即肺动脉压力情况,还可通过测量三尖瓣环收缩期运动幅度(TAPSE)半定量评估右心收缩功能,面积法计算右心射血分数、三尖瓣环组织多普勒测量其运动速度均可对右心收缩功能进行评估。
2.4 肺在VV-ECMO中,肺脏超声的每日扫查可有助于观察肺部病变趋势。包括对胸膜腔、胸膜下肺部病变、膈肌活动度的扫查,可协助发现是否出现气胸、胸腔积液、积血等合并症,并协助呼吸机参数、俯卧位和肺复张等治疗策略调整。在VA-ECMO中,肺部超声探查可协助呼吸及血流动力学管理,如果B线增加,需警惕左室扩张后肺水肿。
2.5 中枢神经系统大脑中动脉血流多普勒可协助评估脑血流灌注,协助调整VA-ECMO流量。视神经鞘宽度的超声探查可协助评估和管理患者脑水肿情况(图 21)。
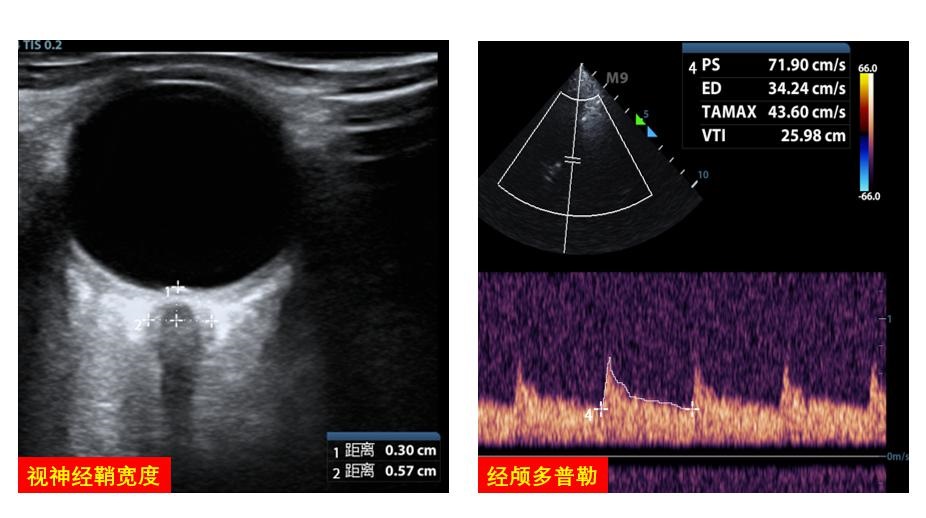
|
| 图 21 中枢神经系统 |
|
|
肾脏血流图可协助评估肾灌注情况,调节VA-ECMO流量,并明确发生AKI的原因。在实施过程中,对输尿管、膀胱的探查可快速明确少尿/无尿的肾后性梗阻因素(图 22)。
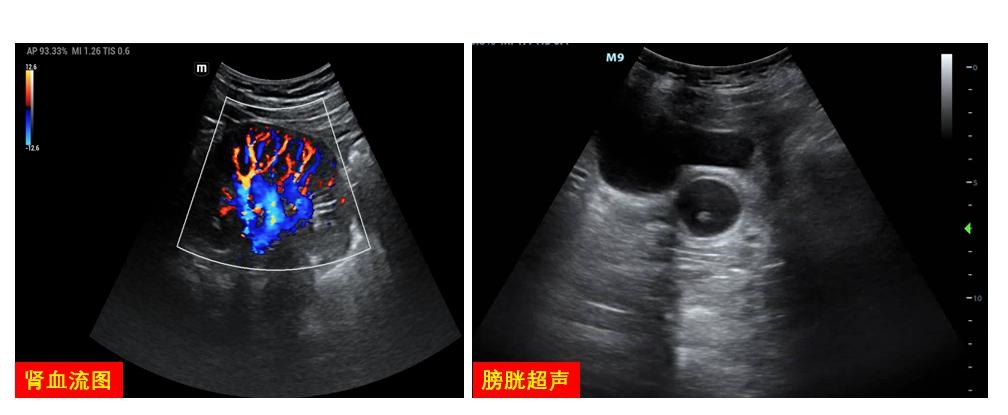
|
| 图 22 泌尿系统图 |
|
|
良好的胃肠功能是保证重症患者治疗顺利的重要前提。床旁超声可以协助留置营养管(鼻胃管/鼻空肠管),判断留置管位置,并对胃肠动力进行评估,协助喂养速度和策略制定(图 23)。
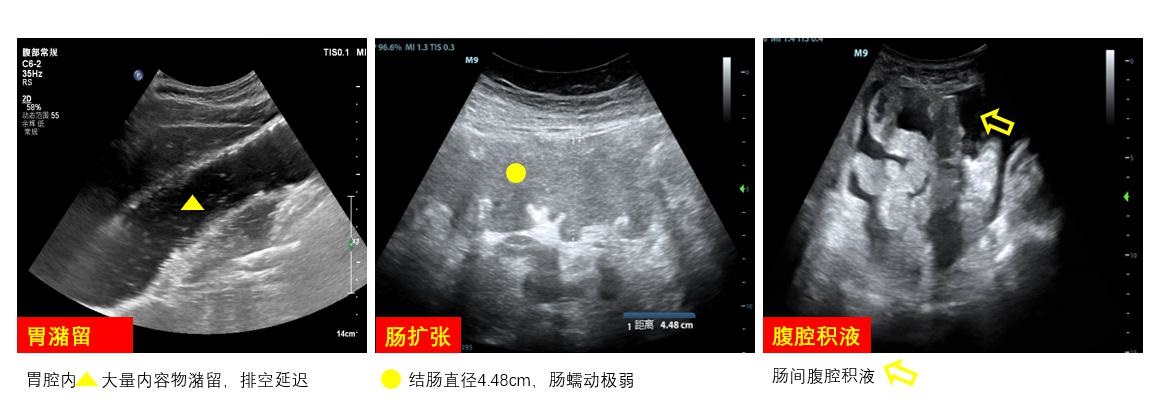
|
| 图 23 胃肠道和腹腔超声 |
|
|
在实施ECMO过程中对包括膈肌和骨骼肌在内的肌肉活动度和肌肉密度、厚度进行超声监测可以协助营养治疗和康复训练等[22](图 24)。
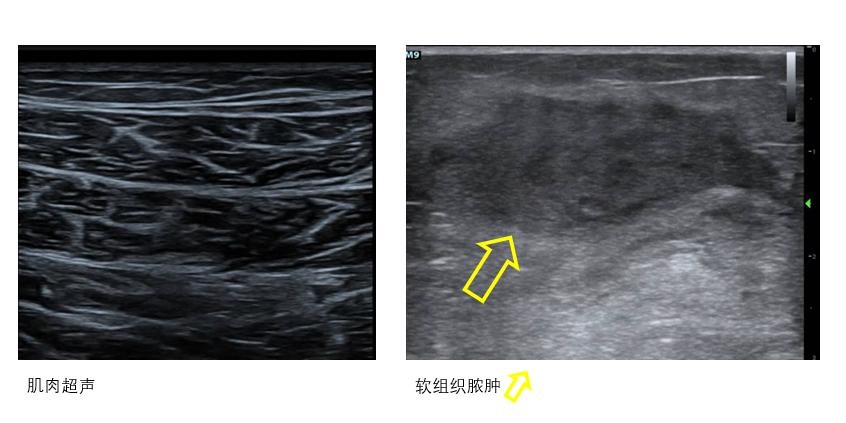
|
| 图 24 肌肉和软组织超声 |
|
|
出血是ECMO患者常见的并发症,床旁超声可通过直接或间接超声证据协助判断出血部位、血肿范围、对周围组织器官压迫情况等(图 25)。明确出血部位和出血量可为抗凝强度调整提供参考,此外,超声还可以协助积血定位和穿刺引流。
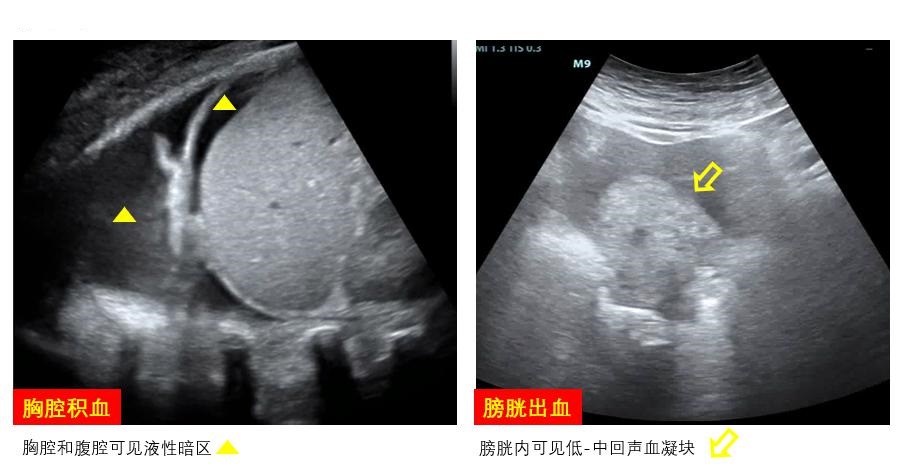
|
| 图 25 出血 |
|
|
血栓也是ECMO常见的并发症之一。由于穿刺损伤血管内皮、血流受阻、血管内置管等多种因素同时存在,对ECMO患者血栓监测不可或缺,超声可对置管血管进行血栓筛查,协助①制定抗凝;②血小板管理策略;③制定拔管计划;④预防血栓脱落避免造成更严重的栓塞并发症。
ECMO监测阶段超声决策:ECMO运行过程中,患者可能会出现多种病情变化,ECMO模式可能需要因病情变化而调整,其他药物和机械辅助可因此而增减,超声可以在多个角度为治疗决策提供证据并及时发现并发症。将VV和VA不同模式日常运行超声监测侧重点总结如下(图 26、图 27)。
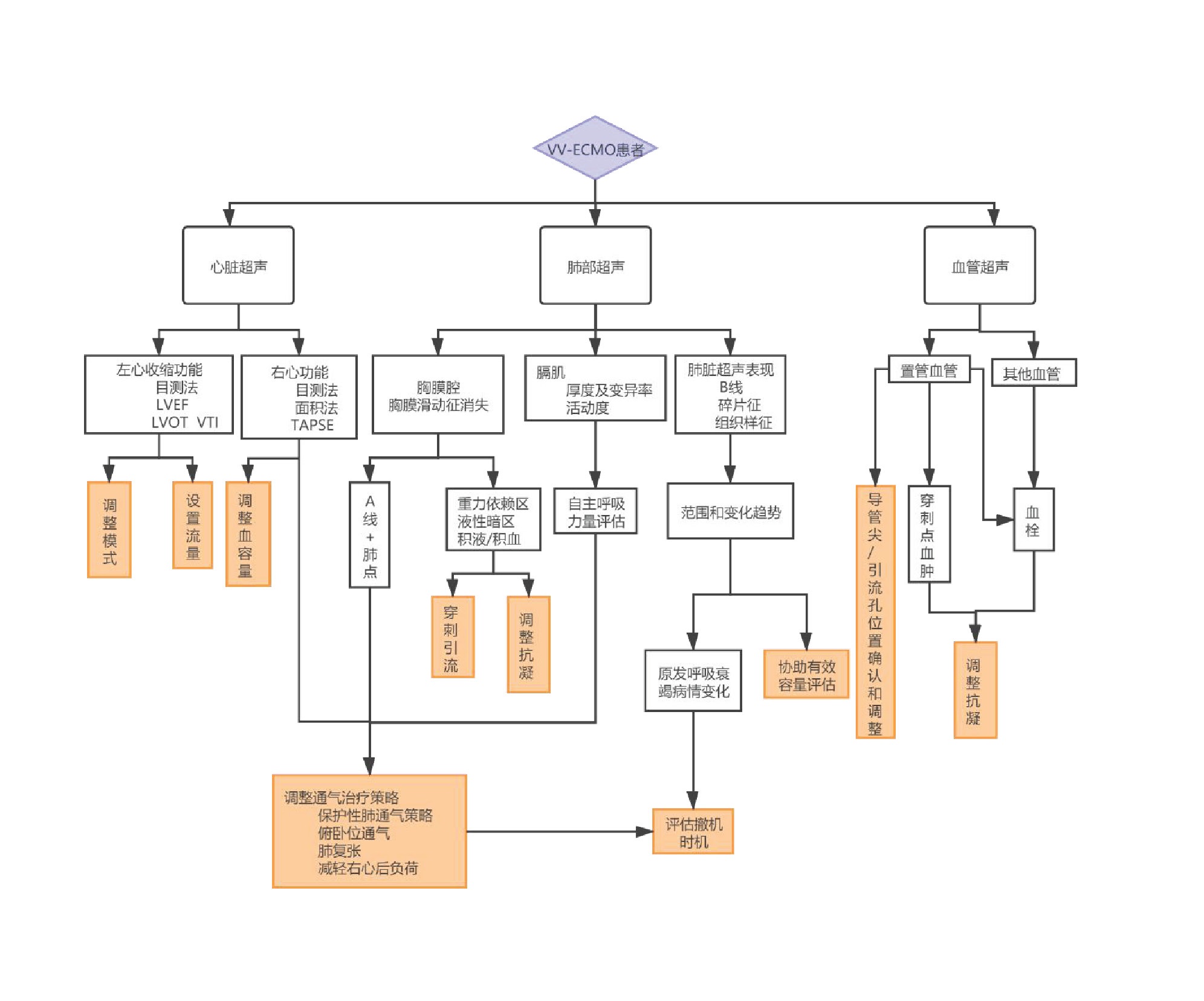
|
| 图 26 VV-ECMO日常超声监测流程图 |
|
|
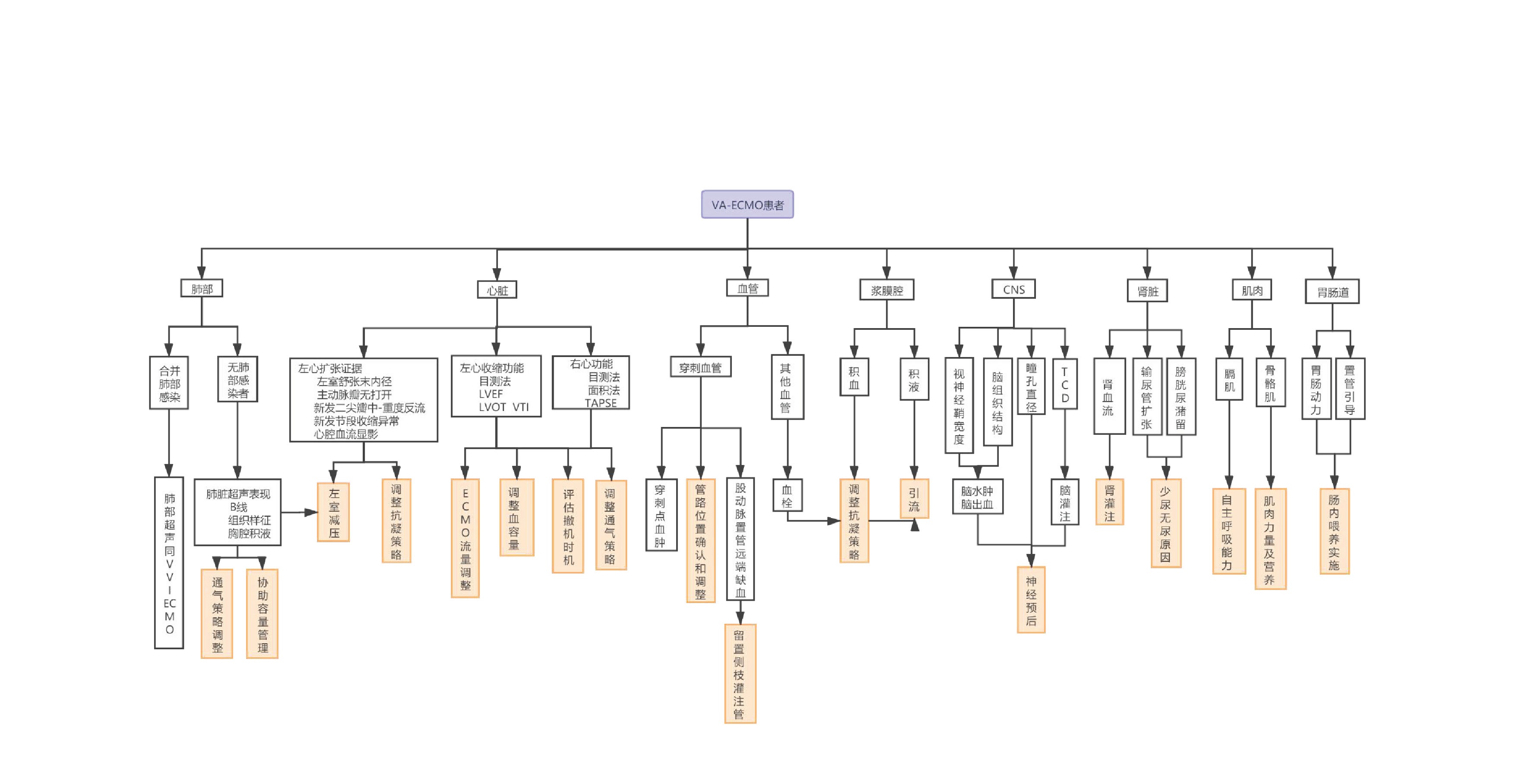
|
| 图 27 VA-ECMO日常超声监测流程图 |
|
|
监测阶段推荐意见:
⑦ ECMO运行期间,推荐床旁超声作为首选的影像学手段对患者进行评估;
⑧ ECMO运行期间,推荐至少每日床旁超声对患者进行评估。
3 撤机指导ECMO患者好转时及时撤机可减少并发症,提前撤机则可能导致撤机失败,因此,准确评估撤机时机对ECMO患者预后至关重要。在撤机时机把握方面,床旁超声可评估原发病恢复程度,为准确评估撤机时机提供更多证据。
3.1 VV-ECMO对VV-ECMO支持的呼吸衰竭患者,撤机前提为呼吸衰竭原发病好转。床旁超声可协助评估肺脏疾病变化及恢复情况[23]。对膈肌厚度和活动度进行探查,可了解患者自主呼吸能力恢复情况。肺部超声对于未累及胸膜的肺部病变及骨骼遮挡部分肺脏探查受限,可使用其他影像学进行补充。
3.2 VA-ECMOVA-ECMO患者需每日使用床旁超声评估心脏功能,当心脏功能逐渐恢复并且心排量可以满足机体需求时,可考虑撤机[24]。心脏功能恢复的超声证据包括:无左室扩张状态、瓣膜反流减少,左室射血分数、左室流出道或主动脉速度时间积分、三尖瓣环收缩期运动幅度、三尖瓣环运动速度等左右心室收缩功能指标好转,但目前仍无上述各项指标的统一推荐值,需结合临床进行个性化动态评估,反复权衡ECMO获益和风险,才可选取最佳撤机时机。
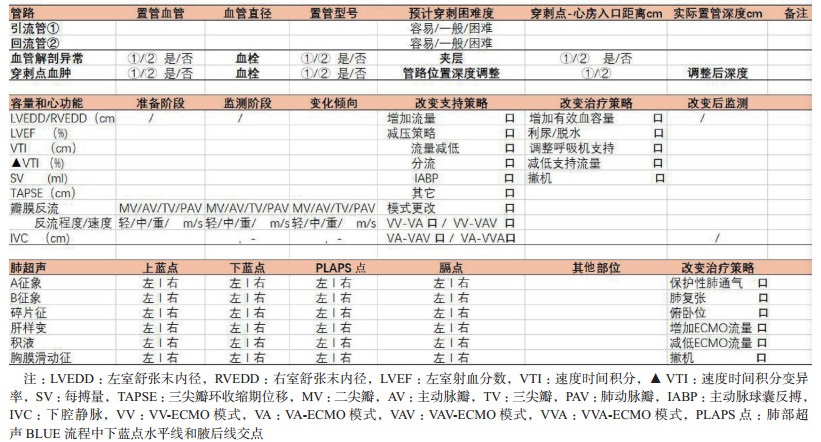
ECMO撤机阶段超声决策:ECMO运行期间应每日例行超声探查并评估撤机时机。本推荐将每日超声评估重点归纳在表 2中。
撤机阶段推荐意见:
⑨ 原发病改善后,推荐对患者每日床旁超声评估撤机指征。
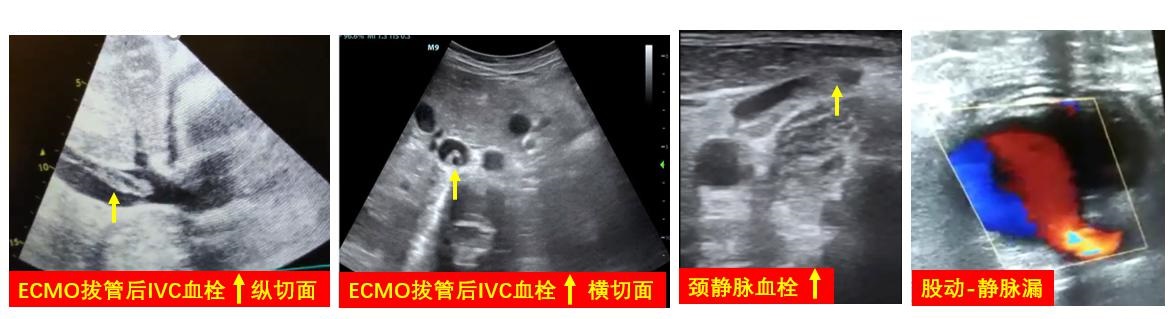
4 撤机后监测ECMO患者撤机后,仍需利用床旁超声对穿刺血管和穿刺部位进行并发症筛查,包括置管血管的血栓,穿刺部位动脉瘤、动静脉瘘等(图 28)。其余包括原发病的脏器功能监测和重症支持相关即时超声扫查内容则根据患者进行个体化选择,与其他重症患者无异。
|
| 图 28 置管后并发症 |
|
|
ECMO撤机后超声决策:ECMO撤机后仍使用床旁超声对穿刺部位进行监测。
撤机后阶段推荐意见:
⑩ 推荐床旁超声对ECMO并发症进行监测。
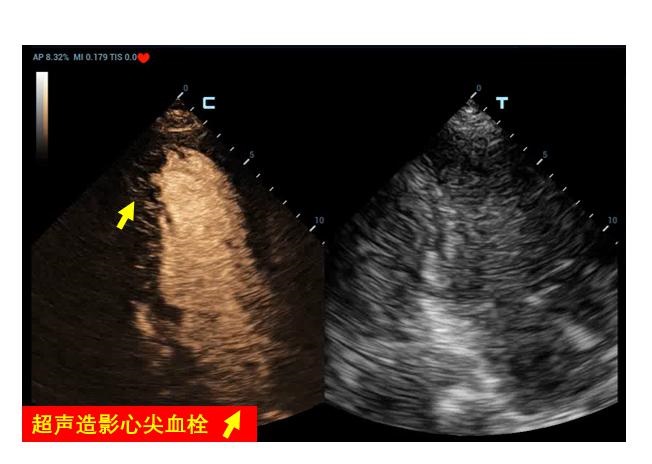
5 特殊超声检查和技术 5.1 超声造影超声造影常用于创伤出血患者的脏器破裂、出血部位查找,也常用于心腔内膜的清晰显示。虽然目前在ECMO患者中使用超声造影剂的安全性没有足够证据支持,但已有少量病例报道应用超声造影协助发生南北综合征的VA-ECMO患者寻找血流接触平面位置、判断主动脉瓣反流、协助明确左心室血栓形成(图 29)及撤机后使用超声造影协助评估穿刺点部位血管并发症等多方面应用[25-28]。
|
| 图 29 左心尖血栓形成 |
|
|
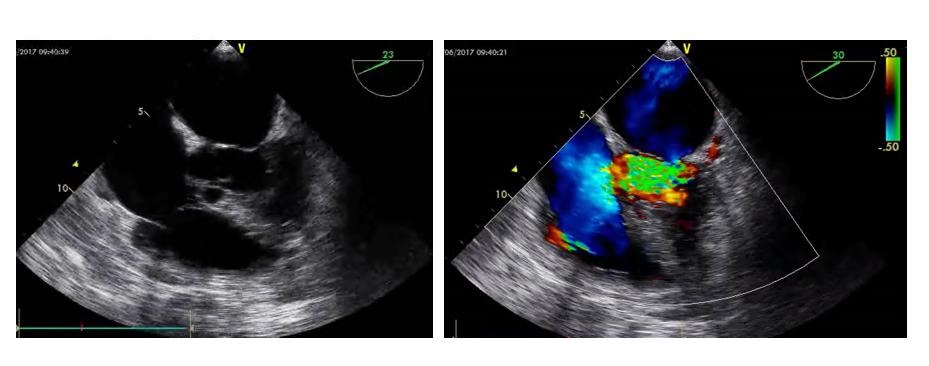
与经体表超声相比,经食道超声实施的简便性相对较低,但是经食道超声可在胸腔内血管和心脏的探查中得到更加清晰的影像,是经体表超声的重要补充,也是双腔管留置时协助定位的重要辅助手段(图 30)。
|
| 图 30 经食道超声心电图 |
|
|
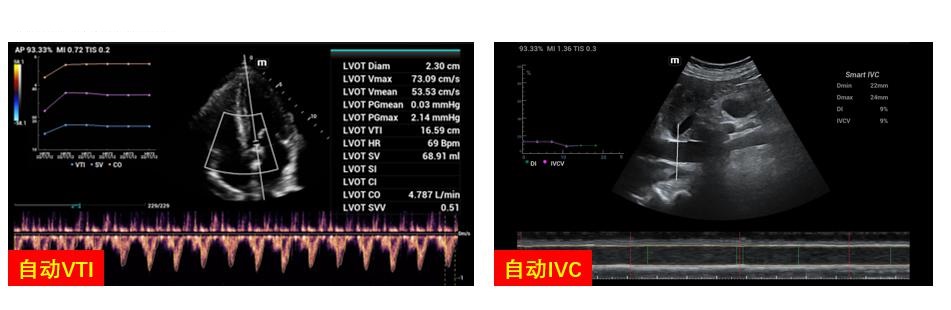
目前一些床旁超声设备内预设了多种自动测量技术和算法,如自动LVOT VTI变异率、自动IVC定量分析等(图 31),为临床快速获得数据提供了便利,需要强调的是准确的计算结果依赖于清晰的成像和标准的位置及角度设置校正,其适用人群需要个体化判断。
|
| 图 31 自动计算工具 |
|
|
床旁超声在ECMO准备、实施和监测过程中可对患者多个部位进行即时、连续的扫查和监测,快速解答临床问题,协助规避风险、减少并发症,在ECMO患者的实施全程中均具有重要的作用。但在使用过程中,应注意以下情况:
① 超声探查作为一项辅助检查,其结果需结合其他临床证据共同做出判断和决策;②超声检查不能延缓其他更重要的治疗和检查实施的时间,除非超声结果是其决策不可或缺的依据;③超声扫查的准确性依赖检查者的经验和技术、被检查者的条件等,需要根据实际情况综合判读超声扫查结果;④在超声数据读取时,需重视数据的变化趋势,结合病情综合判断超声测量结果的临床价值。
执笔:张秋彬(海南医学院第二附属医院急诊科) 孙峰(江苏省人民医院急诊科) 尹路(北京协和医院急诊科) 金魁(安徽省立医院急诊科)
专家组成员(按姓氏拼音字母排序):陈旭锋(江苏省人民医院) 曹钰(四川大学华西医院) 高恒波(河北医科大学第二医院) 韩小彤(湖南省人民医院) 李勇(河北省沧州市中心医院) 刘红升(中国人民解放军总医院第一附属医院) 卢俊宇(广西医科大学第二附属医院) 吕传柱(海南医学院第一附属医院) 吕立文(广西医科大学附属第一医院) 马青变(北京大学第三医院) 宋振举(复旦大学附属中山医院) 石岩(江苏省淮安市第二人民医院) 史迪(北京协和医院) 王旭东(航天中心医院) 王瑞兰(上海市第一人民医院) 王日兴(海南医学院第二附属医院) 吴鹏(天津市第三人民医院) 夏剑(武汉大学附属中南医院) 徐军(北京协和医院) 于学忠(北京协和医院) 余海放(四川大学华西医院) 赵晓东(中国人民解放军总医院第一附属医院) 张国强(中日友好医院) 张劲松(江苏省人民医院) 张茂(浙江大学医学院附属第二医院) 周树生(安徽省立医院) 周利平(中南大学湘雅医院) 周光居(浙江大学医学院附属第二医院) 周平(四川省人民医院) 朱海燕(中国人民解放军总医院第六医学中心) 朱华栋(北京协和医院)
利益冲突 所有作者均声明不存在利益冲突。
| [1] | Parzy G, Daviet F, Persico N, et al. Prevalence and risk factors for thrombotic complications following venovenous extracorporeal membrane oxygenation: a CT scan study[J]. Crit Care Med, 2020, 48(2): 192-199. DOI:10.1097/CCM.0000000000004129 |
| [2] | Fisser C, Reichenbächer C, Müller T, et al. Incidence and risk factors for cannula-related venous thrombosis after venovenous extracorporeal membrane oxygenation in adult patients with acute respiratory failure[J]. Crit Care Med, 2019, 47(4): e332-e339. DOI:10.1097/CCM.0000000000003650 |
| [3] | Knudson KA, Gustafson CM, Sadler LS, et al. Long-term health-related quality of life of adult patients treated with extracorporeal membrane oxygenation (ECMO): an integrative review[J]. Heart Lung, 2019, 48(6): 538-552. DOI:10.1016/j.hrtlng.2019.08.016 |
| [4] | Nakasato GR, Murakami BM, Batistão Gonçalves MA, et al. Predictors of complications related to venoarterial extracorporeal membrane oxygenation in adults: a multicenter retrospective cohort study[J]. Heart Lung, 2020, 49(1): 60-65. DOI:10.1016/j.hrtlng.2019.09.003 |
| [5] | Colman E, Yin EB, Laine G, et al. Evaluation of a heparin monitoring protocol for extracorporeal membrane oxygenation and review of the literature[J]. J Thorac Dis, 2019, 11(8): 3325-3335. DOI:10.21037/jtd.2019.08.44 |
| [6] | Gulkarov I, Bobka T, Elmously A, et al. The effect of acute limb ischemia on mortality in patients undergoing femoral venoarterial extracorporeal membrane oxygenation[J]. Ann Vasc Surg, 2020, 62: 318-325. DOI:10.1016/j.avsg.2019.06.012 |
| [7] | Lee SY, Jeon KH, Lee HJ, et al. Complications of veno-arterial extracorporeal membrane oxygenation for refractory cardiogenic shock or cardiac arrest[J]. Int J Artif Organs, 2020, 43(1): 37-44. DOI:10.1177/0391398819868483 |
| [8] | Harnisch LO, Riech S, Mueller M, et al. Longtime neurologic outcome of extracorporeal membrane oxygenation and non extracorporeal membrane oxygenation acute respiratory distress syndrome survivors[J]. J Clin Med, 2019, 8(7): E1020. DOI:10.3390/jcm8071020 |
| [9] | Cardiac ultrasound and extracorporeal life support: the two go together[J]. J Am Soc Echocardiogr, 2015, 28(4): A18-A19. DOI: 10.1016/j.echo.2015.02.008. |
| [10] | Lu X, Arbelot C, Schreiber A, et al. Ultrasound assessment of lung aeration in subjects supported by venovenous extracorporeal membrane oxygenation[J]. Respir Care, 2019, 64(12): 1478-1487. DOI:10.4187/respcare.06907 |
| [11] | Chimot L, Marqué S, Gros A, et al. Avalon© bicaval dual-lumen cannula for venovenous extracorporeal membrane oxygenation: survey of Cannula use in France[J]. ASAIO J, 2013, 59(2): 157-161. DOI:10.1097/MAT.0b013e31827db6f3 |
| [12] | Ahn HJ, Lee JW, Joo KH, et al. Point-of-care ultrasound-guided percutaneous cannulation of extracorporeal membrane oxygenation: make it simple[J]. J Emerg Med, 2018, 54(4): 507-513. DOI:10.1016/j.jemermed.2017.12.013 |
| [13] | Long L, Zhao HT, Zhang ZY, et al. Lung ultrasound for the diagnosis of pneumonia in adults: a meta-analysis[J]. Medicine (Baltimore), 2017, 96(3): e5713. DOI:10.1097/MD.0000000000005713 |
| [14] | Farghaly S, Hasan. Diaphragm ultrasound as a new method to predict extubation outcome in mechanically ventilated patients[J]. Aust Crit Care, 2017, 30(1): 37-43. DOI:10.1016/j.aucc.2016.03.004 |
| [15] | Extracorporeal Life Support Organization: ELSO guidelines. http://www.elsoorg/resources/guidelines |
| [16] | Thomas J, Kostousov V, Teruya J. Bleeding and thrombotic complications in the use of extracorporeal membrane oxygenation[J]. Semin Thromb Hemost, 2018, 44(1): 20-29. DOI:10.1055/s-0037-1606179 |
| [17] | Rao P, Khalpey Z, Smith R, et al. Venoarterial extracorporeal membrane oxygenation for cardiogenic shock and cardiac arrest[J]. Circ Heart Fail, 2018, 11(9): e004905. DOI:10.1161/CIRCHEARTFAILURE.118.004905 |
| [18] | Xie A, Lo P, Yan TD, et al. Neurologic complications of extracorporeal membrane oxygenation: a review[J]. J Cardiothorac Vasc Anesth, 2017, 31(5): 1836-1846. DOI:10.1053/j.jvca.2017.03.001 |
| [19] | Bonicolini E, Martucci G, Simons J, et al. Limb ischemia in peripheral veno-arterial extracorporeal membrane oxygenation: a narrative review of incidence, prevention, monitoring, and treatment[J]. Crit Care, 2019, 23(1): 266. DOI:10.1186/s13054-019-2541-3 |
| [20] | Ericsson A, Frenckner B, Broman LM. Adverse events during inter-hospital transports on extracorporeal membrane oxygenation[J]. Prehosp Emerg Care, 2017, 21(4): 448-455. DOI:10.1080/10903127.2017.1282561 |
| [21] | Broman LM, Holzgraefe B, Palmér K, et al. The Stockholm experience: interhospital transports on extracorporeal membrane oxygenation[J]. Crit Care, 2015, 19: 278. DOI:10.1186/s13054-015-0994-6 |
| [22] | Hayes K, Holland AE, Pellegrino VA, et al. Acute skeletal muscle wasting and relation to physical function in patients requiring extracorporeal membrane oxygenation (ECMO)[J]. J Crit Care, 2018, 48: 1-8. DOI:10.1016/j.jcrc.2018.08.002 |
| [23] | Lu X, Arbelot C, Schreiber A, et al. Ultrasound assessment of lung aeration in subjects supported by venovenous extracorporeal membrane oxygenation[J]. Respir Care, 2019, 64(12): 1478-1487. DOI:10.4187/respcare.06907 |
| [24] | Huang KC, Lin LY, Chen YS, et al. Three-dimensional echocardiography-derived right ventricular ejection fraction correlates with success of decannulation and prognosis in patients stabilized by venoarterial extracorporeal life support[J]. J Am Soc Echocardiogr, 2018, 31(2): 169-179. DOI:10.1016/j.echo.2017.09.004 |
| [25] | Buchtele N, Staudinger T, Schwameis M, et al. Feasibility and safety of watershed detection by contrast-enhanced ultrasound in patients receiving peripheral venoarterial extracorporeal membrane oxygenation: a prospective observational study[J]. Crit Care, 2020, 24(1): 126. DOI:10.1186/s13054-020-02849-y.[PubMed |
| [26] | Bennett CE, Tweet MS, Michelena HI, et al. Safety and feasibility of contrast echocardiography for ECMO evaluation[J]. JACC Cardiovasc Imaging, 2017, 10(5): 603-604. DOI:10.1016/j.jcmg.2016.05.004 |
| [27] | Au SY, Fong KM, Ng WG, et al. Confirming distal perfusion catheter position by micro-bubbles in patients on peripheral venoarterial extracorporeal membrane oxygenation[J]. ASAIO J, 2019, 65(7): 753-755. DOI:10.1097/MAT.0000000000000868 |
| [28] | Janus SE, Hajjari J, Al-Kindi S, et al. Contrast-enhanced echocardiographic detection of severe aortic insufficiency in venoarterial extracorporeal membrane oxygenation[J]. Echocardiography, 2020, 37(6): 905-907. DOI:10.1111/echo.14752 |
 2020, Vol. 29
2020, Vol. 29