超广谱β内酰胺酶(extended-spectrumβ-lactam, ESBLs)是由质粒介导的能水解青霉素类、头孢菌素及单环酰胺类等β-内酰胺类抗菌药物的β-内酰胺酶,其对碳青霉烯类和头霉素类水解能力弱。ESBLs主要由肠杆菌科细菌产生,以肺炎克雷伯菌、大肠埃希菌、变形杆菌最为常见,产ESBLs肠杆菌(extended-spectrumβ-lactam, enterobacteriaceae, ESBL-E)也成为急危重患者耐药菌感染的主要致病菌之一。急诊患者有其独特的临床特点:(1)病情复杂,基础疾病和并发症多,病变可累及多个脏器,涉及多个专科。(2)多为老年慢性病、营养不良和免疫功能低下(肿瘤、免疫系统疾病、糖尿病等)患者,滞留在急诊接受治疗。(3)病情危重,多需要有创抢救和治疗(机械通气、各种导管的留置,肾脏替代治疗等),操作远多于普通住院患者。上述特点造成急诊患者ESBL-E感染发生率较高[1-2],为此ESBL-E感染急诊诊疗中国专家组结合大量循证医学证据,采用德尔菲调查法制定共识,针对急诊ESBL-E感染患者诊疗密切相关的问题给予指导和推荐。
1 急诊ESBL-E感染的流行病学特点?推荐意见1:急诊ESBL-E感染主要以泌尿道和血流感染为主,病原菌以大肠埃希菌和肺炎克雷伯菌为主。鉴于ESBL-E感染率居高不下,对常规抗菌治疗无反应并伴危险因素的患者,建议针对ESBL-E进行检测。
近年来,ESBL-E感染率在全球逐年增高,社区感染率增高是主要的特征之一,2012-2017年5年间美国ESBL-E感染率增长了53%[3]。在一些欠发达落后地区形势更为严峻,ESBL-E的检出率持续呈较高水平,例如也门地区2014-2015年产ESBLs大肠埃希菌的检出率高达33.8%[4]。中国细菌耐药监测网(CHINET)数据显示(自2016年以来没有常规检测ESBLs,以头孢噻肟耐药的数据替代),2018年我国产ESBLs大肠埃希菌检出率为61.8%,2019年上半年的检出率是59.5%,与2013年的61.0%基本持平[5]。我国2个多中心研究发现血流感染的大肠埃希菌和肺炎克雷伯菌产ESBLs的检出率分别高达55.5%和16.5%[6],下呼吸道产ESBLs大肠埃希菌和肺炎克雷伯菌检出率分别为55.9%%和24.3%[7]。
急诊社区获得性ESBL-E感染的比例逐年增高是ESBLs流行病学的新特点,急诊ESBL-E的主要感染部位为泌尿道感染和血流感染[8],产ESBLs大肠埃希菌和肺炎克雷伯菌在医院和社区获得性泌尿道感染中发生率均较高,已经成为社区获得性血流感染和泌尿道感染的主要致病菌[8-9]。一个单中心研究显示急诊感染患者产ESBLs大肠埃希菌和肺炎克雷伯菌的检出率分别高达62.0%和26.0%[2],另一研究发现急诊社区获得性血流感染产ESBLs大肠埃希菌和肺炎克雷伯菌的检出率也分别达到44.44%和12.29%[10]。此外,我国台湾地区一项回顾性研究对2005-2009年急诊ESBL-E引起的菌血症患者进行分析,结果表明ESBL-E主要是大肠埃希菌和肺炎克雷伯菌,分别达到62.5%和34.4%,ESBL-E引起的菌血症的28 d病死率高达18.8%,严重影响感染患者的预后[8]。
2 ESBL-E感染的危险因素和风险评估工具?推荐意见2:急诊ESBL-E感染的危险因素主要包括高龄、反复应用抗菌药物史、侵袭性操作、医院或者养老院居住史、免疫抑制等,CoMEB-ESBL和umbarello/Johnson评分系统可作为急诊ESBL-E感染风险评估的主要工具。
ESBL-E感染的常见危险因素包括高龄、反复应用抗菌药物史、留置导管(包括中心静脉/动脉置管、经皮胃或空肠造瘘管、导尿管等)、有结石或梗阻(如胆道、泌尿道)、既往曾有ESBL-E感染、反复住院、曾入住过ICU史、高龄、合并基础疾病(糖尿病、血液病、肿瘤、自身免疫病等)、呼吸机辅助通气、住院时间>20 d、长期应用激素等[11]。除了上述危险因素,急诊恶性血液病和肿瘤的患者也逐渐增多,研究显示急诊ESBL-E感染的肿瘤患者中,恶性血液病相比于其他实体肿瘤的比例更高[12]。也有研究发现泌尿道梗阻和手术史导致的泌尿道感染是社区获得性ESBL-E血流感染的独立危险因素[13-14]。
目前国外很多研究都试图建立一种有效的评分系统,用来预测ESBL-E感染的可能性,本共识推荐以下2个相对有效的评分系统(见表 1),可以用来作为急诊感染患者ESBL-E感染风险评估的主要工具。
| 变量 | CoMEB-ESBL 评分 |
变量 | Tumbarello 评分 |
Johnson 评分 |
| 居住于养老院 | 1 | 年龄≥70岁 | 2 | — |
| 发生菌血症症状前4周内 | Charlson合并症指数>3分 | 2 | — | |
| 接受抗菌治疗 | 1 | 近3个月,接受免疫抑制治疗 | — | 2 |
| 接受侵袭性操作1 | 1 | 近期(1年内),曾住院治疗 | 3 | 2 |
| 住院进行治疗0 | 0 | 由医疗保健机构转诊 | 3 | 4 |
| 1年内曾因菌血症急诊就诊† | 1 | 近3个月,曾使用过β-内酰胺类或喹诺酮类 | 2 | 3 |
| 合并症 | 近1个月,接受导尿管 | 2 | 5 | |
| 泌尿系疾病 | 0 | |||
| 糖尿病 | 0 |
(1)CoMEB-ESBL评分系统[15]:是用来预测社区获得性肠杆菌科菌血症是否具有产ESBLs风险,主要包括:居住于养老院(1分);发生菌血症前4周内,曾接受抗菌治疗或接受侵袭性操作(各1分);既往1年内曾因菌血症频繁的急诊科就诊史>3次(1分),其中“频繁急诊就诊”首次作为一项重要因素,来预测ESBL-E感染的高危患者。当CoMEB-ESBL评分≥3分,诊断ESBL-E感染敏感性为84.6%,特异性可达到92.5%。
(2)Tumbarello/Johnson评分系统[16]:用来评估入院时社区获得性肠杆菌感染是否具有产ESBLs风险,评估内容包括:年龄≥70岁;Charlson指数>3分;近3个月存在免疫抑制;近期(1年内)曾住院治疗;由医疗保健机构转诊;近3个月曾使用过β-内酰胺类或氟喹诺酮类;近1个月接受导尿管。当Tumbarello评分≥8分,特异性:100%;阳性预测率:98%;阴性预测率:88%;当Johnson评分≥8分,特异性: 95%;阳性预测率:79%;阴性预测率:87%。
3 ESBL-E感染,急诊如何病情评估?推荐意见3:除传统脓毒症3.0指南标准定义的重度脓毒症和脓毒性休克以外,推荐以感染严重程度、感染源和宿主免疫状态等三方面对ESBL-E感染严重程度做出综合评估,INCREMENT-ESBL评分可用于ESBL-E血流感染患者严重程度的分层。
急诊ESBL-E感染病情严重程度的分层对于患者预后的评估、治疗地点的选择、抗菌药物的应用都至关重要。通常我们在选择抗菌药物应用方案时,除了要评估病原体和耐药性,需重点评估患者感染的严重程度,以往的评估标准主要是参考2016年脓毒症3.0指南标准。然而在实际临床工作中,很多急诊感染患者初期并未出现严重器官损伤,但却有免疫抑制,极易发展成重症感染。有研究推荐以感染严重程度、感染源和宿主免疫状态等三方面对ESBL-E重症感染做出综合分析(见表 2),具备以下三部分就可以确定为重症感染[17]。(1)严重感染:具备以下任何一项:Pitt评分≥4;APACHE II评分 > 10;入住ICU;并表现为严重脓毒症或脓毒性休克。(2)复杂感染源:不可能引流或引流不充分(例如肺炎,心内膜炎,引流不充分的深层感染。(3)宿主免疫抑制:具备以下任何一项:中性粒细胞减少症(< 500/mL);白血病;淋巴瘤;HIV感染(CD4 < 200/mL);实体器官或造血干细胞移植;细胞毒性化学疗法;类固醇(泼尼松15mg/d,疗程2周以上)。也有研究推荐了针对ESBL-E血流感染患者的死亡风险评分—INCREMENT-ESBL评分[18],该评分系统包括年龄 > 50岁(3分);产ESBsL肺炎克雷伯菌属(2分);除泌尿道外的其他感染源(3分);McCabe状态(濒临或快速死亡)(4分);Pitt评分 > 3(3分);重症脓毒症或脓毒性休克(4分);不恰当早期靶向治疗(2分),当INCREMENT-ESBL评分≥11分就提示患者处于高死亡风险。
| 分类 | 条件 |
| 严重程度的体现 | |
| 严重感染 | 以下任何一项:Pitt评分≥4,APACHE II评分 > 10,入住ICU,并表现为严重脓毒症或脓毒性休克 |
| 非严重感染 | 所有其他人 |
| 感染源 | |
| 高危患者 | 高病原菌接种感染,不可能引流或引流不充分(例如肺炎,心内膜炎,引流不充分的深层感染) |
| 中危患者 | 不包括在高风险或低风险患者(例如血管导管感染,导管去除感染,胆道引流或腹腔内) |
| 低危患者 | 不包括在高风险或低风险患者(例如血管导管感染,导管去除感染,胆道引流或腹腔内) |
| 免疫状态 | |
| 严重免疫受损 | 以下任何一项:中性粒细胞减少症(< 500/mL),白血病,淋巴瘤,HIV感染(CD4 < 200/mL),实体器官或造血干细胞移植,细胞毒性化学疗法,类固醇(每天泼尼松15 mg,疗程2周以上) |
| 非严重免疫受损 | 所有其他人 |
推荐意见4:社区获得性或轻中度:ESBL-E呼吸道和血流感染可以应用β-内酰胺/β-内酰胺酶抑制复合制剂,腹腔和泌尿道感染可以应用β-内酰胺/β-内酰胺酶抑制复合制剂、厄他培南或氨基甙等;医院获得性或重度ESBL-E感染:首选亚胺培南/西司他丁或美罗培南等碳青霉烯类抗菌药物。
(1)呼吸道感染:社区获得性ESBL-E肺炎治疗推荐使用哌拉西林/他唑巴坦或头孢哌酮/舒巴坦、厄他培南、头霉素类等[19]。对于医院获得性和呼吸机相关性肺炎,非危重感染可采用β-内酰胺类/β-内酰胺酶抑制剂的联合用药方案,重症感染可选择碳青霉烯类药物[5, 20]。
(2)腹腔感染:医院获得性腹腔感染ESBL-E发生的比例更高,对于轻、中度的社区获得性ESBL-E腹腔感染,可以选择单药治疗,推荐使用哌拉西林/他唑巴坦、阿米卡星或厄他培南[21-22];重度社区获得性和医院获得性ESBL-E腹腔感染应选用碳青霉烯类抗菌药物[23-24]。
(3)泌尿道感染:ESBL-E引起的急性单纯性下尿路感染可选用呋喃妥因或磷霉素氨丁三醇口服治疗。ESBL-E引起的复杂性尿路感染,可选用β-内酰胺类/β-内酰胺酶抑制剂或厄他培南[5],继发脓毒性休克的患者可直接选用碳青霉烯类抗菌药物。
(4)血流感染:首先应明确感染的来源,积极处理原发病灶,如血管内导管相关血流感染,应拔除导管,明确感染灶后立刻进行抗菌治疗,碳青霉烯类抗菌药物是治疗重度ESBL-E血流感染的首选,在轻中度或低风险来源的血流感染,可以考虑使用β-内酰胺类/β-内酰胺酶抑制剂[25]。
(5)颅内感染:针对ESBL-E颅内感染,可采用易透过血脑屏障的碳青霉烯类抗菌药物,如美罗培南疗效较好。
5 急诊常用治疗ESBL-E感染的抗菌药物效价及特点?推荐意见5:急诊ESBL-E对碳青霉烯类和β-内酰胺/β-内酰胺酶抑制复合制剂敏感,推荐使用的抗菌药物包括碳青霉烯类、β-内酰胺/β-内酰胺酶抑制复合制剂、头霉素、喹诺酮、氨基甙、甘氨酰环素类等(见表 3)。
| 药物名称 | 常规剂量(肝、肾功能正常情况下) |
| 美罗培南 | 1~2 g /8 h,静脉 |
| 亚胺培南/西司他丁 | 1.0 g /6 h(其中亚胺培南剂量0.5 g),静脉 |
| 厄他培南 | 1~2 g /d,静脉 |
| 头孢哌酮/舒巴坦 | 3.0 g /12~8 h,静脉 |
| 哌拉西林/他唑巴坦 | 4.5 g /8~6 h,静脉 |
| 头孢他啶/阿维巴坦 | 2.5 g /8 h,静脉 |
| 头孢美唑 | 2.0 g /12~8 h |
| 头孢西丁 | 2.0 g /8~6 h,静脉 |
| 拉氧头孢 | 2.0 g /8 h,静脉 |
| 环丙沙星 | 0.4 g/12~8 h,静脉;0.25~0.5 g2次/d 3次/d,口服 |
| 左氧氟沙星 | 0.4~0.6 g/d,静脉或口服 |
| 莫西沙星 | 0.4 g/d,静脉或口服 |
| 依替米星 | 0.4 g/12 h静脉 |
| 阿米卡星 | 0.2 g /12 h,7.5 mg/(kg ·12 h),15 mg/(kg ·d)静脉 |
| 替加环素 | 50~100 mg/12 h(负荷剂量100~200 mg),静脉 |
| 注:推荐剂量参考国家抗微生物治疗指南、ABX指南以及药品说明书。 | |
ESBLs可以被β-内酰胺酶抑制剂抑制,能够水解青霉素类、头孢菌素类及单环酰胺类的β-内酰胺类抗菌药物,对头霉素类、碳青霉烯类的β-内酰胺类抗菌药物水解能力弱,因此ESBL-E对青霉素类、头孢菌素类和单环酰胺类抗菌药物耐药;对碳青霉烯类药物敏感;对β-内酰胺/β-内酰胺酶抑制复合制剂及头霉素类通常敏感。ESBLs虽然不能水解其他非β-内酰胺类抗菌药物(例如喹诺酮类、氨基糖苷类、磺胺类等),但是ESBL-E可能也携带其他耐药基因或发生基因突变,因此对其他非β-内酰胺类抗菌药物是否敏感,需要结合体外药敏结果协助判断。
(1)碳青霉烯类:碳青霉烯类是对ESBL-E感染疗效最肯定的抗菌药物,常用药物品种包括亚胺培南/西司他丁、厄他培南、美罗培南、帕尼培南/倍他米隆、比阿培南等。急诊ESBL-E感染患者出现急性或进展性器官功能不全、血流动力学改变和需要机械通气支持等重度感染时,首选碳青霉烯类药物。对可能ESBL-E的院内感染如呼吸机相关肺炎、泌尿道感染和血流感染,也均可经验性使用碳青霉烯类抗菌药物治疗。亚胺培南/西司他丁和美罗培南主要用于重度感染,厄他培南可作为轻、中度社区获得性呼吸道、泌尿道和腹腔感染的经验性治疗,在急诊治疗ESBL-E感染中使用便捷(1次/d)[26]。
(2)β内酰胺类/β内酰胺酶抑制剂复合制剂:对ESBL-E敏感性良好,有较好临床疗效的药物包括:哌拉西林/他唑巴坦、头孢哌酮/舒巴坦、头孢他啶/阿维巴坦等。其中哌拉西林/他唑巴坦和头孢哌酮/舒巴坦是主要治疗药物,可用于无脓毒性休克时ESBL-E所致的轻、中度感染。新型β-内酰胺酶抑制剂(阿维巴坦)对ESBLs有抑制作用外,临床主要用来治疗碳青霉烯耐药肺炎克雷伯菌的感染,不建议首选头孢他定/阿维巴坦治疗ESBL-E感染[5, 27]。
(3)头霉素类及氧头孢烯类:对于ESBL-E具有良好的抗菌作用,可用作轻症感染的治疗选择。临床常用药物包括头孢美唑、头孢米诺、头孢西丁和拉氧头孢等,由于肠杆菌染色体介导或质粒携带的AmpC酶可水解头霉素类抗菌药物,因此在使用此类药物抗感染治疗过程中,如临床观察到疗效不满意,尽管体外药敏试验显示敏感,也应果断调整治疗方案,避免治疗失败。
(4)喹诺酮类:临床常用药物包括环丙沙星、左氧氟沙星和莫西沙星。如体外药敏试验显示敏感,可用于治疗ESBL-E引起的轻、中度的尿路感染和腹腔感染,也可用于重症感染的联合用药。
(5)氨基甙类:常用药物有阿米卡星、依替米星、异帕米星、妥布霉素等,对包括ESBL-E的革兰阴性菌有较好的抗菌活性,但因这类药物主要分布在细胞外液,尿中浓度高,在支气管分泌物、胆汁及组织浓度不高,限制了该类药物的治疗范围,可作为ESBL-E尿路感染轻症的用药。
(6)甘氨酰环素类:目前已在我国上市的品种仅有替加环素,体外显示对ESBL-E具有良好的抗菌活性,临床主要用来治疗除铜绿假单胞菌感染以外的广泛耐药革兰阴性菌感染,体内组织分布广泛,可以用来作为对一线药物不能耐受患者的ESBL-E治疗选择。
(7)其他抗菌药物:替加环素对ESBL-E有较好疗效,在常规抗菌药物疗效不佳的情况下,可选择作为联合用药[22]。磷霉素对产ESBLs大肠埃希菌所致的复杂性下尿路感染有效。呋喃妥因、复方新诺明、阿莫西林/克拉维酸,仅可用来治疗ESBL-E所致的下尿路感染。
6 急诊ESBL-E感染合并急性肾损伤的抗菌药物使用策略推荐意见6:急诊ESBL-E重症感染合并急性肾损伤时,需要结合年龄、肌酐清除率、药物肾毒性、血液滤过等因素综合考虑抗菌药物的选择,抗菌药物的使用策略采取标准负荷剂量和根据肌酐清除率调整的维持剂量。
抗菌药物的选择通常需要结合患者的基础疾病、免疫状态、血流动力学情况、感染严重程度、脏器功能、病原学培养和药敏结果等方面综合考虑,其中肾功能是主要参考的指标之一。急诊ESBL-E重症感染患者常常合并急性肾损伤(acute kidney injury,AKI),需要结合年龄、肌酐清除率、药物肾毒性、血液滤过等因素综合考虑抗菌药物的选择,通常会根据患者的肌酐清除率来调整抗菌药物的负荷剂量和维持剂量。在重症感染合并AKI早期抗感染过程中,根据肾功能减少抗菌药物使用剂量的时机是非常重要的。近期的研究发现,57.2%的重症感染合并AKI的患者在48 h内肾功能得以恢复,称之为“短暂AKI”,特别是针对不需或不能行CRRT的患者,推迟(48 h后)减少抗菌药物的使用剂量能够明显改善感染患者的临床结局[28]。在重症感染合并AKI的患者中,早期减少标准抗菌药物剂量会引起有效治疗血药浓度的下降,从而影响抗感染的效果[29]。特别在早期存在肾脏功能亢进的患者,与常规维持剂量比较,增加抗菌药物的维持剂量可以明显降低重症肺炎的治疗失败率和复发率[30]。最近的一项研究推荐,不论是否存在肾功能损伤,重症感染患者都不需要调整起始抗菌药物的标准负荷剂量,负荷剂量应独立于维持剂量,维持剂量根据肾脏功能状态来调整[31]。有研究显示不同肾功能状态的重度感染时,保持不变的负荷剂量和根据肾功能变化的维持剂量,特别是给予延长输注(连续输注),可以显著降低脓毒血症患者的死亡风险[32-33]。
7 急诊ESBL-E感染单药或联合用药治疗的选择时机?推荐意见7:合并脓毒性休克需要联合使用抗菌药物,碳青霉烯类或者β-内酰胺类/β-内酰胺酶抑制剂联合喹诺酮类或氨基糖苷类抗菌药物是急诊ESBL-E感染的主要联合用药方案。
绝大多数急诊ESBL-E感染仅需单药治疗,单药治疗的指征是无脓毒性休克、仅局部感染、接受抗菌药物后临床改善、无严重合并症、无其他病原体合并感染等。少数严重感染(如并发脓毒性休克)的患者需要联合用药方案,如碳青霉烯类抗菌药物、哌拉西林/他唑巴坦、头孢哌酮/舒巴坦联合喹诺酮类或氨基糖苷类[34]。中、重度社区获得性腹腔感染,可以选择碳青霉烯类或β-内酰胺类/β-内酰胺酶抑制剂联合替加环素[22]。对于复杂性尿路感染,根据当地ESBLs的敏感性试验,β-内酰胺类/β-内酰胺酶抑制剂联合氨基糖类药物可作为选择方案[5]。
8 急诊ESBL-E感染抗菌药物的治疗疗程?推荐意见8:不同感染部位和严重程度的患者抗菌药物使用疗程是有差异的,要综合分析评估患者的具体情况,既要减少患者的抗菌药物暴露,又要保证临床疗效。
目前关于脓毒症抗菌治疗持续时间的指导是有限的,通常抗菌药物的使用时间与患者的感染严重程度、感染部位、病原菌等密切相关,是以患者最终临床状况改善和稳定作为抗菌药物的停药指征,这本身也会导致重症感染患者抗菌药物使用时间的延长,2016拯救脓毒症指南建议:使用7~10 d的抗菌药物足以能够应对大多数脓毒性休克,虽然这个时间可能在某些情况下会有所延长(例如不能引流的感染灶等)[35]。不同感染部位和严重程度的患者抗菌药物使用时间是有差异的,要综合分析评估患者的具体情况,既要减少患者的抗菌药物暴露,又要保证临床疗效。对于呼吸机相关性肺炎,抗菌药物的使用时间在8~15 d,很早就有研究发现使用抗菌药物8 d的的疗效并不逊色于15 d[36]。对于社区获得性肺炎,抗菌药物的使用时间指南推荐不少于5 d[37]。对于社区获得性泌尿道感染抗菌药物的使用时间建议7~10 d,更长的使用时间与并发念珠菌感染密切相关[38]。血流感染抗菌药物一般使用时间在7~14 d,研究显示使用抗菌药物8 d的的疗效并不差于15 d(90 d的临床结局)[39]。腹腔感染抗菌药物使用时间一般在5~10 d,及时有效的干预治疗会明显缩短抗菌药物的使用时间[40]。
9 急诊ESBL-E感染的诊疗流程?推荐意见9:急诊ESBL-E感染的诊疗流程主要分为四步骤:危险因素评估、感染严重程度评估、病原学标本的留取、分层进行抗菌治疗(见图 1)。
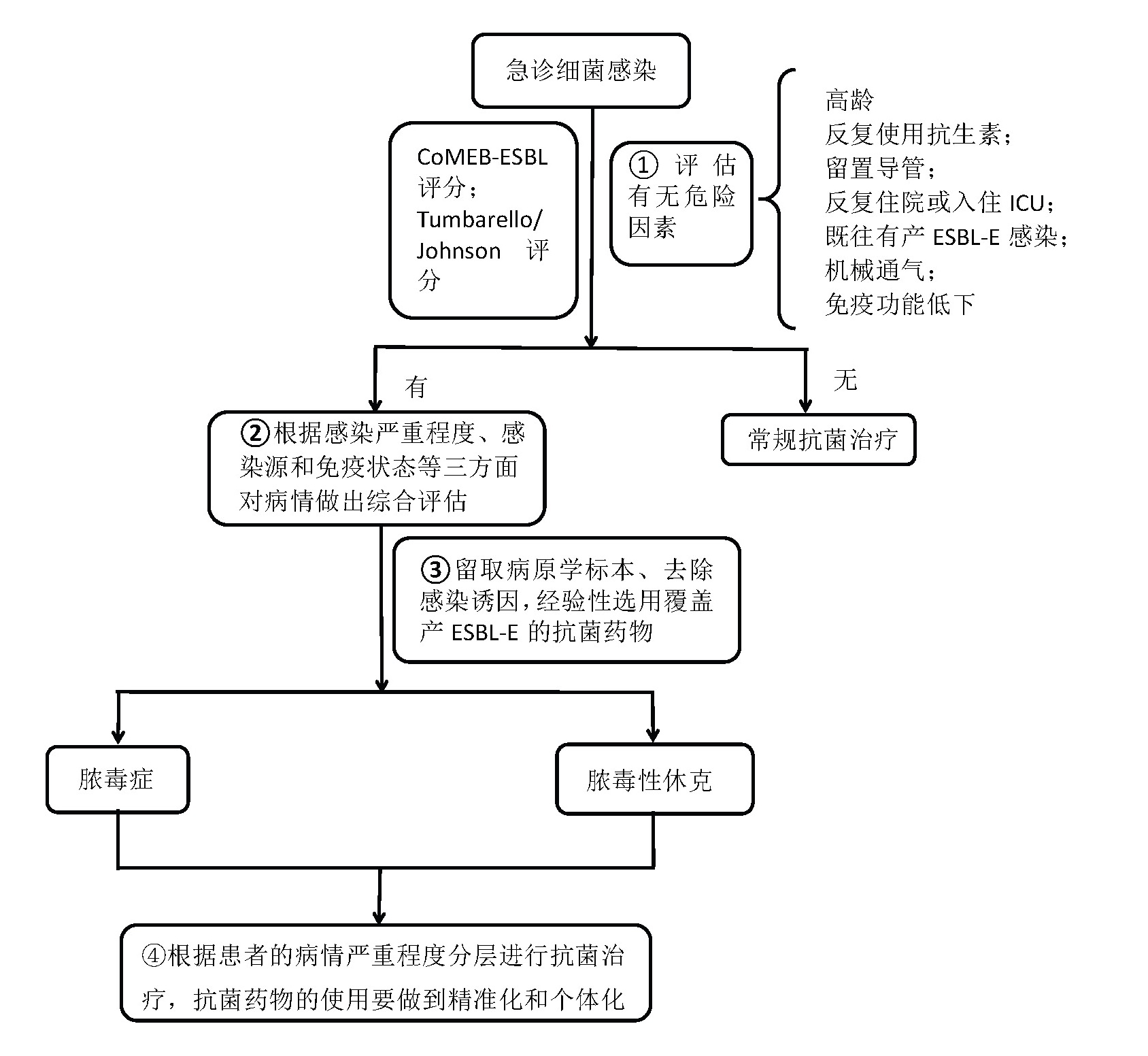
|
| 图 1 急诊产ESBLs肠杆菌感染的诊疗流程 |
|
|
急诊ESBL-E感染的诊疗流程主要分为四个步骤:(1)首先对ESBL-E感染的主要危险因素进行评估,对于存在高危险因素的患者进行合理的选择抗菌药物。(2)对急诊ESBL-E感染患者的病情严重程度要做出快速的评估,严重程度的分层是选择抗菌药物的重要参考依据之一[41]。(3)使用经验性抗菌药物之前应及时留取病原学标本,一旦病原菌获得阳性结果,应根据患者病情、临床诊断以及药敏结果调整抗菌药物治疗方案。(4)根据患者的病情严重程度分层进行抗菌治疗,抗菌药物的使用要做到精准化和个体化。要结合指南和共识经验性的合理使用抗菌药物,做到恰当、足够和广义降阶梯的抗菌治疗,同时需要优化抗菌药物管理,根据抗菌药物药代动力学和药效动力学(PK/PD)的特点合理使用抗菌药物,选择正确的给药方案,包括给药途径、剂量、间隔等,例如对于高MIC致病菌重症感染患者,推荐采用β-内酰胺类药物延时输注(如延长3 h输注)和连续输注(如连续24 h输注),以提高PK/PD达标概率,从而增加疗效[19]。
10 急诊ESBL-E感染治疗的多样性和替换性治疗方案的实现?推荐意见10:β内酰胺类/β内酰胺酶抑制剂为ESBL-E感染的经验性和目标性治疗提供了选择的多样性,可以作为ESBL-E感染治疗的替换性抗菌药物。
碳青霉烯类抗菌药物主要用于ESBL-E感染死亡风险较高的重症患者,如重症肺炎或者感染性休克患者。同样β内酰胺类/β内酰胺酶抑制剂(哌拉西林他唑巴坦等)也发挥着重要的作用,为疑诊或确定ESBL-E感染的经验性和目标性治疗提供了抗菌药物选择的多样性,保证ESBL-E感染治疗的多样性。有证据显示β内酰胺类/β内酰胺酶抑制剂类药物可依据PK/PD原理,通过提高每日使用剂量或者延长输注时间治疗ESBL-E引起的重症感染[42]。替换性治疗是指针对一定范围内出现的耐药菌暴发流行,以治疗耐药菌感染、控制耐药菌流行为目的,策略性替换原来的抗感染方案。随着碳青霉烯类耐药菌检出率的提高,对于处于稳定状态、药敏试验为敏感的ESBL-E感染的患者可选择β-内酰胺类/β-内酰胺酶抑制剂,以减少碳青霉烯耐药细菌的产生[43],研究证实β-内酰胺类/β-内酰胺酶抑制剂治疗产ESBLs大肠埃希菌引起的血流和泌尿道感染,细菌学清除、疗效、病死率与碳青霉烯类药物都相同[44-45],因此β内酰胺类/β内酰胺酶抑制剂可以作为ESBL-E感染治疗的替换性抗菌药物之一。
专家组成员(按姓氏拼音排列):蔡文伟(浙江省人民医院) 曹钰(四川大学华西医院) 曹照龙(北京大学人民医院) 曾红科(广东省人民医院) 柴艳芬(天津医科大学总医院) 陈兵(天津医科大学第二医院) 陈波(常熟市第一人民医院) 陈都(苏州大学第一医院) 陈旭岩(北京清华长庚医院) 陈玉国(山东大学齐鲁医院) 封启明(上海市第六人民医院) 顾伟(清华大学附属垂杨柳医院) 郭伟(首都医科大学附属北京天坛医院) 韩小彤(湖南省人民医院) 何小军(中华急诊医学杂志) 洪玉才(浙江大学邵逸夫医院) 黄曼(浙江大学医学院附属第二医院) 李春盛(首都医科大学附属北京友谊医院) 李小刚(中南大学湘雅医院) 李子龙(余姚市人民医院) 林兆奋(海军军医大学长征医院) 刘励军(苏州大学附属第二医院) 吕传柱(海南医学院) 马青变(北京大学第三医院) 马序竹(北京清华长庚医院) 马渝(重庆急救中心) 马岳峰(浙江大学医学院附属第二医院) 潘龙飞(西安交通大学第二附属医院) 潘曙明(上海交通大学医学院附属新华医院) 彭鹏(新疆医科大学附属第一医院) 秦历杰(河南省人民医院) 石松菁(福建省立医院) 宋振举(复旦大学附属中山医院) 孙同文(郑州大学第一附属医院) 童朝阳(复旦大学附属中山医院) 王军(南京鼓楼医院) 王立明(西安交通大学第二附属医院) 温晓红(湖州市第一人民医院) 肖永红(浙江大学医学院第一医院) 谢苗荣(首都医科大学附属北京友谊医院) 邢吉红(吉林大学第一医院) 许岚(湖州市中心医院) 许铁(徐州医科大学附属医院) 张国强(中日友好医院) 张泓(安徽医科大学附属第一医院) 张劲松(江苏省人民医院) 张睢扬(火箭军特色医疗中心) 张瑛琪(河北医科大学第一附属医院) 郑波(北京大学第一医院)
利益冲突 所有作者均声明不存在利益冲突。
| [1] | 张翠云, 柴舟, 杨芳. 急诊科患者医院感染的易感因素及病原菌分析[J]. 中华医院感染学杂志, 2014, 24(2): 380-382. DOI:10.3760/cma.j.issn.1671-0282.2016.04.007 |
| [2] | 王远芳, 康梅. 急诊科感染患者微生物标本送检及临床分离菌分布和耐药分析[J]. 中华急诊医学杂志, 2016, 25(4): 429-432. DOI:10.3760/cma.j.issn.1671-0282.2016.04.007 |
| [3] | Jernigan JA, Hatfield KM, Wolford H, et al. Multidrug-resistant bacterial infections in US hospitalized patients, 2012-2017[J]. N Engl J Med, 2020, 382(14): 1309-1319. DOI:10.1056/nejmoa1914433 |
| [4] | Nasher S, Alsharapy S, Al-Madhagi A, et al. Epidemiology of extended-spectrum β-lactamase producing Escherichia coli from hospital settings in Yemen[J]. J Infect Dev Ctries, 2018, 12(11): 953-959. DOI:10.3855/jidc.10560 |
| [5] | 《β‐内酰胺类抗菌药物/β‐内酰胺酶抑制剂复方制剂临床应用专家共识》编写专家组. β‐内酰胺类抗菌药物/β‐内酰胺酶抑制剂复方制剂临床应用专家共识(2020年版)[J]. 中华医学杂志, 2020, 100(10): 738-747. DOI:10.3760/cma.j.cn112137‐20200202‐00178 |
| [6] | Quan JJ, Zhao DD, Liu LL, et al. High prevalence of ESBL-producing Escherichia coli and Klebsiella pneumoniae in community-onset bloodstream infections in China[J]. J Antimicrob Chemother, 2017, 72(1): 273-280. DOI:10.1093/jac/dkw372 |
| [7] | 唐翔, 卓超, 徐英春. 全国多中心呼吸科住院患者下呼吸道和血液分离菌的构成及耐药性分析[J]. 中华结核和呼吸杂志, 2018, 41(4): 281-287. DOI:10.3760/cma.j.issn.1001-0939.2018.04.007 |
| [8] | Lin JN, Chen YH, Chang LL, et al. Clinical characteristics and outcomes of patients with extended-spectrum β-lactamase-producing bacteremias in the emergency department[J]. Intern Emerg Med, 2011, 6(6): 547-555. DOI:10.1007/s11739-011-0707-3 |
| [9] | 龙志伟, 廖彧, 林绍怡, 等. 2012-2014年医院急诊科感染患者病原菌分布与耐药性分析[J]. 中华医院感染学杂志, 2015, 25(3): 522-524. |
| [10] | 冒山林, 葛梓, 赵晖, 等. 急诊社区发生血流感染的病原菌分布特点及耐药性分析[J]. 中华危重病急救医学, 2019, 31(1): 67-72. DOI:10.3760/cma.j.issn.2095-4352.2019.01.014 |
| [11] | 周华, 李光辉, 陈佰义, 等. 中国产超广谱β-内酰胺酶肠杆菌科细菌感染应对策略专家共识[J]. 中华医学杂志, 2014, 94(24): 1847-1856. DOI:10.3760/cma.j.issn.0376-2491.2014.24.003 |
| [12] | Kim YJ, Jung SM, Kang J, et al. Risk factors for extended-spectrum beta-lactamase-producing Enterobacteriaceae infection causing septic shock in cancer patients with chemotherapy-induced febrile neutropenia[J]. Intern Emerg Med, 2019, 14(3): 433-440. DOI:10.1007/s11739-018-02015-x |
| [13] | 钟敏, 张凯, 黄湘宁, 等. 社区获得性血流感染产ESBLs大肠埃希菌与肺炎克雷伯菌流行情况及危险因素初步分析[J]. 中华微生物学和免疫学杂志, 2016, 36(2): 117-123. DOI:10.3760/cma.j.issn.0254-5101.2016.02.007 |
| [14] | 李晓军, 邓明惠, 张波, 等. 产超广谱β-内酰胺酶大肠埃希菌所致社区获得性血流感染特征分析[J]. 中华医学杂志, 2015, 95(26): 2084-2089. DOI:10.3760/cma.j.issn.0376-2491.2015.26.010 |
| [15] | Lee CH, Chu FY, Hsieh CC, et al. A simple scoring algorithm predicting extended-spectrum β-lactamase producers in adults with community-onset monomicrobial Enterobacteriaceae bacteremia: Matters of frequent emergency department users[J]. Medicine, 2017, 96(16): e6648. DOI:10.1097/MD.0000000000006648 |
| [16] | Bassetti M, Carnelutti A, Peghin M. Patient specific risk stratification for antimicrobial resistance and possible treatment strategies in gram-negative bacterial infections[J]. Expert Rev Anti Infect Ther, 2017, 15(1): 55-65. DOI:10.1080/14787210.2017.1251840 |
| [17] | Gutiérrez-Gutiérrez B, Rodríguez-Baño J. Current options for the treatment of infections due to extended-spectrum beta-lactamase-producing Enterobacteriaceae in different groups of patients[J]. Clin Microbiol Infect, 2019, 25(8): 932-942. DOI:10.1016/j.cmi.2019.03.030 |
| [18] | Palacios-Baena ZR, Gutiérrez-Gutiérrez B, De Cueto M, et al. Development and validation of the INCREMENT-ESBL predictive score for mortality in patients with bloodstream infections due to extended-spectrum-β-lactamase-producing Enterobacteriaceae[J]. J Antimicrob Chemother, 2017, 72(3): 906-913. DOI:10.1093/jac/dkw513 |
| [19] | Guilhaumou R, Benaboud S, Bennis Y, et al. Optimization of the treatment with beta-lactam antibiotics in critically ill patients-guidelines from the French Society of Pharmacology and Therapeutics (Société Française de Pharmacologie et Thérapeutique-SFPT) and the French Society of Anaesthesia and Intensive Care Medicine (Société Française d'Anesthésie et Réanimation-SFAR)[J]. Crit Care, 2019, 23(1): 104. DOI:10.1186/s13054-019-2378-9 |
| [20] | Corrêa RA, Costa AN, Lundgren F, et al. 2018 recommendations for the management of community acquired pneumonia[J]. J Bras Pneumol, 2018, 44(5): 405-423. DOI:10.1590/S1806-37562018000000130 |
| [21] | Ma XJ, Wu YH, Li LY, et al. First multicenter study on multidrug resistant bacteria carriage in Chinese Icus[J]. BMC Infect Dis, 2015, 15: 358. DOI:10.1186/s12879-015-1105-7 |
| [22] | 中华医学会外科学分会外科感染与重症医学学组, 中国医师协会外科医师分会肠瘘外科医师专业委员会. 中国腹腔感染诊治指南(2020版)[J]. 中国实用外科杂志, 2020, 40(1): 38-53. DOI:10.3760/cma.j.cn112137‐20200202‐00178 |
| [23] | Wong G, Taccone F, Villois P, et al. Β-Lactam pharmacodynamics in Gram-negative bloodstream infections in the critically ill[J]. J Antimicrob Chemother, 2020, 75(2): 429-433. DOI:10.1093/jac/dkz437 |
| [24] | 中国医疗保健国际交流促进会急诊医学分会, 中华医学会急诊医学分会, 中国医师协会急诊医师分会, 等. 中国脓毒症早期预防与阻断急诊专家共识[J]. 中华急诊医学杂志, 2020, 29(07): 885-895. DOI:10.3760/cma.j.issn.1671-0282.2020.07.001 |
| [25] | Gudiol C, Cuervo G, Carratalà J. Optimizing therapy of bloodstream infection due to extended-spectrum β-lactamase-producing Enterobacteriaceae[J]. Curr Opin Crit Care, 2019, 25(5): 438-448. DOI:10.1097/MCC.0000000000000646 |
| [26] | Tamma PD, Aitken SL, Bonomo RA, et al. Infectious diseases society of America antimicrobial resistant treatment guidance: gram-negative bacterial infections[J]. Clin Infect Dis, 2020: 1478. DOI:10.1093/cid/ciaa1478 |
| [27] | Rodríguez-Baño J, Gutiérrez-Gutiérrez B, Machuca I, et al. Treatment of infections caused by extended-spectrum-beta-lactamase-, AmpC-, and carbapenemase-producing Enterobacteriaceae[J]. Clin Microbiol Rev, 2018, 31(2): e00079-e00017. DOI:10.1128/CMR.00079-17 |
| [28] | Crass RL, Rodvold KA, Mueller BA, et al. Renal dosing of antibiotics: are we jumping the gun?[J]. Clin Infect Dis, 2019, 68(9): 1596-1602. DOI:10.1093/cid/ciy790 |
| [29] | Li JG, Lovern M, Riccobene T, et al. Considerations in the selection of renal dosage adjustments for patients with serious infections and lessons learned from the development of ceftazidime-avibactam[J]. Antimicrob Agents Chemother, 2020, 64(4): e02105-e02119. DOI:10.1128/AAC.02105-19 |
| [30] | Carrié C, Chadefaux G, Sauvage N, et al. Increased β-Lactams dosing regimens improve clinical outcome in critically ill patients with augmented renal clearance treated for a first episode of hospital or ventilator-acquired pneumonia: a before and after study[J]. Crit Care, 2019, 23: 379. DOI:10.1186/s13054-019-2621-4 |
| [31] | De Backer D, Cecconi M, Lipman J, et al. Challenges in the management of septic shock: a narrative review[J]. Intensive Care Med, 2019, 45(4): 420-433. DOI:10.1007/s00134-019-05544-x |
| [32] | Vardakas KZ, Voulgaris GL, Maliaros A, et al. Prolonged versus short-term intravenous infusion of antipseudomonal β-lactams for patients with Sepsis: a systematic review and meta-analysis of randomised trials[J]. Lancet Infect Dis, 2018, 18(1): 108-120. DOI:10.1016/S1473-3099(17)30615-1 |
| [33] | Heffernan AJ, Sime FB, Taccone FS, et al. How to optimize antibiotic pharmacokinetic/pharmacodynamics for Gram-negative infections in critically ill patients[J]. Curr Opin Infect Dis, 2018, 31(6): 555-565. DOI:10.1097/QCO.0000000000000494 |
| [34] | Annoni F, Grimaldi D, Taccone FS. Individualized antibiotic therapy in the treatment of severe infections[J]. Expert Rev Anti Infect Ther, 2020, 18(1): 27-35. DOI:10.1080/14787210.2020.1696192 |
| [35] | Rhodes A, Evans LE, Alhazzani W, et al. Surviving sepsis campaign: international guidelines for management of sepsis and septic shock: 2016[J]. Intensive Care Med, 2017, 43(3): 304-377. DOI:10.1007/s00134-017-4683-6 |
| [36] | Chastre J, Wolff M, Fagon JY, et al. Comparison of 8 vs 15 days of antibiotic therapy for ventilator-associated pneumonia in adults: a randomized trial[J]. JAMA, 2003, 290(19): 2588-2598. DOI:10.1001/jama.290.19.2588 |
| [37] | Metlay JP, Waterer GW, Long AC, et al. Diagnosis and treatment of adults with community-acquired pneumonia. An official clinical practice guideline of the American thoracic society and infectious diseases society of America[J]. Am J Respir Crit Care Med, 2019, 200(7): e45-e67. DOI:10.1164/rccm.201908-1581ST |
| [38] | Busch LM, Kadri SS. Antimicrobial treatment duration in Sepsis and serious infections[J]. J Infect Dis, 2020, 222(Supplement_2): S142-S155. DOI:10.1093/infdis/jiaa247 |
| [39] | Yahav D, Franceschini E, Koppel F, et al. Seven versus 14 days of antibiotic therapy for uncomplicated gram-negative bacteremia: a noninferiority randomized controlled trial[J]. Clin Infect Dis, 2019, 69(7): 1091-1098. DOI:10.1093/cid/ciy1054 |
| [40] | Sawyer RG, Claridge JA, Nathens AB, et al. Trial of short-course antimicrobial therapy for intraabdominal infection[J]. N Engl J Med, 2015, 372(21): 1996-2005. DOI:10.1056/NEJMoa1411162 |
| [41] | Singer M, Deutschman CS, Seymour CW, et al. The third international consensus definitions for Sepsis and septic shock (Sepsis-3)[J]. JAMA, 2016, 315(8): 801-810. DOI:10.1001/jama.2016.0287 |
| [42] | Pilmis B, Jullien V, Tabah A, et al. Piperacillin-tazobactam as alternative to carbapenems for ICU patients[J]. Ann Intensive Care, 2017, 7(1): 113. DOI:10.1186/s13613-017-0334-x |
| [43] | Pana ZD, Zaoutis T. Treatment of extended-spectrum β-lactamase-producing Enterobacteriaceae (ESBLs) infections: what have we learned until now?[J]. F1000Res, 2018, 7: F1000 Faculty Rev-F1000 Faculty1347. DOI:10.12688/f1000research.14822.1 |
| [44] | Nasir N, Ahmed S, Razi S, et al. Risk factors for mortality of patients with ceftriaxone resistant E. coli bacteremia receiving carbapenem versus beta lactam/beta lactamase inhibitor therapy[J]. BMC Res Notes, 2019, 12(1): 611. DOI:10.1186/s13104-019-4648-7 |
| [45] | Kaye KS, Rice LB, Dane AL, et al. Fosfomycin for injection (ZTI-01) versus piperacillin-tazobactam for the treatment of complicated urinary tract infection including acute pyelonephritis: ZEUS, A phase 2/3 randomized trial[J]. Clin Infect Dis, 2019, 69(12): 2045-2056. DOI:10.1093/cid/ciz181 |
 2020, Vol. 29
2020, Vol. 29




