2 浙江大学医学院附属第二医院烧伤与创面修复科, 杭州 310009
脓毒症是机体对感染导致炎症反应失调引起的生理、生化异常的临床综合征[1]。脓毒症病死率高,2015年国家疾病预防控制中心数据显示,每100 000人有66.7例因脓毒症死亡,估计全年全国有1 025 997例患者死于脓毒症[2]。
烧伤脓毒症是脓毒症的特殊类型。皮肤屏障破坏,免疫功能紊乱,肠道菌群移位等因素使得烧伤患者极易发生脓毒症,尤其是烧伤面积 > 20%全身体表面积(total body surface Area, TBSA)的患者[3]。烧伤脓毒症增加围手术期风险,诱发多器官功能衰竭(multiple organ dysfunction syndrome,MODS),延长患者住院时间,增加住院费用和病死率[3-4]。早期诊断烧伤脓毒症能指导补液和抗生素决策,使患者获益。烧伤脓毒症因特殊的高代谢反应,异常免疫状态,与主流脓毒症在定义、诊断、治疗存在较大区别[3]。烧伤应激导致的体温和心率增高,免疫紊乱导致的感染指标增高,很容易误诊为脓毒症。烧伤脓毒症主要通过2007年发布的ABA标准进行诊断[5]。自2016年脓毒症3.0标准推出至今,围绕着脓毒症3.0的争议从未停止[1]。脓毒症3.0是否适用于烧伤脓毒症诊断,目前尚无答案。本文将结合特重度烧伤患者展开的前瞻观察性研究结果,围绕烧伤脓毒症诊断标准差异进行论述。
1 脓毒症和烧伤脓毒症诊断标准1991年脓毒症1.0标准首次被提出,全身炎症反应综合征(systemic inflammatory response syndrome, SIRS)概念深入人心[6]。在感染的基础上,临床医师使用SIRS标准,通过体温、心率、呼吸频率、白细胞计数这4个指标快速识别脓毒症[6],见表一。脓毒症1.0标准突出缺点是特异性低,应激状态满足SIRS标准是容易的,包括创伤、烧伤、放化疗及入住重症监护室(intensive care unit, ICU)。其次,脓毒症1.0诊断标准无法指导治疗,评估预后。随后,国际学术机构在2001年发布了脓毒症2.0标准[7],在脓毒症1.0基础上增加了21条诊断标准,涵盖了炎症反应、血流动力学、器官功能障碍和组织灌注等相关指标。脓毒症2.0沿用了SIRS标准,而且包含指标复杂, 临床使用少。
| 脓毒症1.0标准[6] | 脓毒症2.0标准[7] | 美国烧伤协会(ABA)标准[5] | 脓毒症3.0标准[1] |
| 1992年 | 2001年 | 2007年 | 2016年 |
| 确诊或疑似感染+SIRS标准 | 脓毒症1.0标准+21条诊断标准 | 感染+6个改良指标(感染包括培养、病理、抗生素反应) | 确诊或疑似感染+SOFA标准 |
| SIRS标准(满足2条) | 21条诊断标准(满足2条) | 6个改良指标(满足3条) | SOFA评分(评分增加2分以上) |
| ①体温 < 36℃或 > 38℃ | ①一般指标7条(体温、心率、呼吸、精神状态、容量负荷、血糖) | ①体温 > 39℃或 < 36.5℃ | ①格拉斯哥昏迷评分 |
| ②心率 > 90次/min | ②炎症指标5条(白细胞、C-反应蛋白,降钙素原) | ②心率 > 110次/min | ②平均动脉压和血管活性药物剂量 |
| ③呼吸频率 > 20次/min或二氧化碳分压 < 32 mmHg | ③血流动力学指标3条(血压、静脉血氧饱和度、心排指数) | ③呼吸 > 25次/min或机械通气 > 12 L/min | ③氧合指数、是否机械通气 |
| ④白细胞 < 4 000/mm3或 > 12000/mm3 | ④器官功能指标7条(氧合指数、肌酐、尿量、凝血功能、肠梗阻、血小板、胆红素) | ④血小板计数 < 10 000/mm3 | ④血小板计数 |
| ⑤组织灌注指标2条(乳酸、毛细血管充盈时间) | ⑤高血糖状态:无糖尿病基础上,血糖 > 11.1 mmol/L或出现胰岛素抵抗 | ⑤肌酐和24 h尿量 | |
| ⑥肠内营养不耐受超过24 h,包括腹胀、腹泻、胃潴留 | ⑥总胆红素 |
烧伤患者具有特殊的高代谢状态,常见的无菌性炎症反应,增加了SIRS的假阳性率[7]。所以在早期脓毒症研究和指南中,烧伤患者通常被排除在外[7-8]。在这样的背景下,2007年美国烧伤烧伤协会(American Burn Association,ABA)在SIRS的基础上删除了白细胞计数,重新确定生命体征阈值并增加了血小板、血糖、肠内营养不耐受的临床指标,组成了烧伤脓毒症的诊断标准[5],见表一。ABA标准对感染也提出了明确定义,涵盖了培养、病理和抗生素疗效三个方面[5]。ABA标准接受度高,但有部分研究者提出新的预测因素,Mann-Salinas等研究者采用ABA标准和血培养结果匹配进行脓毒症诊断,对采集血培养前72 h的各项指标构建预测模型。该研究发现了6项预测指标,分别为心率 > 130次/min,平均动脉压 < 60 mmHg,碱剩余 < -6 mEq/L,体温 < 36℃,使用血管活性药物和血糖 > 8.33 mmol/L[9]。该模型预测脓毒症患者的接受者操作特征曲线下面积(area under the receiver operating characteristic,AUROC)优于ABA诊断标准[9]。该研究发现无明显感染的稳定患者,SIRS标准阳性仍有95% [9]。但该研究只有59例样本,构建模型存在偶然性。另外基于血培养的分组也值得探讨,菌血症不能代表脓毒症。
基于SIRS标准的脓毒症1.0,脓毒症2.0和ABA标准,存在SIRS标准固有缺陷。2016年,脓毒症3.0标准摒弃了SIRS,引入序贯性器官功能障碍评分(sequential organ failure assessment,SOFA),定义脓毒症为宿主对感染的反应失调导致危及生命的器官功能障碍,即SOFA评分增加2分或以上[1],见表一。SOFA评分包括6项代表六大脏器的指标,格拉斯哥昏迷评分(glasgow coma scale,GCS)、平均动脉压和血管活性药物、氧合指数和机械通气、血小板、肌酐和尿量、胆红素[1]。脓毒症3.0简化了此前提出的21条标准,准确度并未下降。Shankar-Hari等[10]学者通过英国ICU数据库,发现197 724例患者符合脓毒症2.0标准,197 142例符合脓毒症3.0标准,重叠率为92%。脓毒症3.0标准删繁就简,提高了特异度,临床应用更广,但新标准并未得到广泛认同,反对观点主要为:①脓毒症救治高度依赖时间,新标准强调器官功能障碍和不良预后,忽视早期诊断和干预,一旦患者出现器官功能障碍,错失了最佳可逆性时期[11-12]。②缺乏病理生理、遗传学等依据和前瞻性循证医学证据,涉及对比的前瞻性研究缺乏伦理支持[11-12]。③可疑感染定义含糊,界限不清[12]。
值得注意的是,脓毒症3.0并未提及亚组,烧伤患者在验证SOFA的数据库中占比很小,或者被排除在外[1]。故而烧伤脓毒症采用脓毒症3.0标准是否合适,需要进一步探讨。
2 特重度烧伤患者前瞻观察性研究本中心收治15名油罐车爆炸导致的特重度烧伤患者,设计并进行前瞻观察性研究(伦理编号浙大二院2020-652)。烧伤脓毒症诊断通过多学科讨论综合判定(烧伤科、重症医学科、感染科、抗生素管理委员会、院外专家)。培养、病理、抗生素、SOFA评分和ABA标准指标通过综合ICU数据库自动化采集。患者病情好转后再次出现脓毒症且时间超过5 d以上定义为新发脓毒症。脓毒症3.0标准和ABA标准判断日期存在差异,本批患者定义实际诊断前后2 d内阳性定义为同一次脓毒症判断,与实际诊断匹配。实际诊断前2 d内阳性定义为提前诊断,后2 d内的阳性定义为延迟诊断。所有数据分析通过SPSS 25(IBM,USA)完成。
15例烧伤患者年龄平均66岁,60%为老年人(> 65岁)。85%TBSA以上烧伤患者11人(78.6%)。患者APACHE II评分平均为26分,入科SOFA评分平均为11分。脓毒症来源主要为创面(70.5%),其次是胃肠道(27.1%),见表 2。
| 例数 | 15 |
| 性别(男性,%) | 13(86.7%) |
| 年龄 | 66±16 |
| 老年人(> 65岁)(n,%) | 9(60%) |
| 身体质量指数(BMI) | 24.05±3.09 |
| 总烧伤面积(TBSA) | 85%±14% |
| 超过85% TBSA(n,%) | 11(78.6%) |
| APACHE II评分 | 26±5 |
| 入科时SOFA评分 | 11±2 |
| 手术(次) | 97 |
| 诊断脓毒症(次) | 85 |
| 人均脓毒症次数 | 5.6±2.3 |
| 脓毒症可能来源(n,%) | |
| 创面 | 60(70.5%) |
| 胃肠道 | 23(27.1%) |
| 肺部 | 2(2.4%) |
| 血培养阳性(次) | 48(56.5%) |
| 宏基因测序阳性(次) | 24(28.2%) |
| 感染性休克(人) | 10(66.7%) |
| 28 d存活率 | 15(100%) |
| 90 d存活率 | 9(60%) |
15例患者总ICU住院时间为954 d,3个月观察期间诊断脓毒症85次,每位患者平均发生5次脓毒症,符合ABA烧伤脓毒症诊断标准共86次,符合脓毒症3.0标准为79次。与ABA标准相比,脓毒症3.0标准在准确率(92.10%和82.74%)、灵敏度(79.74%和51.16%)、特异度(94.52%和89.62%),AUROC(0.85和0.71)等方面更好,详见图一。尽管脓毒症3.0在提前诊断上并不优于ABA标准(21.74%和18.18%),但延迟诊断比例更低(15.20%和36.36%),见表 3。
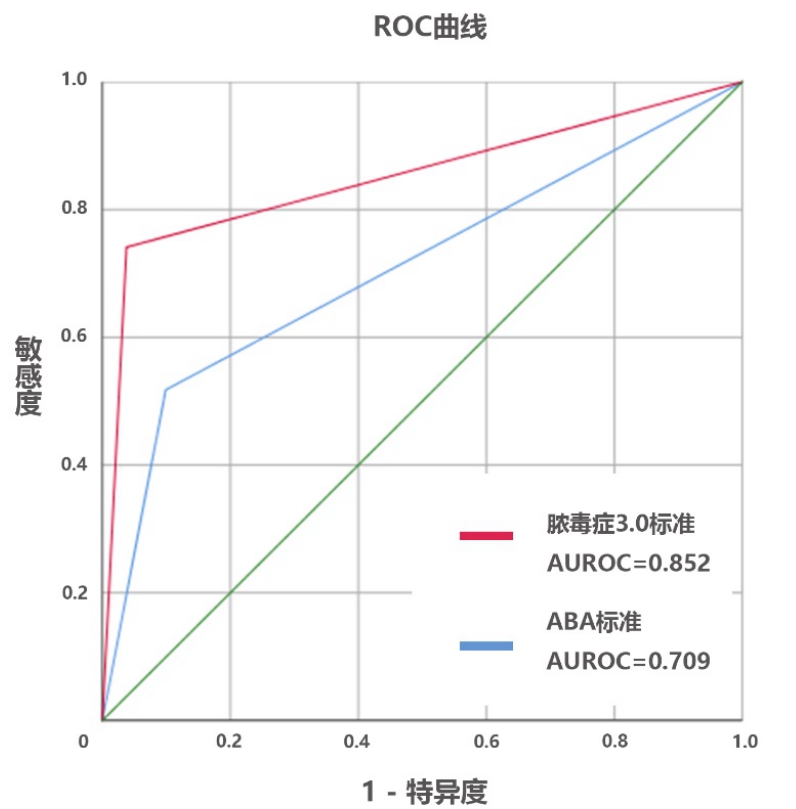
|
| 图 1 ABA标准和脓毒症3.0标准诊断ROC曲线 |
|
|
| 指标 | ABA标准 | 脓毒症3.0标准 |
| 诊断数 | 86 | 79 |
| 实际诊断数 | 85 | 85 |
| 与实际诊断匹配(n,%) | 44(51.76) | 69(81.18) |
| 提前诊断(n,%) | 8(18.18) | 15(21.74) |
| 延迟诊断(n,%) | 16(36.36) | 12(15.20) |
| 准确率(%) | 82.74 | 92.10 |
| 敏感性(%) | 51.16 | 79.74 |
| 特异度(%) | 89.62 | 94.52 |
| 阳性预测值(%) | 51.76 | 74.12 |
| 阴性预测值(%) | 89.39 | 96.20 |
| AUC | 0.706 | 0.850 |
笔者纳入脓毒症诊断当天及前3天临床数据,包括SOFA指标、ABA诊断指标、感染指标等进行对比,发现SOFA评分增加超过2分,氧合指数,降钙素原和白介素-6差异有统计学意义,而ABA标准包含的各项指标并差异无统计学意义。多因素分析中,SOFA评分增加超过2分(P=0.004),降钙素原(P=0.009)和白介素-6(P=0.02)差异有统计学意义,见表 4。
| 指标 | 脓毒症诊断当天指标 N=85 |
诊断前3 d指标 N=255 |
P值 (单因素分析) |
P值 (多因素分析) |
OR(95%CI) |
| 体温 | 37.13±1.17 | 37.01±1.20 | 0.415 | ||
| 心率 | 103±14 | 104±15 | 0.832 | ||
| 呼吸 | 24±6 | 23±6 | 0.186 | ||
| 平均动脉压 | 84±12 | 85±12 | 0.465 | ||
| 去甲肾上腺素剂量 | 0.20±0.5 | 0.13±0.4 | 0.270 | ||
| 白细胞计数 | 11.90±6.81 | 11.55±6.50 | 0.682 | ||
| 血小板计数 | 172.13±105.63 | 176.18±110.85 | 0.770 | ||
| 血糖 | 9.62±2.83 | 9.26±2.72 | 0.309 | ||
| 氧合指数 | 274±109 | 315±118 | 0.005 | ||
| 肌酐 | 82.36±60.00 | 85.38±66.80 | 0.712 | ||
| 总胆红素 | 49.79±32.79 | 48.84±35.83 | 0.919 | ||
| ABA诊断标准(n,%) | |||||
| 体温 | 46(54.11) | 128(50.20) | 0.531 | ||
| 心率 | 67(78.82) | 209(81.96) | 0.522 | ||
| 呼吸频率 | 15(17.65) | 30(11.76) | 0.166 | ||
| 血小板技术 | 31(36.47) | 81(31.76) | 0.427 | ||
| 血糖 | 36(42.35) | 96(37.65) | 0.441 | ||
| 胃肠功能障碍 | 30(35.29) | 70(27.45% | 0.168 | ||
| SOFA评分(单项) | |||||
| 氧合指数 | 2.64(2.45~2.84) | 2.19(2.04~2.33) | 0.001 | ||
| 机械通气 | 61(71.76%) | 157(61.57%) | 0.09 | ||
| 血管活性药物剂量 | 1.40(1.13~1.68) | 1.43(1.28~1.59) | 0.769 | ||
| 胆红素 | 1.06(0.79~1.34) | 0.91(0.75~1.07) | 0.249 | ||
| 血小板 | 1.01(0.76~1.27) | 0.89(0.75~1.03) | 0.449 | ||
| 肌酐及尿量 | 0.98(0.68~1.27) | 0.98(0.81~1.15) | 0.806 | ||
| GCS评分 | 12.10(11.41~12.78) | 11.97(11.56~12.38) | 0.731 | ||
| SOFA | 9.09 | 7.91 | 0.141 | ||
| △SOFA > 2分(n,%) | 66(77.65) | 24(9.41) | 0.000 | 0.004 | 3.43(2.45-4.64) |
| 感染指标 | |||||
| CRP | 135.93±67.18 | 137.48±68.20 | 0.856 | ||
| PCT | 6.14±6.10 | 3.82±3.10 | 0.002 | 0.009 | 1.28(1.02-1.44) |
| 肝素结合蛋白 | 64.09±59.90 | 61.55±60.06 | 0.568 | ||
| 白介素-6 | 6179.54±1106.44 | 718.38±395.59 | 0.019 | 0.02 | 1.03(1.00-1.08) |
| 乳酸 | 2.91±3.71 | 2.81±3. | 0.816 | ||
ABA标准从2007年发布以来,被广泛用于烧伤脓毒症的诊断和研究中。ABA标准存在特异度低、严重程度和预后评估能力弱的缺点。Mann-Salinas等[13]学者研究发现ABA标准提高了脓毒症的假阳性率,而且预测脓毒症的作用仅限于血培养前一天[9]。脓毒症3.0标准已发布4年,在烧伤领域影响有限。Yoon等[13]学者通过对比1185例烧伤患者,平均年龄为49岁,平均烧伤TBSA为33.4%,符合ABA标准的患者为565人,符合脓毒症3.0标准为809人,符合脓毒症1.0标准为812人。在脓毒症诊断效能方面,ABA标准优于脓毒症3.0标准和1.0标准(AUROC分别为0.732,0.629和0.622)。在脓毒性休克诊断效能上,脓毒症3.0标准优于ABA标准,优于脓毒症1.0标准(AUROC分别为0.798,0.782和0.749)[13]。此外,该研究通过决策树模型发现将SOFA评分阈值设定在6分,拥有最好的诊断效能,准确度高达86%[13]。该研究证明ABA标准在脓毒症诊断上优于脓毒症3.0标准,但在更为严重的脓毒症休克上,脓毒症3.0表现更出众。
从选择的临床指标而言,ABA标准基于SIRS评分并增加了具有烧伤特征的3个评分,包括血小板计数、高血糖状态、胃肠功能障碍[5]。本研究患者年龄平均66岁,烧伤TBSA平均达85%。老年特重度烧伤应激反应强烈,生命体征波动更大,以生命体征为主要指标误判率增加,提高了本研究ABA标准的假阳性率。血小板的预测价值在脓毒症标准中充分展现。尽管高血糖状态在ABA标准中至关重要,但在普通脓毒症中的影响尚无定论,尤其是应激性高血糖缺乏特异性,另外有研究发现低血糖对脓毒症更有指导意义,这可能与肝功能异常导致糖元合成异常相关,在SOFA中与胆红素存在共线性[14]。另外,血糖变异度而不是高血糖状态,可能是一个脓毒症潜在指标[15]。肠内营养不耐受标准不统一,测量困难,尚未被用于诊断脓毒症。尽管烧伤患者神经系统问题并不一定源自脓毒症,但SOFA评分在神经系统的评估比ABA标准多[1]。基于SOFA评分的脓毒症3.0标准主要强调脏器功能损害,较好的区分患者严重程度和预测预后。但SOFA采用的评分具有普适性,是否适合烧伤患者还需要更多研究验证。
从疾病严重程度而言,笔者发现脓毒症3.0标准比ABA标准更适合严重的烧伤患者。本研究患者多为老年人,大面积烧伤需要成倍的补液量。早期复苏和序贯补液治疗中诱发心衰和肺水肿可能性更大[16]。而限制性补液可能导致血管活性药物使用频率增加,因为老年人血管弹性下降,血压下降更明显。老年人基础肾脏功能退化,急性肾损伤发生率高[16]。这些并发症导致SOFA评分的显著增高,导致了本研究平均SOFA高达8分。Yoon的研究中,诊断脓毒性休克的患者烧伤TBSA更高,使用脓毒症3.0诊断效能优于ABA标准[13]。该研究认为需提高SOFA评分阈值到6分,具有更好的诊断效能[13],似乎也能说明对于老年特重度烧伤,更容易出现脏器功能衰竭的这部分患者,选择脓毒症3.0更为合适。
从感染定义而言,感染判断困难,绝大部分依靠主诊医师的临床经验。所以脓毒症3.0对感染的定义是含糊的。而ABA标准对感染有更明确定义,包括了培养阳性、病理明确和抗生素临床反应。相对而言病理诊断流程复杂,缓慢,依赖于病理科医生专业水平。抗生素临床反应观察时间长,可能需要2~3 d才能确定。所以目前感染主要取决于培养。但目前临床现状:⑴培养阳性率不高,真菌培养困难,病毒无法培养,宏基因测序价格昂贵。⑵微生物培养阳性结果需鉴别定植或感染,尤其创面和胃肠道。⑶微生物产物介导脓毒症定义不清,病理机制不清;⑷风湿免疫性疾病、肿瘤等介导的无菌性炎症尚未确定。目前有研究发现细菌内毒素和肿瘤介导的炎症反应模式识别受体相同,即使是分子层面可能也无法区分炎症是否由微生物介导[17]。Hogan等[18]分析196例符合ABA标准的患者后仅发现心率和体温与菌血症显著相关,在严重烧伤患者中,ABA标准阳性与菌血症无显著相关性,AUROC也仅0.638。本研究中患者普遍缺乏自体供皮区,有效创面覆盖有限,创面培养持续阳性,医生更容易误判感染发生,进一步导致ABA标准准确率下降。所以是否需要更明确的感染定义依然是值得探讨的话题。
从临床适用性而言,ABA标准以生命体征结合生化指标,除胃肠功能紊乱指标相对主观且判断困难外,其余指标均容易获得,操作性强,在烧伤普通病房和ICU均能使用。而SOFA评分更适合ICU监护环境,GCS评分,氧合指数都是复合型指标,且SOFA评分每项评估0~4分,评分系统复杂,适用性欠佳。尽管qSOFA可能适合烧伤普通病房,但还需要进一步研究。
4 未来展望与结语宏观而言,ABA标准和脓毒症3.0标准,都是以各种预测指标为基础的诊断模型。伴随着脓毒症3.0的更新,沿用了13年的ABA标准是否更新还未可知。
但近年来,烧伤脓毒症风险预测指标研究很多[19]。PCT作为早期脓毒症生物标志物的性能优于其他生物标志物,荟萃分析显示PCT的特异度为79%,敏感度为77%[20]。Cabral等[21]学者分析了150名烧伤脓毒症患者的降钙素原,白细胞和血小板计数,凝血酶原,D-二聚体,C反应蛋白,血乳酸和体温,最终发现降钙素原是早期研究败血症的最佳生物标志物。Stephan Hager等[22]学者通过分析94例烧伤患者发现白介素-6水平与烧伤严重程度和不良预后相关。本研究也发现了类似规律,降钙素原和白介素-6可能预示特重度烧伤患者脓毒症发生。其他已有研究基础的潜在指标包括心房脑钠肽前体和血管阻力指数[23],TNF-α,血管加压素,血栓调节蛋白,细胞间黏附分子,热休克蛋白等[24]。此外,通过基因表达特征、基因组差异、非编码RNA标记、表观遗传标记发现了大量烧伤脓毒症潜在标记物[24]。
诊断模型方面,伴随着人工智能的热潮,未来烧伤脓毒症可通过更大样本,更好的机器学习构建更稳定的预测模型。基于人工智能的脓毒症预测模型发展迅速,已有130余个脓毒症预测模型被开发,能够更早的预测重症监护室、急诊科和普通病房的脓毒症发生[25]。Megan A Rech等学者汇总了407名严重烧伤患者后根据ABA标准和SOFA标准构建了一套马丁算法,准确度达到86.0%,AUROC达0.81[26]。Tran等[27]学者通过分析211名严重烧伤脓毒症患者,通过K-近邻算法构建了烧伤脓毒症预测模型,准确率达90%,AUROC达0.96。尽管两个研究样本量少且可能存在过拟合现象,但提供了烧伤脓毒症早期诊断的新思路。
综上所述,ABA标准提供了简洁,可靠的指标诊断烧伤脓毒症患者,而脓毒症3.0标准可能更适合有潜在脏器功能障碍风险的烧伤患者。在未来,借助新型预测指标和人工智能算法,烧伤脓毒症将走入个体化诊断的全新道路。
利益冲突 所有作者均声明不存在利益冲突。
| [1] | Singer M, Deutschman CS, Seymour CW, et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3)[J]. JAMA, 2016, 315(8): 801-810. DOI:10.1001/jama.2016.0287 |
| [2] | The China Critical Care Clinical Trials Group (CCCCTG). Sepsis-related mortality in China: a descriptive analysis[J]. Intensive Care Med, 2018, 44(7): 1071-1080. DOI:10.1007/s00134-018-5203-z |
| [3] | Stanojcic M, Vinaik R, Jeschke MG. Status and Challenges of Predicting and Diagnosing Sepsis in Burn Patients[J]. Surg Infect (Larchmt), 2018, 19(2): 168-175. DOI:10.1089/sur.2017.288 |
| [4] | Rech MA, Mosier MJ, McConkey K, et al. Outcomes in Burn-Injured Patients Who Develop Sepsis[J]. J Burn Care Res, 2019, 40(3): 269-273. DOI:10.1093/jbcr/irz017 |
| [5] | Greenhalgh DG, Saffle JR, Holmes JHt, et al. American Burn Association consensus conference to define sepsis and infection in burns[J]. J Burn Care Res, 2007, 28(6): 776-790. DOI:10.1097/BCR.0b013e3181599bc9 |
| [6] | Bone RC, Balk RA, Cerra FB, et al. Definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis. The ACCP/SCCM Consensus Conference Committee. American College of Chest Physicians/Society of Critical Care Medicine[J]. Chest, 1992, 101(6): 1644-1655. DOI:10.1378/chest.101.6.1644 |
| [7] | Levy MM, Fink MP, Marshall JC, et al. 2001 SCCM/ESICM/ACCP/ATS/SIS International Sepsis Definitions Conference[J]. Crit Care Med, 2003, 31(4): 1250-1256. DOI:10.1097/01.CCM.0000050454.01978.3B |
| [8] | Kaukonen KM, Bailey M, Pilcher D, et al. Systemic inflammatory response syndrome criteria in defining severe sepsis[J]. N Engl J Med, 2015, 372(17): 1629-1638. DOI:10.1056/NEJMoa1415236 |
| [9] | Mann-Salinas EA, Baun MM, Meininger JC, et al. Novel predictors of Sepsis outperform the American burn association Sepsis criteria in the burn intensive care unit patient[J]. J Burn Care Res, 2013, 34(1): 31-43. DOI:10.1097/bcr.0b013e31826450b5 |
| [10] | Shankar-Hari M, Harrison DA, Rubenfeld GD, et al. Epidemiology of sepsis and septic shock in critical care units: comparison between sepsis-2 and sepsis-3 populations using a national critical care database[J]. Br J Anaesth, 2017, 119(4): 626-636. DOI:10.1093/bja/aex234 |
| [11] | Simpson SQ. New Sepsis criteria[J]. Chest, 2016, 149(5): 1117-1118. DOI:10.1016/j.chest.2016.02.653 |
| [12] | Sprung CL, Schein RMH, Balk RA. The new Sepsis consensus definitions: the good, the bad and the ugly[J]. Intensive Care Med, 2016, 42(12): 2024-2026. DOI:10.1007/s00134-016-4604-0 |
| [13] | Yoon J, Kym D, Hur J, et al. Comparative usefulness of Sepsis-3, burn Sepsis, and conventional Sepsis criteria in patients with major burns[J]. Crit Care Med, 2018, 46(7): e656-e662. DOI:10.1097/ccm.0000000000003144 |
| [15] | Perez-Calatayud AA, Guillen-Vidana A, Fraire-Felix IS, et al. Metabolic control in the critically ill patient an update: hyperglycemia, glucose variability hypoglycemia and relative hypoglycemia[J]. Cir Cir, 2017, 85(1): 93-100. DOI:10.1016/j.circir.2016.10.026 |
| [16] | Jeschke MG, Patsouris D, Stanojcic M, et al. Pathophysiologic Response to Burns in the Elderly[J]. Ebio Medicine, 2015, 2(10): 1536-1548. DOI:10.1016/j.ebiom.2015.07.040 |
| [17] | Chen GY, Nunez G. Sterile inflammation: sensing and reacting to damage[J]. Nat Rev Immunol, 2010, 10(12): 826-837. DOI:10.1038/nri2873 |
| [18] | Hogan BK, Wolf SE, Hospenthal DR, et al. Correlation of American Burn Association sepsis criteria with the presence of bacteremia in burned patients admitted to the intensive care unit[J]. J Burn Care Res, 2012, 33(3): 371-378. DOI:10.1097/BCR.0b013e3182331e87 |
| [19] | Riedel S. Predicting Bacterial Versus Viral Infection, or None of the Above: Current and Future Prospects of Biomarkers[J]. Clin Lab Med, 2019, 39(3): 453-472. DOI:10.1016/j.cll.2019.05.011 |
| [20] | Wacker C, Prkno A, Brunkhorst FM, Schlattmann P. Procalcitonin as a diagnostic marker for sepsis: a systematic review and meta-analysis[J]. Lancet Infect Dise, 2013, 13(5): 426-435. DOI:10.1016/S1473-3099(12)70323-7 |
| [21] | Cabral L, Afreixo V, Santos F, et al. Procalcitonin for the early diagnosis of Sepsis in burn patients: a retrospective study[J]. Burns, 2017, 43(7): 1427-1434. DOI:10.1016/j.burns.2017.03.026 |
| [22] | Hager S, Foldenauer AC, Rennekampff HO, et al. Interleukin-6 Serum Levels Correlate With Severity of Burn Injury but Not With Gender[J]. J Burn Care Res, 2018, 39(3): 379-386. DOI:10.1097/BCR.0000000000000604 |
| [23] | Paratz JD, Lipman J, Boots RJ, et al. A new marker of sepsis post burn injury?[J]. Crit Care Med, 2014, 42(9): 2029-2036. DOI:10.1097/CCM.0000000000000400 |
| [24] | Munoz B, Suarez-Sanchez R, Hernandez-Hernandez O, et al. From traditional biochemical signals to molecular markers for detection of sepsis after burn injuries[J]. Burns, 2019, 45(1): 16-31. DOI:10.1016/j.burns.2018.04.016 |
| [25] | Fleuren LM, Klausch TLT, Zwager CL, et al. Machine learning for the prediction of sepsis: a systematic review and meta-analysis of diagnostic test accuracy[J]. Intensive Care Med, 2020, 46(3): 383-400. DOI:10.1007/s00134-019-05872-y |
| [26] | Rech MA, Mosier MJ, Zelisko S, et al. Comparison of Automated Methods Versus the American Burn Association Sepsis Definition to Identify Sepsis and Sepsis With Organ Dysfunction/Septic Shock in Burn-Injured Adults[J]. J Burn Care Res, 2017, 38(5): 312-318. DOI:10.1097/BCR.0000000000000504 |
| [27] | Tran NK, Albahra S, Pham TN, et al. Novel application of an automated-machine learning development tool for predicting burn sepsis: proof of concept[J]. Sci Rep, 2020, 10(1): 12354. DOI:10.1038/s41598-020-69433-w |
 2020, Vol. 29
2020, Vol. 29




