目前心房纤颤治疗方式可分为药物治疗和手术治疗[1],其中微创手术导管下射频消融术在临床的运用越来越广泛,带来临床获益的同时也可能产生一些的手术并发症,射频治疗后的心房食管瘘就是其中一项严重的手术并发症[2]。由于患者射频消融点多位于在左心房或者肺静脉口或窦周围,而食管与左心房位置紧密,因此在手术同时容易损伤食管,一旦心房与食管有瘘口形成时,即造成心房食管瘘(atrial esophageal fistula,AEF),产生一系列临床症状[2]。目前文献报道AEF发病率有所差别,资料显示占射频消融手术患者的0.1%~0.25%[2],虽然发病率小但是其发病后往往出现致命情况[3]。同时由于AEF在术后发病时间差异较大,临床症状不典型,往往在早期症状较多且相关性不紧密,容易被忽视,因此需要加强该疾病的认识。本文报道一例射频消融术后出现心房食管瘘的病例,同时进行文献复习,以期增加临床工作者对该疾病的认识。
1 资料与方法患者,男,68岁;因“间断胸闷心慌1个月余,呕血伴发热1 d,意识障碍12 h”收入华中科技大学同济医学院附属同济医院。患者一个月前自觉胸闷、心慌,至当地市级医院诊断为“房颤、冠状动脉粥样硬化”,入院前34 d行房颤消融术+冠脉造影术,术后口服达比加群酯110 mg 2次/d,术后3 d再次因胸闷心慌至当地县人民医院住院治疗,给予对症治疗,症状可缓解。入院2 d前再次出现胸闷心慌等不适,入院前1日下午4时呕血约300 mL,伴寒战高热,最高可达39.5 ℃,并于入院当日中午12时出现意识障碍,言语不清,为求进一步治疗转至本院急诊科。急查头部CT示:脑萎缩,脑白质病;右侧半卵圆中心及左侧基底节区片状低密度影,考虑为缺血梗死灶;右侧小脑半球片状低密度影,考虑脑梗死、软化灶形成。后患者意识障碍较前缓解,急诊科收治入院。既往史:高血压史十余年,5年前脑梗死病史,10年前行腰椎间盘突出手术治疗,吸烟30余年,每日一包,饮酒30余年,每日250 mL,戒酒10年。入院体格检查:患者意识清醒状态,言语沟通不畅,心电监护提示:血压105/80 mmHg,脉搏87次/min,SPO2 100%,心率18次/min;双侧瞳孔等大等圆,直径2.5 mm,对光反射存在,双肺呼吸音粗, 未闻及啰音;心音可,律齐,未闻及杂音;腹软,移动性浊音阴性,肠鸣音正常。四肢无畸形,四肢活动无障碍,双下肢无水肿,生理反射存在,双侧巴氏征阳性可疑。患者入院后完善相关检查。血常规:白细胞计数23.23×109/L,血红蛋白93.0 g/L,血小板计数117.0×109/L,谷丙转氨酶14 U/L,谷草转氨酶17 U/L,尿素15.93 mmol/L,肌酐103 μmol/L,葡萄糖10.84 mmol/L,N-末端脑利钠肽前体(N-terminal pro brain natriuretic peptide,NT-proBNP)5 577 pg/mL,降钙素原32.51 ng/mL,高敏心肌肌钙蛋白I 413.9 pg/mL,血乳酸2.22 mmol/L。心脏超声检查示左房扩大55 mm,心脏收缩力下降,左心EF值40%。患者入院后给予抗感染、抑酸、营养支持等治疗,患者于入院当晚9时出现剧烈咳嗽,后意识障碍再次加深,遂行颅脑CT检查,示左侧大脑内气体栓塞(图 1);神经内科会诊,考虑脑内气体栓塞。给予患者头低脚高位,降低颅内压等治疗,次日晨复查胸部增强CT,示左房改变,考虑左房破食管瘘并左房血栓形成(图 2),诊断为“心房食管瘘”,请胸外科会诊意见:患者颅脑内积气吸收后,可进行心脏食管手术。患者于入院第2天上午8时出现呼吸衰竭,行气管插管术,呼吸机辅助呼吸,患者家属于当日下午因个人原因办理出院。
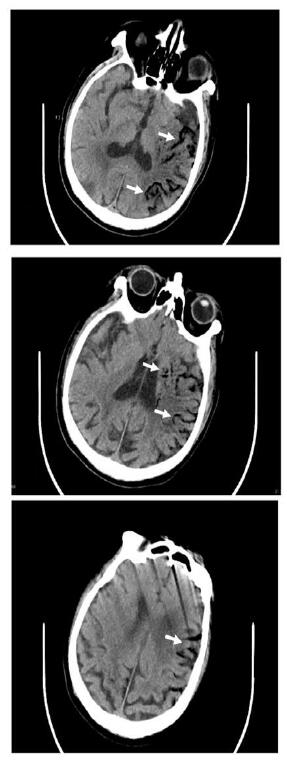
|
| 左侧大脑不同层面内沿血管走行低密度气体影,考虑气体栓塞(白色箭头示) 图 1 患者颅脑CT结果 |
|
|
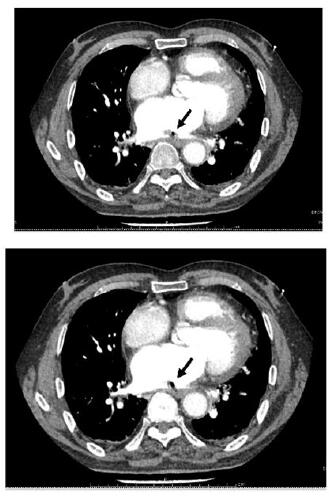
|
| 不同层面内左心房内低密度影,考虑心房食管瘘后气体残留,周围有血栓形成(黑色箭头示) 图 2 患者胸部增强CT结果 |
|
|
房颤射频消融术出现心房食管瘘的情况比较少见,自2001年首例病例报道以来[4],国外有综述搜集报道病例约百余例[5],目前国内报道尚不多。AEF临床表现不典型,部分地区因临床检查局限,患者病情可进展迅速,迅速导致死亡,可能导致其发病率被低估[5]。因此临床多学科需要进一步加深对该疾病的诊断及治疗的认识。
目前认为AEF的发病机制可能是由于左心房与食管位置接近,当采用射频消溶治疗时,可能导致食管内皮细胞缺血、坏死,进而导致溃疡;进一步影响到纵隔可出现胸闷、胸痛、不适、呼吸困难等心血管症状;若形成瘘口可出现吞咽困难、呕吐呕血、黑便等消化道症状(患者的胃食管反流可能会加重这种过程);当食管内细菌进入纵隔或者血液内可出现发热等感染症状;同时若气体入血可出现气栓形成脑梗死,产生偏瘫,意识障碍等神经系统症状[6]。
目前AEF疾病诊断较困难,主要体现在以下三个方面。首先,患者的发病时间区间大,有文献报道相关症状出现平均为术后19.3 d,最短为术后6 d,最长可以达到术后59 d[3],这可能与食道溃疡形成需要一定时间有关,本例患者明显的消化道出血出现在术后33 d,发病时间较晚,极易忽略症状与手术间的联系。其次,由于患者发病机制可导致临床表现不具有特异性,可出现胸部不适、呼吸困难症状,也可能出现呕血、意识不清等症状;目前文献报道常见临床症状主要集中在术后2~4周内(42%),主要症状表现为发热(73%)、神经系统症状(72%),消化道症状(41%)[5]。本例患者术后出现胸部不适症状,外院反复检查治疗,无明显改善,后患者出现呕血、高热、意识不清,复查头颅CT发现气体栓塞,排除深静脉穿刺等有创操作后,最后通过胸部增强CT明确诊断,整个诊断过程比较曲折。因此需要急诊特别是专科医生加深对该疾病的认识。此外,AEF目前检查方式主要包括胸部平扫或增强CT、胸部MRI[7]、食管X线造影、心脏超声、食管胃镜检查等,其中胸部CT平扫或增强CT是首选检查方式,必要时可反复检查,本例患者最终通过胸部增强CT明确诊断,主要表现为左心室气栓并血栓形成。而需要注意的是部分患者行食管胃镜检查可使病情明显加重,当怀疑该疾病时应当避免该检查,同时食管X线造影或经食道超声也应尽量避免。部分地区缺乏相应的检查手段或时间条件受限,使得部分危重患者失去诊断机会,因此临床上对于房颤射频消融术后新出现感染表现和消化、神经系统等症状的患者需要高度重视,积极选择合适的检查方法以明确诊断。
目前对于AEF的治疗包括手术治疗、内镜下支架治疗、保守治疗等。一项纳入120例AEF患者的回性研究提示,治疗上总体病死率为55%,亚组分析显示手术治疗病死率为33%,内镜下支架治疗病死率为65%,保守治疗病死率高达97%;意识障碍、癫痫、神经缺损症状及消化道出血是预后不良的标志[5]。该例患者入院后出现意识障碍,伴有消化道出血等症状,确诊为颅内大面积气体栓塞,虽然具有手术指征,但患者预后极差,和家属沟通后未行心脏手术治疗。其他对于疾病的预防工作研究,包括手术中对于食道温度的监测控制[8],术中对食管位置的移动性保护[9],采用PPI药物抑制胃酸分泌等[10],目前没有证据表明这些措施具有确切效果。对患者的健康宣教,包括对出现相关症状需要及时引起重视,可能对于疾病的诊断和治疗有一定帮助。
综上所述,AEF是一项发病率低,诊断困难,病死率高的疾病。当患者行射频消融术后,要重点观察手术后一段时间内临床症状,当出现胸闷胸痛、呼吸困难、消化道出血、神经症状时,要高度重视,及时并可重复行胸部CT(或增强CT)检查,一旦确诊,及时手术治疗。临床遇到该类患者,需要详细询问病史,以做好疾病的早期识别工作,并选择合适的诊断方式。另外,射频消融术患者的术后健康宣教工作同样重要。
利益冲突 所有作者均声明不存在利益冲突
| [1] | 宋晓漪, 郭杰. 阵发性房颤并心衰药物复律治疗的临床观察[J]. 中华急诊医学杂志, 2007, 16(1): 87-89. DOI:10.3760/j.issn.1671-0282.2007.01.024 |
| [2] | Calkins H, Kuck KH, Cappato R, et al. 2012 HRS/EHRA/ECAS expert consensus statement on catheter and surgical ablation of atrial fibrillation: recommendations for patient selection, procedural techniques, patient management and follow-up, definitions, endpoints, and research trial design[J]. Europace, 2012, 14(4): 528-606. DOI:10.1093/europace/eus027 |
| [3] | Barbhaiya CR, Kumar S, John RM, et al. Global survey of esophageal and gastric injury in atrial fibrillation ablation[J]. J Am Coll Cardio, 2015, 65(13): 1377-1378. DOI:10.1016/j.jacc.2014.12.053 |
| [4] | Gillinov AM, Pettersson G, Rice TW. Esophageal injury during radiofrequency ablation for atrial fibrillation[J]. J Thorac Cardiovasc Surg, 2001, 122(6): 1239-1240. DOI:10.1067/mtc.2001.118041 |
| [5] | Han H, Ha FJ, Sanders P, et al. Atrioesophageal fistula[J]. Circ Arrhythm Electrophysiol, 2017, 10(11): e005579. DOI:10.1161/CIRCEP.117.005579 |
| [6] | Nair KK, Danon A, Valaparambil A, et al. Atrioesophageal fistula: a review[J]. J Atr Fibrillation, 2015, 8(3): 1331. DOI:10.4022/jafib.1331 |
| [7] | Gilcrease GW, Stein JB. A delayed case of fatal atrioesophageal fistula following radiofrequency ablation for atrial fibrillation[J]. J Cardiovasc Electrophysiol, 2010, 21(6): 708-711. DOI:10.1111/j.1540-8167.2009.01688.x |
| [8] | Leite LR, Santos SN, Maia H, et al. Luminal esophageal temperature monitoring with a deflectable esophageal temperature probe and intracardiac echocardiography may reduce esophageal injury during atrial fibrillation ablation procedures[J]. Circ Arrhythm Electrophysiol, 2011, 4(2): 149-156. DOI:10.1161/CIRCEP.110.960328 |
| [9] | Chugh A, Rubenstein J, Good E, et al. Mechanical displacement of the esophagus in patients undergoing left atrial ablation of atrial fibrillation[J]. Heart Rhythm, 2009, 6(3): 319-322. DOI:10.1016/j.hrthm.2008.12.010 |
| [10] | Zellerhoff S, Lenze F, Eckardt L. Prophylactic proton pump inhibition after atrial fibrillation ablation: is there any evidence?[J]. Europace, 2011, 13(9): 1219-1221. DOI:10.1093/europace/eur139 |
 2020, Vol. 29
2020, Vol. 29




