感染是急危重症患者最为常见的就诊原因之一,急诊科作为患者就医的首站,感染的处置是急诊临床工作的重要内容[1-3]。急诊感染患者具有临床表现不典型、就医时间紧迫、诊断未明确、危重患者病情进展迅速等特点,急诊患者的抗菌药物使用较其他专科需要面对更大的挑战[4-5]。抗菌药物的合理使用是我国长期以来非常关注的问题,有充分的证据表明,合理的抗感染诊疗策略,合适的抗菌药物使用能够显著改善患者预后,减少耐药菌的产生,极大地节约医疗资源[6-7]。为了更好地对成人细菌性感染进行诊疗,合理使用抗菌药物,减少急诊耐药菌的产生,故编写本共识。
1 急诊感染的诊断和评估 1.1 感染的诊断感染是指微生物侵入宿主体内引起的病理变化或疾病状态[8-9]。就诊于急诊科的感染患者具有起病急和(或)病情重的特点,如不能给予快速识别和准确诊治,常会出现病情快速进展恶化甚至死亡。此外,急诊感染病情错综复杂,感染的诊断有时较为困难,临床诊疗中的误诊、漏诊时有发生。因此,感染的正确诊断和评估是感染治疗的首要前提。
机体在发生感染后会出现局部或全身的炎症反应,表现为充血、肿胀、疼痛、渗出(如分泌物增加)、发热、白细胞升高以及影像学改变等。由于这些表现都是非特异性的,仅仅通过单一的表现去诊断感染常常导致误诊。比如,感染可以表现为发热,但发热的患者并非都有感染,临床上有相当一部分患者为非感染性发热;再如,细菌性感染可表现为血液中白细胞计数升高,然而活动性炎症、妊娠、血液病、某些药物(糖皮质激素或儿茶酚胺)、应激、剧烈运动、烧伤、电击、手术或创伤及实验室误差等都可以表现为白细胞计数升高。近年来发现降钙素原(procalcitonin,PCT)可能是预测细菌性感染比较好的标志物;然而,前瞻性临床试验显示,基于PCT鉴别是否存在感染时应谨慎解读其结果,PCT对感染的预测受到院前因素的影响,也缺乏适用于各种临床情形的恰当阈值[10]。以PCT指导启动抗生素治疗并不能减少抗生素的使用[11]。事实上,感染标志物如白细胞计数、C反应蛋白(C reactive protein,CRP)、白介素-6(interleukin-6,IL-6)、脂多糖结合蛋白(lipopolysaccharide binding protein,LBP)、可溶性髓系细胞触发受体-1(soluble triggering receptor expressed on myeloid cell-1,sTREM-1)等用于鉴别感染性全身炎症反应综合征(systemic inflammatory response syndrome,SIRS)和非感染性SIRS时,均缺乏理想的灵敏度和特异度[12],单独应用的价值有限,必须要结合临床实践。
因此,必须认识到感染诊断的复杂性。由于发病场所、宿主因素、感染部位、病原微生物等的不同,感染的表现千差万别,不能仅仅根据患者的发热、白细胞计数升高、PCT的升高而诊断感染,不能在缺乏其他感染表现时武断地启动抗生素治疗,更不能把一时不能解释的临床情况归因于“感染”。不加选择地使用抗菌药物治疗将导致抗生素的滥用,加剧细菌耐药的产生[13]。
从某种意义上说,感染更多是一种概率性诊断。不同发病场所的病原体流行情况存在差异,不同宿主对特定病原体的易感性存在差异,不同病原微生物的易感部位、病理变化及演进过程也有显著差异。因此,应基于病史、症状、体征、生物标志物、影像学表现等综合分析,支持感染的证据越多,则诊断感诊的可靠性也越大。即便如此,当抗感染治疗效果不理想时,仍要怀疑感染的诊断是不是正确,而不是简单地更换抗菌药物治疗方案。此外,还应强调:⑴重视病史和查体,而非过于依赖检验和影像学。绝大多数(56%~94%)感染的诊断可基于病史做出,通过仔细的体格检查又可进一步增加4%~17%的合理诊断率,而仅14%的诊断必须依据其他辅助检验检查手段[14-16];⑵感染的初步诊断应包括感染部位,应当避免仅诊断感染而没有感染部位。若感染部位难以确定,则需要尽可能地完善相关检查以明确。对于血流感染,也要尽量明确血流感染的细菌来源和可能发生播散性感染的部位。
1.2 感染的评估 1.2.1 病原学评估目前,关于我国急诊感染的病原学资料仍较少,急诊常见的病原菌见图 1。作为医院的前沿窗口,急诊感染患者病原学理论上应更符合社区性感染的病原分布[17-18],但我国情况较为复杂,如患者反复转诊、住院待床、自行使用抗菌药物等,使部分感染患者具有院内获得性感染的特征。因此,应仔细询问病史,进一步明确可能的病原学特征及耐药风险,应认识到由于不同的个人接触病史、流行病学史、就诊季节,其病原菌也会存在差异。了解人体不同部位的常见定植菌和致病菌的分布情况,对于评估可能的病原菌有一定的参考价值。急诊常见病原菌及不同部位常见病原菌的分类见图 2和表 1。
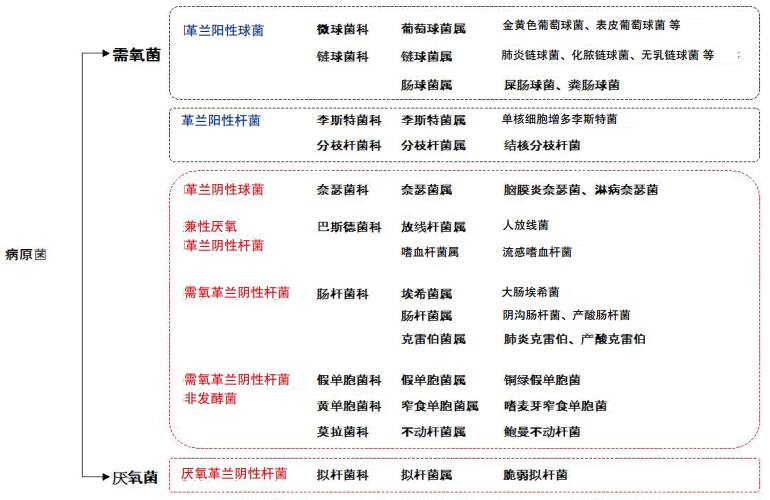
|
| 图 1 急诊常见病原菌分类 |
|
|
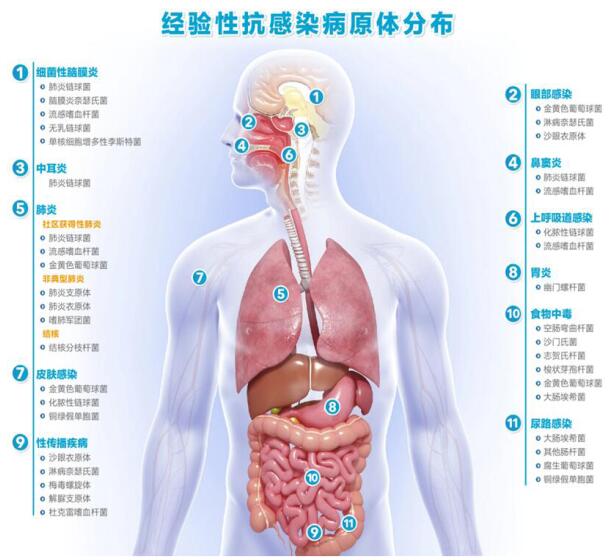
|
| 图 2 感染的部位和相应可能的病原菌 |
|
|
| 感染部位 | 可能病原体 | 药物选择 | 备选药物 |
| 急性细菌性呼吸道感染 | |||
| 急性上呼吸道感染 | |||
| 咽炎 | A组溶血性链球菌 | 青霉素G,阿莫西林 | 一、二代口服头孢菌素 |
| 中耳炎,急性上颌窦炎 | 肺炎链球菌 | 阿莫西林、阿莫西林/克拉维酸 | 一、二代口服头孢菌素 |
| 流感嗜血杆菌 | |||
| 急性下呼吸道感染 | |||
| 急性气管-支气管炎(细菌性) | 肺炎支原体、百日咳博得特菌 | 大环内酯类、喹诺酮类 | 病毒感染多见,不常规使用抗菌药物 |
| 社区获得性肺炎 | |||
| 免疫功能正常、青壮年 | 肺炎链球菌、流感嗜血杆菌、肺炎衣原体等 | 青霉素、阿莫西林 | 一、二代头孢菌素,喹诺酮类 |
| 无铜绿假单胞菌感染风险,无死亡高危风险a | 肺炎链球菌、流感嗜血杆菌、军团菌、支原体等 | 头孢曲松、头孢噻肟静脉联合大环内酯类静脉给药 | 喹诺酮类静脉给药;厄他培南联合大环内酯类静脉给药 |
| 有铜绿假单胞菌感染风险,合并死亡高危风险a | 肺炎链球菌、流感嗜血杆菌、军团菌、支原体等+铜绿假单胞菌 | 两种具有抗假单胞菌活性的药物联用,如β-内酰胺类药物(头孢他啶,头孢哌酮/舒巴坦,亚胺培南,美罗培南等)联用氨基糖苷类药物 | 酌情考虑覆盖MRSA |
| 皮肤/软组织感染 | |||
| 蜂窝组织炎 | A组溶血性链球菌 | 青霉素、阿莫西林 | 一代头孢菌素、阿莫西林/克拉维酸、头孢曲松 |
| 坏死性筋膜炎 | 溶血性链球菌、梭菌属、混合感染 | 大剂量青霉素联合克林霉素 | 美罗培南或亚胺培南+万古霉素 |
| 尿路感染 | |||
| 急性非复杂性下尿路感染 | 大肠埃希菌 | 呋喃妥因、磷霉素氨丁三醇 | 头孢氨苄、头孢拉定、喹诺酮类药物b |
| 急性非复杂性上尿路感染(肾盂肾炎) | 大肠埃希菌、其他肠杆菌科细菌、肠球菌属 | 氨苄西林/舒巴坦、阿莫西林/克拉维酸 | 一、二、三代头孢菌素 |
| 复杂性尿路感染 | 肠杆菌科细菌、铜绿假单胞菌、肠球菌属 | 必须纠正尿路感染复杂因素,根据药敏试验结果选用敏感药物 | 哌拉西林/他唑巴坦、头孢哌酮/舒巴坦、厄他培南、头孢噻肟等 |
| 脑膜炎 | |||
| 免疫功能正常 | 肺炎链球菌,脑膜炎奈瑟菌 | 头孢曲松和头孢噻肟 | 万古霉素+头孢曲松或头孢噻肟 |
| 免疫功能缺陷或年龄 > 50岁 | 肺炎链球菌、李斯特菌,革兰阴性杆菌 | 头孢曲松或头孢噻肟联合氨苄西林 | 美罗培南联合万古霉素 |
| 腹腔感染 | |||
| 原发性腹膜炎 | 大肠埃希菌、变形杆菌属 | 氨苄西林/舒巴坦,阿莫西林/克拉维酸,二、三代头孢菌素 | 头孢哌酮/舒巴坦、哌拉西林/他唑巴坦、氨基糖苷类,碳青霉烯类 |
| 注:a使用血管活性药物维持血压,或者使用机械通气;b由于我国喹诺酮类药物对大肠埃希菌耐药率超过50%,需要参考药敏试验结果选用;MRSA为耐甲氧西林金黄色葡萄球菌 | |||
不同地区和不同级别的医院急诊科收治的患者有很大差异,具有不同的病原流行特点,如有条件,应结合本地区、本医院甚至本科室的病原学流行数据及所有可获取的资料来评估可能的病原学[19],并在启动治疗前积极地留取病原学标本。
此外,在启动初始经验性治疗前还应评估耐药菌感染的风险,避免教条地根据指南和共识选择抗菌药物。患者的免疫状态、基础疾病、医疗机构接触史、用药史、定植史等均对感染的病原学有影响。应当指出的是,这些因素常合并存在且相互影响,使得耐药菌评估异常复杂。例如:免疫功能受损患者罹患感染的风险增加,感染的病原体常常是某些特定病原,如体液免疫功能异常或补体缺乏的患者可能增加含荚膜病原体的侵入可能,而获得性免疫缺陷的患者合并机会性感染的概率将显著增加。需强调的是,容易罹患感染和罹患耐药菌感染是不同维度的问题,不应混淆。
1.2.2 感染严重程度评估感染的严重程度不同,抗感染治疗的策略亦不同。对于重症感染患者,由于治疗的紧迫性,可能不允许进行更为充分地病原学诊断,建议采用积极的抗感染策略,应尽早启动抗感染治疗,可使用相对广谱的抗生素以覆盖最可能的病原菌。而对于非重症感染,则应充分评估可能的病原微生物,采用相对保守的治疗策略。关于感染严重程度的评估目前缺乏一致的意见,本共识建议,如果感染导致了急性或进展性器官功能不全、血流动力学不稳定、或需要机械通气支持时应视为重症感染。在急诊科,如果在患者接诊早期缺乏全面的临床资料的情况下,建议使用快速序贯器官衰竭评分(quick sequential organ failure assessment,qSOFA)来识别重症感染的患者。qSOFA评分包括三项指标:呼吸频率≥22次/min、意识改变、收缩压≤100 mmHg(1 mmHg=0.133 kPa),每项计1分。如果感染所致的qSOFA评分≥2分时患者死亡风险明显增加,应视为重症感染。该评分主要用于重症感染的早期识别,具有方便、快捷的特点。对于临床资料相对较全的患者(如留观、住院或EICU患者),建议采用更为详细的序贯器官衰竭评分(sequential organ failure assessment,SOFA),该评分是目前急诊和危重症患者中较常规使用的区分患者感染严重程度的评分系统[20],如果感染患者SOFA评分≥2分,应视为重症感染[21-22]。
2 急诊经验性抗菌药物治疗原则急诊抗感染治疗分为经验性治疗和目标治疗[23-25]。由于实验室检查的病原和药敏结果常滞后于临床需求,且受到标本质量、检验条件、治疗干扰等因素的影响,急诊病原学结果常难以获取。然而,更多的循证医学证据表明初始抗菌药物治疗时间点与危重患者的预后息息相关。因此,经验性抗菌药物治疗是急危重症患者常用的抗感染治疗策略[4, 26]。
经验性抗菌药物治疗绝不是没有目标的盲目治疗,经验性治疗前,临床医师应结合流行病学接触史、发病环境、临床表现,感染部位及宿主等因素对可能的病原微生物进行推断,同时评估其发生耐药性风险,进行综合判断和治疗决策[27]。经验治疗不等于广谱覆盖治疗,而是应当根据患者病史、感染部位及所有可获取的资料覆盖最为可能的病原菌,经验性治疗应当考虑以下几个方面。
首先,患者发病与治疗所处环境的细菌谱和耐药谱是经验性抗菌药物应用重要的参考依据(Location & Environment,L & E):当地的细菌谱和耐药情况的流行病学数据是急诊经验性抗菌药物治疗临床决策的重要参考依据。不同地区,不同级别医院,不同来源患者的急诊经验性抗菌药物治疗需要覆盖的病原体也不相同[17-18]。如经验性治疗感染性休克患者时,若耐甲氧西林的金黄色葡萄球菌(meticillin-resistant Staphylococcus aureus,MRSA)当地检出率超过20%时,则需要经验性覆盖MRSA;而急诊科或重症医学科中铜绿假单胞菌和鲍曼不动杆菌的流行病学数据和耐药情况的流行病学资料也可为经验性选择抗菌药物提供有价值的信息[19]。
其次,需考虑患者病史和抗菌药物使用史(medical hiStory,S)。患者病史及抗菌药物的使用史也应是临床医师抗菌药物选择的重点考量因素。一般来说符合以下条件的患者,需要警惕多药耐药菌的感染:①本次就诊前90 d使用过静脉抗菌药物;②本次就诊合并感染性休克;③本次就诊感染导致急性呼吸窘迫综合征;④住院时间超过5 d的感染;⑤本次就诊感染发生前已经开始肾脏替代治疗。存在多药耐药菌感染风险时,例如铜绿假单胞菌或鲍曼不动杆菌导致的肺部感染,需要结合当地耐药情况的流行病学数据,考虑选择两种不同作用机制的抗菌药物联合进行治疗。
第三,需考虑感染部位及常见病原菌(infection Site,S)。经验性治疗前,需再次结合患者的病史、临床表现及感染部位对病原学进行推断。感染部位的判断将直接影响经验性抗菌药物应用的选择和剂量,经验性抗菌药物治疗时,需要充分考虑感染的部位和相应的病原菌。避免不加选择地应用广谱抗菌药物。同时应注意感染源的清除与引流。
第四,需根据患者病情严重程度选择抗菌药物(Severity,S)。急诊抗感染治疗时,同时需要充分考虑患者病情,一般来说因感染导致的脏器功能不全,需要使用机械通气及血管活性药物等支持时提示患者病情危重。对于这类患者,目前循证医学证据表明需要尽早开始抗菌药物治疗,而不能因为等待细菌学及药敏试验结果而延误治疗[21-22]。此类患者常需要使用广谱抗菌药物,甚至联合使用抗菌药物,覆盖最为可能的病原体。此外,由于此类患者常合并低蛋白血症、接受大量液体复苏等情况,使用抗菌药物时,需要充分考虑抗菌药物的药动学(pharmacokinetics,PK)和药代学(pharmacodynamics,PD)参数的改变,以感染部位抗菌药物浓度达标为目的,优化抗菌药物的使用。此外,对于老年患者、肝肾功能减退、超常规剂量使用抗菌药物、使用不良反应较大的抗菌药物时,有条件的单位应当进行药物浓度的监测,并合理地进行治疗剂量的调整[28-29]。
急诊抗感染治疗应当基于以上“LESSS”原则,详细采集患者病史,充分考虑宿主、病原菌、抗菌药物间的关系,尽早正确地使用抗菌药物。此外,病原学标本的留取是合理与正确使用抗菌药物的重要基础,是目标抗菌药物治疗的必要条件。
3 规范病原微生物采集病原微生物鉴定对于感染的诊断和治疗至关重要,鉴定方法包括传统的病原微生物培养和不断新增的免疫学检测技术。其中病原微生物培养过程中的采集、保存和送检对培养结果有明显影响。
3.1 采集尽量在使用抗菌药物之前采集标本。血、脑脊液、关节液等需要穿刺获得的标本,注意有效消毒以避免标本被皮肤或黏膜正常定植菌群污染。碘酊和氯己定消毒的消毒效果优于聚维酮碘[30-31]。对于经纤支镜留取的痰液,正确操作污染可能小。对于经口留取的痰培养标本,在咳痰前1~2 h内应禁食,咳痰之前应漱口;咳出深部痰液。对于尿培养标本,建议清洁尿道口以降低污染率[32-33]。应使用不起泡的消毒液对尿道口和邻近黏膜进行局部消毒,然后用无菌拭子擦干以避免尿液与消毒液混合。留取时尽量减少尿流与黏膜的接触。应弃去初段尿液。如果不了解相关标本采集要求,应在样本采集前咨询微生物学实验室。
3.2 保存最好在样本采集后1~2 h内将细菌培养样本送检至微生物实验室。标本处理延迟可造成部分微生物过度生长或苛养病原体的死亡。如果延时送检无法避免,大部分标本(除了血液、脑脊液、关节液以及用于淋病奈瑟菌培养的样本)需要储存于专用的标本储藏冰箱,4℃冷藏保存直至转运。还要避免标本干燥脱水。
3.3 送检标本盛放于无菌、防渗漏容器中,用塑料袋密封后进行送检。用注射器采集的液态样本(例如,穿刺抽液、关节抽吸、脓肿穿刺引流液),可将注射器内采集的标本转移到另一容器后再进行转运,也可以拔掉注射器针头并加帽后直接送检含有抽吸物的注射器。对于特殊的测试申请,或疑为罕见病原体、高度传染性病原体、生物恐怖病原体,送检前需要提前通知微生物学实验室。
3.4 初步判断痰标本的自身性状可以对病原学情况进行一定的推断。铁锈色痰提示肺炎链球菌;砖红色痰提示肺炎克雷伯菌;黄绿色或者翠绿色痰液提示铜绿假单胞菌;脓性痰伴有恶臭提示厌氧菌;白色粘稠、难以咳出的拉丝样痰提示白色念珠菌;大量稀薄浆液性痰中含粉皮样物提示棘球蚴病。
4 急诊抗菌药物初次选择后的再评估和优化治疗通常急诊经验使用抗菌药物后,应当在48~72 h内评估抗菌药物的疗效。特别对于使用广谱抗菌药物及联合2种及以上抗菌药物使用的患者,应综合考虑体格检查、影像学表现、临床疗效、初步的细菌学证据等因素,在抗菌药物治疗有效的情况下尽可能选择较为窄谱的抗菌药物。必须注意感染的诊断有时非常困难,对于抗菌药物治疗无反应的患者,鉴别诊断应当贯穿整个治疗过程中,充分考虑治疗无反应的原因,如:①症状并非为感染所致;②病原体判断错误,如症状为真菌、病毒等所致或为耐药菌感染,所选抗菌药物无效;③抗菌药物疗程或剂量不足;④感染灶未能祛除而单纯依靠抗菌药物也将导致治疗的失败。
抗菌药物治疗有效时一般应使用到患者体温正常,感染症状消退后的3~4 d;对于存在明确感染灶的患者,应根据感染灶是否基本吸收,适当延长抗菌药物疗程[34-37]。
宿主免疫功能也是急诊抗菌药物治疗能否成功的关键因素[5, 38]。急诊抗感染治疗时应当避免单纯依赖抗菌药物,而忽视了宿主免疫功能的调整。在应用抗菌药物时应当充分考虑患者一般情况和免疫功能,如积极纠正休克、补充循环容量、纠正低蛋白血症和贫血,充分改善大循环、微循环和组织灌注。处理基础疾病、脏器功能支持、营养支持等综合治疗是抗菌药物治疗中的重要环节,需得到临床医师的充分重视[39-40]。
5 急诊常用抗菌药物的分类 5.1 目标细菌急诊临床医师选用抗菌药物时需要充分注意目标细菌,其中选择治疗革兰阳性菌重点需要关注所选药物能否覆盖:链球菌、金黄色葡萄球菌[凝固酶阴性/凝固酶阳性,甲氧西林敏感的金黄色葡萄球菌(methicillin sensitive Staphylococcus aureus,MSSA)/MRSA]。选择治疗革兰阴性菌时重点需要关注所选药物能否覆盖肠杆菌科细菌中的大肠埃希菌、肺炎克雷伯菌,假单胞科细菌中的铜绿假单胞菌,不动杆菌属中的鲍曼不动杆菌和厌氧菌中的脆弱拟杆菌。
5.2 常用药物分类 5.2.1 青霉素类药物代表品种包括:青霉素G,苄星青霉素;耐酶青霉素包括:氯唑西林、氟氯西林;广谱青霉素包括:氨苄西林、阿莫西林;青霉素类药物具有不良反应少、治疗敏感细菌所致感染敏感性好,是敏感肺炎链球菌的首选药物,但近期我国肺炎链球菌耐药菌株(penicillin resistant Streptococcus pneumoniae,PRSP)的分离率有所升高,需要引起临床医师的注意。
5.2.2 头孢菌素类药物头孢菌素类抗菌药物抗菌谱广,临床使用较为广泛,作用机制同青霉素类药物,但具有抗菌作用更强,不良反应少,过敏反应少的特点。目前分为四代,主要代表品种包括:一代的头孢唑林;二代的头孢呋辛、头孢孟多、头孢替安;三代的头孢噻肟、头孢曲松、头孢哌酮、头孢他啶。每一代的头孢类药物的抗菌谱都有所不同。一至三代头孢菌素抗革兰阳性球菌的作用逐渐减弱,抗革兰阴性杆菌的作用逐渐增强;多数三代头孢药物对革兰阴性杆菌产生的β内酰胺酶稳定,但对细菌产生的产超广谱β-内酰胺酶(extended spectrum β-lactamases,ESBLs)和AmpC酶不稳定。第四代头孢菌素对金黄色葡萄球菌等革兰阳性菌的作用较第三代强;对产酶革兰阴性菌的稳定性优于三代头孢。
5.2.3 β-内酰胺类/β-内酰胺酶抑制剂合剂β-内酰胺酶抑制剂能够抑制大部分β-内酰胺酶,恢复β-内酰胺类抗生素的抗菌活性。因此,β-内酰胺类抗生素/β-内酰胺酶抑制剂合剂在临床抗感染中的地位不断提升,已成为临床治疗多种耐药细菌感染的重要选择。目前临床应用的主要品种有阿莫西林/克拉维酸、氨苄西林/舒巴坦、头孢哌酮/舒巴坦、替卡西林/克拉维酸、哌拉西林/他唑巴坦,头孢他啶/阿维巴坦。
β-内酰胺类酶抑制剂对流感嗜血杆菌、卡他莫拉菌、部分肠杆菌科细菌等细菌所产的β-内酰胺酶有较强的抑制作用。因此β-内酰胺酶复方制剂对多种革兰阳性菌、阴性菌有良好的抗菌作用。其中头孢哌酮-舒巴坦中的舒巴坦制剂还有抗不动杆菌的活性。但必须注意,β-内酰胺酶复合制剂的抗菌作用主要取决于其中的β-内酰胺类药物,β-内酰胺酶一般不增强与其配伍药物的抗菌活性。
5.2.4 碳青霉烯类抗菌药物碳青霉烯类药物为硫霉素衍生物,同样通过抑制细菌细胞壁合成发挥杀菌作用,为广谱抗菌药物,对包括铜绿假单胞菌、脆弱拟杆菌、葡萄球菌等革兰阳性和阴性菌都具有强大的杀菌活性。主要品种包括:亚胺培南/西司他丁、美罗培南、厄他培南、比阿培南等。近年来铜绿假单胞菌、不动杆菌等细菌对碳青霉烯类药物的耐药率呈逐年上升趋势。且临床产灭活碳青霉烯类药物的β-内酰胺酶的细菌也呈上升趋势,临床使用时需要加以注意。
5.2.5 喹诺酮类药物喹诺酮类药物是吡酮酸化学合成产物。抗菌谱广、组织浓度高、可每日给药1次,静脉及口服品种齐全,在急诊应用广泛。主要品种包括:环丙沙星、左氧氟沙星、莫西沙星、萘洛沙星。其中左氧氟沙星、莫西沙星、加替沙星、吉米沙星等作为“呼吸喹诺酮”对肺炎链球菌、化脓性链球菌、肺炎支原体、衣原体及嗜肺军团菌等社区获得性肺炎病原微生物有良好的杀菌活性。此外,喹诺酮类药物主要经肾脏排泄,肾组织和尿液中浓度均较高,可用于治疗敏感菌导致的上、下尿路感染。
5.2.6 大环内酯类药物大环内酯类药物均具有大环内酯环而得名,代表品种包括:红霉素、克拉霉素、阿奇霉素等。对于临床常见的病原菌具有良好的抗生素后效应(post-antibiotic effect,PAE)。主要用于治疗社区获得性呼吸道感染,对支原体属、衣原体属等非典型病原体具有良好的抗菌活性。
5.2.7 氨基糖苷类药物氨基糖苷类药物可由链霉素培养液、小单胞菌属滤液或者半合成获得。代表品种包括:庆大霉素、阿米卡星、妥布霉素、奈替米星等[41],对各种革兰阴性杆菌有强大的杀菌活性。氨基糖苷类药物具有耳毒性和肾毒性[42-43],曾一度较少在临床应用,但近年来随着革兰阴性杆菌耐药率的增加,氨基糖苷类药物的使用有增加的趋势,常联合其他抗菌药物治疗敏感革兰阴性杆菌所致的全身感染。
执笔人:金魁、刘树元、尹路、孙峰、张秋彬
共识组专家(按姓氏拼音顺序排列):蔡文伟、曹钰、柴艳芬、陈飙、陈聪、陈锋、陈凤英、陈建荣、陈明泉、陈威、陈晓辉、陈旭岩、党星波、邓扬、邓颖、丁邦晗、丁宁、窦清理、范晨芳、范西真、方邦江、封启明、何小军、黄亮、黄子通、冀兵、蒋龙元、金红旭、金魁、康海、康健、李彩霞、李立宏、李德忠、李培武、李小刚、李小民、李湘民、李燕、梁显泉、刘红升、刘明华、刘树元、刘笑然、刘宇鹏、卢中秋、逯林欣、陆一鸣、吕传柱、马俊麒、马渝、聂时南、欧阳军、潘显峰、裴俏、彭鹏、钱传云、秦历杰、单爱军、商德亚、司君利、宋海晶、苏琴、孙峰、唐柚青、田英平、童朝阳、王伯良、王芳、王晶、王瑞兰、王旭东、王振杰、王仲、魏捷、吴国平、吴利东、邢吉红、熊辉、徐峰、徐军、许硕贵、许铁、闫柏刚、杨灿菊、杨立山、姚卫海、尹路、尹文、于学忠、曾红科、詹红、张泓、张秋彬、张建波、张剑锋、张劲松、张茂、张为、张玮、张文武、张新超、赵斌、赵敏、赵晓东、郑艳杰、周利平、周人杰、周荣斌、朱华栋、朱继红、朱长举、左永波
利益冲突 所有作者均声明不存在利益冲突
| [1] | Wen LS, Xu J, Steptoe AP, et al. Emergency department characteristics and capabilities in Beijing, China[J]. J Emerg Med, 2013, 44(6): 1174-1179. DOI:10.1016/j.jemermed.2012.07.083 |
| [2] | Wang Z, Xiong XY, Wang S, et al. Causes of emergency department overcrowding and blockage of access to critical services in Beijing: a 2-year study[J]. J Emerg Med, 2018, 54(5): 665-673. DOI:10.1016/j.jemermed.2018.02.009 |
| [3] | Ali R. Emergency medicine in China: redefining a specialty[J]. J Emerg Med, 2001, 21(2): 197-207. DOI:10.1016/s0736-4679(01)00372-9 |
| [4] | Sherwin R, Winters ME, Vilke GM, et al. Does early and appropriate antibiotic administration improve mortality in emergency department patients with severe sepsis or septic shock?[J]. J Emerg Med, 2017, 53(4): 588-595. DOI:10.1016/j.jemermed.2016.12.009 |
| [5] | Denny KJ, Gartside JG, Alcorn K, et al. Appropriateness of antibiotic prescribing in the emergency department[J]. J Antimicrob Chemother, 2019, 74(2): 515-520. DOI:10.1093/jac/dky447 |
| [6] | Dellit TH, Owens RC, McGowan JE, et al. Infectious diseases society of America and the society for healthcare epidemiology of America guidelines for developing an institutional program to enhance antimicrobial stewardship[J]. Clin Infect Dis, 2007, 44(2): 159-177. DOI:10.1086/510393 |
| [7] | Carugati M, Franzetti F, Wiemken T, et al. De-escalation therapy among bacteraemic patients with community-acquired pneumonia[J]. Clin Microbiol Infect, 2015, 21(10): 936.e11-936.e18. DOI:10.1016/j.cmi.2015.06.015 |
| [8] | Napolitano LM. Sepsis 2018: definitions and guideline changes[J]. Surg Infect (Larchmt), 2018, 19(2): 117-125. DOI:10.1089/sur.2017.278 |
| [9] | Singer M, Deutschman CS, Seymour CW, et al. The third international consensus definitions for sepsis and septic shock (Sepsis-3)[J]. JAMA, 2016, 315(8): 801-810. DOI:10.1001/jama.2016.0287 |
| [10] | Wacker C, Prkno A, Brunkhorst FM, et al. Procalcitonin as a diagnostic marker for sepsis: a systematic review and meta-analysis[J]. Lancet Infect Dis, 2013, 13(5): 426-435. DOI:10.1016/s1473-3099(12)70323-7 |
| [11] | Huang DT, Yealy DM, Filbin MR, et al. Procalcitonin-guided use of antibiotics for lower respiratory tract infection[J]. N Engl J Med, 2018, 379(3): 236-249. DOI:10.1056/nejmoa1802670 |
| [12] | Liu Y, Hou JH, Li Q, et al. Biomarkers for diagnosis of sepsis in patients with systemic inflammatory response syndrome: a systematic review and meta-analysis[J]. SpringerPlus, 2016, 5(1): 1-10. DOI:10.1186/s40064-016-3591-5 |
| [13] | Grenet J, Davido B, Bouchand F, et al. Evaluating antibiotic therapies prescribed to adult patients in the emergency department[J]. Med Mal Infect, 2016, 46(4): 207-214. DOI:10.1016/j.medmal.2016.04.006 |
| [14] | Morgan DJ, Dhruva SS, Wright SM, et al. Update on medical practices that should be questioned in 2015[J]. JAMA Intern Med, 2015, 175(12): 1960-1964. DOI:10.1001/jamainternmed.2015.5614 |
| [15] | Kroenke K. A practical and evidence-based approach to common symptoms: a narrative review[J]. Ann Intern Med, 2014, 161(8): 579-586. DOI:10.7326/m14-0461 |
| [16] | Reilly BM. Physical examination in the care of medical inpatients: an observational study[J]. Lancet, 2003, 362(9390): 1100-1105. DOI:10.1016/s0140-6736(03)14464-9 |
| [17] | 于学忠, 周荣斌, 陈旭岩, 等. 2015年中国急诊社区获得性肺炎临床实践指南--疾病诊断篇[J]. 中国急救医学, 2015, 35(12): 1057-1062. DOI:10.3969/j.issn.1002-1949.2015.12.001 |
| [18] | 郑亮亮, 张新超. 急诊成人社区获得性肺炎治疗的几点思考[J]. 中国急救医学, 2020, 40(1): 7-9. DOI:10.3969/j.issn.1002-1949.2020.01.002 |
| [19] | Shindo Y, Hasegawa Y. Regional differences in antibiotic-resistant pathogens in patients with pneumonia: Implications for clinicians[J]. Respirology, 2017, 22(8): 1536-1546. DOI:10.1111/resp.13135 |
| [20] | Adhikari NKJ, Rubenfeld GD. qSOFA score for patients with sepsis in low- and middle-income countries[J]. JAMA, 2018, 319(21): 2175. DOI:10.1001/jama.2018.6413 |
| [21] | Levy MM, Evans LE, Rhodes A. The surviving sepsis campaign bundle: 2018 update[J]. Crit Care Med, 2018, 46(6): 997-1000. DOI:10.1097/ccm.0000000000003119 |
| [22] | Morr M, Lukasz A, Rübig E, et al. Sepsis recognition in the emergency department – impact on quality of care and outcome?[J]. BMC Emerg Med, 2016, 17: 11. DOI:10.1186/s12873-017-0122-9 |
| [23] | Buckman SA, Turnbull IR, Mazuski JE. Empiric antibiotics for Sepsis[J]. Surg Infect (Larchmt), 2018, 19(2): 147-154. DOI:10.1089/sur.2017.282 |
| [24] | Cecconi M, Evans L, Levy M, et al. Sepsis and septic shock[J]. Lancet, 2018, 392(10141): 75-87. DOI:10.1016/s0140-6736(18)30696-2 |
| [25] | Jain S. Sepsis: an update on current practices in diagnosis and management[J]. Am J Med Sci, 2018, 356(3): 277-286. DOI:10.1016/j.amjms.2018.06.012 |
| [26] | 金魁, 徐军, 于学忠. Sepsis与感染性休克的急诊救治及流程优化[J]. 协和医学杂志, 2018, 9(5): 389-392. DOI:10.3969/j.issn.1674-9081.2018.05.002 |
| [27] | Rhodes A, Evans LE, Alhazzani W, et al. Surviving sepsis campaign: international guidelines for management of sepsis and septic shock: 2016[J]. Intensive Care Med, 43(3): 304-377. DOI:10.1007/s00134-017-4683-6 |
| [28] | Wongsurakiat P, Chitwarakorn N. Severe community-acquired pneumonia in general medical wards: outcomes and impact of initial antibiotic selection[J]. BMC Pulm Med, 2019, 19(1): 179. DOI:10.1186/s12890-019-0944-1 |
| [29] | Carugati M, Aliberti S, Reyes LF, et al. Microbiological testing of adults hospitalised with community-acquired pneumonia: an international study[J]. ERJ Open Res, 2018, 4(4): 00096-2018. DOI:10.1183/23120541.00096-2018 |
| [30] | Suwanpimolkul G, Pongkumpai M, Suankratay C. A randomized trial of 2% chlorhexidine tincture compared with 10% aqueous povidone-iodine for venipuncture site disinfection: Effects on blood culture contamination rates[J]. J Infect, 2008, 56(5): 354-359. DOI:10.1016/j.jinf.2008.03.001 |
| [31] | Little JR, Murray PR, Traynor PS, et al. A randomized trial of povidone-iodine compared with iodine tincture for venipuncture site disinfection: effects on rates of blood culture contamination[J]. Am J Med, 1999, 107(2): 119-125. DOI:10.1016/s0002-9343(99)00197-7 |
| [32] | Verliat-Guinaud J, Blanc P, Garnier F, et al. A midstream urine collector is not a good alternative to a sterile collection method during the diagnosis of urinary tract infection[J]. Acta Paediatr, 2015, 104(9): e395-e400. DOI:10.1111/apa.13019 |
| [33] | LaRocco MT, Franek J, Leibach EK, et al. Effectiveness of preanalytic practices on contamination and diagnostic accuracy of urine cultures: a laboratory medicine best practices systematic review and meta-analysis[J]. Clin Microbiol Rev, 2016, 29(1): 105-147. DOI:10.1128/CMR.00030-15 |
| [34] | Bernal-Vargas MA, Cortés JA. Duration of treatment and oral administrad on of antibiotics in community acquired pneumonia[J]. Rev Chilena Infectol, 2016, 33(2): 177-186. DOI:10.4067/s0716-10182016000200007 |
| [35] | Veiga RP, Paiva JA. Pharmacokinetics-pharmacodynamics issues relevant for the clinical use of beta-lactam antibiotics in critically ill patients[J]. Crit Care, 2018, 22(1): 233. DOI:10.1186/s13054-018-2155-1 |
| [36] | Yahav D, Franceschini E, Koppel F, et al. Seven versus 14 days of antibiotic therapy for uncomplicated gram-negative bacteremia: a noninferiority randomized controlled trial[J]. Clin Infect Dis, 2019, 69(7): 1091-1098. DOI:10.1093/cid/ciy1054 |
| [37] | Hanretty AM, Gallagher JC. Shortened courses of antibiotics for bacterial infections: a systematic review of randomized controlled trials[J]. Pharmacotherapy, 2018, 38(6): 674-687. DOI:10.1002/phar.2118 |
| [38] | Seymour CW, Rea TD, Kahn JM, et al. Severe sepsis in pre-hospital emergency care[J]. Am J Respir Crit Care Med, 2012, 186(12): 1264-1271. DOI:10.1164/rccm.201204-0713oc |
| [39] | Báez AA, Hanudel P, Perez MT, et al. Prehospital sepsis project (PSP): knowledge and attitudes of United States advanced out-of-hospital care providers[J]. Prehosp Disaster Med, 2013, 28(2): 104-106. DOI:10.1017/s1049023x12001744 |
| [40] | Ginde AA, Moss M. Has the time for advanced pre-hospital care of severe sepsis finally arrived?[J]. Am J Respir Crit Care Med, 2012, 186(12): 1204-1205. DOI:10.1164/rccm.201210-1895ed |
| [41] | Becker B, Cooper MA. Aminoglycoside antibiotics in the 21st century[J]. ACS Chem Biol, 2013, 8(1): 105-115. DOI:10.1021/cb3005116 |
| [42] | Serio AW, Keepers T, Andrews L, et al. Aminoglycoside revival: review of a historically important class of antimicrobials undergoing rejuvenation[J]. Ecosal Plus, 2018, 8(1). DOI:10.1128/ecosalplus.esp-0002-2018 |
| [43] | Pitiriga V, Dimitroulia E, Saroglou G, et al. The challenge of curbing aminoglycoside resistance: can antimicrobial stewardship programs play a critical role?[J]. Expert Rev Anti Infect Ther, 2017, 15(10): 947-954. DOI:10.1080/14787210.2017.1382355 |
 2020, Vol. 29
2020, Vol. 29




