2 浙江大学医学院附属第二医院肾内科,杭州 310009;
3 建德市第一人民医院肾内科 311600
Gitelman综合征(gitelman syndrome,GS)是一种以顽固性低血钾、低血镁、低尿钙、代谢性碱中毒、正常或偏低血压以及继发性肾素-血管紧张素-醛固酮系统(Renin Angiotensin Aldosterone System, RAAS)激活为临床特点的常染色体隐性遗传肾小管疾病[1]。该病由Gitelman等[2]在1996年首次报道,病因是编码位于远曲小管的噻嗪类利尿剂敏感的钠氯共同转运体(sodium chloride cotransporter, NCCT)蛋白的基因SLC12A3发生失活性突变, 从而导致肾脏远曲小管对钠、氯的重吸收障碍[3]。由于GS患者存在长期的低钾低镁血症,可能导致糖代谢异常,心律失常,肾功能受损等并发症而影响预后,因此早期诊断,合理治疗非常必要[4]。由于GS在人群中的患病率低[5],因此基层医院对该病认识度并不高,而甲亢较为常见,部分可引起低钾型周期性麻痹。甲亢及GS均可引起低钾血症,当两者同时出现的时候,容易出现漏诊GS情况。现报道一例先误诊为甲亢引起的低钾型周期性麻痹,但因甲亢缓解后,仍有持续性低钾血症,最终诊断为甲亢合并GS的一例低钾血症患者,并结合文献进行分析,旨在加强基层内分泌科医生对GS的认识。
1 资料与方法 1.1 基本病史患者,女,50岁,因“发现低钾血症2年,头晕乏力1 d”于2019年8月27日入院。患者2年前体检发现低钾血症,当时血钾2.9 mmol/L,自觉无四肢酸软,无头晕头痛,无胸闷气促等不适,后多次在当地社区复查血电解质,血钾波动在2.6~3.0 mmol/L;予口服补钾治疗可稍缓解。8月前因“心悸手抖”在外院就诊,发现促甲状腺激素(TSH)降低,游离三碘甲状腺原氨酸(FT3)、游离甲状腺素(FT4)升高,甲状腺过氧化物酶抗体(TPOAb)阳性,血钾2.6 mmol/L,诊断考虑“甲亢,低钾型周期性麻痹”,予甲巯咪唑每日10 mg口服,辅予口服补钾治疗,心悸手抖症状缓解,TSH恢复正常,但低钾血症仍持续存在,血钾波动在2.8~3.0 mmol/L。1 d前患者自觉头晕,伴乏力,无明显四肢软瘫及麻木,来本院就诊,测血钾2.66 mmol/L,急诊予口服及静脉补钾后复测血钾2.59 mmol/L,为进一步明确低钾血症原因收住入本科。入科后详细询问患者既往病史,否认口干,多饮多尿,夜尿增多,遗尿,嗜盐,腹痛便秘,四肢关节疼痛及手足抽搐等不适,否认口服利尿剂史。生长发育正常,月经可,育有1子,体健。父母非近亲结婚,父亲已故,母亲体健,否认家族中有类似病史。
1.2 体格检查患者身高150 cm,体质量53 kg,BMI:23.6;血压113/57 mmHg;体型中等,发育正常,营养正常,无突眼,甲状腺未及肿大,双手无细颤,心肺无殊,腹平软,四肢肌力Ⅳ级。
1.3 辅助检查入院后查:动脉血气分析示:pH:7.490(7.35~7.45),PO2:81 mmHg(83.0~108.0 mmHg),PCO2:43 mmHg(35.0~48.0 mmHg),HCO3-:32.8mmol/L(22.0~29.0 mmol/L),BE:8.5 mmol/L(-2~3 mmmol/L);血电解质:钾2.66 mmol/L(参考值3.5~5.3 mmol/L),镁0.62 mmol/L(参考值:0.75~1.02 mmol/L), 钠140 mmol/L(参考值137~147 mmol/L),氯97 mmol/L(参考值:99~110 mmol/L),钙2.44 mmol/L(参考值:2.36~2.44 mmol/L);24 h尿(尿量1 800 mL):钾61.8 mmol,钙0.13 mmol,氯146.9 mmol,钠91.3 mmol;RAAS系统(卧位):醛固酮:173.75 ng/L(参考值:30~180 ng/L),肾素活性:5.94 μg/L/h;(参考值:0.13~1.74 μg/L/h);RAAS系统(立位):醛固酮:186.47 ng/L(参考值:50~313 ng/L),肾素活性:3.47 μg/(L·h);(参考值:1.45~5.00 μg/L/h);甲状腺功能:TSH:3.404 mIU/L(参考值:0.490~4.910 mIU/L);FT4:0.88 ng/dL(参考值:0.59~1.25 ng/dL);TPOAb:69.4 IU/L(参考值:0.00~9 IU/L);心电图示:窦性心律;U波增高;QTc(校正):459 ms;肾上腺CT:左侧肾上腺略增粗改变。
1.4 诊断依据患者2年前常规体检中发现低钾血症,后多次复查电解质,血钾均偏低,提示患者为慢性低钾血症,24 h尿钾偏高,提示肾脏失钾,不符合转移性低钾,甲状腺功能正常后,予口服及静脉同时补钾效果仍不佳,故不支持甲亢引起的低钾型周期性麻痹。患者入院后多次复查电解质均提示低钾、低镁血症,血气分析提示失代偿代谢性碱中毒,卧位肾素活性增高但血压正常,查阅相关文献后诊断首先考虑Gitelman综合征。为进一步明确诊断,予基因检测。基因检测结果示:发现SLC12A3基因有两个杂合突变,为复合杂合突变,其中c.863T > G突变为新发突变(图 1A, 1B),根据患者病史,实验室检查和基因检测结果,诊断GS明确。
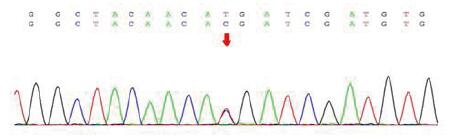
|
| 图 1A 患者SLC12A3基因携带一个c.179C > T(p.Thr60Met)杂合突变。 |
|
|

|
| 图 1B 患者SLC12A3基因携带一个c.863T > G(p.Leu288Arg)杂合突变,为新发突变 |
|
|
入院后予10%氯化钾15 mL+硫酸镁注射液2.5 g+0.9%氯化钠500 mL静滴,口服门冬氨酸钾镁片,并鼓励患者多摄入富含钾及镁的食物,出院当日复查血钾2.95 mmol/L,血镁0.57 mmol/L,患者乏力头晕缓解,予出院,院外继续口服氯化钾缓释片每日2.0 g,门冬氨酸钾镁每日6片。患者出院1月后在本科门诊复查电解质,血钾:2.99 mmol/L,血镁0.67 mmol/L,在原治疗基础上加用螺内酯每日20 mg,1月后患者再次复查电解质:血钾3.94 mmol/L,血镁0.75 mmol/L。
2 讨论甲亢常可以引起低钾血症,其机制目前多认为是由于甲状腺激素提高了细胞膜上Na+-K+-ATP酶活性,β受体数量增加,K+向细胞内转移加速, 导致转移性低钾血症的发生,另外甲亢时植物神经功能紊乱, 醛固酮、胰岛素分泌增加, 组织对儿茶酚胺的敏感性加强,加速钾的利用也是导致低钾血症的原因[6]。此类患者的低钾血症为急性,发作时会有典型的周期性麻痹表现,出现发作性四肢或双下肢迟缓性瘫痪,予补钾治疗可迅速缓解瘫痪症状,且抗甲亢治疗后可有效控制周期性麻痹的复发[7]。由于该患者有甲亢病史,因此在急诊入院后首先考虑甲亢引起的低钾周期性麻痹,但该患者表现为慢性低钾血症,甲亢缓解后低钾血症仍持续存在,且入院后24 h尿电解质提示肾脏失钾,不符合甲亢所致转移性低钾血症。因此,此时需要考虑其他原因所致慢性低钾血症,患者有肾脏失钾,低镁血症,尿钙不高,失代偿性代谢性碱中毒,RAAS激活但血压不高等临床特点,因此考虑到该患者可能还存在GS,进一步的基因分析证实了GS的诊断。
GS患者的临床表现有很大的个体差异,部分患者可完全没有任何临床症状,只在常规体检中发现低钾血症,从而进一步被确诊[8]。自1996年其致病基因被成功克隆后,至今已发现的SLC12A3基因突变类型共有443种[9],包括错义突变、剪切突变、无义突变、读码框位移突变等, 其中大部分以错义突变为主[10]。其致病机制是由于SLC12A3的突变导致位于肾远曲小管的噻嗪类利尿剂敏感的NCCT的功能丧失,从而引起的肾脏远曲小管对钠氯重吸收障碍导致的低血容量、RAAS激活、低钾血症和代谢性碱中毒等一系列病理生理和临床表现[4, 11]。有研究发现,中国人的SLC12A3基因主要突变类型为Thr60Met,突变率达33%[8]。本例患者的突变位点有两处,均为错义突变,第一处位点为c.179C > T,导致相应的氨基酸改变为p.Thr60Met,此突变位点符合中国人的常见变异点,ClinVar数据库收录该异位点为致病变异。第二处位点为c.863T > G,导致相应的氨基酸改变为p.Leu288Arg,查询HGMD,ClinVar等公共数据库显示该突变的致病性无相关报道,为新发突变。
目前GS的治疗主要为对症治疗,包括鼓励患者多进食含有氯化钠的食物,口服或静脉补钾和(或)补镁,需个体化及终身治疗。如患者存在低镁血症,应首先补镁以助维持正常血钾水平。同时建议将患者的血钾和血镁水平分别至少维持在3.0 mmo/L及0.6 mmol/L以上,如出现补钾效果不佳,也可考虑保钾利尿剂、肾素-血管紧张素阻断剂或非甾体抗炎药[4]。有研究认为醛固酮拮抗剂螺内酯或依普利酮可改善GS患者的症状,另外氨苯喋啶和阿米洛利可通过选择性阻断肾小管上皮细胞的钠离子通道,抑制钠离子的重吸收,从而发挥保钾的作用[11-12]。由于肾素-血管紧张素拮抗剂(血管紧张素转换酶抑制剂/血管紧张素受体拮抗剂)可以抑制RAAS活性,也可考虑使用,但此类药物会引起血压下降,因此使用时需谨慎。另外也有报道称非甾体抗炎药如消炎痛、罗非考昔可治疗GS引起的顽固性低钾血症[13-14]。
该患者甲状腺功能提示TPOAb(+),考虑患者属于自身免疫性甲状腺疾病。目前对于GS合并自身免疫性甲状腺疾病的病例报道并不多,因此没有足够证据证明这两种疾病是否存在相关性。随着基因检测的价格下降和对遗传性疾病认识的提高,基因诊断技术也逐渐普及,因此当甲亢患者出现顽固性低钾血症时,尤其是合并低镁血症,尿钙不高,代谢性碱中毒等,需考虑到患者是否合并有GS可能,进一步完善基因检查以明确诊断,以避免漏诊。
利益冲突 所有作者均声明不存在利益冲突。
| [1] | Berry MR, Robinson C, Karet Frankl FE. Unexpected clinical sequelae of Gitelman syndrome: hypertension in adulthood is common and females have higher potassium requirements[J]. Nephrol Dial Transplant, 2013, 28(6): 1533-1542. DOI:10.1093/ndt/gfs600 |
| [2] | Gitelman HJ, Graham JB, Welt LG. A familial disorder characterized by hypokalemia and hypomagnesemia[J]. Ann N Y Acad Sci, 1969, 162(2): 856-864. DOI:10.1111/j.1749-6632.1969.tb13015.x |
| [3] | Melander O, Orho-Melander M, Bengtsson K, et al. Genetic variants of thiazide-sensitive NaCl-cotransporter in gitelman's syndrome and primary hypertension[J]. Hypertension, 2000, 36(3): 389-394. DOI:10.1161/01.hyp.36.3.389 |
| [4] | Gitelman综合征诊治专家共识协作组. Gitelman综合征诊治专家共识[J]. 中华内科杂志, 2017, 56(9): 712-716. |
| [5] | Tago N, Kokubo Y, Inamoto N, et al. A high prevalence of gitelman's syndrome mutations in Japanese[J]. Hypertens Res, 2004, 27(5): 327-331. DOI:10.1291/hypres.27.327 |
| [6] | 王家驰. 弥漫性甲状腺肿伴甲亢与低钾血症[J]. 中国实用内科杂志, 2001(09): 515-516. |
| [7] | 叶梦萱. 以低钾周期性麻痹为首诊的甲亢42例临床观察[J]. 内科急危重症杂志, 2009, 15(04): 209-214. |
| [8] | 秦岭, 邵乐平, 任红, 等. 中国人Gitelman综合征高发突变的基因型和表型特征[J]. 肾脏病与透析肾移植杂志, 2018, 17(4): 331-334. DOI:10.3969/J.ISSN.1006-298X.2008.04.006 |
| [9] | Luo JW, Yang X, Liang JX, et al. A pedigree analysis of two homozygous mutant Gitelman syndrome cases[J]. Endocr J, 2015, 62(1): 29-36. DOI:10.1507/endocrj.ej14-0289 |
| [10] | Monnens L. Gitelman syndrome comes of age[J]. Nephrol Dial Transplant, 1998, 13(7): 1617-1619. DOI:10.1093/ndt/13.7.1617 |
| [11] | Nakhoul F, Nakhoul, Dorman E, et al. Gitelman's syndrome: a pathophysiological and clinical update[J]. Endocrine, 2012, 41(1): 53-57. DOI:10.1007/s12020-011-9556-0 |
| [12] | Knoers NV, Levtchenko EN. Gitelman syndrome[J]. Orphanet J Rare Dis, 2008, 3: 22. DOI:10.1186/1750-1172-3-22 |
| [13] | Mayan H, Gurevitz O, Farfel Z. Successful treatment by cyclooxyenase-2 inhibitor of refractory hypokalemia in a patient with Gitelman's syndrome[J]. Clin Nephrol, 2002, 58(7): 73-76. DOI:10.5414/cnp58073 |
| [14] | 陶红, 戴为信, 陆召麟, 等. Gitelman综合征——附二例报道[J]. 中华内分泌代谢杂志, 2003, 19(4): 33-35. DOI:10.3760/j.issn.1000-6699.2003.04.009 |
 2020, Vol. 29
2020, Vol. 29




