2 浙江大学医学院附属邵逸夫医院急诊科,杭州 310016;
3 浙江大学医学院附属邵逸夫医院重症医学科,杭州 310016;
4 浙江大学,杭州 310058
2 Department of Emergency Medicine, Run Run Shaw Hospital, Zhejiang University School of Medicine, Hangzhou 310016, China;
3 Department of Critical Care Medicine, Run Run Shaw Hospital, Zhejiang University School of Medicine, Hangzhou 310016, China;
4 Zhejiang University, Hangzhou 310058, China
急性胰腺炎(acute pancreatitis, AP)是临床医生面临的常见疾病,其全世界发病率为每年34/10万,大约每10万人中既有1.6人死于急性胰腺炎,并且发病率还有逐年增高趋势[1-2]。目前认为其发病机制为各种原因引起的胰酶激活,胰酶消化自身组织导致胰腺腺泡细胞死亡,从而继发胰腺局部甚至全身炎症反应。
亚特兰大分类标准根据严重程度将AP分为3种:(1)轻症急性胰腺炎(MAP)指没有并发器官衰竭和不存在局部/全身并发症,患者病死率很低。(2)中重症急性胰腺炎(MSAP)以存在短暂的器官衰竭(持续时间 < 48 h)或局部/全身并发症,但不存在持续的器官功能衰竭。(3)重症急性胰腺炎(SAP)以持续的器官功能衰竭为特征,器官功能衰竭发持续时间 > 48 h[3]。AP患者约20%会发展为SAP,SAP病死率明显增高,高达30%~50%[4]。由此可见,早期识别可能发展为SAP的患者对于指导治疗意义重大。
机器学习是一种多层描述的表征学习,从已有数据中分析挖掘获得规律,并利用这些规律对未知数据做出预测的算法。近年来,机器学习在社会各个领域都具有很高的热度,在策略类竞技项目中更是大显身手。因此,不难想到,当机器学习与策略性要求极高的医疗行为相结合很可能会带来突破性的进展。机器学习已经应用于许多癌症方面的研究,如癌症的早期筛查、危险因素分析、预后等[5]。而在疾病的发生、恶化发展与诊疗策略的优化等医疗核心领域,近年来也不断地在取得成果。Google在其Deep Mind在AlphaGo取得划时代的成果后,也在2018年2月与美国的老兵协会合作,尝试通过对AKI的的预测、恶化发展评估来建立疾病的恶化发展评估体系。但目前尚未有研究通过机器学习建立一种SAP预测评分系统。因此,本团队通过机器学习的手段对本院历年的AP患者数据进行学习,结合前沿算法,建立一个低时延标准化的SAP预测评分系统,从而大幅度提高SAP的预测的准确率,减少因延迟诊断导致的大量医疗成本,并降低因医务人员经验不同所带来的误差。
1 资料与方法 1.1 数据来源本研究数据提取自浙江大学医学院附属邵逸夫医院医疗数据库。该院建院早期即致力于患者信息结构化系统,以便于之后的数据研究,并于2016年成立胰腺中心,因此在机器学习研究方面具有先天优势。本研究已通过浙江大学医学院附属邵逸夫医院伦理委员会审查(科研20190725-287)。
1.2 研究对象根据排纳标准及诊断名称,从数据库中筛选出1 397例研究对象,共130万条数据元组。纳入标准:①年龄 > 18岁;②收住入院,并且第一次因该疾病入院;③入院后完善所需检查指标。排除标准:①未收治入院;②非首次因该疾病入院;③入院后检查结果大量缺失。
1.3 重症胰腺炎诊断标准急性胰腺炎的严重性评估,基本上是采用亚特兰大分类系统[3]。重症急性胰腺炎的发作具有持续性(> 48 h)的器官衰竭,可为单器官衰竭或多器官衰竭。指南指出,应评估三个器官系统来定义器官衰竭:呼吸系统、心血管系统和肾脏。为了给机器一个具体可执行的条件,选择改良的Marshall评分系统(表 1)定义器官衰竭,即当该器官的Marshall评分为2分或2分以上时为器官衰竭[6]。因此,本研究为机器学习设置的SAP诊断条件为存在下列情况中的一项:①P/F比值< 201、②血肌酐 > 311μmol/L、③血压 < 90 mmHg,并且对补液没有反应;并且入院后持续了48 h。
| 器官 | 分数 | ||||
| 0 | 1 | 2 | 3 | 4 | |
| 呼吸系统(PaO2/FiO2) | > 400 | 301~400 | 201~300 | 101~200 | ≤101 |
| 肾功能(肌酐,μmol/L) | ≤134 | 134~169 | 170~310 | 311~439 | >439 |
| 心血管系统(收缩压,mmHg) | >90 | <90对补液有反应 | <90对补液无反应 | <90 pH<7.3 | <90 pH<7.2 |
研究首先收集了34个变量,一方面,包括患者人口统计学参数,年龄、性别;另一方面,还纳入患者临床生理参数,包括血压、呼吸、心率、体温、血钾、血钠、血钙、肌酐、尿素氮、同型半胱氨酸、乳酸、碱剩余、氧分压、P/F比值、总胆红素、谷草转氨酶、谷丙转氨酶、谷氨酰转肽酶、红细胞计数、红细胞压积、红细胞体积、红细胞蛋白量、白细胞计数、中性粒细胞百分比、嗜酸粒细胞百分比、嗜碱性粒细胞百分比、单核细胞百分比、中性粒细胞计数、嗜酸粒细胞计数、嗜碱性粒细胞计数、单核细胞计数、血小板计数。我们以每小时组织这些数据,即在进入住院状态后按小时记录每位患者每天的这些字段的值。缺失值补充零。其次是在步骤1中使用相同的机制将数据聚合到每个患者的数据集中;所有缺失的数据将使用K-Mean方法对缺失值进行插值;最后,将3 d的数据拼接在一起作为预测模型的输入,从而形成输入数据的特征向量。
1.4.2 模型训练本研究采用自研发DBN(Deep Belief Network)程序对训练数据组进行训练,建立模型。计算的统计参数,包括TPR(敏感性,真阳性率),SPC(特异性,阴性阳性率),PPV(阳性预测值),NPV(阴性预测值),ACC(准确度),AUC(ROC下的面积)。
1.4.3 特征排名选取互信息(MI, Mutual Information)来描述单个特征与模型预测SAP发生准确性的相关性。互信息是信息论中的一个重要概念,它是衡量随机变量之间相互依赖程度的度量。互信息由随机变量的联合概率分布和边缘概率分布计算得出,其数值越大,表示当知晓该特征时,预测患者发生SAP的准确度提升越大。在本文中,称MI为危险因子(risk factor)。
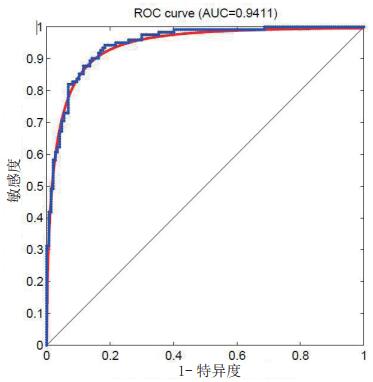
2 结果 2.1 模型建立本研究分析了1 397例研究对象的住院数据,其中重症胰腺炎患者386例。基线数据如下(表 2)。通过机器学习建立的SAP评分系统,其TPR 84.43%,SPC 89.80%,ACC可达87.36%,AUC 94.11%(图 1)。
| 项目 | 入院基线数据值 |
| 年龄 | 59±12 |
| 性别 | |
| 男 | 921 |
| 女 | 476 |
| P/F | 317.47±112.24 |
| 氧分压(cmH2O) | 89.27±23.55 |
| 红细胞压积(%) | 38.16±7.35 |
| 中性粒细胞绝对数(×109/L) | 9.74±5.63 |
| 谷氨酰转肽酶(U/L) | 192.00±175.29 |
| 中性粒百分数(%) | 80.51±11.92 |
| 血钙(mmol/L) | 2.07±0.54 |
| 红细胞计数(×1012/L) | 4.23±0.86 |
| 谷丙转氨酶(U/L) | 87.95±193.61 |
| 血小板计数(×109/L) | 192.76±79.61 |
|
| 图 1 SAP预测模型的ROC曲线 Fig 1 ROC curve of SAP prediction model |
|
|
本研究列举了模型中的特征排名中的前十项(表 3)。发现入院24 h的P/F比值、氧分压、红细胞压积、中性粒细胞绝对数在模型计算中比重最重。由此可见,在临床工作中需要特别关注这几个指标值,以预判患者有无较大可能发展为SAP。
| 编号 | 项目 | 危险因子 |
| 1 | P/F比值 | 0.2368 |
| 2 | 氧分压 | 0.2334 |
| 3 | 红细胞压积 | 0.2095 |
| 4 | 中性粒细胞绝对数 | 0.2062 |
| 5 | 谷氨酰转肽酶 | 0.1911 |
| 6 | 中性粒百分数 | 0.1813 |
| 7 | 钙 | 0.1716 |
| 8 | 红细胞计数 | 0.1497 |
| 9 | 谷丙转氨酶 | 0.1454 |
| 10 | 血小板计数 | 0.1425 |
早期识别可能发展为SAP的患者对于指导治疗意义重大。为了解决这个问题,国内外的研究者提出了多种评分系统。其中较为得到认可的是Ranson评分及急性生理和慢性健康状况评分(acute physiology and chronic health evaluation Ⅱ, APACHE Ⅱ)评分。(1)Ranson评分[7]:Ranson评分由11个指标组成,一部分需要在入院时完成检测,而另一部分需要在入院48 h时完成,当评分≥3分时表示可能存在SAP。(2)APACHE Ⅱ评分:APACHE Ⅱ评分是Knaus等[8]提出的患者预后预测评分,该评分并非SAP的专属评分系统,它几乎可以应用于所有ICU患者,其中当APACHE Ⅱ评分≥8分时表示可能存在SAP。然而,这两种评分并不完善。Ranson评分需要在入院48 h才能完成,具有较长的时延性,患者转入普通病房后又在24 h内因呼吸衰竭转入ICU,增加住院费用,也增加了住院管理风险。APACHE评分虽然敏感性高,但是其很多参数需要ICU环境才能测定,并且也具有时延性,对于局部并发症的预测方面也存在缺陷[9]。另外,序贯器官衰竭估计评分(sequential organ failure assessment, SOFA)、改良早期预警评分(modified early warning score, MEWS)、日本严重度评分(Japanese severe score, JSS)、胰腺炎结局预测(pancreatitis outcome prediction, POP)评分系统等是近几年新提出的评分系统[10-13],这些评分对于SAP预测或具有延时性,或缺乏足够的研究证据,均不够完善。不难发现,SAP预测评分系统的数量很多,但至今尚未存在足够完善的评分系统,笔者认为出现这个现象可能是因为目前所有的评分系统其建立的基础均停留在传统统计学层面,受制于“小数据”的限制。因此,本研究选择通过大数据驱动的机器学习来建立一个早期SAP预测评分。实验中,本模型学习了1397例患者的130万条数据,通过前沿算法,得到了不错的准确度及AUC。这种方法突破了传统统计学的极限,让病例中大量的参数得到应用,即便目前仅使用了本院的数据,但其可靠性足以提供临床建议,从而降低住院管理风险,也降低了住院费用。从特征排名发现,模型采用指标与APACHE Ⅱ有较多重合,但又添加了更多与胰腺炎相关的指标,例如血钙、肝功能等,体现了模型对传统评分的继承以及总结。
一个足够优秀的SAP评分系统除了需要利用好已经拥有的旧数据,还需要利用好其他研究者发现的新检测指标。最近的一项实验通过测定胰腺炎小鼠血清中的miR-216a水平发现miR-216a可能是的SAP早期预测标志物[14]。其他一些临床报道发现患者血清中的胰腺磷脂酶A(2)、血管生成素2(angiopoietin-2,Ang-2)可以早期预测SAP的发生[15-16]。一项来自中国的临床报道分析了169名AP患者的临床数据,发现前白蛋白/纤维蛋白原比值小于31.70 mg/g可以预测SAP的发生,其ROC曲线分析显示,前白蛋白/纤维蛋白原比值对SAP预测的敏感性、特异性、阳性预测值和阴性预测值分别为76.5%、94.1%、89.6%、85.6% [17]。另一项来自中国的临床报道分析了自2014年至2017年的375例AP患者,发现入院时血清载脂蛋白(apolipoprotein, Apo)ApoB/A1比值大于0.88时可提示患者可能发展为SAP,灵敏度为83.08%,特异性为69.03%[18]。此外,心肌损伤标记物cTnI和CK-MB[19]以及强离子隙(SIG)[20]对SAP也有一定的预测价值。如果在其他形式的模型中,这些研究成果就很难得到应用。而基于机器学习的SAP评分系统的另一个优势就在于,可以添加新的参数,当其他研究者发现新的预测因素时,可以在数据库中添加新的自变量,优化模型,从而吸收利用最新的研究成果。
本团队致力于建立一个足够完善的基于机器学习的SAP早期预测评分,但目前数据仅源于单中心数据库。由于治疗措施会影响SAP的发展,根据单中心建立的模型难以具备足够的可信度,其准确性需要得到多中心数据的验证与支持。在未来的研究中,将采用MIMIC-ⅡI(Medical Information Mart for Intensive Care, MIT),eICU(The eICU Collaborative Research Database, Philips Healthcare)等数据集来验证模型。同时,笔者将在国内继续推广该SAP预测评分,以期获得更多的数据以构建更早期更完善的评分模型。
综上所述,本研究基于机器学习建立了一个SAP预测评分系统,其可在入院24 h对患者SAP风险进行预测,预测准确率高达87.36%,AUC 94.11%。在该模型的指导下,不同年资的医生都能更为准确的识别治疗介入时机,并进行相关干预。
利益冲突 所有作者均声明不存在利益冲突。
| [1] | Xiao A Y, Tan M L Y, Wu L M, et al. Global incidence and mortality of pancreatic diseases: a systematic review, meta-analysis, and meta-regression of population-based cohort studies[J]. The Lancet Gastroenterology & Hepatology, 2016, 1(1): 45-55. DOI:10.1016/S2468-1253(16)30004-8 |
| [2] | Roberts S E, Morrison-Rees S, John A, et al. The incidence and aetiology of acute pancreatitis across Europe[J]. Pancreatology, 2017, 17(2): 155-165. DOI:10.1016/j.pan.2017.01.005 |
| [3] | Banks PA, Bollen TL.Dervenis C, et al. Classification of acute pancreatitis--2012:revision of the Atlanta classification and definitions by international consensus[J]. Gut, 2013, 62(1): 102-111. DOI:10.1136/gutjnl-2012-302779 |
| [4] | SandLer RS, Everhart JE.Donowitz M, et al. The burden of selected digestive diseases in the United States[J]. Gastroenterology, 2002, 122(5): 1500-1511. DOI:10.1053/gast.2002.32978 |
| [5] | Tseng cJ, LU CJ, Chang CC, et al. Application of machine learning to predict the recurrence—proneness for cervical cancer[J]. Neural Computing & Applications, 2014, 24(6): 1311-1316. DOI:10.1007/s00521-013-1359-1 |
| [6] | Johnson C, Abu-Hilal M. Persistent organ failure during the first week as a marker of fatal outcome in acute pancreatitis[J]. Gut, 2004, 53(9): 1340-4. DOI:10.1136/gut.2004.039883 |
| [7] | Ranson JH, Rifind KM, Roses DF, et al. Objective early identification of severe acute pancreatitis[J]. Am J Gastroenterol, 1974, 61(6): 443-451. DOI:10.1007/BF01076154 |
| [8] | Knaus WA, Zimmerman JE, Wagner DP, et al. APACHE-acute physiology and chronic health evaluation: a physiologically based classification system[J]. Crit Care Med, 1981, 9(8): 591-597. DOI:10.1097/00003246-198108000-00008 |
| [9] | Yang L, Liu J, Xing Y, et al. Comparison of BISAP, Ranson, MCTSI, and APACHE Ⅱ in predicting severity and prognoses of hyperlipidemic acute pancreatitis in Chinese patientst[J]. Gastroenterol Res Prac, 2016, 2016: 1834256. DOI:10.1155/2016/1834256 |
| [10] | Vincent J L, Moreno R, Takala J, et al. The SOFA (Sepsis-related Organ Failure Assessment) score to describe organ dysfunction/failure. On behalf of the Working Group on Sepsis-Related Problems of the European Society of Intensive Care Medicine[J]. Intensive Care Med, 1996, 22(7): 707-710. DOI:10.1007/BF01709751 |
| [11] | Subbe C P, Kruger M, Rutherford P, et al. Validation of amodified early warning score in medical admissions[J]. QJM, 2001, 94(10): 521-526. DOI:10.1093/qjmed/94.10.521 |
| [12] | Hirota M, Takada T, Kawarada Y, et al. JPN Guidelines for the management of acute pancreatitis: severity assessment of acute pancreatitis[J]. J Hepatobiliary Pancreat Surg, 2006, 13(1): 33-41. DOI:10.1007/s00534-005-1049-1 |
| [13] | Harrison DA, D'AMICO G, Singer M. The Pancreatitis outcome prediction (POP) score: a new prognostic index for patients with severe acute pancreatitis[J]. Crit Care Med, 2007, 35(7): 1703-1708. DOI:10.1097/01.CCM.0000269031.13283.C8 |
| [14] | Zhang X X, Deng L H, Chen W W, et al. Circulating microRNA 216 as a marker for the early identification of severe acute pancreatitis[J]. Am J Med Sci, 2017, 353(2): 178-186. DOI:10.1016/j.amjms.2016.12.007 |
| [15] | Buddingh K T, Koudstaal L G, Van Santvoort H C, et al. Early angiopoietin-2 levels after onset predict the advent of severe pancreatitis, multiple organ failure, and infectious complications in patients with acute pancreatitis[J]. J Am Coll Surg, 2014, 218(1): 26-32. DOI:10.1016/j.jamcollsurg.2013.09.021 |
| [16] | Aufenanger J, Samman M, Quintel M, et al. Pancreatic phospholipase A2 activity in acute pancreatitis: a prognostic marker for early identification of patients at risk[J]. Clin Chem Lab Med, 2002, 40(3): 293-297. DOI:10.1515/CCLM.2002.046 |
| [17] | Yue W, Liu Y, Ding W, et al. The predictive value of the prealbumin-to-fibrinogen ratio in patients with acute pancreatitis[J]. Int J Clin Pract, 2015, 69(10): 1121-1128. DOI:10.1111/ijcp.12682 |
| [18] | Wu J, Wang Y, Li H, et al. Serum apolipoprotein B-to-apolipoprotein A1 ratio is independently associated with disease severity in patients with acute pancreatitis[J]. Sci Rep, 2019, 23;9(1): 7764. DOI:10.1038/s41598-019-44244-w |
| [19] | 朱会会, 赵冰, 倪童天, 等. 心肌损伤标记物对急性胰腺炎严重程度的预测效应[J]. 中华急诊医学杂志, 2018, 27(9): 972-976. DOI:10.3760/cma.j.issn.1671-0282.2018.09.004 |
| [20] | 张红兵, 唐晴琴, 陆士奇, 等. 强离子隙预测急性胰腺炎严重程度的价值[J]. 中华急诊医学杂志, 2018, 27(9): 977-981. DOI:10.3760/cma.j.issn.1671-0282.2018.09.005 |
 2020, Vol. 29
2020, Vol. 29




