ICU重症患者常需要多个干预治疗手段来改善其临床预后。其中,肠内营养(Enteral nutrition,EN)是一个较为重要但常被ICU医师低估和忽视的治疗措施。研究表明早期EN具有促进胃肠功能恢复、维护胃肠黏膜屏障结构和功能的完整性、减少感染并发症以及缩短住院时间等诸多优点[1, 2]。由于早期EN耐受及消化吸收需要充足的胃肠道血供,而重症患者常伴有血流动力学不稳定需要接受血管活性药物,使得胃肠道血供难以得到有效灌注。此类患者能否早期启动EN支持目前仍存在争议[3-5];同样,迄今为止尚无明确的循证医学证据建议如何安全地管理这一常见的临床问题。本研究在一组需要血管活性药物支持维持血流动力学稳定的ICU重症患者中,初步探讨早期开始EN的耐受性及对其临床预后的影响。
1 资料与方法 1.1 一般资料2014年5月至2016年5月在浙江省人民医院重症医学科(ICU)连续招募248例血流动力学不稳定重症患者。研究对象入选标准:(1)年龄大于18岁;(2)APACHE评分 > 8;(3)预期入ICU停留时间超过48 h;(4)需要接受血管活性药物(包括多巴胺、去甲肾上腺素、肾上腺素、苯氧肾上腺素及血管加压素)支持下维持血流动力学稳定(平均动脉压≥65 mmHg)持续6 h。其中,各血管活性药物剂量范围:多巴胺 < 15 μg/(kg·min);去甲肾上腺素 < 0.2 μg/(kg·min);肾上腺素 < 0.1 μg/(kg·min);血管加压素 < 0.04 U/min。排除标准包括:(1)孕妇、濒临死亡或液体复苏失败患者;(2)多脏器功能衰竭终末期患者;(3)恶性肿瘤患者;(4)短肠综合征患者。
1.2 研究方法研究数据收集、AGI分级和肠内外营养实施由2名指定的高年资ICU医师负责。研究对象入选后1周内,每日按照2012年欧洲危重病学会推荐意见评估AGI分级[6],肠内喂养按照目前美国和欧洲重症患者营养支持临床实践指南实施[7-8]。肠内营养实施常规流程包括:半卧位体位(30度~45度);优先选择鼻胃管;残胃量大于200 mL加用肠动力药物或考虑实施鼻肠管喂养[9]。患者在接受一定剂量血管活性药物支持下,维持血流动力学稳定(MAP≥65 mmHg)6 h后即开始启动EN。患者入ICU第1周EN喂养采用允许性低热卡喂养目标[20 kcal/(kg·d)]。初始EN喂养速度10~25 mL/h,如患者喂养耐受,按照10~25 mL/h喂养速度逐渐增加。对于存在营养不良的患者,若EN达不到喂养目标热卡的60%,在入ICU后第4天给予肠外营养补充相应热卡。研究分组:入ICU 48 h内启动EN为早期EN组;入ICU 48 h至7 d内启动EN为晚期EN组;入ICU 7 d内尚未启动EN为7 d未喂养组。
腹内压测定采用AbViser腹内压监测系统(ABV300,前茂公司)测定膀胱内压,间接反映腹内压。每日测量3次腹内压,取其平均值。腹内高压定义为6 h内至少两次测量IAP≥12 mmHg。
1.3 临床资料收集和定义研究对象数据收集包括人口学、临床特征和生化检测指标。记录不同组患者EN开始时间、ICU停留时间、机械通气时间和28 d和60 d病死率。同时观察患者EN喂养消化道症状(呕吐/反流、残胃量、肠鸣音、腹泻、腹胀、消化道出血等)。喂养不耐受定义为各种原因(呕吐、大量残胃量、腹泻、消化道出血及消化道瘘等)而导致患者入ICU 72 h内反复尝试肠内喂养热卡低于20 kcal/kg/d,或需要停止肠内喂养。消化道出血定义为呕吐物、胃内容物或大便镜检下证实消化道内存在出血。胃储留定义为单次胃残余量回抽超过200 mL。腹泻定义为每日解3次以上稀水样便,并且量大于200~250 g/d(或超过250 mL/d)。急性胃肠损伤(acute gastrointestinal injury, AGI)分级按照2012年欧洲危重病学会推荐意见[6]分为4级:Ⅰ级,存在发展至胃肠道功能障碍和衰竭的风险;Ⅱ级,胃肠道功能障碍;Ⅲ级,胃肠道功能衰竭;Ⅳ级,胃肠道功能衰竭伴有远隔器官功能障碍。
1.4 统计方法采用SAS 9.1软件进行数据分析。计量资料以均数±标准差(Mean±SD)表示,组间比较采用单因素ANOVA方差分析;计数资料采用例数或构成比表示,组间比较采用χ2检验。多因素Cox回归模型中评估EN喂养时机对28 d和60 d死亡的独立预测价值。采用Kaplan-Meier生存曲线评估累积生存率,Log-rank检验比较不同EN喂养时机组生存率差异。以P < 0.05为差异有统计学意义。
2 结果 2.1 一般临床资料特征248例血流动力学不稳定的招募患者中,47例患者入ICU后血管活性药物使用剂量超过入选标准而排除(多巴胺≥15 μg/(kg·min),n=15;去甲肾上腺素0.2 μg/(kg·min),n=33;肾上腺素≥0.1μg/(kg·min),n=12;血管加压素≥0.04 U/min,n=7),最终共201例患者纳入研究分析。其中,男性140例(69.6%),年龄和APACHE Ⅱ评分分别为(65.3±16.4)岁和(22.4±6.85)岁;合并脓毒症162例(80.6%);慢性阻塞性肺病41例(20.4%);2型糖尿病27例(13.4%);急性肾损伤58例(28.9%);191例(95.0%)患者接受机械通气治疗;30例(14.9%)患者接受肾脏替代治疗。
2.2 不同EN喂养时机组临床资料比较早期EN喂养组与晚期EN喂养组之间入ICU时收缩压和舒张压、白蛋白、血糖、血肌酐、血乳酸、EN喂养耐受性、AGI分级和机械通气时间差异无统计学意义(P≥0.12)。7 d未喂养组患者入ICU时收缩压(P=0.01)、舒张压(P=0.05)和白蛋白(P=0.02)显著低于早期和晚期EN喂养组;而肾上腺素使用(P=0.02)、血糖(P=0.01)、血肌酐(P=0.04)、血乳酸(P=0.02)、AGI分级严重程度(P=0.01)和APACHE Ⅱ评分(P=0.03)显著高于早期和晚期EN喂养组。
2.2 不同EN喂养时机组消化道症状及临床预后比较与7 d未喂养组相比,早期和晚期EN喂养组残胃量[(106.3±62.1) mL vs (94.7±60.3) mL vs (78.4±57.1) mL,P=0.02]和腹泻发生率增加(38.0% vs. 28.2% vs.16.7%,P=0.05),而消化道出血比例显著减少(24.5% vs.26.3% vs.47.2%,P=0.04)。而早期和晚期EN喂养组之间残胃量(P=0.88)、腹内压(P=0.23)及消化道症状差异无统计学意义(P≥0.15)。同样,与晚期EN喂养组和7 d未喂养组相比,早期EN喂养组患者28 d(P=0.01)和60 d病死率(P=0.017)显著降低。(见表 2)
| 临床特征 | 早期喂养组(n=92) | 晚期喂养组(n=73) | 7 d内未喂养组(n=36) | t或χ2值 | Pa值 | t或χ2值 | Pb值 |
| 年龄(岁) | 65.7±16.1 | 65.2±15.2 | 64.5±17.9 | 0.25 | 0.87 | 0.64 | 0.59 |
| 男性(n,%) | 64 (69.6) | 48 (65.8) | 28(77.8) | 0.27 | 0.62 | 0.86 | 0.40 |
| 体质量指数(kg/m2) | 22.0±2.40 | 22.5±4.22 | 22.0±3.0 | 0.76 | 0.44 | 0.51 | 0.68 |
| 血管活性药物类型 | |||||||
| 多巴胺(n,%) | 25(27.2) | 15 (20.5) | 13(36.1) | 0.92 | 0.36 | 0.99 | 0.32 |
| 去甲肾上腺素(n,%) | 62(67.4) | 57(78.1) | 31(86.1) | 2.31 | 0.16 | 4.99 | 0.05 |
| 肾上腺素及其他(n,%) | 15(16.3) | 19(26.0) | 14(38.9) | 2.35 | 0.12 | 6.29 | 0.01 |
| 休克类型 | |||||||
| 分布性休克(n,%) | 47 (51.1) | 40 (54.8) | 23(63.9) | ||||
| 低血容量休克(n,%) | 29(31.5) | 18 (24.7) | 6(16.7) | ||||
| 心源性休克及其他(n,%) | 16 (17.4) | 15 (20.5) | 7(19.4) | 0.99 | 0.61 | 2.92 | 0.23 |
| 入ICU时 | |||||||
| 收缩压(mmHg) | 93.1±14.4 | 91.5±15.0 | 84.7±18.6 | 0.53 | 0.49 | 2.62 | 0.01 |
| 舒缩压(mmHg) | 53.7±12.8 | 52.1±10.3 | 47.8±10.7 | 0.91 | 0.36 | 1.98 | 0.05 |
| 中心静脉压(mmHg) | 8.35±3.98 | 8.02±4.09 | 8.38±3.93 | 0.41 | 0.52 | 0.19 | 0.87 |
| 心率(次/min) | 120.6±24.3 | 118.5±28.8 | 124.1±24.5 | 0.82 | 0.40 | 0.61 | 0.57 |
| 白蛋白(mg/dL) | 29.9±5.67 | 28.7±6.26 | 26.4±7.09 | 1.35 | 0.22 | 2.43 | 0.02 |
| 血糖(mmol/L) | 9.96±4.53 | 9.18±3.50 | 12.1±6.13 | 1.14 | 0.31 | 2.59 | 0.01 |
| 血肌酐(μmol/L) | 116.2±76.4 | 125.9±67.9 | 156.9±93.5 | 1.09 | 0.32 | 2.15 | 0.04 |
| 血乳酸(mmol/L) | 3.02±2.12 | 3.46±2.10 | 4.44±3.01 | 1.23 | 0.25 | 2.36 | 0.02 |
| 相关疾病(n,%) | |||||||
| 慢性阻塞性肺病 | 20(21.7) | 14(19.2) | 7(19.4) | 0.16 | 0.68 | 0.08 | 0.91 |
| 脓毒症 | 68(73.9) | 62(84.9) | 32(88.9) | 2.96 | 0.12 | 3.40 | 0.09 |
| 2型糖尿病 | 11 (12.0) | 10 (13.7) | 6(16.7) | 0.11 | 0.74 | 0.50 | 0.56 |
| 冠心病 | 16 (17.4) | 18 (24.7) | 3(8.3) | 1.31 | 0.25 | 1.68 | 0.20 |
| 急性肾损伤 | 28 (30.4) | 17 (23.3) | 13(36.1) | 1.05 | 0.31 | 0.38 | 0.54 |
| RRT(n,%) | 13 (14.3) | 7 (9.60) | 10(27.8) | 0.79 | 0.38 | 3.27 | 0.07 |
| 接受机械通气(n,%) | 87 (94.6) | 69 (94.5) | 35(97.2) | 0.001 | 0.99 | 0.41 | 0.53 |
| 机械通气时间(d) | 11.3±6.4 | 9.81±5.6 | 9.73±5.4 | 1.59 | 0.15 | 1.68 | 0.12 |
| AGI分级(n,%) | |||||||
| I级 | 45(48.9) | 26(35.6) | 9(25.0) | ||||
| Ⅱ级 | 35(38.0) | 32(43.8) | 13(36.1) | ||||
| Ⅲ级 | 12(12.9) | 13(17.8) | 10(27.8) | ||||
| IV级 | 0 | 2(2.8) | 4(11.1) | 5.14 | 0.16 | 17.0 | 0.001 |
| SOFA评分 | 10.8±3.12 | 11.6±3.67 | 12.7±4.25 | 1.22 | 0.23 | 1.83 | 0.09 |
| APACHE Ⅱ评分 | 21.3±6.26 | 22.4±5.89 | 23.9±6.94 | 1.38 | 0.17 | 2.31 | 0.03 |
| 注:AGI:急性胃肠损伤;RRT:肾脏替代治疗;SOFA评分SOFA评分:序贯器官衰竭评分;APACHEⅡ:急性生理与慢性健康状况评分Ⅱ。a为早期喂养组与晚期喂养组比较;b为早期喂养组与7 d未喂养组比较。 | |||||||
| 临床特征 | 48 h内喂养(n=92) | 48 h后喂养(n=73) | 7 d内未喂养组(n=36) | t或χ2值 | Pa值 | t或χ2值 | Pb值 |
| 腹内压(mmHg) | 9.41±3.45 | 9.32±3.64 | 11.3±5.03 | 0.17 | 0.88 | 1.90 | 0.09 |
| 残胃量(mL) | 126.3±62.1 | 94.7±60.3 | 78.4±57.1 | 1.16 | 0.23 | 2.41 | 0.02 |
| 消化道症状 | |||||||
| 腹胀(n,%) | 51(55.4) | 40(54.8) | 18(50.0) | 0.01 | 0.93 | 0.31 | 0.58 |
| 肠鸣音消失(n,%) | 64(69.6) | 45(61.6) | 22(61.1) | 1.14 | 0.29 | 0.84 | 0.48 |
| 胃储留(n,%) | 35(38.0) | 20(28.2) | 6(16.7) | 2.08 | 0.18 | 5.43 | 0.02 |
| 腹泻(n,%) | 22(23.9) | 11(15.1) | 7(19.4) | 1.89 | 0.21 | 0.30 | 0.59 |
| 消化道出血(n,%) | 23(24.5) | 20(26.3) | 17(47.2) | 0.12 | 0.73 | 5.94 | 0.02 |
| 腹腔内高压(n,%) | 39(42.4) | 23(31.5) | 14(38.9) | 2.06 | 0.15 | 0.13 | 0.72 |
| 喂养耐受性(n,%) | 63(68.5) | 53(72.6) | 0.33 | 0.61 | |||
| 28 d病死率(n,%) | 28(30.4) | 35(47.9) | 20(55.6) | 5.29 | 0.02 | 6.97 | 0.01 |
| 60 d病死率(n,%) | 35(38.0) | 39(53.4) | 23(63.9) | 3.98 | 0.04 | 6.12 | 0.017 |
| 注:a为早期喂养组与晚期喂养组比较;b为早期喂养组与7 d未喂养组比较。 | |||||||
校正年龄、性别、入ICU来源、冠心病、2型糖尿病、脓毒症、接受机械通气、血乳酸和入ICU时收缩压和舒张压等因素,多因素Cox回归分析显示:EN喂养时机(早期vs.晚期:χ2≥5.83,P < 0.05;早期vs. 7 d未喂养:χ2≥7.90,P < 0.01)、血肌酐(χ2≥5.06,P < 0.05)、白蛋白水平(χ2≥6.41,P < 0.05)、AGI分级(χ2≥8.15,P < 0.01)和APACHE Ⅱ评分(χ2≥9.62,P < 0.01)是重症患者28 d和60 d死亡的独立危险因素,见表 3。
| 变量 | 28 d死亡 | ||
| χ2值 | HR (95% CI) | P值 | |
| 血肌酐(μmol/L) | 5.06 | 1.002(1.001-1.004) | 0.02 |
| 血浆白蛋白(g/L) | 6.41 | 0.97(0.95-0.99) | 0.01 |
| 入ICU AGI分级 | |||
| (I+Ⅱ级vs Ⅲ+IV级) | 8.15 | 1.45(1.12-2.01) | 0.004 |
| 入ICU喂养时机 | |||
| 早期vs.晚期 | 5.83 | 1.90(1.13-3.21) | 0.03 |
| 早期vs.7 d未喂养 | 7.90 | 2.63(1.34-5.16) | 0.006 |
| APACHE Ⅱ评分 | 9.62 | 1.09(1.03-1.15) | 0.004 |
| 变量 | 60 d死亡 | ||
| χ2值 | HR(95% CI) | P值 | |
| 血肌酐(μmol/L) | 6.59 | 1.002(1.001-1.004) | 0.01 |
| 血浆白蛋白(g/L) | 7.35 | 0.97(0.95-0.99) | 0.007 |
| 入ICU AGI分级 | |||
| (I+Ⅱ级vs. Ⅲ+IV级) | 8.70 | 1.48(1.15-1.96) | 0.003 |
| 入ICU喂养时机 | |||
| 早期vs.晚期 | 6.28 | 1.86(1.15-3.01) | 0.012 |
| 早期vs. 7 d未喂养 | 8.01 | 2.49(1.32-4.69) | 0.005 |
| APACHE Ⅱ评分 | 10.1 | 1.10(1.04-1.16) | < 0.001 |
| AGI:急性胃肠损伤;APACHE Ⅱ评分:急性生理与慢性健康状况评分Ⅱ;校正危险因素包括:年龄、性别、体质量指数、接受机械通气、糖尿病、脓毒症、冠心病、入ICU时收缩压、舒张压和血乳酸。 | |||
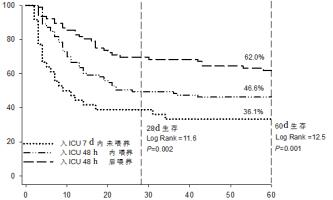
Kaplan-Meier生存曲线显示血流动力学不稳定重症患者早期EN喂养与其28 d和60 d生存显著相关。早期EN组患者28 d和60 d生存率分别30.4%和38.0%,显著高于晚期EN组(28 d生存率:47.9%;60 d生存率:55.6%)和7 d未喂养组患者(28 d生存率:38.0%,χ2=11.6,P=0.002;60 d生存率:63.9%,χ2=12.5,P=0.001),见图 1。
|
| P值显示Log-rank检验不同喂养时机患者之间生存率存在差异 图 1 Kaplan-Meier曲线按照入ICU不同EN时机预测血流动力学不稳定的重症患者28 d和60 d死亡风险。 Fig 1 The Kaplan-Meier curve stratifi ed on the basis of different EN time on admission to ICU for 28- and 60-day mortality in critically ill patients with hemodynamic instability. |
|
|
EN是重症患者营养支持的首选方式,早期EN实施与改善其临床预后密切相关[10]。然而,重症患者常因各种病因导致血流动力学不稳定,尽管给予液体复苏及血管活性药物支持来维持循环稳定,但机体仍存在胃肠道低灌注、肠系膜缺血及肠蠕动减弱等风险。若在血流动力学不稳定状态实施EN,一方面理论上EN可以增加胃肠道血流,从而保护胃肠黏膜屏障和改善免疫力;但另一方面EN可增加氧耗而加剧肠缺血风险。
目前血流动力学不稳定患者EN耐受性仍存在争议[11-15]。早期研究表明在大剂量血管活性药物支持下的血流动力学不稳定患者,EN实施能增加肠坏死发生率[11]。但近年来研究发现在一定剂量范围血管活性药物支持下,血流动力学不稳定患者EN实施是可以安全耐受的。本研究在一组接受血管活性药物维持血流动力学稳定患者中,EN实施耐受性为70.3%,且早期组(EN开始 < 48 h)与晚期组(EN开始 > 48 h)之间EN耐受性差异无统计学意义。相比较7 d未喂养组患者,尽管早期和晚期EN组胃储留发生率增加,但其消化道出血比例显著减少。既往几项研究报道[12-14]合并不同类型休克的患者EN耐受性在62%~75%,与本研究结果较一致。Merchan等[12]对120例接受血管活性药物支持的脓毒症休克患者实施EN,结果62%患者能耐受早期EN,无肠缺血事件发生,喂养不耐受主要原因为大量胃储留(74%);进一步研究发现患者接受等同剂量去甲肾上腺素 < 0.14 μg/(kg·min)的血管活性药物,早期启动EN是更加安全耐受的。Mancl等[13]对259例同时接受血管活性药物和EN支持患者进行回顾性分析,结果发现74.9%患者能同时耐受血管活性药物和EN支持。与本研究及其他研究患者早期EN具有较高胃储留不同,该研究喂养不良事件主要表现为血乳酸升高(30.6%),同时该研究也发现接受去甲肾上腺素支持患者EN喂养耐受性优于接受多巴胺和血管加压素治疗。即使在需要体外膜肺氧合支持的严重血流动力学衰竭患者中,EN实施也是相对安全的[15]。上述研究结果表明,接受血管活性药物维持血流动力学稳定的患者能耐受早期EN实施,其EN耐受性与血管活性药物类型、剂量以及血流动力学稳定性相关。
除了EN可耐受,已有研究表明血流动力学不稳定患者早期启动EN可能改善临床预后[16-18]。Khalid等[16]回顾性分析1 174例同时接受血管活性药物和机械通气的患者,结果发现早期EN能显著降低患者ICU和住院病死率;在需要多种血管活性药物支持的患者中,早期EN对改善预后优势更为显著。本研究也发现,与晚期EN组和7 d未喂养组相比,早期EN组患者28 d和60 d病死率显著降低,且校正影响预后的危险因素后,EN喂养时机仍是预测血流动力学不稳定患者死亡的独立危险因素。同样,在一项多中心、前瞻性、随机对照的严重脓毒症液体复苏和强化胰岛素治疗(VISEP)临床研究中,353例入住ICU时间超过7 d的严重脓毒症和脓毒症休克患者纳入亚组分析评估EN、PN以及EN联合PN对临床预后影响,结果发现相比较其他营养策略,仅接受EN的患者90 d死亡、继发感染发生率、接受肾脏替代治疗以及机械通气持续时间均显著降低[17],这一研究结果也间接支持脓毒症休克患者早期启动EN能改善其临床预后。另有研究报道,在66例接受机械通气的脓毒症休克患者中,早期给予低热卡EN(< 600 kcal/d)患者ICU停留和机械通气持续时间显著低于EN未启动和高热卡EN组患者(> 600 kcal/d)[18],这提示对于血流动力学不稳定患者,早期少量EN既能维护肠黏膜屏障,又不增加肠道负荷,可能更有利于改善预后。然而,本研究和既往研究仍存在一些混杂因素影响研究结果的局限性,如尽管本研究是一项前瞻性研究,但研究患者并不是完全随机实施EN,而是采用意向性治疗策略;其次,本研究与既往研究没有进一步探讨患者早期EN热卡总量对临床预后的影响;此外,重症患者不能实施EN或喂养不耐受本身就是反映疾病严重程度的一个混杂因素。但本研究患者启动EN的前提条件是血管活性药物维持下血流动力学稳定,且无其他EN禁忌证;同时对7 d未喂养患者进行单独分组,在多因素回归分析中也校正了反映疾病严重程度的APACHE Ⅱ评分,以减少混杂因素对研究结果的影响。
血流动力学不稳定患者早期EN改善临床预后其机制尚不完全明确,动物和临床研究结果提示可能与早期EN可改善不同类型休克肠道黏膜微循环、改善肠道组织灌注、降低肠道菌群易位相关[19-21]。McClave和Chang[19]在动物实验研究中发现,缺血-再灌注前采用EN预处理可减少实验动物肠腔毒素生成,降低小肠消化吸收时的氧耗,提示低血压状态下早期EN可通过降低肠道通透性、应激反应及脓毒症相关并发症的发生,减轻小肠缺血性损伤程度。在心脏术后需要持续去甲肾上腺素和多巴酚丁胺维持循环稳定的患者中,早期幽门后置管实施EN能提高术后患者的心排指数和胃肠道血流,改善患者组织灌注[21]。这一研究结果提示心脏术后患者即使需要一定剂量血管活性药物维持血流动力学稳定,也应早期启动EN。
综上所述,应用稳定剂量的血管活性药物维持血流动力学稳定的患者持续实施EN是安全耐受的,早期实施EN可降低患者病死率。然而,目前的研究结果仍需要大样本前瞻性队列研究加以证实。同时在EN实施过程中要严格执行EN耐受性评估, 及时根据患者循环状态调整EN方案,这样才能让血流动力学不稳定的患者从早期EN中真正获益。
利益冲突 所有作者均声明不存在利益冲突
| [1] | Peter JV, Moran JL, Phillips-Hughes J. A metaanalysis of treatment outcomes of early enteral versus early parenteral nutrition in hospitalized patients[J]. Crit Care Med, 2005, 33(1): 213-220. DOI:10.1097/01.ccm.0000150960.36228.c0 |
| [2] | GramLich L, Kichian K, Pinilla J, et al. Does enteral nutrition compared to parenteral nutrition result in better outcomes in critically ill adult patients? A systematic review of the literature[J]. Nutrition, 2004, 20(10): 843-848. DOI:10.1016/j.nut.2004.06.003 |
| [3] | Allen JM. Vasoactive substances and their effects on nutrition in the critically ill patient[J]. Nutr Clin Pract, 2012, 27(3): 335-339. DOI:10.1177/0884533612443989 |
| [4] | Yang SF, Wu XJ, Yu WK, et al. Early enteral nutrition in critically ill patients with hemodynamic instability[J]. Nutr Clin Pract, 2014, 29(1): 90-96. DOI:10.1177/0884533613516167 |
| [5] | 于娣, 龙玲, 赵鹤龄, 等. 血流动力学不稳定重症患者肠内营养的耐受性与安全性[J]. 中华急诊医学杂志, 2016, 25(1): 113-116. DOI:10.3760/cma.j.issn.1671-0282.2016.01.030 |
| [6] | Reintam Blaser A, Malbrain MLNG, Starkopf J, et al. Gastrointestinal function in intensive care patients: terminology, definitions and management. Recommendations of the ESICM Working Group on Abdominal Problems[J]. Intensive Care Med, 2012, 38(3): 384-394. DOI:10.1007/s00134-011-2459-y |
| [7] | Martindale RG, McClave SA, Vanek VW, et al. Guidelines for the provision and assessment of nutrition support therapy in the adult critically ill patient: Society of Critical Care Medicine and American Society for Parenteral and Enteral Nutrition: Executive Summary[J]. Crit Care Med, 2009, 37(5): 1757-1761. DOI:10.1097/ccm.0b013e3181a40116 |
| [8] | Kreymann KG, Berger MM, Deutz NEP, et al. ESPEN guidelines on enteral nutrition: intensive care[J]. Clin Nutr, 2006, 25(2): 210-223. DOI:10.1016/j.clnu.2006.01.021 |
| [9] | 呼邦传, 孙仁华, 吴爱萍, 等. ICU内喂养不耐受与重症患者临床预后的相关研究:一项多中心、前瞻性、观察性研究[J]. 中华急诊医学杂志, 2017, 26(4): 434-440. DOI:10.3760/cma.j.issn.1671-0282.2017.04.016 |
| [10] | Artinian V, Krayem H, DiGiovine B. Effects of early enteral feeding on the outcome of critically ill mechanically ventilated medical patients[J]. Chest, 2006, 129(4): 960-967. DOI:10.1378/chest.129.4.960 |
| [11] | Marvin RG, McKinley BA, McQuiggan M, et al. Nonocclusive bowel necrosis occurring in critically ill trauma patients receiving enteral nutrition manifests No reliable clinical signs for early detection[J]. Am J Surg, 2000, 179(1): 7-12. DOI:10.1016/s0002-9610(99)00261-5 |
| [12] | Merchan C, Altshuler D, Aberle C, et al. Tolerability of enteral nutrition in mechanically ventilated patients with septic shock who require vasopressors[J]. Intensive Care Med, 2017, 32(9): 540-546. DOI:10.1177/0885066616656799 |
| [13] | Mancl EE, Muzevich KM. Tolerability and safety of enteral nutrition in critically ill patients receiving intravenous vasopressor therapy[J]. JPEN J Parenter Enteral Nutr, 2013, 37(5): 641-651. DOI:10.1177/0148607112470460 |
| [14] | Rai SS, O' Connor SN, Lange K, et al. Enteral nutrition for patients in septic shock: a retrospective cohort study[J]. Crit Care Resusc, 2010, 12(3): 177-181. DOI:10.1378/chest.10-0849 |
| [15] | Umezawa Makikado LD, Flordelís Lasierra JL, Pérez-Vela JL, et al. Early enteral nutrition in adults receiving venoarterial extracorporeal membrane oxygenation[J]. JPEN J Parenter Enteral Nutr, 2013, 37(2): 281-284. DOI:10.1177/0148607112451464 |
| [16] | Khalid I, Doshi P, DiGiovine B. Early enteral nutrition and outcomes of critically ill patients treated with vasopressors and mechanical ventilation[J]. Am J Crit Care, 2010, 19(3): 261-268. DOI:10.4037/ajcc2010197 |
| [17] | Elke G, Kuhnt E, Ragaller M, et al. Enteral nutrition is associated with improved outcome in patients with severe sepsis[J]. Med Klin Intensivmed Notfmed, 2013, 108(3): 223-233. DOI:10.1007/s00063-013-0224-4 |
| [18] | Patel JJ, Kozeniecki M, Biesboer A, et al. Early trophic enteral nutrition is associated with improved outcomes in mechanically ventilated patients with septic shock[J]. J Intensive Care Med, 2016, 31(7): 471-477. DOI:10.1177/0885066614554887 |
| [19] | McClave SA, Chang WK. Feeding the hypotensive patient: does enteral feeding precipitate or protect against ischemic bowel?[J]. Nutr Clin Pract, 2003, 18(4): 279-284. DOI:10.1177/0115426503018004279 |
| [20] | Klinzing S, Simon M, Reinhart K, et al. Moderate-dose vasopressin therapy may impair gastric mucosal perfusion in severe sepsis: a pilot study[J]. Anesthesiology, 2011, 114(6): 1396-1402. DOI:10.1177/0115426503018004279 |
| [21] | Berger MM, Revelly JP, Cayeux MC, et al. Enteral nutrition in critically ill patients with severe hemodynamic failure after cardiopulmonary bypass[J]. Clin Nutr, 2005, 24(1): 124-132. DOI:10.1016/j.clnu.2004.08.005 |
 2020, Vol. 29
2020, Vol. 29




