脓毒症常发生于严重感染的危重症患者中,其往往伴随脓毒症休克或多器官功能衰竭的发生,严重影响危重症患者的预后。因此,明确脓毒症有效靶点,延缓或阻断病程进展,以期部分或完全治愈脓毒症,是脓毒症研究的主要任务。骨桥蛋白作为一种多功能蛋白兴起,作用广泛,近年来备受研究者们关注。本文综合近几年的文献浅析OPN的分子结构、功能及其在脓毒症中发挥作用的可能机制。
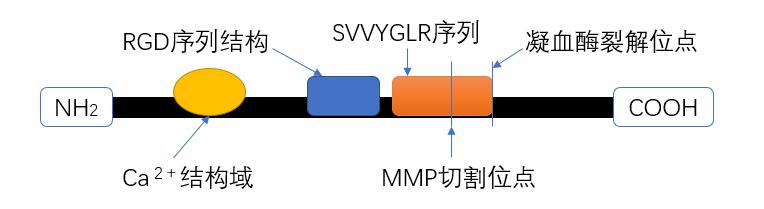
1 骨桥蛋白的介绍骨桥蛋白(osteopontin,OPN),是小的整联蛋白结合配体N端联结糖蛋白家族中的一员,相对分子质量在44 - 75 000之间,广泛存在于免疫细胞、成骨细胞等细胞中,分布于肌肉、骨骼、脑、肾脏等全身多处。经酶作用或修饰后,OPN可暴露出精氨酸-甘氨酸-天冬氨酸(RGD)序列结构、凝血酶裂解位点、基质金属蛋白酶(MMP)作用位点、Ca2+结合位点等多个作用位点[1-4](图 1),在多种生理及病理过程中,多种细胞表面受体(主要是整合素和CD44)作用于OPN不同的作用位点,发挥介导信号转导、参与调节多种细胞因子的表达与分泌从而调控细胞迁徙、增殖、分化等作用[5-6]。因此,OPN的作用位点、结合的受体种类及OPN所处的病理生理条件决定了其将发挥何种功能与作用。
|
| 图 1 OPN结构特点:OPN包含RGD序列结构域、凝血酶裂解位点、MMP切割位点、Ca2+结构域等多个作用位点 |
|
|
OPN参与脓毒症的机制可能是诱导中性粒细胞募集、激活巨噬细胞、诱导释放炎症介质协同作用以促进炎症反应,从而导致机体平衡紊乱,加速脓毒症的进展。近年有研究表明,OPN可由炎症细胞表达,并在炎症激活过程中被高度诱导,可促进巨噬细胞的趋化迁移和选择性活化,也可上调小鼠的过氧化物酶水平,导致中性粒细胞的募集[7-9]。OPN同时可通过改变高迁移率族蛋白B1(HMGB1)的功能在疾病的进展过程中起调节作用[10],而既往众多研究已证实,HMGBl作为晚期炎症介质,可促进炎症细胞聚集,与脓毒症后期免疫反应受抑、急性肺损伤、肠黏膜损伤等并发症密切相关[11-13]。在炎性肠病中也有发现,粒细胞-巨噬细胞集落刺激因子水平与血浆OPN表达之间存在显著的相关性[14]。另有实验证明,中和OPN并阻断其受体整合素,可显著抑制CD4(+) T细胞迁移,增加内毒素血症的易感性[15]。此外,OPN还可协同多种炎症细胞分泌的细胞因子激活更多炎症细胞,导致炎症反应的不断放大,引发恶性循环,进一步导致炎症反应失控。而Hirano Y和Fortis S团队等均通过脓毒症小鼠模型发现,予敲除OPN基因或抗OPN抗体处理后,对照组小鼠血浆炎性细胞因子显著降低外,病死率亦有降低[16-17]。
2.2 调节免疫细胞,参与免疫反应OPN可通过在免疫应答中调节Th1和Th2细胞因子平衡、诱导B细胞产生、促进树突状细胞(DC)在抗原免疫应答中的成熟,导致机体平衡向促炎反应倾斜,进而导致脓毒症的发生。Th细胞对Th1或Th2表型的极化是细胞介导的免疫的关键方面,在不同病理条件下,受分泌的各种细胞因子及炎症介质等影响,Th1与Th2细胞失衡,Th1细胞偏多时细胞免疫占优势[18]。Th细胞向Th1极化是细胞免疫的重要方面,OPN能通过增强Th1细胞因子及抑制Th2细胞因子的表达参与免疫反应[19]。有类似的实验证明,在体外重组了大鼠OPN蛋白,并使用实验性自身免疫性重症肌无力大鼠模型评估OPN如何影响自身免疫的发展。他们的结果显示,OPN处理后可在体外强烈促进Th1细胞的分化[20]。除作用于Th细胞参与细胞免疫,OPN还可作用于B细胞发挥体内免疫作用。研究者们采用感染铜绿假单胞菌的野生型小鼠和OPN基因敲除小鼠,通过观察其在脓毒症中的作用发现,与野生型小鼠相比,OPN基因敲除小鼠的病死率降低,且OPN基因敲除小鼠脾脏中B细胞的百分率和绝对值均升高[21]。此外,有研究者通过临床试验发现,缺乏OPN会导致DC的不成熟和分泌功能缺陷,并抑制了病毒刺激后DC诱导的Th1的激活[22]。
2.3 参与凝血与抗凝血平衡OPN可通过加强纤溶功能,调节凝血与抗凝血机制参与脓毒症反应。有研究者发现,恶性胸腔积液患者的胸膜液中监测的OPN、尿激酶纤溶酶原激活物(uPA)浓度呈正相关[23],这表明uPA可随OPN含量增加而增加,从而引导反应向纤溶功能亢进方向进展,导致止凝血功能障碍,可诱导弥散性血管内凝血和休克的产生,加重脓毒症。不仅如此,Vaschetto R等通过评估脓毒性休克患者的OPN和尿激酶纤溶酶原激活物受体(uPAR)血液水平, 发现OPN可通过增加uPAR基因的表达和细胞表面的可溶性尿激酶受体(suPAR)释放来诱导单核细胞suPAR的产生[24],由此可得出OPN与血浆suPAR水平升高相关,可介导纤溶酶原的活化,从而间接启动纤维蛋白溶解系统,使凝血与抗凝血系统失衡,加重脓毒症反应。
3 骨桥蛋白与脓毒症中的相关性OPN在炎症部位和组织重塑过程中可明显上调,作为一种促炎细胞因子,OPN水平在临床上各种慢性疾病中得到证实。近年来,不少临床试验发现OPN水平在急性感染疾病特别是脓毒症中亦有增高。Irion CI等在小儿和老年脓毒症或肺炎患者中,应用免疫荧光技术定量OPN蛋白在心肌尸检组织中的表达,发现心肌细胞中的OPN表达增加[25],这是首次在小儿脓毒症中报告心肌细胞OPN表达增加的研究,提示OPN在急性炎症中也可发挥作用。前不久,意大利一项单中心前瞻性观察性研究发现,单次OPN浓度测定有助于鉴别急诊科患者的脓毒症,OPN水平不仅在脓毒症中升高,并且它们都与更高的病死率相关[26]。此外,OPN已被证明是一个独立的重症监护病房与危重患者(包括脓毒症患者)的长期病死率的预测因素。Roderburg团队分析了大型危重症患者队列中的OPN血清浓度后发现,OPN浓度与病情严重程度与既定的预后评分、炎症和多器官功能衰竭的经典和实验性指标显著相关。此外,OPN水平的预测能力与其他常规炎症、感染和器官衰竭生物标记物如C反应蛋白、国际标准化比率、降钙素原等相比,具有更好的预后能力[27]。综上所述,患者体内OPN浓度随着急性感染疾病严重程度的增加而增加,且较CRP等多项常用炎症指标有较好的预后性,因此,可以推断持续升高的OPN水平可作为预后不良的独立预测因子,在脓毒症的诊断与治疗中发挥作用。
5 结语脓毒症发病凶险,预后极差,严重消耗医疗资源,危害机体健康。作为一种促炎细胞因子,OPN水平在各种慢性及急性炎症疾病中得到证实,多项临床试验证明,OPN在脓毒症患者水平增高,且与预后评分、炎症和多器官功能衰竭等实验性指标显著相关,有望成为临床具应用价值的脓毒症生物标志物及脓毒症潜在的治疗靶点。
| [1] | Abdelaziz Mohamed I, Gadeau AP, Hasan A, et al. Osteopontin: a promising therapeutic target in cardiac fibrosis[J]. Cells, 2019, 8(12): 1558. DOI:10.3390/cells8121558 |
| [2] | Kaleta B. The role of osteopontin in kidney diseases[J]. Inflamm Res, 2019, 68(2): 93-102. DOI:10.1007/s00011-018-1200-5 |
| [3] | Wei R, Wong JPC, Kwok HF. Osteopontin: a promising biomarker for cancer therapy[J]. J Cancer, 2017, 8(12): 2173-2183. DOI:10.7150/jca.20480 |
| [4] | Subraman V, Thiyagarajan M, Malathi N, et al. OPN -Revisited[J]. J Clin Diagn Res, 2015, 9(6): E10-E13. DOI:10.7860/JCDR/2015/12872.6111 |
| [5] | Lok ZSY, Lyle AN. Osteopontin in vascular disease[J]. Arterioscler Thromb Vasc Biol, 2019, 39(4): 613-622. DOI:10.1161/atvbaha.118.311577 |
| [6] | Cao JY, Li J, Sun LK, et al. Hypoxia-driven paracrine osteopontin/integrin αvβ3 signaling promotes pancreatic cancer cell epithelial–mesenchymal transition and cancer stem cell-like properties by modulating forkhead box protein M1[J]. Mol Oncol, 2019, 13(2): 228-245. DOI:10.1002/1878-0261.12399 |
| [7] | Zhu Y, Yang J, Xu D, et al. Disruption of tumour-associated macrophage trafficking by the osteopontin-induced colony-stimulating factor-1 signalling sensitises hepatocellular carcinoma to anti-PD-L1 blockade[J]. Gut, 2019, 68(9): 1653-1666. DOI:10.1136/gutjnl-2019-318419 |
| [8] | Zhao GQ, Hu M, Li C, et al. Osteopontin contributes to effective neutrophil recruitment, IL-1β production and apoptosis in Aspergillus fumigatus keratitis[J]. Immunol Cell Biol, 2018, 96(4): 401-412. DOI:10.1111/imcb.12010 |
| [9] | Wen YK, Feng DC, Wu HL, et al. Defective initiation of liver regeneration in osteopontin-deficient mice after partial hepatectomy due to insufficient activation of IL-6/Stat3 pathway[J]. Int J Biol Sci, 2015, 11(10): 1236-1247. DOI:10.7150/ijbs.12118 |
| [10] | Passmore M, Nataatmadja M, Fung YL, et al. Osteopontin alters endothelial and valvular interstitial cell behaviour in calcific aortic valve Stenosis through HMGB1 regulation[J]. Eur J Cardiothorac Surg, 2015, 48(3): e20-e29. DOI:10.1093/ejcts/ezv244 |
| [11] | 金善子, 胡博, 栾正刚.高迁移率族蛋白1在脓毒症急性肺损伤中作用的研究进展[J]. 2018, 27(4): 459-462. DOI: 10.3760/cma.j.issn.1671-0282.2018.04.026. |
| [12] | 胥朵, 李建英, 王小众, 等. 脓毒症大鼠肠黏膜IL-6/STAT3信号通路对高迁移率族蛋白表达的调控作用[J]. 中华急诊医学杂志, 2018, 27(12): 1360-1364. DOI:10.3760/cma.j.issn.1671-0282.2018.12.009 |
| [13] | 任超, 童亚林, 姚咏明.高迁移率族蛋白B1介导脓毒症免疫功能障碍研究进展[J]. 2015, 24(2): 223-226. DOI: 10.3760/cma.j.issn.1671-0282.2015.02.029. |
| [14] | Komine-Aizawa S, Masuda H, Mazaki T, et al. Plasma osteopontin predicts inflammatory bowel disease activities[J]. Int Surg, 2015, 100(1): 38-43. DOI:10.9738/intsurg-d-13-00160.1 |
| [15] | Inoue M, Shinohara ML. Cutting edge: role of osteopontin and integrin αv in T cell–mediated anti-inflammatory responses in endotoxemia[J]. J Immunol, 2015, 194(12): 5595-5598. DOI:10.4049/jimmunol.1500623 |
| [16] | Hirano Y, Aziz M, Yang WL, et al. Neutralization of osteopontin attenuates neutrophil migration in Sepsis-induced acute lung injury[J]. Crit Care, 2015, 19(1): 53. DOI:10.1186/s13054-015-0782-3 |
| [17] | Fortis S, Khadaroo RG, Haitsma JJ, et al. Osteopontin is associated with inflammation and mortality in a mouse model of polymicrobial Sepsis[J]. Acta Anaesthesiol Scand, 2015, 59(2): 170-175. DOI:10.1111/aas.12422 |
| [18] | Gandhi GR, Neta MTSL, Sathiyabama RG, et al. Flavonoids as Th1/Th2 cytokines immunomodulators: a systematic review of studies on animal models[J]. Phytomedicine, 2018, 44: 74-84. DOI:10.1016/j.phymed.2018.03.057 |
| [19] | Icer MA, Gezmen-Karadag M. The multiple functions and mechanisms of osteopontin[J]. Clin Biochem, 2018, 59: 17-24. DOI:10.1016/j.clinbiochem.2018.07.003 |
| [20] | Zhao JR, Jing J, Zhao W, et al. Osteopontin exacerbates the progression of experimental autoimmune myasthenia gravis by affecting the differentiation of T cell subsets[J]. Int Immunopharmacol, 2020, 82: 106335. DOI:10.1016/j.intimp.2020.106335 |
| [21] | Piao ZH, Yuan HY. Osteopontin exacerbates Pseudomonas aeruginosa-induced bacteremia in mice[J]. Cell Immunol, 2017, 318: 23-28. DOI:10.1016/j.cellimm.2017.05.004 |
| [22] | Diao HY, Cui GY, Chen JN, et al. Osteopontin promotes dendritic cell maturation and function in response to HBV antigens[J]. Drug Des Dev Ther, 2015: 3003. DOI:10.2147/dddt.s81656 |
| [23] | Hsu LH, Hsu PC, Liao TL, et al. Pleural fluid osteopontin, vascular endothelial growth factor, and urokinase-type plasminogen activator levels as predictors of pleurodesis outcome and prognosticators in patients with malignant pleural effusion: a prospective cohort study[J]. BMC Cancer, 2016, 16: 463. DOI:10.1186/s12885-016-2529-1 |
| [24] | Vaschetto R, Navalesi P, Clemente N, et al. Osteopontin induces soluble urokinase-type plasminogen activator receptor production and release[J]. Minerva Anestesiol, 2015, 81(2): 157-165. |
| [25] | Irion CI, Parrish K, John-Williams K, et al. Osteopontin expression in cardiomyocytes is increased in pediatric patients with Sepsis or pneumonia[J]. Front Physiol, 2018, 9: 1779. DOI:10.3389/fphys.2018.01779 |
| [26] | Castello LM, Baldrighi M, Molinari L, et al. The role of osteopontin as a diagnostic and prognostic biomarker in Sepsis and septic shock[J]. Cells, 2019, 8(2): 174. DOI:10.3390/cells8020174 |
| [27] | Roderburg C, Benz F, Cardenas DV, et al. Persistently elevated osteopontin serum levels predict mortality in critically ill patients[J]. Crit Care, 2015, 19: 271. DOI:10.1186/s13054-015-0988-4 |
 2020, Vol. 29
2020, Vol. 29


