2 中国医学科学院 北京协和医院重症医学科,北京 100730
约67%的ICU患者发生ICU获得性衰弱(intensive care unit-acquired weakness, ICU-AW)[1],降低了ICU生存率[2-5],同时亦可导致幸存者长达3~5年的机体功能障碍[2-4]。因此,早期发现ICU-AW至关重要。然而,由于医学研究委员会肌力评分(MRC)[6]和测力计[7]等常规方法受患者意识水平的影响,无法在ICU早期开展。神经肌肉活检为有创性操作[8],计算机断层扫描和磁共振成像具有便携性差等劣势,无法广泛应用[9-10]。而超声具有无创、可床旁操作等特点[11],可通过对肌肉进行定性及定量资料提取,评估肌肉功能[12]。目前临床使用超声量化评估ICU-AW尚未形成标准统一的超声评估方法。概况性评价作为一种整理证据的方法[13],可为实践提供指导[14]。因此,本研究将使用概况性评价的方法对超声量化评估肌肉的文献进行汇总和分析,旨在对研究现况形成全面的认识,为超声评估ICU-AW标准方案的构建提供依据。
1 资料与方法研究者使用Arksey和O’Malley提出的方法学框架[15]指导本项概况性评价,该框架共包括5个步骤:(1)确定研究问题;(2)确定相关研究;(3)研究选择;(4)资料提取;(5)绘制数据总结图表并报告结果。同时按照2018年PRISMA工作组提出的PRISMA-ScR声明[16-17]进行规范报告。
1.1 文献的纳入与排除 1.1.1 纳入标准① ICU患者,且年龄≥18岁;②使用超声评估肌肉;③发表语言为中文或英文;④原始研究。
1.1.2 排除标准① 单纯膈肌超声相关研究;②结局指标为信效度;③无法获取全文的文献、会议摘要、病例报告、干预性研究等。
1.2 文献检索① 检索的中文数据库为万方、知网、CBM;英文数据库为pubmed,embase,web of science,cochrane;检索时限为建库至2019年6月。②中文检索词为超声/神经肌肉超声/肌肉超声、重症监护室/重症监护病房/ICU/危重病、ICU获得性衰弱/ICU获得性肌无力/ICU获得性虚弱/肌肉;英文检索词为ultrasound/ultrasonography/neuromuscular ultrasound/NMUS/muscular ultrasound,ICU/intensive care unit/critical care unit/critical illness,ICU-AW/ICU-acquired weakness/ intensive care unit-acquired weakness/muscle/muscle weakness/muscle atrophy。③补充检索:追溯纳入文献的参考文献。
1.3 文献筛选由2名研究者独立进行文献筛选。首先,根据题目和摘要进行初步筛选;随后,根据全文信息进行全文筛选。如有不同意见,共同讨论解决;若仍无法达成共识,由第三方介入协商解决。
1.4 资料提取采用标准化的资料提取表格提取所要分析的数据,包括①基本信息:发表年份、作者姓名、国家、研究类型、研究目的、研究场所、研究人群;②超声评估方法:超声探头类型、评估时间、评估部位、患者体位、肌肉超声参数、参数计算方法;③主要结果及结论。
1.5 资料总结对提取出来的资料进行描述性总结,分析主要的提取结果。
2 结果 2.1 证据选择初步检索1 351篇文献,经阅读标题和摘要筛选初步纳入132篇,阅读全文后最终纳入29篇原始研究。筛选流程见图 1。
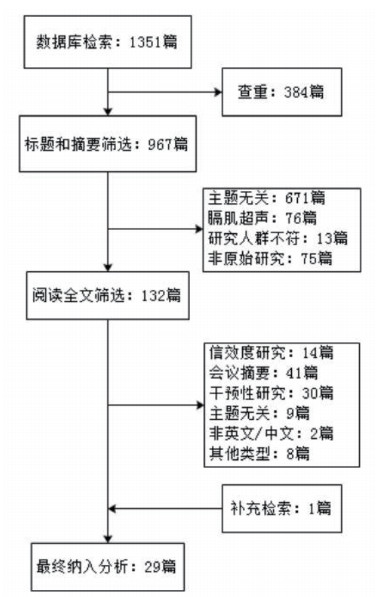
|
| 图 1 筛选流程图 |
|
|
近3年,使用超声评估ICU患者肌肉的研究呈上升趋势,并涉及脓毒症、急性肾功能损伤、急性脑创伤等ICU多种人群。
2.3 结果综合 2.3.1 超声评估方法 2.3.1.1 评估时间多数研究在患者入ICU后24~48 h内进行首次评估以获取基线值,随后每1~4 d进行连续评估,以探索肌肉的发展变化过程。
2.3.1.2 评估部位约1/2的文献仅选择股四头肌作为评估部位,且41%为股直肌,41%为股直肌和股中间肌,其余文献选择性地联合评估了肱二头肌、肱桡肌、胫骨前肌等。对股四头肌进行评估时,要求患者仰卧位,床头抬高30-45°,下肢放松自然伸展,取髂前上棘与髌骨上缘连线的中点处或2/3处作为测量点。
2.3.1.3 肌肉参数肌肉厚度及横截面积是最常用的肌肉参数,其次为回声强度和羽状角。参数计算时,分别在平面内进行定点直线测量、肌肉区域描绘获得肌肉厚度及横截面积。回声强度通常使用Heckmann分级法和灰度分析等方法进行量化评估。
2.3.2 肌肉参数的变化 2.3.2.1 厚度Campbell等[18]、Reid等[19]研究显示ICU患者肌肉厚度每天减少0.2%~9.2%,且肌肉厚度在入ICU后3 d内已出现显著减少[20]。而在Turton等[21]研究中,仅股直肌在第5、10天显著减少了10.66%和28.81%,其余肌肉未发生明显变化。脓毒症患者入ICU一周后,股直肌厚度可减少17.9%[22]。此外,Silva等[23]发现不同肌肉之间的萎缩程度差异无统计学意义。且Parry等[4]研究显示在入ICU的前6 d,股直肌厚度下降速度最快。
2.3.2.2 横截面积脓毒症患者股直肌横截面积在入ICU第7天时减少12.5%[24]-23.2%[22],10 d内减少14.5%[25]-30%[4],且器官衰竭数目越多的患者,减少越多[24]。ECMO患者在ICU前10 d内,股直肌横截面积可减少19.2%[26]。Ten等[27]研究显示患者上肢肌肉横截面积的减少多于下肢肌肉。
2.3.2.3 回声强度在ICU中,分别有13.8%、34.5%、51.7%的患者存在肌肉异常、肌肉坏死和筋膜炎及脂肪浸润[28]。Parry等[4]发现股直肌和股中间肌的回声强度在入ICU 10 d内分别增加了13%和25%。然而Puthucheary等[24]研究显示股直肌回声强度在入ICU 10 d内并没有变化,仅通过肌肉活检发现肌肉坏死患者的回声强度变化值显著多于非肌肉坏死患者。
2.3.3 肌肉参数与结局指标的关系 2.3.3.1 肌力股直肌横截面积及横截面积的减少幅度、股中间肌厚度均与MRC评分呈负相关[24],而Palakshappa等[22]发现肌肉厚度的减少幅度与MRC评分无关。此外,股直肌回声强度与下肢肌力成负相关[26, 29]。
2.3.3.2 ICU-AWHadda等[20]研究结果显示入ICU一周内,ICU-AW患者肱二头肌和股直肌厚度的减少幅度显著多于非ICU-AW患者。且Hernandez-Socorro等[28]发现股直肌横截面积和其中央肌腱厚度可有效预测肌肉萎缩。然而,Witteveen等[30]认为虽然ICU-AW患者肌肉厚度减少程度强于非ICU-AW患者,但其并不能对其作出鉴别。此外,肌肉回声强度联合炎症因子可能有助于ICU-AW的诊断[31]。
2.3.3.3 预后Galindo等[32]研究表明肌肉厚度是病死率的独立保护因素。Hadda等[20]结果显示手臂肌肉厚度减少≥6.59%的14 d死亡风险是减少<6.59%的7.3倍,同时大腿肌肉厚度减少<5.20%和≥5.20%的14 d生存率分别为88.2%、66.3%。再者,Muller等[33]将股直肌横截面积作为肌少症的判断标准,结果显示死亡患者均被评估为肌肉减少症。然而Kelmenson等[34]发现患者异常的回声强度与病死率之间并无显著相关性,但回声强度与患者机体功能状态呈负相关[4]。
3 讨论 3.1 肌肉超声是ICU早期评估肌肉质量的有效手段大量研究使用超声证实了肌肉在ICU期间的损失过程[4, 18-19, 24-25, 34-36],且肌肉损失在危重病早期即可发生,且呈持续损失状态。再者,多数研究表明肌肉萎缩与器官衰竭程度[24, 34]、肌力、功能状态密切相关,并且肌无力可独立预测病死率[37]、机械通气[7, 37]和住院时间[37]等临床结局。因此,建议在临床对ICU患者早期开展床旁超声肌肉检查,动态评估患者肌肉变化,以进行有效防护与治疗。
3.2 股四头肌可作为ICU肌肉超声评估的主要肌肉股四头肌是唯一的双斜肌,有一个独特的肌内中心肌腱[1],且股直肌是股四头肌肌群中Ⅱ型快速纤维含量最多的肌肉[38],能够产生快速强有力地收缩。同时股四头肌与人的日常生活活动有密切联系。动物模型研究中发现肌肉损失的速度和程度取决于肌肉类型和制动程度[39],制动后,伸肌的肌肉损失更大,因此股直肌作为伸肌,其损失程度更严重。同时,与上肢肌肉相比,下肢肌肉更容易早期发生肌肉萎缩[40]。因此,建议使用股四头肌作为评估的主要肌肉。
3.3 超声量化评估肌肉有助于识别ICU-AW目前临床上主要通过MRC评分<48分诊断ICU-AW[1, 41]。肌肉损失在危重病早期即可发生,而至少21%的患者由于早期处于镇静状态等因素,难以完成MRC评估[22]。超声可将肌肉进行清晰成像,能够早期、动态地监测到肌肉质量及结构的变化。Formenti等[12]认为若肌肉厚度减少20%、横截面积减少10%、羽状角减少5%、回声强度增加8%,患者可能发生ICU-AW,需进一步的检查。因此,虽然研究显示超声鉴别诊断ICU-AW的能力较弱,但其可作为辅助手段进行早期识别。
肌肉超声为评估ICU的肌肉功能提供了新的方法,使得更好了肌肉的变化以及ICU-AW的发生发展过程,以有效地进行早期发现,为患者提供更加全面的预防和治疗,促进康复。
| [1] | Fan E, Cheek F, Chlan L, et al. An official American Thoracic Society Clinical Practice guideline: the diagnosis of intensive care unit-acquired weakness in adults[J]. Am J Respir Crit Care Med, 2014, 190(12): 1437-1446. DOI:10.1164/rccm.201411-2011ST |
| [2] | de Jonghe B. Paresis acquired in the intensive care UnitA prospective multicenter study[J]. JAMA, 2002, 288(22): 2859. DOI:10.1001/jama.288.22.2859 |
| [3] | Grimm A, Teschner U, Porzelius C, et al. Muscle ultrasound for early assessment of critical illness neuromyopathy in severe Sepsis[J]. Crit Care, 2013, 17(5): R227. DOI:10.1186/cc13050 |
| [4] | Parry SM, El-Ansary D, Cartwright MS, et al. Ultrasonography in the intensive care setting can be used to detect changes in the quality and quantity of muscle and is related to muscle strength and function[J]. Crit Care, 2015, 30(5): 1151.e9-1151.e14. DOI: 10.1016/j.jcrc.2015.05.024 |
| [5] | Latronico N, Shehu I, Seghelini E. Neuromuscular sequelae of critical illness[J]. Curr Opin Crit Care, 2005, 11(4): 381-390. DOI:10.1097/01.ccx.0000168530.30702.3e |
| [6] | Hermans G, Clerckx B, Vanhullebusch T, et al. Interobserver agreement of medical research council sum-score and handgrip strength in the intensive care unit[J]. Muscle Nerve, 2012, 45(1): 18-25. DOI:10.1002/mus.22219 |
| [7] | Ali NA, O'Brien JMJr, Hoffmann SP, et al. Acquired weakness, handgrip strength, and mortality in critically ill patients[J]. Am J Respir Crit Care Med, 2008, 178(3): 261-268. DOI:10.1164/rccm.200712-1829oc |
| [8] | Bunnell A, Ney J, Gellhorn A, et al. Quantitative neuromuscular ultrasound in intensive care unit-acquired weakness: a systematic review[J]. Muscle Nerve, 2015, 52(5): 701-708. DOI:10.1002/mus.24728 |
| [9] | Hirose T, Shiozaki T, Shimizu K, et al. The effect of electrical muscle stimulation on the prevention of disuse muscle atrophy in patients with consciousness disturbance in the intensive care unit[J]. Crit Care, 2013, 28(4): 536.e1-536.e7. DOI:10.1016/j.jcrc.2013.02.010 |
| [10] | Matsuda N, Kobayashi S, Tanji Y, et al. Widespread muscle involvement in critical illness myopathy revealed by MRI[J]. Muscle Nerve, 2011, 44(5): 842-844. DOI:10.1002/mus.22218 |
| [11] | Mourtzakis M, Parry S, Connolly B, et al. Skeletal muscle ultrasound in critical care: a tool in need of translation[J]. Annals ATS, 2017, 14(10): 1495-1503. DOI:10.1513/annalsats.201612-967ps |
| [12] | Formenti P, Umbrello M, Coppola S, et al. Clinical review: peripheral muscular ultrasound in the ICU[J]. Ann Intensive Care, 2019, 9: 57. DOI:10.1186/s13613-019-0531-x |
| [13] | Pham MT, Rajić A, Greig JD, et al. A scoping review of scoping reviews: advancing the approach and enhancing the consistency[J]. Res Syn Meth, 2014, 5(4): 371-385. DOI:10.1002/jrsm.1123 |
| [14] | Daudt HM, van Mossel C, Scott SJ. Enhancing the scoping study methodology: a large, inter-professional team's experience with Arksey and O'Malley's framework[J]. BMC Med Res Methodol, 2013, 13: 48. DOI:10.1186/1471-2288-13-48 |
| [15] | Arksey H, O'Malley L. Scoping studies: towards a methodological framework[J]. Int J Soc Res Methodol, 2005, 8(1): 19-32. DOI:10.1080/1364557032000119616 |
| [16] | Tricco AC, Lillie E, Zarin W, et al. PRISMA extension for scoping reviews (PRISMA-ScR): checklist and explanation[J]. Ann Intern Med, 2018, 169(7): 467. DOI:10.7326/m18-0850 |
| [17] | 卢存存, 王芳芳, 高亚, 等. Scoping Review报告规范简介[J]. 中国药物评价, 2018, 6(35): 401-403. |
| [18] | Campbell IT, Watt T, Withers D, et al. Muscle thickness, measured with ultrasound, may be an Indicator of lean tissue wasting in multiple organ failure in the presence of edema[J]. Am J Clin Nutr, 1995, 62(3): 533-539. DOI:10.1093/ajcn/62.3.533 |
| [19] | Reid C. Muscle wasting and energy balance in critical illness[J]. Clin Nutr, 2004, 23(2): 273-280. DOI:10.1016/s0261-5614(03)00129-8 |
| [20] | Hadda V, Kumar R, Khilnani GC, et al. Trends of loss of peripheral muscle thickness on ultrasonography and its relationship with outcomes among patients with Sepsis[J]. J Intensive Care, 2018, 6: 81. DOI:10.1186/s40560-018-0350-4 |
| [21] | Turton P, Hay R, Taylor J, et al. Human limb skeletal muscle wasting and architectural remodeling during five to ten days intubation and ventilation in critical care – an observational study using ultrasound[J]. BMC Anesthesiol, 2016, 16: 119. DOI:10.1186/s12871-016-0269-z |
| [22] | Palakshappa JA, Reilly JP, Schweickert WD, et al. Quantitative peripheral muscle ultrasound in Sepsis: Muscle area superior to thickness[J]. Crit Care, 2018, 47: 324-330. DOI:10.1016/j.jcrc.2018.04.003 |
| [23] | Silva PE, Maldaner V, Vieira L, et al. Neuromuscular electrophysiological disorders and muscle atrophy in mechanically-ventilated traumatic brain injury patients: New insights from a prospective observational study[J]. J Crit Care, 2018, 44: 87-94. DOI:10.1016/j.jcrc.2017.10.026 |
| [24] | Puthucheary ZA, Rawal J, McPhail M, et al. Acute skeletal muscle wasting in critical illness[J]. JAMA, 2013, 310(15): 1591. DOI:10.1001/jama.2013.278481 |
| [25] | Borges RC, Soriano FG. Association between muscle wasting and muscle strength in patients who developed severe Sepsis and septic shock[J]. Shock, 2019, 51(3): 312-320. DOI:10.1097/shk.0000000000001183 |
| [26] | Hayes K, Holland AE, Pellegrino VA, et al. Acute skeletal muscle wasting and relation to physical function in patients requiring extracorporeal membrane oxygenation (ECMO)[J]. J Crit Care, 2018, 48: 1-8. DOI:10.1016/j.jcrc.2018.08.002 |
| [27] | ten Haaf D, Hemmen B, van de Meent H, et al. The magnitude and time course of muscle cross-section decrease in intensive care unit patients[J]. Am J Phys Med Rehabilitation, 2017, 96(9): 634-638. DOI:10.1097/phm.0000000000000711 |
| [28] | Hernández-Socorro C, Saavedra P, López-Fernández J, et al. Assessment of muscle wasting in long-stay ICU patients using a new ultrasound protocol[J]. Nutrients, 2018, 10(12): 1849. DOI:10.3390/nu10121849 |
| [29] | Berry MJ, Files DC, Campos CL, et al. Echogenicity is related to skeletal muscle strength in patients with acute respiratory failure[J]. J Cardiopulm Rehabilitation Prev, 2019, 39(3): E17-E20. DOI:10.1097/hcr.0000000000000403 |
| [30] | Witteveen E, Sommers J, Wieske L, et al. Diagnostic accuracy of quantitative neuromuscular ultrasound for the diagnosis of intensive care unit-acquired weakness: a cross-sectional observational study[J]. Ann Intensive Care, 2017, 7: 40. DOI:10.1186/s13613-017-0263-8 |
| [31] | Patejdl R, Walter U, Rosener S, et al. Muscular ultrasound, syndecan-1 and procalcitonin serum levels to assess intensive care unit-acquired weakness[J]. Can J Neurol Sci, 2019, 46(2): 234-242. DOI:10.1017/cjn.2018.390 |
| [32] | Galindo Martín CA, del Carmen Ubeda Zelaya R, Monares Zepeda E, et al. ROUNDS studies: relation of OUtcomes with nutrition despite severity: round one: ultrasound muscle measurements in critically ill adult patients[J]. J Nutr Metab, 2018, 2018: 1-7. DOI:10.1155/2018/7142325 |
| [33] | Mueller N, Murthy S, Tainter CR, et al. Can sarcopenia quantified by ultrasound of the rectus femoris muscle predict adverse outcome of surgical intensive care unit patients as well as frailty? A prospective, observational cohort study[J]. Ann Surg, 2016, 264(6): 1116-1124. DOI:10.1097/sla.0000000000001546 |
| [34] | Kelmenson DA, Quan DN, Moss M. What is the diagnostic accuracy of single nerve conduction studies and muscle ultrasound to identify critical illness polyneuromyopathy: a prospective cohort study[J]. Crit Care, 2018, 22: 342. DOI:10.1186/s13054-018-2281-9 |
| [35] | Gruther W, Benesch T, Zorn C, et al. Muscle wasting in intensive care patients: Ultrasound observation of the M. quadriceps femoris muscle layer[J]. Acta Derm Venereol, 2008, 40(3): 185-189. DOI:10.2340/16501977-0139 |
| [36] | Connolly B, Maddocks M, MacBean V, et al. Nonvolitional assessment of tibialis anterior force and architecture during critical illness[J]. Muscle Nerve, 2018, 57(6): 964-972. DOI:10.1002/mus.26049 |
| [37] | Baldwin CE, Bersten AD. Alterations in respiratory and limb muscle strength and size in patients with Sepsis who are mechanically ventilated[J]. Phys Ther, 2014, 94(1): 68-82. DOI:10.2522/ptj.20130048 |
| [38] | Balius R, Maestro A, Pedret C, et al. Central aponeurosis tears of the rectus femoris: practical sonographic prognosis[J]. Br J Sports Med, 2009, 43(11): 818-824. DOI:10.1136/bjsm.2008.052332 |
| [39] | Henriksson-Larsen K B, Lexell J, Sjostrom M. Distribution of different fibre types in human skeletal muscles. I. Method for the preparation and analysis of cross-sections of whole tibialis anterior[J]. Histochem J, 1983, 15(2): 167-178. DOI:10.1007/BF01042285 |
| [40] | Annetta MG, Pittiruti M, Silvestri D, et al. Ultrasound assessment of rectus femoris and anterior tibialis muscles in young trauma patients[J]. Ann Intensive Care, 2017, 7(1): 104. DOI:10.1186/s13613-017-0326-x |
| [41] | Stevens RD, Marshall SA, Cornblath DR, et al. A framework for diagnosing and classifying intensive care unit-acquired weakness[J]. Critical Care Medicine, 2009, 37(SUPPL. 10): S299-S308. DOI:10.1097/CCM.0b013e3181b6ef67 |
 2020, Vol. 29
2020, Vol. 29




