2 浙江大学湖州医院,湖州市中心医院,湖州师范学院附属中心医院 神经内科, 湖州 313000;
3 浙江大学湖州医院,湖州市中心医院,湖州师范学院附属中心医院 超声科, 湖州 313000;
4 浙江大学医学院,杭州 310052
2 Department of Neurology, Zhejiang University Huzhou Hospital, Huzhou Center Hospital, Affiliated Center Hospital of Huzhou University, Huzhou 313000, China;
3 Department of Ultrasound, Zhejiang University Huzhou Hospital, Huzhou Center Hospital, Affiliated Center Hospital of Huzhou University, Huzhou 313000, China;
4 School of Medicine, Zhejiang University, Hangzhou 310052, China
脓毒症(sepsis)有很高的发病率和病死率,在全球范围内严重威胁全人类的生命健康[1]。关于脓毒症导致脏器受累的检测和诊治研究主要集中在循环、呼吸以及肾脏等方面,对于其对脑功能影响以及相关脑循环的监测研究相对较少。作为脑血管功能及脑循环监测的常用及有效手段,脑血管多普勒(transcranial doppler,TCD)具有无创、可反复检测、动态评估等优点,在脑血管病应用方面意义重大,但对脓毒症脑循环监测的应用及对其转归预测价值的临床研究,国内外尚无报道。本研究通过床旁TCD对脓毒症患者大脑中动脉进行监测,分析这些指标与临床症状、严重程度之间的关系,以探讨其对脓毒症患者脑循环及脑功能的早期评估和预后早期预测的价值。
1 资料与方法 1.1 一般资料回顾性分析2017年1月至2018年6月入住本院脓毒症患者,脓毒症诊断标准符合《2016国际脓毒症和脓毒性休克管理指南》。排除标准:既往存在中枢神经系统疾病、精神疾病;中毒;已知存在脑梗死、脑出血或中枢感染,或其他代谢障碍导致的脑病;严重的肝肾功能不全。所有患者加入本研究前均签署知情同意书(不同意签署者,给予排除),并经湖州市中心医院伦理委员会批准。最终,本研究纳入脓毒症患者98例。
1.2 TCD检查采用中国深圳德力凯公司的超声经颅多普勒血流分析仪(EMS-9A),所有患者分别在24 h之内和第3天进行TCD检查,检测时暂停镇静药物。以2-MHz探头通过颞窗探测其两侧大脑中动脉,每一侧检测3次,取其最高值,将两侧最高值的平均数作为有效数据进行记录,检测内容包括平均血流速度(mean Velocity, Vm)、搏动指数(pulastility Index,PI)、阻力指数(resistivity index,RI)、收缩期峰值血流速度(peak systolic velocity,PSV)、舒张末期峰值血流速度(end diastolic velocity,EDV)等各项参数。其中一位患者第1天及第3天TCD检查图像见图 1。
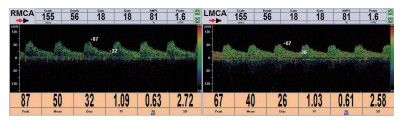
|
| 图 1 脓毒症患者第1天和第3天TCD图像 Fig 1 TCD images of sepsis patients on day 1 and day 3 |
|
|
所有患者记录以下指标:①入院24 h内的一般临床资料:年龄、性别、HsCRP、血管活性药物、镇静药物使用情况、平均动脉压(MAP)、动脉血pH值,动脉血二氧化碳分压(PCO2)、GCS评分、APACHE Ⅱ评分、CAM-ICU评分, 其中CAM-ICU阳性者与排除其他原因引起的昏迷者被认定存在脓毒症相关性脑病(sepsis-associated Encephalopathy,SAE)。②第1天和第3天TCD参数:PI、RI、Vm、PSV、EDV,同时计算第3天和第1天这些参数的差值。
1.4 研究方法所有患者均给予常规治疗,最后按28 d预后不同分为生存组(痊愈或感染控制转往普通病房患者)和死亡组(在院死亡或放弃抢救自动出院随访在家死亡患者)。回顾性分析两组间一般临床资料、第1天及第3天TCD参数是否差异有统计学意义,并分别比较两组第1和第3天治疗前后TCD参数变化,筛选出有意义的TCD参数指标,评估对患者转归的预测价值。
1.5 统计学方法运用SPSS 20软件统计学进行分析。两组及组间连续变量比较使用成组t检验。两组及组间率的比较使用χ2检验。绘制TCD指标对预后评价的受试者工作特征曲线(ROC),计算曲线下面积(area under curve,AUC),求出各指标对其预后的最佳预测界值。以P<0.05为差异具有统计学意义。
2 结果 2.1 一般临床资料共纳入98例患者,年龄为(65±16)岁,男性61例;生存组56例和死亡组42例,死亡组GCS评分显著低于生存组、而APACHE Ⅱ评分、血管活性药物以及镇静药物的使用比例均显著高于生存组(P均 < 0.05)。另外,死亡组脓毒症脑病(谵妄+昏迷)发生比例也明显多于生存组,具有统计学意义(P < 0.01)(见表 1)。
| 项目 | 脓毒症 (98例) |
生存组 (56例) |
死亡组 (42例) |
χ2/t值 | P值 |
| 年龄[岁] | 65±16 | 64±18 | 67±12 | -1.034 | 0.304 |
| 男性(例,%) | 61(62.2) | 33(58.9) | 28(66.7) | 0.612 | 0.434 |
| HsCRP[mg/dl] | 123±83 | 130±89 | 116±77 | 0.677 | 0.501 |
| pH | 7.36±0.11 | 7.45±0.03 | 7.36±0.19 | 1.723 | 0.088 |
| PCO2(mmHg) | 31±10 | 29±3 | 29±10 | -0.867 | 0.389 |
| MAP[mmHg] | 83±16 | 84±14 | 81±19 | 0.946 | 0.347 |
| GCS[分] | 13±3 | 14±2 | 12±4 | 2.522 | 0.014 |
| APACHE Ⅱ[分] | 13±7 | 10±5 | 17±7 | -5.968 | < 0.01 |
| CAM-ICU[阳性,(例,%)] | 20(20.4) | 9(17) | 11(33.3) | 3.047 | 0.081 |
| 谵妄+昏迷(例,%) | 32(32.7) | 12(21.4) | 20(47.6) | 7.486 | < 0.01 |
| 血管活性药物(例,%) | 21(21.4) | 7(12.5) | 14(33.3) | 6.187 | 0.013 |
| 镇静药物(例,%) | 18(18.4) | 5(8.9) | 13(31.0) | 6.365 | 0.012 |
TCD参数组间比较:(1)第1天生存组的PI及RI低于死亡组,差异存在统计学意义(P < 0.05),而两组间PSV、Vm、EDV差异无统计学意义(P > 0.05),见表 2。(2)第3天生存组的PI及RI低于死亡组,差异存在统计学意义(P < 0.05),而两组间PSV、Vm、EDV差异无统计学意义(P > 0.05),见表 3。(3)生存组PI及RI第1天与第3天的差值均大于死亡组,差异存在统计学意义(P < 0.01),见表 4。
| 指标 | 脓毒症 | 生存组 | 死亡组 | t值 | P值 |
| PSV(cm/s) | 96±20 | 95±22 | 89±14 | 1.553 | 0.124 |
| Vm(cm/s) | 54±14 | 56±15 | 52±12 | 1.732 | 0.087 |
| EDV(cm/s) | 34±10 | 36±10 | 33±9 | 1.669 | 0.098 |
| PI | 1.12±0.13 | 1.09±0.11 | 1.16±0.12 | -2.981 | 0.004 |
| RI | 0.64±0.04 | 0.63±0.04 | 0.65±0.04 | -3.569 | 0.001 |
| 指标 | 脓毒症 | 生存组 | 死亡组 | t值 | P值 |
| PSV(cm/s) | 91±19 | 91±15 | 92±22 | -0.177 | 0.860 |
| Vm(cm/s) | 54±12 | 56±11 | 52±13 | 1.389 | 0.169 |
| EDV(cm/s) | 35±8 | 36±7 | 33±9 | 1.778 | 0.08 |
| PI | 1.03±0.61 | 0.96±0.12 | 1.12±0.12 | -6.836 | < 0.01 |
| RI | 0.61±0.05 | 0.58±0.05 | 0.64±0.04 | -6.789 | < 0.01 |
| 指标 | 脓毒症 | 生存组 | 死亡组 | t值 | P值 |
| Day1PI-Day3PI | 0.09±0.14 | 0.13±0.14 | 0.02±0.12 | 4.114 | < 0.01 |
| Day1RI-Day3RI | 0.03±0.05 | 0.04±0.05 | 0.01±0.03 | 3.829 | < 0.01 |
TCD参数组内治疗前后比较,生存组中无论PI还是RI在第3天时均较第1天有了明显下降,具有统计学意义(P < 0.05), 见图 2和图 3。死亡组在第1天和第3天测得的PI和RI值比较差异无统计学意义(P > 0.05),见图 4和图 5。可见生存组经治疗后脑循环较前改善,而死亡组治疗前后脑循环无明显改变。
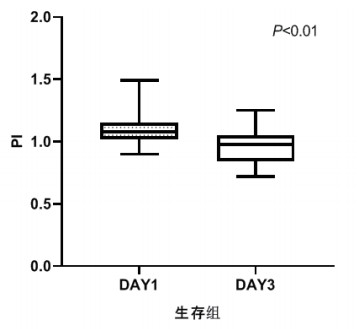
|
| 图 2 生存组第1天和第3天PI比较 Fig 2 Comparison of PI between the first day and the third day in the survival group |
|
|
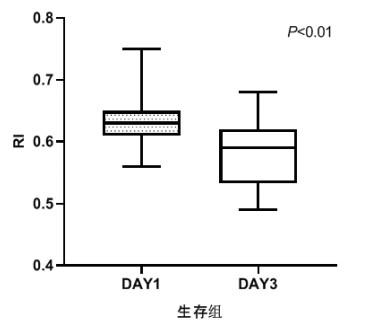
|
| 图 3 生存组第1天和第3天RI比较 Fig 3 Comparison of RI between the first day and the third day in the survival group |
|
|
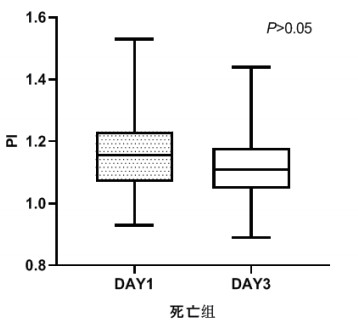
|
| 图 4 死亡组第1天和第3天PI比较 Fig 4 Comparison of PI between the first day and the third day in the death group |
|
|
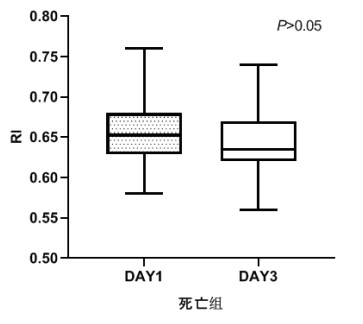
|
| 图 5 死亡组第1天和第3天RI比较 Fig 5 Comparison of RI between the first day and the third day in the death group |
|
|
第1天PI、第3天PI、Day1PI-Day3PI、第1天RI、第3天RI及Day1RI-Day3RI、APACHE Ⅱ预测脓毒症患者预后的AUC分别为0.657(95%CI:0.545~0.769)、0.835(95%CI:0.758~0.913)、0.730(95%CI:0.631~0.828)、0.707(95%CI:0.602~0.812)、0.826(95%CI:0.746~0.906)、0.705(95%CI:0.602~0.808)、0.815(95%CI:0.728~0.901),P均<0.01,可见第3天PI及RI的预测价值最大与APACHE Ⅱ相当,而第1天PI、Day1PI-Day3PI、第3天RI及Day1RI-Day3RI的预测价值降低。当第3天PI截断值为1.02时,预测脓毒症预后的灵敏度为85.7%、特异度为61.3%,第3天RI截断值为0.62时,预后脓毒症预后的灵敏度为78.6%、特异度为71.4%。见图 6及表 5。
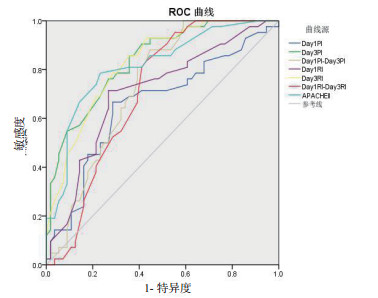
|
| 图 6 各指标预测预后的ROC曲线 Fig 6 ROC curve of indexes for predicting prognosis |
|
|
| 指标 | AUC | 95%CI | 截断值 | 敏感度 (%) |
特异度 (%) |
| Day1PI | 0.657 | 0.545~0.769 | 1.12 | 66.7 | 71.4 |
| Day3PI | 0.835 | 0.758~0.913 | 1.02 | 85.7 | 61.3 |
| Day1PI-Day3PI | 0.730 | 0.613~0.828 | 0.13 | 55.4 | 88.1 |
| Day1RI | 0.707 | 0.606~0.812 | 0.64 | 71.4 | 73.2 |
| Day3RI | 0.826 | 0.746~0.906 | 0.62 | 78.6 | 71.4 |
| Day1RI-Day3RI | 0.705 | 0.602~0.808 | 0.38 | 57.1 | 83.3 |
| APACHE Ⅱ | 0.815 | 0.728~0.901 | 12.5 | 78.6 | 76.8 |
脓毒症是全世界重症病房中主要致死原因之一[2],脓毒症时低血压[3-4]、脑血管自身调节障碍会导致脑血流量减少[3-5],炎症介质释放、血管内皮受损、凝血功能障碍会引起大脑微循环受损[6],此外脓毒症治疗过程中使用血管活性药物[7]和镇静剂[8]、运用机械通气[9]均会影响脑血管收缩舒张、血流状态以及血管阻力。脑作为脓毒症易累及的部位,可以出现淡漠、活动减少、反应迟钝、认知功能减退、定向力障碍、神志模糊、谵妄甚至昏迷等表现,即脓毒症相关性脑病(sepsis-associated encephalopathy, SAE)。研究表明脑灌注减少及微循环障碍是SAE发病的重要机制之一[10],SAE可能为脓毒症的首要症状,是脓毒症患者死亡的独立危险因素,会导致脓毒症幸存者的长期认知缺陷[2],因此早期监测脑循环变化、及时判断脑功能情况至关重要。
TCD作为一项脑功能、脑循环监测的非侵入性检查方法,可以和远红外线监测仪、脑电图、体感诱发电位、CT以及MRI等一样成为重症病房中对脓毒症患者进行诊断、管理和预测的辅助手段[11]。PI为搏动指数,反映血管顺应性;RI为阻力指数,反映血管的舒缩状况和阻力状况;PSV为收缩期峰值血流速度,间接反应体循环总血流量;EDV为舒张末期峰值血流速度,反映血管远端阻力;Vm为平均血流速度,反映脑灌注情况。研究表明,TCD可以通过测量大脑中动脉的流速变化,无创、实时的监测脑血流量变化[12-13]。De Azevedo等[14]报道在脓毒症早期,由于脑自动调节功能的存在,颅内压维持不变,而PI增加,提示血管顺应性下降、血管弹性减退,可能是炎症介质释放引起的微血管内皮功能紊乱,从而反映大脑微循环障碍。目前已有研究将静态TCD参数用于早期辅助判断脑血流情况[15-16],但脓毒症患者的脑灌注是随时间不断变化的,本研究动态监测脓毒症患者入院第1天及第3天TCD参数变化,从而了解脑灌注变化,评估脑功能情况及预测预后。
相较于健康对照组[17]和其他非脓毒症的重症患者[15],脓毒症患者PI明显升高,PI越大,远端血管阻力增高,反之则远端血管阻力降低;同时发现,RI也明显升高[15], 而其Vm并差异无统计学意义。甚至可以通过TCD观察脑灌注障碍来解释SAE的临床症状[15], 艾美林等[16]报道SAE组患者PI、RI明显高于脓毒症未合并脑病组患者,提示SAE患者存在脑灌注不足可能。在本研究中,两组患者年龄、性别、血pH值、血二氧化碳分压以及平均动脉压等均差异无统计学意义,从而排除了这些因素对脑血流速度的影响,两组脑循环监测具有可比性。死亡组的APACHE Ⅱ评分明显高于生存组,SAE患者例数也多于生存组,说明死亡组病情较重且脑功能情况较差。无论是第1天还是第3天,死亡组PI和RI均高于生存组,而两组间PSV、Vm、EDV则差异无统计学意义,提示相对于后三者,脓毒症患者的PI和RI变化更为敏感。而PI和RI的升高提示死亡组血管顺应性更差,阻力更高,推测其脑循环及脑功能情况相对更差。动态比较两组PI、RI第1天和第3天变化情况显示,生存组第3天的PI与RI的值均较第1天下降,而死亡组PI与RI的值均无明显变化,可能提示生存组患者的血管顺应性和阻力状况较前改善,也预示着病情的好转。
脓毒症患者第1天PI > 1.3,可预测患者出现谵妄的可能,AUC为0.908,敏感度为95%,特异度为88%。艾美林等[16]的研究表明第1天PI、RI均可预测SAE,AUC均 > 0.7,截断值分别为1.16、0.65。SAE又是脓毒症患者死亡的独立危险因素,且本研究显示PI及RI能反映疾病严重度及脑功能情况,动态PI、RI可反映病情变化,因而认为动态TCD检测对脓毒症预后有一定的预测价值。APACHE Ⅱ是目前我国重症病房广泛应用的评价危重患者病情严重程度的评分系统。在本研究中第1天PI、第3天PI、Day1PI-Day3PI、第1天RI、第3天RI、Day1RI-Day3RI及APACHEⅡ均可预测脓毒症患者预后,AUC分别为0.657、0.835、0.730、0.707、0.826、0.705、0.815,其中第3天PI及RI预测价值较大,与APACHE Ⅱ相当,当第3天PI截断值为1.02时,灵敏度为85.7%、特异度为61.3%,第3天RI截断值为0.62时,灵敏度为78.6%、特异度为71.4%。PI、RI前后变化值预测预后的价值不高,但Day1PI-Day3PI、Day1RI-Day3RI截断值分别为0.13、0.38时有较高的特异度,特异度为88.1%、83.3%,灵敏度为55.4%、57.1%。
利益冲突 所有作者均声明不存在利益冲突
| [1] | 杜欣欣, 郭驹, 李文哲, 等. 急诊、重症一体化:攻克脓毒症, 需要团队力量[J]. 中华急诊医学杂志, 2019, 28(8): 926-928. DOI:10.3760/cma.j.issn.1671-0282.2019.08.002 |
| [2] | Chung HY, Wickel J, Brunkhorst FM, et al. Sepsis-Associated Encephalopathy: From Delirium to Dementia?[J]. J Clin Med, 2020, 9(3). DOI:10.3390/jcm9030703 |
| [3] | Pfister D, Siegemund M, Dell-Kuster S, et al. Cerebral perfusion in sepsis-associated delirium[J]. Crit Care, 2008, 12(3): R63. DOI:10.1186/cc6891 |
| [4] | Goodson CM, Rosenblatt K, Rivera-Lara L, et al. Cerebral blood flow autoregulation in Sepsis for the intensivist: why its monitoring may be the future of individualized care[J]. J Intensive Care Med, 2018, 33(2): 63-73. DOI:10.1177/0885066616673973 |
| [5] | Hotchkiss RS, Moldawer LL, Opal SM, et al. Sepsis and septic shock[J]. Nat Rev Dis Primers, 2016, 2: 16045. DOI:10.1038/nrdp.2016.45 |
| [6] | Taccone FS, Su FH, de Deyne C, et al. Sepsis is associated with altered cerebral microcirculation and tissue hypoxia in experimental peritonitis[J]. Crit Care Med, 2014, 42(2): e114-e122. DOI:10.1097/ccm.0b013e3182a641b8 |
| [7] | Berg RM, Plovsing RR, Bailey DM, et al. The dynamic cerebral autoregulatory adaptive response to noradrenaline is attenuated during systemic inflammation in humans[J]. Clin Exp Pharmacol Physiol, 2015, 42(7): 740-746. DOI:10.1111/1440-1681.12421 |
| [8] | KaDOI Y, Saito S, Kawauchi C, et al. Comparative effects of propofol vs dexmedetomidine on cerebrovascular carbon dioxide reactivity in patients with septic shock[J]. Br J Anaesth, 2008, 100(2): 224-229. DOI:10.1093/bja/aem343 |
| [9] | Berg RMG, Plovsing RR. Effects of short-term mechanical hyperventilation on cerebral blood flow and dynamic cerebral autoregulation in critically ill patients with Sepsis[J]. Scand J Clin Lab Investig, 2016, 76(3): 226-233. DOI:10.3109/00365513.2015.1137350 |
| [10] | Robba C, Crippa IA, Taccone FS. Septic encephalopathy[J]. Curr Neurol Neurosci Rep, 2018, 18(12): 82. DOI:10.1007/s11910-018-0895-6 |
| [11] | Oddo M, Taccone FS. How to monitor the brain in septic patients?[J]. Minerva Anestesiol, 2015, 81(7): 776-788. |
| [12] | Molnar L, Fulesdi B, Nemeth N, et al. Sepsis-associated encephalopathy: A review of literature[J]. Neurol India, 2018, 66(2): 352-361. DOI:10.4103/0028-3886.227299 |
| [12] | Fülesdi B, Molnar L, Németh N, et al. Sepsis-associated encephalopathy: a review of literature[J]. Neurol India, 2018, 66(2): 352. DOI: 10.4103/0028-3886.227299. |
| [13] | 杨晓梅, 周保纯, 朱建军, 等. 脑氧代谢率评估心肺复苏后脑功能预后[J]. 中华急诊医学杂志, 2018, 27(12): 1341-1346. DOI:10.3760/cma.j.issn.1671-0282.2018.12.006 |
| [14] | de Azevedo DS, Salinet ASM, de Lima Oliveira M, et al. Cerebral hemodynamics in Sepsis assessed by transcranial Doppler: a systematic review and meta-analysis[J]. J Clin Monit Comput, 2017, 31(6): 1123-1132. DOI:10.1007/s10877-016-9945-2 |
| [15] | Pierrakos C, Antoine A, Velissaris D, et al. Transcranial Doppler assessment of cerebral perfusion in critically ill septic patients: a pilot study[J]. Ann Intensive Care, 2013, 3: 28. DOI:10.1186/2110-5820-3-28 |
| [16] | 艾美林, 黄立, 冯清, 等. 经颅多普勒超声在早期诊断脓毒症相关性脑病中的临床意义[J]. 中华内科杂志, 2019, 58(11): 814-818. DOI:10.3760/cma.j.issn.0578?1426.2019.11.005 |
| [17] | Szatmári S, Végh T, Csomós Á, et al. Impaired cerebrovascular reactivity in Sepsis-associated encephalopathy studied by acetazolamide test[J]. Crit Care, 2010, 14(2): R50. DOI:10.1186/cc8939 |
 2020, Vol. 29
2020, Vol. 29




