2 浙江省人民医院,杭州医学院附属人民医院麻醉科, 310014
2 Department of Anesthesiology, Zhejiang Provincial People's Hospital, People's Hospital of Hangzhou Medical College, Hangzhou 310014, China
心脏骤停(cardiac arrest, CA)是临床上最严重的急症,尽管心肺复苏(cardiopulmonary resuscitation, CPR)技术不断发展和普及,CA患者病死率仍居高不下[1]。CA后脏器功能保护一直是急重症领域研究的难点和热点,但对于CA期间重要脏器病理生理改变的研究较少[2-3]。
在前期的研究中发现,窒息模型大鼠CA时间超过6 min,胸外按压产生的收缩压很难超过30 mmHg,因而复苏失败;开胸检查发现大鼠心脏缩小、触之僵硬,发生缺血性心肌挛缩。室颤后心肌挛缩一般在CA 20~30 min或CPR期间出现[4-5],为何窒息诱发CA早期即发生心肌挛缩?本研究对此现象探索如下。
1 材料与方法 1.1 动物准备本实验获杭州医学院动物伦理委员会批准。31只健康成年雄性Wistar大鼠,体质量280~320 g,由浙江中医药大学动物实验中心提供。动物购进后于SPF级动物房饲养1周,实验前晚禁食不禁水。戊巴比妥钠(sigma公司,美国)30 mg/kg腹腔内注入进行麻醉,酌情给予1/3的首剂量维持。
1.2 手术操作麻醉成功后,以14 G鞘管经口气管插管,接小动物呼吸机(Harvard Apparatus, 美国),通气频率70次/min,潮气量12 mL/kg。连续Ⅱ导联心电监护,解剖分离股、动静脉,24 G留置针穿刺,动脉管监测动脉血压,静脉管用以给药。四通道生理信号采集分析系统(SantaBarbara, 美国)记录血压、心电信息。
1.3 模型制备窒息法建立大鼠CA模型:静脉注射维库溴铵2 mg/kg消除大鼠自主呼吸,于呼气末关闭呼吸机、封堵气管插管,当收缩压至20 mmHg以下开始CA计时。
室颤法建立大鼠CA模型:致颤电极采用两根极细针灸针,一根插入左胸部皮下,另一根经胸壁插入心外膜。电极放置后接交流电(6 V,50 Hz)诱发室颤。致颤成功的标准为:动脉搏动消失,收缩压迅速下降<20 mmHg,心电表现为室颤波形。
1.4 实验分组大鼠随机(随机数字法)分为空白对照组(n=3)、窒息组(n=14)和室颤组(n=14)。空白对照组仅予手术操作,不进行CA诱发;窒息组以窒息法诱导大鼠CA;室颤组以室颤法诱发CA。
1.5 监测与取材记录各组动物造模过程中心电与血压变化,记录诱发CA成功所用时间。CA 0 min时每组随机选择6只大鼠用于心肌ATP含量测定,剩余的每组8只大鼠用于血气分析、心脏长宽测量及CA 8 min时的心肌ATP含量测定。
1.5 血气分析于CA 0 min时抽取动脉血0.3 mL行血气分析检测,检测指标包括pH、二氧化碳分压(Pco2)、氧分压(Po2)、碱剩余(BE)和乳酸(Lac)。
1.6 心脏长度和宽度的测量剪开大鼠胸腔,充分暴露心脏,在CA 0、2、4、6、8 min以游标卡尺分别测量大鼠心脏的长度、宽度。长度指大鼠心尖至主动脉根部的距离,宽度是指心脏在冠状面的最大横径。
1.7 心肌ATP含量的测定取实验大鼠适量心尖部组织用于心肌ATP含量的测定。操作步骤按照试剂盒说明书进行(ATP生物发光检测试剂盒,Roche),心肌ATP含量最终换算成ng/mg表示。
1.8 统计学方法采用SPSS 13.0软件包进行统计分析,计量资料以均数±标准差(Mean±SD)表示,多组间比较采用单因素方差分析,两组间的比较采用Bonferroni检验,同组不同时间点心脏大小之间的比较采用Wilcoxon Signed Ranks检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 基本生理参数各组动物体质量、基础心率、基础平均动脉压比较差异无统计学意义(均P > 0.05)。窒息模型从封堵气管插管至CA诱发成功所用时间(即窒息阶段)为(237±20)s,室颤组从致颤至CA诱发成功用时(3±1)s (表 1)。
| 指标 | 空白组 (n=3) |
窒息组 (n=14) |
室颤组 (n=14) |
| 体质量(g) | 311±6 | 307±11 | 312±10 |
| 心率(次/min) | 396±12 | 403±13 | 405±16 |
| 平均动脉压(mmHg) | 89±6 | 92±12 | 90±13 |
| 诱发CA时间(s) | — | 237±20 | 3±1a |
| 注:与窒息组比较,aP<0.05 | |||
窒息模型收缩压降至20 mmHg以下需要数分钟的时间,在这一时间(窒息阶段)内心脏仍在收缩射血(图 1A),而室颤模型血压在数秒钟内降至最低值,心脏迅速停止射血(图 1C); 窒息模型CA时心电表现为无脉性电活动(图 1B),这与室颤模型的室颤波形不同(图 1D)。
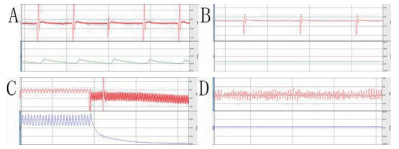
|
| A:窒息阶段心率血压逐渐下降;B:无脉性电活动;C:室颤后血压迅速下降;D:室颤波形。 图 1 两种模型诱发CA过程中心电与血压变化的特点 Fig 1 The characteristics of electrocardiogram and blood pressure at the induced CA stage |
|
|
窒息组大鼠在CA 0 min时已经发生严重的低氧血症、二氧化碳潴留及酸中毒(表 2),而室颤组大鼠血气检测各项指标基本正常。
| 组别 | n | pH | Pco2 | Po2 | BE | Lac |
| 窒息 | 8 | 7.10±0.08 | 73.93±5.75 | 13.33±4.16 | -8.53±0.93 | 5.59±0.62 |
| 室颤 | 8 | 7.41±0.04* | 39.33±2.52a | 73.67±5.69a | -2.19±0.61a | 2.04±0.14a |
| 注:与窒息组比较,aP<0.05 | ||||||
平均动脉压降至20 mmHg时,大鼠心脏颜色鲜红、外形饱满,心房和心室仍有极微弱的收缩。随着CA时间延长,窒息法大鼠心脏长度及宽度逐渐缩小,CA 6 min左右心脏外形扭曲、触之僵硬,CA 8 min心脏长宽与前一时间点相比差异无统计学意义(均P>0.05,表 3),这可能意味着CA 6 min左右心肌挛缩已接近极限。而室颤组大鼠心脏形态在CA后8 min的观察时间内无明显变化。
| 组别 | n | 心脏大小 | 0(min) | 2(min) | 4(min) | 6(min) | 8(min) |
| 窒息 | 8 | 长度(cm) | 1.80±0.09 | 1.67±0.13a | 1.49±0.15a | 1.32±0.17a | 1.36±0.19 |
| 宽度(cm) | 1.36±0.07 | 1.25±0.10a | 1.12±0.12a | 1.01±0.14a | 1.04±0.14 | ||
| 室颤 | 8 | 长度(cm) | 1.78±0.08 | 1.80±0.11 | 1.81±0.12 | 1.81±0.13 | 1.79±0.15 |
| 宽度(cm) | 1.34±0.07 | 1.36±0.09 | 1.36±0.11 | 1.37±0.12 | 1.36±0.12 | ||
| 注:与同组前一时间点比较,aP<0.05 | |||||||
CA 0 min时窒息组心肌ATP含量与空白组比较已明显下降(P<0.05,图 2),而室颤组与空白组比较差异无统计学意义(P>0.05);CA 8 min时窒息及室颤组心肌ATP含量较空白组明显下降(均P<0.05),但室颤组高于窒息组(P<0.05)。
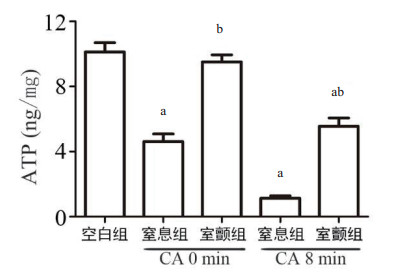
|
| ATP:三磷酸腺苷;CA:心脏骤停;与空白组比较,aP<0.05;与窒息组比较,bP<0.05 图 2 心肌ATP含量的比较 Fig 2 Comparison of myocardial ATP content among the groups |
|
|
有效的胸外按压可使停滞的血液再循环,是脏器功能保护和自主循环恢复的基础[6-7]。发生心肌挛缩的情况下,室壁渐进性增厚、心腔容量缩小,使胸外按压有效性下降[8]。“石头心”是心肌挛缩的极端形式,此时胸外按压的胸泵或心泵机制均无法发挥作用,只能产生少量血流甚至无血流,导致无效的心肺复苏[9]。
CA后为何会发生心肌挛缩?心脏停止射血后细胞开始无氧代谢,发生细胞内酸中毒,过量H+激活钠-氢泵,Na+大量进入细胞反向激活钠-钙泵,随之大量Ca2+进入胞浆[10-11]。细胞膜及肌浆网钙泵转移Ca2+至细胞外或肌浆网内需要消耗能量,如ATP缺乏则无法转运胞浆内的Ca2+,进而Ca2+持续增高导致钙超载[12]。由于CA后的一段时间内肌丝仍有收缩能力,在过量Ca2+刺激下心肌产生不受控制、过度的收缩,即缺血性心肌挛缩[13]。有研究发现在ATP降至正常值10%以下时,会产生心肌挛缩最严重的形式,即“石头心”[14]。
Robert等[4]利用磁共振技术记录了猪室颤过程中心脏形态的改变,发现室颤后20~30 min,心室游离壁进行性增厚、心室容积显著缩小,心脏出现缺血性挛缩。在人类CA的研究中也存在相似的现象[15]。本研究中大鼠在室颤后8 min的时间内未发生心肌挛缩,但窒息模型大鼠CA后心脏长度及宽度逐渐缩小,并且在6 min左右心肌挛缩程度接近最大。窒息模型为何在CA早期即发生心肌挛缩?本研究发现,窒息模型在CA前存在数分钟的窒息过程,机体无氧气摄入,但心脏仍在收缩射血,导致ATP大量消耗。而室颤模型在室颤发生瞬间心脏停搏,心肌ATP得以保存,可用于钙泵功能的维持。窒息阶段ATP大量消耗,导致能量缺乏不足以转运胞浆中的Ca2+,进而钙超载更早出现,可能是窒息性CA早期发生心肌挛缩的原因。但因实验条件所限,本研究没有对心肌细胞内Ca2+浓度进行测定。
综上所述,窒息性CA早期即发生心肌挛缩,这可能与窒息阶段ATP大量消耗有关。相比于室颤,窒息性CA后心肌挛缩发生更早,故对窒息性CA的抢救更应争分夺秒。了解心肌挛缩的发生规律,有助于CA患者更好地救治。
利益冲突 所有作者均声明不存在利益冲突
| [1] | McLaughlin TJ, Jain SK, Voigt AH, et al. Comparison of long-term survival following sudden cardiac arrest in men versus women[J]. Am J Cardiol, 2019, 124(3): 362-366. DOI:10.1016/j.amjcard.2019.04.051 |
| [2] | 朱建良, 朱建军, 刘励军. 心脏骤停后综合征患者早期集束化治疗进展[J]. 中华急诊医学杂志, 2019, 28(1): 7-13. DOI:10.3760/cma.j.issn.1671-0282.2019.01.003 |
| [3] | 江城, 赵剡. 心脏骤停患者实施标准化体外心肺复苏的展望[J]. 中国急救医学, 2018, 27(3): 240-244. DOI:10.3760/cma.j.issn.1671-0282.2018.03.003 |
| [4] | Berg RA, Sorrell VL, Kern KB, et al. Magnetic resonance imaging during untreated ventricular fibrillation reveals prompt right ventricular overdistention without left ventricular volume loss[J]. Circulation, 2005, 111(9): 1136-1140. DOI:10.1161/01.CIR.0000157147.26869.31 |
| [5] | Klouche K, Weil MH, Sun S, et al. Evolution of the stone heart after prolonged cardiac arrest[J]. Chest, 2002, 122(3): 1006-1011. DOI:10.1378/chest.122.3.1006 |
| [6] | 郑康, 马青变, 王国兴, 等. 心脏骤停生存链实施现状及预后因素研究[J]. 中华急诊医学杂志, 2017, 26(1): 51-57. DOI:10.3760/cma.j.issn.1671-0282.2017.01.010 |
| [7] | Koster RW, Baubin MA, Bossaert LL, et al. European Resuscitation Council Guidelines for Resuscitation 2010 Section 2. Adult basic life support and use of automated external defibrillators[J]. Resuscitation, 2010, 81(10): 1277-1292. DOI:10.1016/j.resuscitation.2010.08.009 |
| [8] | 王立祥. 应重视缺血性心脏挛缩的研究[J]. 解放军医学杂志, 2014, 39(2): 85-88. DOI:10.11855/j.issn.0577-7402.2014.02.01 |
| [9] | Ayoub IM, Kolarova J, Yi Z, et al. Sodium-hydrogen exchange inhibition during ventricular fibrillation: Beneficial effects on ischemic contracture, action potential duration, reperfusion arrhythmias myocardial function, and resuscitability[J]. Circulation, 2003, 107(13): 1804-9. DOI:10.1161/01.CIR.0000058704.45646.0D |
| [10] | Avkiran M. Rational basis for use of sodium–hydrogen exchange inhibitors in myocardial ischemia[J]. Am J Cardiol, 1999, 83(10): 10-18. DOI:10.1016/s0002-9149(99)00215-5 |
| [11] | Eigel BN, Hadley RW. Antisense inhibition of Na+/Ca2+ exchange during anoxia/reoxygenation in ventricular myocytes[J]. Am J Physiol Heart Circ Physiol, 2001, 281(5): H2184-190. DOI:10.1152/ajpheart.2001.281.5.H2184 |
| [12] | 王文广, 吴杰, 张存泰. 心肌缺血时钙调蛋白信号转导途径的变化与对心脏的影响[J]. 中国心脏起搏与心电生理杂志, 2005, 19(4): 313-315. DOI:10.3969/j.issn.1007-2659.2005.04.021 |
| [13] | Chalkias A, Xanthos T. Pathophysiology and pathogenesis of post-resuscitation myocardial stunning[J]. Heart Fail Rev, 2012, 17(1): 117-128. DOI:10.1007/s10741-011-9255-1 |
| [14] | Koretsune Y, Marban E. Mechanism of ischemic contracture in ferret hearts: relative roles of[Ca2+]i elevation and ATP depletion[J]. Am J Physiol, 1990, 285(1): H9-16. DOI:10.1152/ajpheart.1990.258.1.H9 |
| [15] | Takino M, Okada Y. Firm myocardium in cardiopulmonary resuscitation[J]. Resuscitation, 1996, 33(2): 101-106. DOI:10.1016/s0300-9572(96)00995-1 |
 2020, Vol. 29
2020, Vol. 29




