重症患者急性胃肠损伤(Acute gastrointestinal injury, AGI)发生率约为40%~90%,是导致多脏器功能衰竭(multiple organ failure, MOF)的始动因素之一[1]。AGI除了增加患者住院时间、住院费用外,还提高医院获得性感染的概率及病死率[2-3]。AGI分级系统及处理推荐意见于2012年由欧洲危重病医学会(European Society of Intensive Care Medicine, ESICM)提出并践行至今[4],但现阶段AGI分级系统较为复杂,缺乏简便准确的量化指标,且因为临床镇静、镇痛及插管等原因,当患者出现恶心、呕吐、肠麻痹甚至腹压增高,胃肠道损伤往往已十分严重,并不利于对AGI早期识别、治疗。对此,有部分学者采用监测瓜氨酸、肠型脂肪酸结合蛋白等来作为早期判断AGI的指标,但其作用仍有较多争议[5-6]。床旁多普勒超声作为一种无创、快速、可重复的检查工具广泛用于危重患者的诊疗[7-8]。基于超声检查的胃窦运动指数(motility index, MI)、肠系膜上动脉(superior mesenteric artery,SMA)时间平均流速(time averaged mean velocity, TAMV)、搏动指数(pulsatility index, PI)、阻力指数(resistance index, RI)等能直接反映患者胃肠道血流灌注、消化及喂养不耐受状态[9-11],缺血-再灌注是胃肠功能障碍的重要起因,喂养不耐受(feeding intolerance, FI)是胃肠功能障碍的重要标志。因此,胃肠道超声可能是临床评价重症患者急性胃肠损伤的一个简便、可靠手段。本研究通过床边超声监测重症患者的MI、TAMV、RI、PI等指标,探讨其对重症患者发生AGI的早期诊断价值。
1 资料与方法 1.1 一般资料前瞻性选取2018年1月至2019年6月广西壮族自治区人民医院EICU收治的重症患者73例。根据患者是否出现AGI分成AGI组和无AGI组。
1.2 诊断标准AGI诊断符合2012年ESICM对AGI的诊断标准,并根据胃肠损伤严重程度诊断标准分级[5];所有研究者需接受研究前培训。所有研究对象入选后1周内,每天由1名高年资医师、1名主管医师及1名主管护士按照2012年欧洲危重病学会推荐意见联合评估AGI分级。
1.3 排除标准ICU住院时间≤7 d;经心肺复苏者;入院前出现急性胃肠功能损伤者;有炎性肠病(IBD)、消化道肿瘤、机械性肠梗阻病史者、慢性功能性肠病;孕期及围产期妇女;3个月内有消化道手术史;多脏器功能衰竭终末期及恶性肿瘤患者;未获得知情同意者。
1.4 伦理学本研究经广西壮族自治区人民医院伦理委员会批准(批文号:KY-GKG-2016-182号)。所有受试者或家属签署知情同意书。
1.5 观察指标收集两组患者一般资料:包括年龄、性别、感染部位、合并疾病、体质量指数(body mass index, BMI)、白细胞、红细胞、降钙素原等。收集两组患者急性生理学与慢性健康状况评分Ⅱ(acute physiology and chronic health evaluationⅡ, APACHEⅡ)、序贯器官功能衰竭评分(sequential organ failure assessment, SOFA)。收集两组患者入院前后MI、TAMV、RI、PI等多普勒超声指标。
1.6 胃肠道超声测量参照单胃窦测量法[12]:患者入科后每天进行床旁超声检查,利用超声监测仪(Vividq,General Electrics,美国)测量,腹部超声探头5 Hz,超声测量由接受过超声系统培训且获得相应资质的ICU医生重复测量同部位3次取均值,由一名超声专业副主任医师进行图像复核。具体操作:患者均常规留置胃管, 检查前空腹8 h或持续胃肠减压。超声依次扫描胃、十二指肠、空回肠、回盲部、升结肠、横结肠、降结肠及乙状结肠, 测量扩张肠管的管腔内径、肠管壁厚度, 测量肠腔内积液及腹腔积液情况。2 min内鼻饲300 mL超声造影剂, 采用胃窦单切面法测定造影后第1、15分钟最大胃窦部黏膜内径作为胃窦面积(AA), 胃排空速率(GER)=(AA1 min-AA15 min)/AA1 min; 胃窦收缩频率(ACF)为造影后6 min内观察到的收缩次数; 胃窦收缩幅度(ACA)为进食后6 min内每隔2 min测定胃窦最大舒张面积和最小收缩面积,ACA=(平均最大舒张面积-平均最小收缩面积)/最大舒张面积; 胃动力指数(MI)= ACF×ACA。十二指肠胃窦反流(DGR):探头置于经幽门平面并同时显示胃窦、幽门及十二指肠球部, 彩色多普勒超声观察到经幽门流体出现朝向探头方向为阳性。造影条件下再次扫面小肠及结肠各段, 观察肠黏膜皱襞、肠管内径及肠蠕动情况, 记录扩张肠管内径及范围、单位时间内观察到的收缩次数。对明显扩张或动力减弱的肠管进行静脉造影多普勒检查, 观察局部肠壁血流, 记录造影剂到达时间、达峰时间、流入时间及增强范围。患者平卧位,探头沿腹主动脉纵切显示SMA长轴,局部放大后在SMA起始部远心端1.0~2.0 cm以内测量血管内径(D),用脉冲多普勒显示血流频谱,血流与声束的夹角为25°~45°,测量计算包括收缩期峰值流速(peak-systolic flow velocity, PSV),舒张末期流速(end-diastolic flow velocity, EDV),TAMV,PI[PI=(PSV-EDV)/TAMV],RI[RI=(PSV-EDV)/PSV]及频谱形态,反复测量,记录至少6个心动周期的血流频谱波形,取其平均值,以此评估受检者SMA血流动力参数情况。正常人SIVIA血流参数95%正常范围:SMA直径(D)5.5~6.8 mm,收缩期峰值流速(Vps)103.52~141.86 cm/s,RI 0.69~0.91,PI 1.84~3.3。
1.7 腹腔内压(intra-abdominal pressure, IAP)测量参照间接测量法[13]:患者仰卧位,排空膀胱,采用前茂企业(中国上海)AbViser膀胱内静压监测包(ABV300),通过三通将换能器与导尿管连接,换能器与导联线连接通过模块将数字显示在监护仪上,每次测量时通过三通向膀胱内注入20 mL生理盐水将换能器置于耻骨联合水平面,测得的数据即为膀胱内压值,亦即IAP。
1.8 统计学方法应用SPSS 20.0对数据进行统计分析,符合正态分布的计量数据资料以均数±标准差(Mean±SD)表示,不符合正态分布的计量数据以中位数(四分位数)[M(QL,QU)]表示,计数资料以频数(百分比)表示;两组间比较采用LSD-t、Mann-Whitney U检验或χ2检验。对单因素分析中P < 0.01的危险因素采用正向逐步方法进行logistic回归。绘制受试者工作特征曲线(ROC),评价胃肠道超声各指标对AGI的诊断价值。以P < 0.05为差异有统计学意义。
2 结果 2.1 纳入重症患者的基线资料共纳入重症患者73例,其中男性42例,女性31例,年龄(46.51±8.37)岁。基础疾病包括外科术后19例,重症肺炎37例,内科感染12例,创伤4例。发生AGI者45例,未发生AGI者28例,两组患者年龄、性别、合并基础疾病、APACHE Ⅱ评分、SOFA评分、平均动脉压、氧合指数等比较,差异无统计学意义(P > 0.05),乳酸、ACF、MI、TAMV比较,差异有统计学意义。见表 1。
| 指标 | AGI组(n=45) | 无AGI组(n=28) | 检验值 | P值 |
| 男/女(例) | 23/22 | 19/9 | 2.522 | 0.112 |
| 年龄(岁,Mean±SD) | 48.44±9.49 | 44.39±7.86 | 1.889 | 0.063 |
| APACHEⅡ评分(分,Mean±SD) | 22.22±4.87 | 21.92±5.84 | 0.232 | 0.817 |
| SOFA评分[分,M(QL, QU)] | 7.0(6, 9) | 6.5(4, 7) | -1.416 | 0.075 |
| 高血压(例,%) | 17(37.78) | 9(32.14) | 0.239 | 0.625 |
| 糖尿病(例,%) | 4(8.89) | 2(7.14) | 0.070 | 0.792 |
| 冠心病(例,%) | 6(13.33) | 2(7.14) | 0.678 | 0.410 |
| BMI指数(kg/m2,Mean±SD) | 1.92±0.12 | 1.87±0.11 | 1.591 | 0.116 |
| MAP(mmHg,Mean±SD) | 75.60±8.11 | 77.71±4.57 | -1.422 | 0.159 |
| CVP(mmHg,Mean±SD) | 8.55±1.03 | 8.57±0.79 | -0.074 | 0.941 |
| 去甲肾上腺素[μg/(kg·min), M(QL, QU)] | 0.16(0.09, 0.21) | 0.15(0.09, 0.25) | 0.165 | 0.869 |
| 白细胞(×109/L,Mean±SD) | 14.55±0.87 | 14.30±1.12 | 1.061 | 0.293 |
| IAP(mmHg,Mean±SD) | 9.08±2.13 | 7.82±0.81 | 3.588 | 0.001 |
| HGB(g/L,Mean±SD) | 94.66±6.93 | 97.07±7.14 | -1.424 | 0.159 |
| 氧合指数(mmHg,Mean±SD) | 252.78±27.00 | 266.68±31.81 | 1.920 | 0.059 |
| 血乳酸(mmol/L,Mean±SD) | 5.04±0.75 | 4.47±1.24 | 2.164 | 0.037 |
| MI(Mean±SD) | 2.78±1.83 | 5.99±2.41 | -6.445 | < 0.01 |
| PI(Mean±SD) | 2.38±0.80 | 2.57±0.59 | -1.097 | 0.276 |
| RI(Mean±SD) | 0.94±0.37 | 0.84±0.05 | 3.436 | 0.095 |
| TAMV(cm/s,Mean±SD) | 40.78±3.54 | 56.04±6.15 | -13.455 | < 0.01 |
| 注:APACHEⅡ评分为急性生理学与慢性健康状况评分;SOFA评分为序贯器官衰竭评分;BMI为体质量指数;MAP为平均动脉压;CVP为中心静脉压;IAP为腹腔内压;HGB为血红蛋白;MI为胃窦运动指数;PI为搏动指数;RI为阻力指数;TAMV为时间平均流速 | ||||
以患者是否出现AGI为因变量,选择IAP、血乳酸、MI、TAMV作为协变量,进行多因素Logistic回归分析,结果显示,MI、TAMV是重症患者出现AGI的独立影响因素。见表 2。
| 因素 | β值 | SE值 | Wald值 | P值 | OR值(95%CI) |
| IAP | -0.885 | 0.521 | 2.884 | 0.890 | 0.413(0.148~1.146) |
| 乳酸 | -3.321 | 1.615 | 4.229 | 0.040 | 0.36(0.002~0.865) |
| MI | 9.620 | 0.392 | 6.023 | 0.014 | 2.618(1.214~5.646) |
| TAMV | 0.394 | 0.172 | 5.244 | 0.022 | 1.483(1.058~2.077) |
以MI < 4.44判断重症患者发生AGI的敏感度为88.9%,特异度为85.7%;以TAMV < 45.79 cm/s判断重症患者发生AGI的敏感度为93.9%,特异度为82.1%;以乳酸 > 5.03 mmol/L判断重症患者发生AGI的敏感度为71.7%,特异度为71.4%;三者联合判断重症患者发生AGI的敏感度为100%,特异度为89.3%。见图 1和表 3。
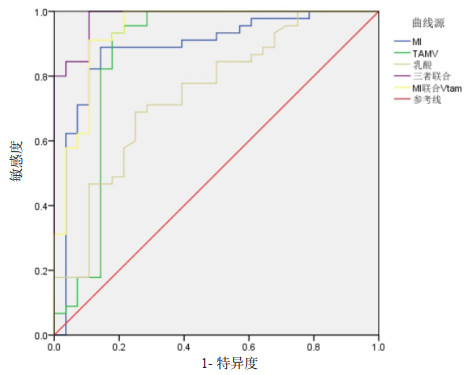
|
| 图 1 MI、TAMV、血乳酸及三者联合对判断重症患者发生急性胃肠损伤的接受者操作特征曲线 Fig 1 The operation characteristic curve of MI, TAMV, blood lactic acid and their combination to judge the recipient of acute gastrointestinal injury in severe patients |
|
|
| 指标 | AUC | 约登指数 | 截断值 | 敏感度(%) | 特异度(%) |
| MI | 0.887 | 0.746 | 4.44 | 88.9 | 85.7 |
| TAMV(cm/s) | 0.863 | 0.755 | 45.79 | 93.9 | 82.1 |
| 乳酸(mmol/L) | 0.746 | 0.714 | 5.03 | 71.7 | 71.4 |
| 三者联合 | 0.982 | 0.893 | 0.63 | 100.0 | 89.3 |
近些年研究者们对ICU危重患者的AGI进行了大量研究,但AGI的诊断仍依赖于2012年ESICM对危重患者胃肠功能的推荐意见及AGI分级。此标准提出后虽在国内外临床上得到了广泛的应用,但ESICM腹部疾病工作组也明确指出AGI诊断及分级目前尚缺乏针对胃肠道功能障碍的客观检测指标,对AGI的分级系统无特定的指标作为基础,需要更多临床验证。AGI作为危重患者多器官功能障碍综合征(MODS)的中心环节,是发生和影响MODS的重要驱动因素,直接影响危重症患者预后[14-15]。目前标准中对于AGI的诊断主要以呕吐、腹胀、消化道出血、肠鸣音、腹内压增高等症状体征描述为主。这些临床表现的描述多且无特征性, 分级诊断标准存在局限性,缺乏对胃肠功能的客观测量方法, 不能量化,且难以与其他胃肠道疾病如慢性功能性肠病、炎症性肠病、机械性肠梗阻等进行区分。早期AGI常因镇静、镇痛药物、呼吸机等药物及医疗设备使用不规范等原因导致病情被掩盖[3, 16-17],丧失了早期发现、干预的机会,不利于有效预防和治疗AGI。AGI是由于各种病因打击下导致肠道缺血缺氧改变,肠道缺血-再灌注损伤引起肠黏膜结构与功能改变,严重的损伤可导致黏膜上皮细胞、紧密连接与腺体分泌(黏液)屏障功能受损,黏膜缺血、通透性增加、肠壁水肿、肠运动障碍,以及肠腔内生态环境改变,其病理生理核心在于缺血-再灌注损伤[18-19],因此综合评价患者胃肠道灌注状态显得尤为重要;胃肠道动力水平能更直观、准确判断胃肠道消化吸收情况[20-21],本研究采用基于超声检查的ACF、MI、TAMV等综合评价胃肠道整体灌注及消化吸收状态,探寻其是否可以早期判断AGI的发生。
本研究中,ICU危重症患者具有极高的AGI发生率,与国内外的流行病学调查相似[2-3, 5-6, 22]。既往研究中,腹腔内压是早期判断发生AGI的有力依据,也是AGI分级的重要指标[16],本研究入选标准排除了已发生AGI患者,但已有部分患者表现出MI、TAMV降低,发生及未发生AGI的患者MI、TAMV比较差异有统计学意义,比两组患者腹腔内压改变更为明显,提示MI、TAMV的变化要早于传统指标。多因素logistic回归分析提示MI和TAMV降低是发生AGI的独立影响因素,MI和TAMV单独应用及联合应用均能早期判断AGI的发生,特别是两者AUC均接近或超过0.9,在临床上更有实际意义。
本研究根据既往研究文献[2, 3, 6, 16-17],入选了乳酸、白细胞等影响AGI发生的相关影响因素,研究发现,发生AGI者TAMV明显下降,与未发生AGI者比较差异有统计学意义(P < 0.01),与两组患者血乳酸水平变化相比,差异更为明显,多因素分析提示TAMV下降比乳酸上升更利于判断AGI,且其敏感度为92.9%,特异度为64.4%。提示ICU重症患者在尚未出现血乳酸明显上升前,已有较明显的肠道血流缺血改变。原因在于患者机体受到疾病打击时,休克与其他低容量状态刺激交感神经兴奋,肠道血管和肠系膜静脉强烈收缩,大量的血液转向重要组织器官循环中,此时胃肠道以缺血、缺氧为代价增加了体循环容量[23]。即使休克液体复苏动脉血压达到目标后,由于肠道黏膜病理生理的特殊性,仍然存在不同程度的肠缺血,且其修复的过程是极其缓慢的,因此,休克时达到循环复苏目标并不一定意味着肠道缺血、缺氧已得到充分纠正。而动脉乳酸水平并不能特异性反映出肠道的缺血缺氧代谢状态[24-25]。因此,了解和评价肠道血流情况显得愈发重要。
既往的研究表明,重症患者胃排空障碍是普遍现象,MI能准确、客观反映患者胃排空情况[26]。本研究显示,MI敏感度为82.1%,特异度为82.2%,也可作为早期判断AGI的有效指标。笔者认为,胃动脉来自于腹腔干,静脉汇于门静脉,疾病打击时,早期缺血缺氧并不比肠道缺血缺氧明显;直到腹压升高,心排出量下降,下腔静脉压力显著升高,胃肠道血液灌注量减少并造成局部应激性溃疡,MI才出现较为明显改变,MI在一定程度上反映了胃的缺血、缺氧情况,但其病理生理变化继发于TAMV下降改变,所以其敏感度低于TAMV,而特异度高于TAMV。
本研究存在以下局限性:为单中心、前瞻性研究,样本量偏少,存在抽样误差风险;在临床实际操作中,胃肠道为空腔脏器,MI及TAMV测量易受胃肠道气体干扰,测量必须严格按照操作要求进行方能获得准确结果,需要更大样本量研究的进一步验证。
综上所述,TAMV和MI降低是重症患者发生AGI的独立危险因素,联合应用TAMV和MI对重症患者发生AGI具有较好的早期判断价值。以MI为4.33、TAMV为16.41 cm/s作为界值可以用于早期判断重症患者发生AGI的指标,对指导临床治疗、降低AGI发生具有重要的临床意义。
利益冲突 所有作者均声明不存在利益冲突
| [1] | Hu BC, Sun RH, Wu AP, et al. Severity of acute gastrointestinal injury grade is a predictor of all-cause mortality in critically ill patients: a multicenter, prospective, observational study[J]. Crit Care, 2017, 21(1): 188. DOI:10.1186/s13054-017-1780-4 |
| [2] | 董科奇, 邓杰, 潘景业, 等. 急性胃肠损伤分级联合序贯器官衰竭评估对严重脓毒症预后评估的价值[J]. 中国全科医学, 2017, 20(5): 526-532. DOI:10.3969/j.issn.1007-9572.2017.05.005 |
| [3] | 王艳, 王建荣, 唐晟, 等. 危重患者急性胃肠损伤现状及影响因素的调查研究[J]. 国际消化病杂志, 2017, 37(1): 54-58. DOI:10.3969/j.issn.1673-534X.2017.01.015 |
| [4] | Reintam Blaser A, Malbrain MLNG, Starkopf J, et al. Gastrointestinal function in intensive care patients: terminology, definitions and management. Recommendations of the ESICM Working Group on Abdominal Problems[J]. Intensive Care Med, 2012, 38(3): 384-394. DOI:10.1007/s00134-011-2459-y |
| [5] | 王静, 于丽梅, 夏永宏, 等. 瓜氨酸和肠型脂肪酸结合蛋白对重症患者急诊胃肠损伤的诊断价值:一项530例患者的前瞻性研究[J]. 中华危重病急救医学, 2017, 29(11): 999-1003. DOI:10.3760/cma.j.issn.2095-4352.2017.11.008 |
| [6] | 骆宁, 路玲, 高红梅. 腹内压联合肠型脂肪酸结合蛋白对机械通气患者急性胃肠损伤的诊断价值[J]. 中华急诊医学杂志, 2019, 29(4): 510-514. DOI:10.3760/cma.j.issn.1671-0282.2019.04.022 |
| [7] | 王元元, 钮金英, 沈继龙, 等. 超声测定颈动静脉截面积比值评估容量反应的研究[J]. 中华急诊医学杂志, 2018, 27(12): 1393-1397. DOI:10.3760/cma.j.issn.1671-0282.2018.12.015 |
| [8] | 杨黎明, 赵博文, 洪玉才, 等. 初学者应用5分钟A-F简便记忆法床旁超声心动图在诊断急性胸痛中的价值[J]. 中华急诊医学杂志, 2019, 28(1): 90-95. DOI:10.3760/cma.j.issn.1671-0282.2019.01.017 |
| [9] | 梅美华, 姚明丽, 李静超, 等. 颅脑损伤患者早期胃窦动力的动态变化[J]. 中华危重病急救医学, 2019, 31(5): 603-606. DOI:10.3760/cma.j.issn.2095-4352.2019.05.016 |
| [10] | 李燕, 冯敏, 刘继章, 等. 彩色多普勒检测早产儿餐前后肠系膜上动脉血流改变与喂养耐受性的研究[J]. 中国医学影像技术, 2007, 23(1): 102-104. DOI:10.13929/j.1003-3289.2007.01.040 |
| [11] | 王贤明, 肖青, 华先平, 等. 彩色多普勒超声血流参数在评估肠系膜上动脉重度狭窄中的价值[J]. 中国循证心血管医学杂志, 2018, 10(9): 1091-1094. DOI:10.3969/j.issn.1674-4055.2018.09.15 |
| [12] | 李彤, 宋加友, 何伟, 等. 改良B超胃窦单切面法对重症病人胃排空功能判断的价值[J]. 外科理论与实践, 2009, 14(6): 619-622. |
| [13] | Bodnár Z, Keresztes T, Kovács I, et al. Increased serum adenosine and interleukin 10 levels as new laboratory markers of increased intra-abdominal pressure[J]. Langenbecks Arch Surg, 2010, 395(7): 969-972. DOI:10.1007/s00423-009-0583-8 |
| [14] | Klingensmith NJ, Coopersmith CM. The gut as the motor of multiple organ dysfunction in critical illness[J]. Crit Care Clin, 2016, 32(2): 203-212. DOI:10.1016/j.ccc.2015.11.004 |
| [15] | Wiest R, Rath HC. Bacterial translocation in the gut[J]. Best Pract Res Clin Gastroenterol, 2003, 17(3): 397-425. DOI:10.1016/s1521-6918(03)00024-6 |
| [16] | 庞韦, 田锐, 朱冠华, 等.严重多发伤患者血清瓜氨酸水平与肠功能损伤的相关性[J/CD].中华重症医学电子杂志, 2019, 5(4): 311-316. DOI: 10.3877/cma.j.issn.2096-1537.2019.04.004. |
| [17] | 包龙, 徐峰, 凌伟华, 等. 创伤性颅脑损伤患者:急性胃肠损伤与营养支持-基于欧洲危重病医学会关于急性胃肠损伤定义及处理指南的思考[J]. 中国急救医学, 2013, 33(9): 793-796. DOI:10.3969/j.issn.1002-1949.2013.9.007 |
| [18] | Sun ZW, Wang XD, Deng XM, et al. Phagocytic and intestinal endothelial and epithelial barrier function during the early stage of small intestinal ischemia and reperfusion injury[J]. Shock, 2000, 13(3): 209-216. DOI:10.1097/00024382-200003000-00007 |
| [19] | 李雯静, 廖吕钊, 王希, 等. 急性胃肠损伤状态下肠黏膜屏障的受损机制[J]. 浙江医学, 2018, 40(19): 2194-2196, 2200. DOI:10.12056/j.issn.1006-2785.2018.40.19.2018-734 |
| [20] | 潘红, 蔡英华, 金科, 等. 基于重症超声监测胃残留量的肠内营养方案在肺移植患者中的应用[J]. 中华现代护理杂志, 2019, 25(9): 1113-1116. DOI:10.3760/cma.j.issn.1674-2907.2019.09.012 |
| [21] | 华先平, 王贤明, 周聪, 等. 彩色多普勒超声诊断肠系膜血管缺血性病变的价值[J]. 中国循证心血管医学杂志, 2017, 9(3): 286-289. DOI:10.3969/j.issn.1674-4055.2017.03.09 |
| [22] | 张静, 齐咏. 脓毒症呼吸衰竭患者急性胃肠损伤危险因素分析[J]. 中国急救医学, 2017, 37(11): 969-972. DOI:10.3969/j.issn.1002-1949.2017.11.001 |
| [23] | 刘丹, 刘伟, 王晓红, 等. 脓毒症患者肠屏障功能损伤的临床研究[J]. 中华急诊医学杂志, 2018, 27(7): 785-789. DOI:10.3760/cma.j.issn.1671-0282.2018.07.015 |
| [24] | Leelahavanichkul A, Worasilchai N, Wannalerdsakun S, et al. Gastrointestinal leakage detected by serum (1→3)-β-D-glucan in mouse models and a pilot study in patients with sepsis[J]. Shock, 2016, 46(5): 506-518. DOI:10.1097/shk.0000000000000645 |
| [25] | Reintam BA, Starkopf J, Malbrain ML. Abdominal signs andsymptoms in intensive care patients[J]. Anaesthesiol Intensive Ther, 2015, 47(4): 379-387. DOI:10.5603/AIT.a2015.0022 |
| [26] | Blaser AR, Starkopf J, Kirsimägi, et al. Definition, prevalence, and outcome of feeding intolerance in intensive care: a systematic review and meta-analysis[J]. Acta Anaesthesiol Scand, 2014, 58(8): 914-922. DOI:10.1111/aas.12302 |
 2020, Vol. 29
2020, Vol. 29




