2 江苏省镇江市第一人民医院急诊医学科 212000;
3 江苏省丹阳市人民医院消化科 212300
2 Emergency Department, Zhenjiang First People's Hospital, Zhenjiang 210000, China;
3 Gastroenterology Department, People's Hospital of Danyang, Danyang 212300, China
脑卒中(cerebral stroke)定义为以脑血管闭塞或破裂引起脑组织发生缺血或出血性损伤的急性脑血管疾病,临床上分为缺血性和出血性脑卒中,而缺血性卒中约占全部卒中的70%~80%,且发病急骤,其致残率、病死率较高。间充质干细胞(mesenchymal stem cell,MSC)具有多向分化潜能及免疫调节活性的成体干细胞,源于中胚层,在组织损伤修复、细胞移植及基因编辑工程等医学工程领域被广泛应用。外泌体(exosome)为细胞分泌的一种特殊小囊泡,是细胞间物质信息传递的重要媒介,调控着多种生物学效应[1]。目前,外泌体对中枢神经退行性疾病中的神经细胞凋亡作用得到了初步的认识,但其在脑卒中中的调节机制有待进一步研究。基于间充质干细胞的特点,人脐带间充质干细胞来源的外泌体(human umbilical cord mesenchymal stem cell-derived exosome,hucMSC-ex)参与缺血缺氧神经细胞损伤修复机制研究具有重要的理论意义和医学转化应用价值。
1 材料与方法 1.1 材料DMEM培养基、多聚赖氨酸购自Gibco公司,MTT试剂为Sigma公司,ExoQuick exosome沉淀溶液为美国SBI公司,PCR试剂盒为Takara公司、实时荧光定量PCR仪为Bio-Rad Laboratories,BCA蛋白分析试剂盒为Bioworld公司,ECL显色剂为Thermo公司,兔抗LC3抗体为Abcam公司,兔抗Caspase-3、Bcl-2、Bax、Beclin1、Atg3、鼠抗β-actin抗体CST公司;ICR胎鼠购自江苏大学动物中心。
1.2 实验方法 1.2.1 huc-MSCs培养与外泌体提取健康孕妇行常规剖宫产术收集无菌新鲜的脐带组织,取材为2017年12月至2019年6月在本院妇产科接受剖宫产的20~30岁健康产妇(本项目经丹阳市人民医院伦理委员会批准且签署知情同意书)。huc-MSCs培养方法及提取方法见参见文献[2-3]。
1.2.2 小鼠原代星型胶质细胞培养仔细剥离新生2~3 d小鼠(由江苏大学实验动物中心提供)的大脑软脑膜及血管,取得脑皮层后用预冷的PBS洗涤,剪碎脑组织并予DMEM/F-12 1:1培养基充分重悬脑组织,离心去上清液后重悬,接种细胞培养。间隔3 d后,予换液,待细胞已经铺满瓶底后,置于37℃摇床中,200 r/min摇晃3~4 h,弃去上清液,用PBS洗瓶2次,0.25%胰酶于37℃消化2~3 min,直接种板用于实验,并在镜下观察原代细胞的生长和存活情况。
1.2.3 OGD模型建立与实验分组细胞生长至一定密度,弃去培养液后滴入PBS缓冲液,放置OGD培养装置,向内充入混合气体(95%N2/5%CO2)5 min后以达到无糖缺氧的状态。根据缺氧时间(0、0.5、1、2、3、4、8、12、24 h)分成9个时间点,观察hucMSC-ex对星型胶质细胞的影响。实验组采用2 μg/mL的hucMSC-ex进行共孵育处理。
1.2.4 细胞增殖实验于96孔培养板中每孔接种100 μL细胞,密度约为1×106/mL,每组设5个复孔,孵育细胞生长汇合至90%,予10 μL MTT(浓度0.5 mg/mL)避光孵育4 h,弃去上清液终止培养,予150 μL DMSO并混匀10 min,彻底溶化结晶物后在酶联免疫检测仪检测波长490 nm各孔吸光度(A)值。
1.2.5 Annexin V-PI流式细胞技术检测凋亡接种2×105个细胞到35 mm培养皿,孵育至最适时间,胰酶消化,1 000 r/min离心5 min,弃去上清液,PBS洗涤,加入500 μL的结合缓冲液,加入5 μL Annexin V-FITC轻轻混匀,置入500 μL的结合缓冲液,加入5 μL Annexin V-FITC轻轻混匀,避光室温反应15 min,加入5 μL PI,过200目筛网过滤,在1 h内用流式细胞仪检测细胞凋亡情况。
1.2.6 RT-PCR检测细胞相关自噬及凋亡基因mRNA表达水平用Trizol法从原代培养的小鼠星形胶质细胞中提取总RNA,以Oligod(T)18为反转录引物,在RevertAid M-MuLV反转录酶催化下反转录出cDNA。将得到的cDNA稀释5倍,反应体系20 μL:2xSYBR Green 10 μL,上下游引物各0.5 μL,cDNA 1 μL,DEPC水8 μL。反应条件:95℃ 5 min,95℃ 30 s,56℃ 30 s,72℃ 30 s,40个循环;72℃10 min。采用2 -ΔΔCt法计算每个样品目标基因经内参基因标准化后的mRNA表达量。
1.2.7 Western blot检测实验相关蛋白表达制备上样缓冲液,蛋白上样量为30 μg;配制10%的分离胶和5%的浓缩胶;电泳在浓缩胶中80V,20 min,分离胶中120 V,60 min;半干式电泳仪转膜100 mA,70 min;5%脱脂牛奶室温下封闭过夜;一抗4℃孵育过夜,二抗37℃孵育1 h,再予TBST洗膜3次,ECL显影,图像用灰度分析软件处理分析。
1.3 统计学方法采用SPSS 17.0统计软件分析,计量资料多组间比较采用方差分析,组间两两比较采用SNK-q检验,以P < 0.05为差异有统计学意义。
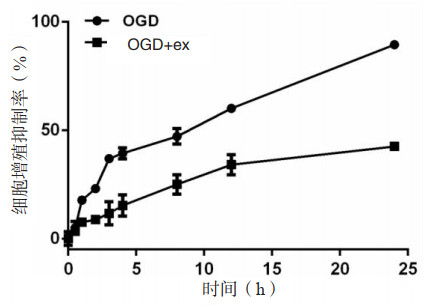
2 结果 2.1 外泌体对OGD模型的神经胶质细胞增殖影响构建OGD实验模型,采用2 μg/mL的hucMSC-ex进行共孵育处理,检测不同时间点神经胶质细胞增殖情况。如图 1所示,与OGD组比较,实验组OGD-ex孵育3 h后细胞增殖抑制率明显下降(P < 0.05),提示外泌体可促进缺血缺氧神经胶质细胞增殖率。
|
| 图 1 MTT法检测hucMSC-ex对OGD神经胶质细胞增殖能力 Fig 1 Effect of hucMSC-ex on the proliferation of OCD glial cells by MTT assay |
|
|
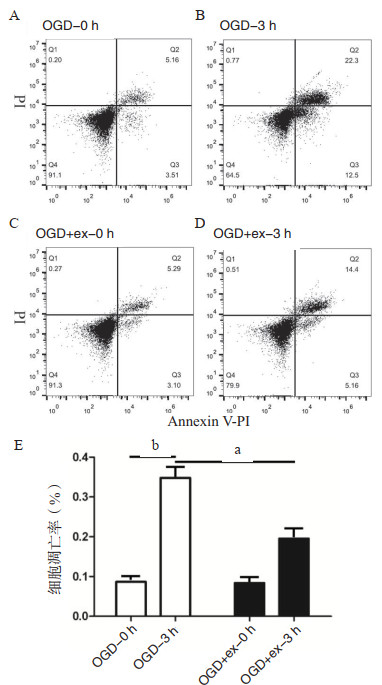
构建OGD实验模型,hucMSC-ex进行共孵育处理,依据细胞增殖实验结果,下游选择OGD-3 h进行实验,流式细胞技术检测细胞凋亡。如图 2所示,OGD处理3 h后明显诱导细胞凋亡(P < 0.01);实验组OGD-ex孵育3 h后较对照组OGD-3 h凋亡明显减少(P < 0.05),结果提示外泌体孵育之后可以减少神经胶质细胞凋亡。
|
| A、B:对照组流式细胞技术检测凋亡图;C、D:实验组流式细胞技术检测凋亡图;E:各组凋亡率差异,aP < 0.05,bP < 0.01 图 2 Annexin V-PI流式细胞技术检测细胞凋亡水平 Fig 2 Effect of hucMSC-ex on the apoptosis of OGD glial cells by Annexin V-PI flow cytometry |
|
|
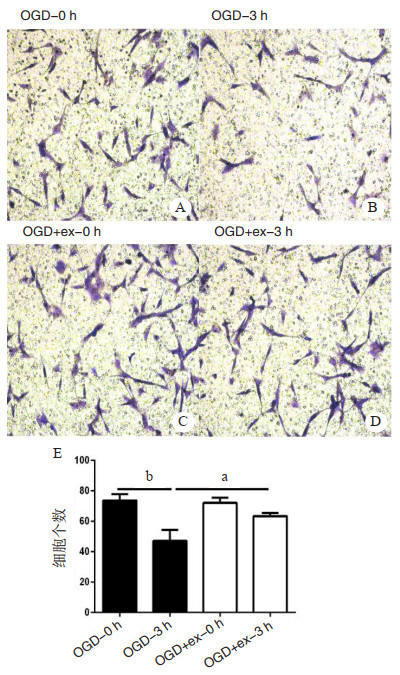
构建OGD实验模型,hucMSC-ex进行共孵育处理,Transwell细胞体外迁移实验结果(图 3)显示,OGD处理3 h后细胞迁移能力明显减弱(P < 0.01),实验组OGD-ex孵育3 h后较对照组OGD-3 h细胞迁移能力增强(P < 0.05)。
|
| A、B:对照组Transwell实验细胞迁移;C、D:实验组Transwell实验细胞迁移;E:各组细胞迁移个数比较,aP < 0.05,bP < 0.01 图 3 Transwell实验检测神经胶质细胞迁移能力 Fig 3 Effect of hucMSC-ex on the migration capacity of OGD glial cells by Transwell assay |
|
|
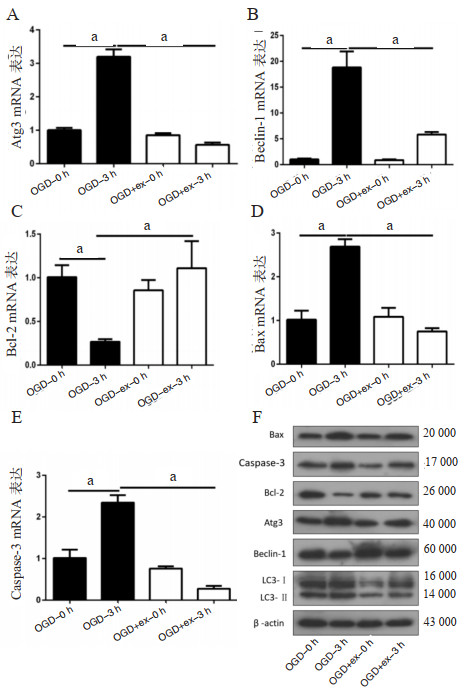
构建OGD实验模型,实验组采用2 μg/mL的hucMSC-ex进行共孵育处理,Western blot和Real-time PCR检测自噬相关蛋白Atg3、Beclin-1、LC3Ⅱ/Ⅰ以及凋亡相关蛋白Bax、Bcl-2、Caspase-3的蛋白及mRNA表达水平。实验结果(图 4)显示,在对照组中,OGD处理3 h后, 可明显促进自噬相关基因Atg3、Beclin-1 mRNA(P < 0.01)及蛋白表达(P < 0.05),同时提高LC3Ⅱ/Ⅰ蛋白比值(P < 0.05);实验组OGD-ex孵育3 h后较对照组OGD-3 h,细胞自噬相关基因Atg3、Beclin-1 mRNA表达水平受到抑制(P < 0.01),Atg3、Beclin-1蛋白表达水平及LC3Ⅱ/Ⅰ蛋白比值下降(P < 0.05)。提示外泌体抑制OGD模型神经胶质细胞自噬水平,防止细胞过度自噬以损伤细胞修复能力。在细胞凋亡蛋白检测实验中,OGD可促进Bax、Caspase-3 mRNA(P < 0.01)及蛋白表达水平(P < 0.05),抑制Bcl-2 mRNA(P < 0.01)及蛋白表达水平(P < 0.05)。实验组OGD-ex孵育3 h后较对照组OGD-3 h,可抑制细胞凋亡相关基因Bax、Caspase-3 mRNA(P < 0.01)及蛋白表达水平(P < 0.05),促进Bcl-2 mRNA(P < 0.01)及蛋白表达水平(P < 0.05);提示外泌体可抑制OGD模型神经胶质细胞凋亡作用,保护缺血缺氧神经细胞。
|
| A、B: Real-time PCR检测Atg3、Beclin-1 mRNA表达量水平;C、D、E: Real-time PCR检测Bcl-2、Bax、Caspase-3 mRNA表达量水平;F: Western blot检测相关自噬蛋白及凋亡蛋白表达水平;aP < 0.01 图 4 Real-time PCR技术及Western blot技术检测OGD神经胶质细胞相关自噬基因及凋亡基因mRNA与蛋白水平的表达 Fig 4 Expression of autophagy-related and apoptotic genes mRNA and protein on OGD glial cells by real-time PCR and Western blot |
|
|
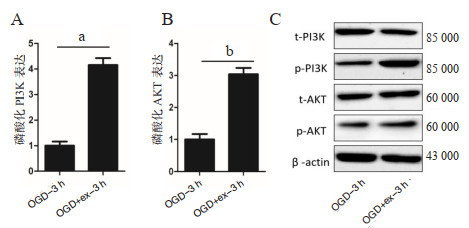
构建OGD实验模型,采用2 μg/mL的hucMSC-ex进行共孵育处理,Western blot检测PI3K/Akt信号通路相关蛋白表达。如图 5所示,共孵育后3 h后,hucMSC-ex可促进OCD模型细胞PI3K(P < 0.01)与Akt(P < 0.05)蛋白磷酸化表达水平。
|
| A、B:磷酸化PI3K、Akt在对照组及实验组表达差异;aP < 0.01,bP < 0.05;C: Western blot检测PI3K/ Akt蛋白表达水平 图 5 Western blot技术检测PI3K/ Akt信号通路相关蛋白表达 Fig 5 Expression of PI3K/Akt signaling pathway related protein by Western blot |
|
|
干细胞移植工程技术方面研究表明MSC在脑卒中治疗中具有神经保护、神经再生及血管新生等作用。然而,目前面临的关键问题是干细胞移植后,由于移植免疫排异反应,在宿主体内存活时间很短[4]。此外,MSC向体细胞的分化效率亦低下。微泡长期以来被认为是无意义的细胞代谢残骸,然而近期有研究证实,微泡是细胞间信息传递与交流的重要载体。
外泌体是胞外囊泡(extracellular vesicles,EV)的一种,起源于粗面内质网,形成胞内体后释放进入细胞间质,其直径为30~100 nm,其直径的大小与来源细胞有关。EV包裹的脂质双分子层膜性结构含有多种活性分子,如活性调节蛋白与脂质及核酸(lncRNA、microRNA、mRNA、DNA)等物质,这些活性分子是外泌体介导细胞间信号传导通讯的重要物质。由神经元、胶质细胞、脑微血管内皮细胞等有机地构成中枢神经系统信号网络回路,传递、储存和加工电生理信号,支配机体的相关行为。研究表明神经元、星形胶质细胞、小胶质细胞和少突胶质细胞均可分泌外泌体[5-6]。神经元及胶质细胞间的信号交流协助胶质细胞参与大脑功能与发育,包含免疫调节、髓鞘形成以及突触形成和可塑。Frühbeis等[7]发现外泌体是神经元轴突-胶质细胞之间的细胞外囊介导信号传导的一种媒介载体。髓鞘形成需神经元轴突与少突胶质细胞间的信息交流,两种细胞之间的通讯介导是以外泌体为媒介[8]。MSC-MV含有多种生物活性物质,具有调控细胞生长分化、调节免疫调节、血管新生及组织再生修复等功能[9-11],近年来成为医学领域研究热点。研究表明在动物实验模型及临床应用中,MSCs对脑卒中及脑损伤是一种有效的治疗方式[12-13]。然而,亦有研究表明,其参与中枢神经损伤修复及康复主要机制不是细胞移植作用,而是MSCs-ex的旁分泌作用[14]。因此,本研究通过模拟体内神经细胞缺血缺氧条件,构建OGD神经胶质细胞模型,hucMSC-ex与其共同孵育,研究外泌体对脑卒中的保护作用并探讨其机制。实验结果表明,采用2 μg/mL的hucMSC-ex进行共孵育处理,3 h开始,与OGD组比较,外泌体可减少细胞增殖抑制率。神经胶质细胞的定向迁移作用对神经元轴突的生长、再生及其迁移有重要的意义,认为其是神经损伤修复一个关键元素[15]。本研究结果显示,hucMSC-ex对OGD神经胶质细胞迁移作用有明显促进效应,提示hucMSC-ex在缺血性脑卒中过程中可促进神经胶质细胞及神经元迁移至损伤区域,修复脑组织损伤。目前认为Bcl-2与Bax是缺血性脑卒中细胞凋亡过程中最关键的调控基因,Caspase-3同样也是重要靶基因。在经典的凋亡通路中,Bcl-2抑制细胞色素C从线粒体释放入胞质中,抑制细胞凋亡;相反,Bax可以拮抗Bcl-2的作用,进而促进细胞凋亡;同时Bax/Bcl-2蛋白的比值常常被用来代表细胞凋亡程度[16-17]。在凋亡早期阶段,Caspase-3是其关键的调节元素。Caspase-3是一种聚ADP核糖聚合酶(poly ADP-ribose polymerase,PARP)裂解酶,其可以通过裂解PARP,激活核酸内切酶,最终导致细胞凋亡。本实验结果显示,与OGD组比较,hucMSC-ex孵育后可明显抑制OGD神经胶质细胞的凋亡效应,抑制Bax与Caspase-3蛋白及mRNA表达水平,促进Bcl-2蛋白及mRNA表达水平。本研究提示在模拟脑卒中OGD模型中,hucMSC-ex可抑制神经凋亡途径,参与脑损伤修复机制。
神经胶质细胞在缺血缺氧条件下其自噬溶酶体活性是增强的,然而3-甲基腺嘌呤(3-MA)、雷帕霉素可抑制脑卒中神经胶质细胞自噬活性并降低细胞的死亡率,提示抑制激活自噬活性可减轻脑缺血损伤,有利于神经细胞的存活[18]。本研究结果显示,hucMSC-ex与OGD神经胶质细胞孵育后,其自噬相关基因Beclin-1、Atg3和LC3-Ⅱ蛋白表达水平及mRNA表达水平明显降低,提示外泌体可减低缺血缺氧神经胶质细胞自噬/溶酶体活性,防止代谢产物堆积,促进底物循环利用,减少细胞损伤。
神经营养因子对神经细胞存活起重要作用,且主要受磷脂酰肌醇-3-激酶/蛋白激酶B(phosphoinositide 3-kinase/protein kinaseB,PI3K/Akt)信号通路调控[19-20]。Akt作为PI3K下游的效应分子,PI3K结合Akt的PH结构域,改变其构象,使Akt的Thr308、Ser473位点磷酸化,活化后的Akt,作用于其下游靶蛋白Bad、Caspase、NF-κB、eNOS、GSK-3等,调控其生物学效应[21-22]。本研究结果表明,在神经胶质细胞OGD模型中,hucMSC-ex孵育可促进p-PI3K蛋白表达增多,诱导其下游靶基因p-Akt表达。因此,笔者推测,在缺血性脑卒中过程中,外泌体可激活PI3K/Akt信号传导途径,抑制细胞凋亡,降低细胞增殖抑制率,促进神经细胞存活。
综上,本研究结果提示hucMSC-ex在脑卒中细胞间信号转导过程中,可通过促进细胞增殖与迁移能力,抑制细胞凋亡及自噬水平,介导PI3K/Akt信号通路参与缺血性脑卒中修复与保护机制,有望成为脑卒中新的治疗靶点。但hucMSC-ex携带何种信号物质及激活何种细胞信号通路,有待今后进一步研究。
利益冲突 所有作者均声明不存在利益冲突
| [1] | Lee C, Mitsialis SA, Aslam M, et al. Exosomes mediate the cytoprotective action of mesenchymal stromal cells on hypoxia-induced pulmonary hypertension[J]. Circulation, 2012, 126(22): 2601-2611. DOI:10.1161/circulationaha.112.114173 |
| [2] | Qu Z, Guo L, Fang G, et al. Biological characteristics and effect of human umbilical cord mesenchymal stem cells (hUC-MSCs) grafting with blood plasma on bone regeneration in rats[J]. Cell Biochem Biophys, 2012, 63(2): 171-181. DOI:10.1007/s12013-012-9354-1 |
| [3] | Qu ZG, Guo SN, Fang GJ, et al. AKT pathway affects bone regeneration in nonunion treated with umbilical cord-derived mesenchymal stem cells[J]. Cell Biochem Biophys, 2015, 71(3): 1543-1551. DOI:10.1007/s12013-014-0378-6 |
| [4] | Zhang Z, Yang J, Yan W, et al. Pretreatment of cardiac stem cells with exosomes derived from mesenchymal stem cells enhances myocardial repair[J]. J Am Heart Assoc, 2016, 5(1): e002856. DOI:10.1161/JAHA.115.002856 |
| [5] | Goldie BJ, Dun MD, Lin MJ, et al. Activity-associated miRNA are packaged in Map1b-enriched exosomes released from depolarized neurons[J]. Nucleic Acids Res, 2014, 42(14): 9195-9208. DOI:10.1093/nar/gku594 |
| [6] | Glebov K, Löchner M, Jabs R, et al. Serotonin stimulates secretion of exosomes from microglia cells[J]. Glia, 2015, 63(4): 626-634. DOI:10.1002/glia.22772 |
| [7] | Frühbeis C, Fröhlich D, Krämer-Albers EM. Emerging roles of exosomes in neuron-Glia communication[J]. Front Physiol, 2012, 3: 119. DOI:10.3389/fphys.2012.00119 |
| [8] | Krämer-Albers EM, White R. From axon-glial signalling to myelination: the integrating role of oligodendroglial Fyn kinase[J]. Cell Mol Life Sci, 2011, 68(12): 2003-2012. DOI:10.1007/s00018-010-0616-z |
| [9] | Gupta A, Pulliam L. Exosomes as mediators of neuroinflammation[J]. J Neuroinflammation, 2014, 11: 68. DOI:10.1186/1742-2094-11-68 |
| [10] | Bátiz LF, Castro MA, Burgos PV, et al. Exosomes as novel regulators of adult neurogenic niches[J]. Front Cell Neurosci, 2016, 9: 501. DOI:10.3389/fncel.2015.00501 |
| [11] | Marote A, Teixeira FG, Mendes-Pinheiro B, et al. MSCs-derived exosomes: cell-secreted nanovesicles with regenerative potential[J]. Front Pharmacol, 2016, 7: 231. DOI:10.3389/fphar.2016.00231 |
| [12] | Li Y, Chopp M. Marrow stromal cell transplantation in stroke and traumatic brain injury[J]. Neurosci Lett, 2009, 456(3): 120-123. DOI:10.1016/j.neulet.2008.03.096 |
| [13] | Nichols JE, Niles JA, DeWitt D, et al. Neurogenic and neuro-protective potential of a novel subpopulation of peripheral blood-derived CD133+ ABCG2+CXCR4+ mesenchymal stem cells: development of autologous cell-based therapeutics for traumatic brain injury[J]. Stem Cell Res Ther, 2013, 4(1): 3. DOI:10.1186/scrt151 |
| [14] | Zhang YL, Chopp M, Meng YL, et al. Effect of exosomes derived from multipluripotent mesenchymal stromal cells on functional recovery and neurovascular plasticity in rats after traumatic brain injury[J]. J Neurosurg, 2015, 122(4): 856-867. DOI:10.3171/2014.11.jns14770 |
| [15] | Torpe N, Gopal S, Baltaci O, et al. A protein disulfide isomerase controls neuronal migration through regulation of wnt secretion[J]. Cell Rep, 2019, 26(12): 3183-3190. DOI:10.1016/j.celrep.2019.02.072 |
| [16] | Tian ZY, Li SM, Guo H, et al. Acupuncture of intraorbital and extraorbital acupoints reduces apoptosis of retinal ganglion by down-regulating expression of Caspase-3 and ratio of Bax/Bcl-2 in rabbits with nonarteritis anterior ischemic optic neuropathy[J]. Zhen Ci Yan Jiu, 2019, 44(4): 282-287. DOI:10.13702/j.1000-0607.180440 |
| [17] | Li H, Lv B, Kong L, et al. Nova1 mediates resistance of rat pheochromocytoma cells to hypoxia-induced apoptosis via the Bax/Bcl-2/caspase-3 pathway[J]. Int J Mol Med, 2017, 40(4): 1125-1133. DOI:10.3892/ijmm.2017.3089 |
| [18] | 卢孔渺, 潘曙明. 自吞噬在神经细胞缺血性损伤中的作用及其与凋亡和坏死的关系[J]. 中华急诊医学杂志, 2016, 25(6): 843-846. DOI:10.3760/cma.j.issn.1671-0282.2016.06.034 |
| [19] | Numakawa T, Adachi N, Richards M, et al. Brain-derived neurotrophic factor and glucocorticoids: Reciprocal influence on the central nervous system[J]. Neuroscience, 2013, 239: 157-172. DOI:10.1016/j.neuroscience.2012.09.073 |
| [20] | 张浙, 肖盐, 刁孟元, 等. PI3K/AKt/GSK3β信号通路在复苏中颈部降温的脑保护作用[J]. 中华急诊医学杂志, 2017, 26(5): 554-559. DOI:10.3760/cma.j.issn.1671-0282.2017.05.014 |
| [21] | Noshita N, Lewén A, Sugawara T, et al. Evidence of phosphorylation of akt and neuronal survival after transient focal cerebral ischemia in mice[J]. J Cereb Blood Flow Metab, 2001, 21(12): 1442-1450. DOI:10.1097/00004647-200112000-00009 |
| [22] | Song G, Ouyang GL, Bao SD. The activation of Akt/PKB signaling pathway and cell survival[J]. J Cellular Mol Med, 2005, 9(1): 59-71. DOI:10.1111/j.1582-4934.2005.tb00337.x |
 2020, Vol. 29
2020, Vol. 29




