尽管在过去20年中由于治疗策略及技术的进步, 心源性休克患者的病死率较前明显降低[1-2],但其仍然是急性心肌梗死患者死亡的首要原因[3]。据报道急性心肌梗死合并心源性休克(acute myocardial infarction complicated by cardiogenic shock, AMI-CS)患者院内病死率为40%~50%[2, 4-5]。由于极高的死亡风险,危险分层在AMI-CS患者中显得至关重要,因为准确的风险预测能够帮助早期识别高危患者,及时做出治疗策略上的改变。事实上,基于国外的注册研究或临床试验,研究者已开发出数种针对AMI-CS患者的危险分层评分[6-8],但既往的临床预测评分包括以下缺点:研究纳入人群距今久远,无法较好地代表当下患者的特点;缺乏外部研究验证;评分操作及危险分层复杂,缺乏临床实用性。同时,有研究显示重症评分如APACHEⅡ评分、SAPSⅡ评分等对于心源性休克患者也具备较好的预测价值[9-10]。但由于该类评分计算复杂,因此应用局限于重症监护室中,无法推广至其他场景(如急诊导管室中)。直到近几年,起源于两个大规模、前瞻性、多中心临床研究针对心源性休克人群的危险分层评分,IABP-Shock Ⅱ(intra-aortic balloonpumping in acute myocardial infarction complicated by cardiogenic shock)评分[11]及CardShock评分[12]引起了研究者的关注,被认为可以提供准确的早期危险分级从而帮助临床决策。然而,关于上述评分在AMI-CS患者中的验证与比较尚少有研究。
本研究利用北京朝阳医院心脏中心数据对IABP-ShockⅡ评分及CardShock评分进行外部验证,并将其表现与急性生理学-慢性健康状况评分Ⅱ[9](acute physiology and chronic health evaluationⅡ,APACHEⅡ)比较,从区分度及校准度两个方面对评分预测价值进行评估。区分度是指评估预测评分将高风险患者与低风险患者区别开来的能力,而校准度则是指评估预测评分对不同得分区段内患者绝对风险的预测与该得分区段内实际观测事件发生概率的重合程度[13]。
1 资料与方法 1.1 一般资料回顾性纳入2010年12月至2019年5月于本院心脏监护室(cardiac care unit, CCU)住院治疗的急性心肌梗死合并心源性休克患者。纳入标准:①符合全球第四版急性心肌梗死定义[14],包括ST段抬高型心肌梗死(ST segment elevation myocardial infarction,STEMI)及非ST段抬高型心肌梗死(non-ST segment elevation myocardial infarction,NSTEMI);②符合心源性休克定义,即持续的低血压状态超过30 min,或需要正性肌力药物或机械循环辅助装置维持收缩压 > 90 mmHg(1 mmHg=0.133 kPa),且存在低灌注的临床证据,如神志异常,肢体冰凉或少尿(< 30 mL/h)。
排除标准:①机械并发症诱发的心源性休克(如心脏破裂或室间隔穿孔);②住院期间接受搭桥手术的患者。
根据患者院内存活情况分为院内存活组和死亡组。本研究通过本单位伦理委员会同意(伦理审批号:2019-科-5-1)。
1.2 资料收集通过阅读患者电子病历,收集患者基线资料,包括心血管危险因素(高血压、糖尿病、目前吸烟、既往卒中病史、既往心梗病史、肾功能不全等),临床特征(STEMI、院前休克以及院内休克、是否院前心搏骤停),实验室检查结果(血糖、乳酸、血肌酐值),影像学检查结果(冠状动脉造影、心脏彩超),住院期间干预情况(再灌注治疗、机械循环辅助装置治疗、机械通气治疗),临床结局(院内存活或死亡、总住院时长、CCU住院时长、急性肾损伤、消化道出血、恶性心律失常)等。其中,早期再灌注治疗定义为休克发生后12 h内接受冠状动脉介入术(percutaneous coronary intervention,PCI)治疗或在2 h内接受溶栓治疗。
1.3 评分计算APACHEⅡ评分由我中心CCU住院医师于患者入院时或住院期间计算(通常为休克发生后),由研究者回顾性收集。IABP-Shock Ⅱ评分及CardShock评分由两位研究者(丰和刘)独立进行评分,院前休克的患者根据入院时数据进行评分,而院内发生休克的患者则通过阅读患者电子病历,根据休克发生后最近时间数据计算,当计算结果出现分歧时(如休克发生时间的确定),与第三位研究者(王)协商解决分歧。
IABP-ShockⅡ评分计算:年龄 > 73岁(1分)、卒中史(2分)、血糖 > 10.6 mmol/L(1分)、血肌酐 > 132.6 mmol/L(1分)、动脉血乳酸 > 5 mmol/L(2分)、PCI术后TIMI血流 < 3级(2分),总分9分,0~2分为低风险,3~4分为中等风险,≥5分为高风险。
CardShock评分:年龄 > 75岁(1分)、神志不清(1分)、既往心梗或搭桥术后(1分)、急性冠脉综合征(acute coronary syndrome,ACS)(1分)、左室射血分数(left ventricular ejection fraction,LVEF) < 40%(1分)、血乳酸2~4 mmol/L(1分)、血乳酸 > 4 mmol/L(2分)、肾小球滤过率30~60 mL/(min·1.73 m2)(1分)、肾小球滤过率 < 30 mL/(min·1.73 m2)(2分),总分9分,0~3分为低风险,4~5分为中等风险;6~9分为高风险。未接受早期再灌注治疗的患者默认为术后TIMI血流 < 3级。
1.4 缺失值处理对于与评分计算不相关的变量缺失值不予处理。与评分计算相关的连续变量,使用平均数进行填补,分类变量使用众数进行填补。
1.5 统计学方法所有数据使用SPSS 23.0软件及Med-Calc 19.0.4分析,计量资料采用均数±标准差(Mean±SD)表示,组间比较采用LSD-t检验;计数资料采用频数(百分率)表示,组间比较采用卡方检验或Fisher精确检验。使用受试者操作曲线(receiver operating characteristic curve,ROC)描述评分的区分度。评分的曲线下面积(AUC)值< 0.75为具有较差的区分度,≥0.75为具有良好的区分度,> 0.85为具有优异的区分度,并使用Delong等[15]的方法比较区分度差异是否有统计学意义。使用Hosmer-Lemeshow拟合优度检验评估评分是否充分校准,同时构建各预后评分的校准曲线图以比较预测事件与实际发生事件之间的偏倚。所有检验均为双侧检验,以P < 0.05为差异有统计学意义。
2 结果共纳入150例心肌梗死合并心源性休克患者,院内病死率为60%。所有患者的基线信息、院内干预及临床结局比较见表 1。在未校正的分析中,院内死亡组平均年龄显著高于存活组(72岁vs 66岁,P < 0.05),危险因素如高血压(65.9% vs 47.5%,P < 0.05)、高血脂(46.2% vs 28.8%,P < 0.05)、既往卒中病史(22.0% vs 8.6%,P < 0.05)、慢性肾功能不全(19.8% vs 6.8%,P < 0.05)等比例显著高于院内存活组,院前休克比例较存活组少(57.1% vs 86.4%,P < 0.05),血乳酸水平、血肌酐水平较存活组差(均P < 0.05),接受机械通气治疗比例较存活组高(72.5% vs 25.4%,P < 0.05),早期再灌注比例(49.5% vs 67.7%,P < 0.05)及术后TIMI血流3级比例较存活组低(71.1% vs 92.5%, P < 0.05),并发急性肾损伤比例较存活组高(22.0% vs 5.1%,P < 0.05),总住院时长较存活组短(P < 0.05)。
| 指标 | 院内存活组(n=59) | 院内死亡组(n=91) | 检验值 | P值 |
| 年龄(岁,Mean±SD) | 66±12 | 72±12 | -2.782 | < 0.01 |
| 男性(例,%) | 39(66.1) | 61(67.0) | 0.014 | 0.906 |
| BMI(kg/m2,Mean±SD) | 24±8 | 23±8 | 0.334 | 0.739 |
| 高血压(例,%) | 28(47.5) | 60(65.9) | 5.039 | 0.025 |
| 糖尿病(例,%) | 22(37.3) | 40(44.0) | 0.656 | 0.418 |
| 高脂血症(例,%) | 17(28.8) | 42(46.2) | 4.510 | 0.034 |
| 既往心梗史(例,%) | 6(10.2) | 19(20.9) | 2.956 | 0.086 |
| 卒中史(例,%) | 5(8.5) | 20(22.0) | 4.699 | 0.024 |
| 既往PCI术后(例,%) | 5(8.5) | 14(15.4) | 1.545 | 0.214 |
| 慢性肾脏病(例,%) | 4(6.8) | 18(19.8) | 4.834 | 0.028 |
| 房颤(例,%) | 8(13.6) | 7(7.7) | 1.369 | 0.242 |
| 院前休克(例,%) | 51(86.4) | 52(57.1) | 14.280 | < 0.01 |
| 院前呼吸心搏骤停(例,%) | 11(18.6) | 20(22.0) | 0.243 | 0.095 |
| STEMI(例,%) | 50(84.7) | 71(78.0) | 1.038 | 0.308 |
| 血糖(mmol/L,Mean±SD) | 11±6 | 12±6 | -0.773 | 0.441 |
| 血乳酸(mmol/L,Mean±SD) | 4.51±4.13 | 6.56±4.45 | -2.778 | < 0.01 |
| 血肌酐(mmol/L,Mean±SD) | 119.62±67.00 | 173.45±124.03 | -3.425 | < 0.01 |
| 射血分数(Mean±SD) | 43±10 | 40±13 | 1.575 | 0.118 |
| 早期再灌注治疗(例,%) | 41(69.5) | 46(50.5) | 5.272 | 0.022 |
| 急诊PCI(例,%) | 40(67.7) | 45(49.5) | 4.906 | 0.027 |
| PCI术后血流3级(例,%) | 37(92.5) | 32(71.1) | 6.340 | 0.012 |
| IABP辅助循环(例,%) | 48(81.4) | 64(70.3) | 2.301 | 0.129 |
| 机械通气(例,%) | 15(25.4) | 66(72.5) | 31.971 | < 0.01 |
| APACHEⅡ评分(Mean±SD) | 16.72±7.57 | 33.19±10.18 | -11.287 | < 0.01 |
| CardShock评分(Mean±SD) | 3.86±1.60 | 5.65±1.38 | -7.032 | < 0.01 |
| IABP-ShockⅡ评分(Mean±SD) | 2.41±2.06 | 4.48±2.02 | -6.072 | < 0.01 |
| 总住院时长(d,Mean±SD) | 19.71±13.39 | 9.86±11.60 | 4.780 | < 0.01 |
| CCU住院时长(d,Mean±SD) | 11.75±8.50 | 9.11±10.53 | 1.681 | 0.095 |
| 急性肾损伤(例,%) | 3(5.1) | 20(22.0) | 7.868 | < 0.01 |
| 消化道出血(例,%) | 8(13.6) | 18(19.8) | 0.967 | 0.326 |
| 肺部感染(例,%) | 27(45.8) | 43(47.3) | 0.032 | 0.858 |
| 室性心律失常(例,%) | 10(16.9) | 25(27.5) | 2.216 | 0.137 |
| 注:BMI为体质量指数;PCI为经皮冠状动脉介入术;STEMI为ST段抬高型心肌梗死;肾小球滤过率采用慢性肾脏病流行病学合作研究公式;IABP为主动脉内球囊反搏;GRACE为全球冠脉事件登记研究;APACHEⅡ为急性生理-慢性健康评分Ⅱ | ||||
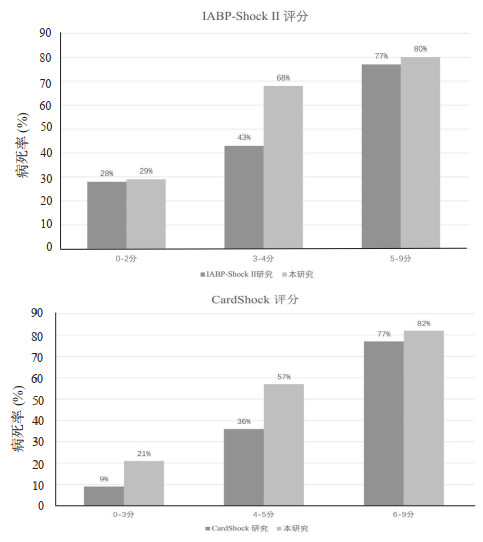
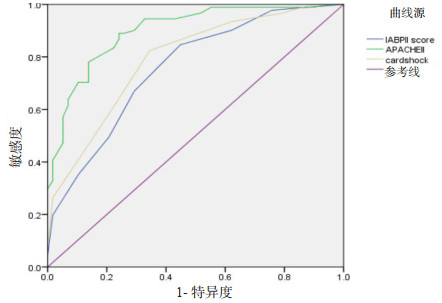
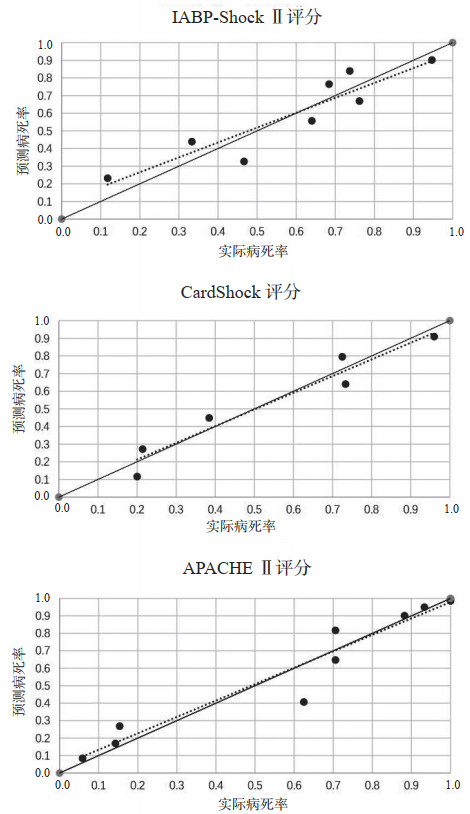
评分表现:与评分计算相关的变量中,血乳酸值缺失20例,血肌酐值缺失15例,射血分数缺失35例,均以其平均数进行填补。如表 1所示,院内死亡组三种评分得分均显著高于院内存活组。IABP-ShockⅡ评分属于低风险(0~2分)45例,中等风险(3~4分)47例,高风险(5~9分)57例,病死率依次为29%、68%、80%。CardShock评分属于低风险(0~3分)29例,中等风险(4~5分)56例,高风险(6~9分)65例,病死率依次为21%、57%、82%。本研究中IABP-ShockⅡ评分及CardShock评分各得分段病死率与原始研究病死率的比较见图 1。APACHEⅡ评分 < 20分53例,20~30分36例,> 30分60例。病死率依次为19%、69%、93%。如图 2所示,对于院内死亡事件的预测,APACHEⅡ评分显示出优异的区分度(AUC=0.90,95%CI:0.84~0.94),而IABP-Shock Ⅱ评分与CardShock评分显示出良好的区分度(AUC=0.76,95%CI:0.68~0.83和AUC=0.79,95%CI:0.72~0.85)。在评分的比较中,IABP-ShockⅡ评分及CardShock评分的区分度比较差异无统计学意义(0.76 vs 0.79,P > 0.05),但均显著低于APACHEⅡ评分(0.76 vs 0.90,P < 0.05和0.79 vs 0.90,P < 0.05)。根据Hosmer-Lemeshow拟合优度检验,三种评分均显示出充分的校准。同时,根据校准曲线图(图 3),APACHEⅡ评分、IABP-ShockⅡ评分及CardShock评分均显示预测事件与发生事件较好重合,即校准准确。
|
| 图 1 本研究IABP-Shock Ⅱ评分与CardShock评分各得分段病死率与原始研究中各得分段病死率比较 Fig 1 Comparison of mortality between the derivation and the validation cohorts for the card shock and the intra-aortic balloon pumping in acute myocardial infarction complicated by cardiogenic shock (IABP-ShockⅡ) risk score according to risk categories |
|
|
|
| 图 2 各预后评分预测急性心肌梗死合并心源性休克患者院内死亡风险ROC曲线图 Fig 2 Receiver-operating characteristic curves of risk scores for predicting in-hospital mortality |
|
|
|
| 图 3 各预后评分预测急性心肌梗死合并心源性休克患者院内死亡风险校准曲线图(预测事件与实际发生事件的对比,参考线表示预测事件与实际发生事件完美重合,截距为0,斜率为1) Fig 3 Calibration graphs for in-hospital mortality showing observed versus predicted risk for each decline (Reference line indicates perfectcalibration, intercept 0, slope 1) |
|
|
| 风险评分 | AUC (95%CI) |
vs APACHE Ⅱ评分P值 | vs IABP-ShockⅡ评分P值 | H-L检验χ2值 | H-L检验P值 |
| APACHEⅡ | 0.90(0.84~0.94) | - | < 0.01 | 6.316 | 0.612 |
| IABP-ShockⅡ | 0.76(0.68~0.84) | < 0.01 | - | 6.619 | 0.286 |
| CardShock | 0.79(0.72~0.85) | < 0.01 | > 0.05 | 4.799 | 0.309 |
| 注:IABP为主动脉内球囊反搏;GRACE为全球冠脉事件登记研究;APACHEⅡ为急性生理-慢性健康评分Ⅱ | |||||
通过回顾在本中心AMI-CS患者队列中验证IABP-ShockⅡ评分及CardShock评分预测患者院内死亡风险的准确性并与APACHEⅡ评分进行比较,发现虽然IABP-ShockⅡ评分及CardShock评分对于高危患者及低危患者的区分度显著低于APACHEⅡ评分,但仍表现出良好的区分度,并且在对于患者院内死亡风险的绝对预测中,预测事件与实际发生事件较好重合,表明具有较精确的校准度。
由于急性心肌梗死合并心源性休克患者病死率极高,准确的危险分级对此类患者极为重要,因为能够早期识别高危患者,帮助临床医师及时做出治疗策略上的调整。APACHEⅡ评分是一项被广泛用于重症监护室中的重症评分系统,被证实对多种疾病的预后具有较好的预测价值,尤其是脓毒症患者[16-17]。APACHEⅡ评分在预测心源性休克患者短期预后方面的应用价值同样早有研究,在最初LeGall等[9]的研究中,APACHEⅡ评分即在心源性休克亚组中对于高危患者显示出优异的区分度(AUC=0.86)。而在IABP-Shock研究中[18],研究者则进一步证实了APACHEⅡ得分对于AMI-CS患者的短期预后具有较高的预测价值(AUC=0.85)。本研究发现APACHEⅡ评分在预测AMI-CS患者短期预后中具有优异的区分度,并且要显著高于IABP-ShockⅡ评分及CardShock评分,这一结果与之前的研究相符。
尽管APACHEⅡ评分在预测心源性休克患者院内死亡风险中表现良好,但由于该评分主要被应用于重症监护室中,且评分过程较为复杂,所以无法扩展应用至其他临床场景中(如在急诊导管室内)。IABP-ShockⅡ评分及CardShock评分是由研究者基于心源性休克人群开展的前瞻性、多中心的随机临床试验和注册研究中开发获得的。在原始队列中,IABP-Shock Ⅱ评分对于预测AMI-CS患者30 d病死率具有良好的区分度(AUC=0.79),CardShock评分对预测CS患者院内死亡风险有优异的区分度(AUC=0.85),但两者中仅有IABP-Shock Ⅱ评分经过外部验证,结果仅显示为一般的区分度(AUC=0.73)。Miller等[19]在CS人群中验证并比较IABP-ShockⅡ评分及CardShock评分,结果两者均仅显示为一般的区分度,但在ACS所致心源性休克的亚组中,两种评分的区分度有升高的趋势。在Rivas-Lasarte等[20]的验证研究中,同样证实了IABP-ShockⅡ评分与CardShock评分对于AMI-CS患者院内死亡风险的较好预测效能。本研究发现两者对于AMI-CS患者的院内死亡风险具有较为准确的预测能力。由于两种评分的变量获取简单,计算快捷,意味着可被应用于各种临床场景对患者进行快速评估,及时指导临床决策,如决定是否在急诊导管室中植入机械循环辅助装置等。
本研究有以下几点局限性:①为单中心研究,且样本量较小,无法准确代表研究人群总体;②评分中仅APACHEⅡ评分为住院期间评分,IABP-ShockⅡ评分及CardShock评分均使用回顾性收集数据计算得出,而由于为回顾性研究,对于院内发生心源性休克的患者不能准确判断休克发生时间节点,因此收集休克后的数据具有误差,且变量有缺失,可能影响评分的准确性。以上缺点可能导致研究的结果受到影响。未来大型前瞻性、多中心的临床研究应该将评分的计算、人群的危险分层考虑在内,可以进一步验证此类评分的准确性及临床应用价值。
综上所述,尽管预测准确性差于APACHEⅡ评分,IABP-ShockⅡ评分及CardShock评分在预测AMI-CS患者的院内死亡风险中仍表现出良好的区分度和较为准确的校准度,且由于其变量获取容易、评分计算简单,可被快速应用于各种临床场景中帮助临床决策。
作者贡献声明 王乐丰教授提出研究计划并对研究内容的准确性及真实性负责;丰德京参与评分计算、数据分析及论文的撰写;刘宇参与评分计算及论文的修改;杨新春、杜胜利、李闯、翟真、李彦彦参与研究对象的筛选及数据收集。丰德京和刘宇为共同第一作者
利益冲突 所有作者均声明不存在利益冲突
| [1] | Thiele H, Ohman EM, de Waha-Thiele S, et al. Management of cardiogenic shock complicating myocardial infarction: an update 2019[J]. Eur Heart J, 2019, 40(32): 2671-2683. DOI:10.1093/eurheartj/ehz363 |
| [2] | Hunziker L, Radovanovic D, Jeger R, et al. Twenty-year trends in the incidence and outcome of cardiogenic shock in AMIS plus registry[J]. Circ Cardiovasc Interv, 2019, 12(4): e007293. DOI:10.1161/CIRCINTERVENTIONS.118.007293 |
| [3] | 李小鹰. 心血管急症救治(1)心源性休克的诊断和处理(续前)[J]. 中国循环杂志, 2013, 28(7): 486-487. DOI:10.3969/j.issn.1000-3614.2013.07.003 |
| [4] | Goldberg RJ, Spencer FA, Gore JM, et al. Thirty-year trends (1975 to 2005) in the magnitude of, management of, and hospital death rates associated with cardiogenic shock in patients with acute myocardial infarction: a population-based perspective[J]. Circulation, 2009, 119(9): 1211-1219. DOI:10.1161/circulationaha.108.814947 |
| [5] | Helgestad OKL, Josiassen J, Hassager C, et al. Temporal trends in incidence and patient characteristics in cardiogenic shock following acute myocardial infarction from 2010 to 2017: a Danish cohort study[J]. Eur J Heart Fail, 2019, 21(11): 1370-1378. DOI:10.1002/ejhf.1566 |
| [6] | Klein LW, Shaw RE, Krone RJ, et al. Mortality after emergent percutaneous coronary intervention in cardiogenic shock secondary to acute myocardial infarction and usefulness of a mortality prediction model[J]. Am J Cardiol, 2005, 96(1): 35-41. DOI:10.1016/j.amjcard.2005.02.040 |
| [7] | Hasdai D, Holmes DR Jr, Califf RM, et al. Cardiogenic shock complicating acute myocardial infarction: predictors of death. GUSTO Investigators. Global utilization of streptokinase and tissue-plasminogen activator for occluded coronary arteries[J]. Am Heart J, 1999, 138(1 Pt 1): 21-31. DOI:10.1016/s0002-8703(99)70241-3 |
| [8] | Sleeper LA, Reynolds HR, White HD, et al. A severity scoring system for risk assessment of patients with cardiogenic shock: a report from the SHOCK Trial and Registry[J]. Am Heart J, 2010, 160(3): 443-450. DOI:10.1016/j.ahj.2010.06.024 |
| [9] | LeGall JR, Loirat P, Alpcrovitch A. APACHE Ⅱ-A severity of disease classification system[J]. Crit Care Med, 1986, 14(8): 754-755. DOI:10.1097/00003246-198608000-00027 |
| [10] | Kellner P, Prondzinsky R, Pallmann L, et al. Predictive value of outcome scores in patients suffering from cardiogenic shock complicating AMI: APACHE Ⅱ, APACHE Ⅲ, Elebute-Stoner, SOFA, and SAPS Ⅱ[J]. Med Klin Intensivmed Notfmed, 2013, 108(8): 666-674. DOI:10.1007/s00063-013-0234-2 |
| [11] | Pöss J, Köster J, Fuernau G, et al. Risk stratification for patients in cardiogenic shock after acute myocardial infarction[J]. J Am Coll Cardiol, 2017, 69(15): 1913-1920. DOI:10.1016/j.jacc.2017.02.027 |
| [12] | Harjola VP, Lassus J, Sionis A, et al. Clinical picture and risk prediction of short-term mortality in cardiogenic shock[J]. Eur J Heart Fail, 2015, 17(5): 501-509. DOI:10.1002/ejhf.260 |
| [13] | Alba AC, Agoritsas T, Walsh M, et al. Discrimination and calibration of clinical prediction models[J]. JAMA, 2017, 318(14): 1377-1384. DOI:10.1001/jama.2017.12126 |
| [14] | Thygesen K, Alpert JS, Jaffe AS, et al. Fourth universal definition of myocardial infarction (2018)[J]. J Am Coll Cardiol, 2018, 72(18): 2231-2264. DOI:10.1016/j.jacc.2018.08.1038 |
| [15] | DeLong ER, DeLong DM, Clarke-Pearson DL. Comparing the areas under two or more correlated receiver operating characteristic curves: a nonparametric approach[J]. Biometrics, 1988, 44(3): 837. DOI:10.2307/2531595 |
| [16] | Chambers KA. Outcomes of severe sepsis and septic shock patients after stratification by initial lactate value[J]. World J Emerg Med, 2018, 9(2): 113-117. DOI:10.5847/wjem.j.1920-8642.2018.02.005 |
| [17] | Khwannimit B, Bhurayanontachai R, Vattanavanit V. Validation of the sepsis severity score compared with updated severity scores in predicting hospital mortality in sepsis patients[J]. Shock, 2017, 47(6): 720-725. DOI:10.1097/shk.0000000000000818 |
| [18] | Prondzinsky R, Lemm H, Swyter M, et al. Intra-aortic balloon counterpulsation in patients with acute myocardial infarction complicated by cardiogenic shock: The prospective, randomized IABP SHOCK Trial for attenuation of multiorgan dysfunction syndrome[J]. Crit Care Med, 2010, 38(1): 152-160. DOI:10.1097/ccm.0b013e3181b78671 |
| [19] | Miller RJH, Southern D, Wilton SB, et al. Comparative prognostic accuracy of risk prediction models for cardiogenic shock[J]. J Intensive Care Med, 2019: 088506661987812. DOI: 10.1177/0885066619878125.[Onlineaheadofprint] |
| [20] | Rivas-Lasarte M, Sans-Roselló J, Collado-Lledó E, et al. External validation and comparison of the CardShock and IABP-SHOCK Ⅱ risk scores in real-world cardiogenic shock patients[J]. Eur Heart J Acute Cardiovasc Care, 2020: 204887261989523. DOI: 10.1177/2048872619895230.[Onlineaheadofprint] |
 2020, Vol. 29
2020, Vol. 29




