2 四川省川北医学院附属医院儿科,南充 637000
创伤性主动脉夹层(traumatic aortic dissection,TAD)是创伤性主动脉损伤(traumatic aortic injury,TAI)的一种类型[1-2],以Stanford B型最多见,其发病率低,但病情凶险,如不及时救治,伤后6 h的病死率达30%,24 h病死率达55%,院前总病死率达80%以上[3-4]。随着交通事故增多,TAD的发生率逐年增加,但此类患者常合并其他部位的损伤,容易被大出血、胸腹腔脏器损伤的表现所掩盖,常被漏诊或误诊,文献报道此病漏诊率达60%[5]。因此提高对本病的认识,早期诊断、及时手术是降低该病病死率的关键。传统的外科手术为直接修补破裂/断裂的主动脉或行主动脉人工血管置换,但手术风险极大。但近年来,随着胸主动脉腔内修复(thoracic endovascular aortic repair,TEVAR)的迅速发展,为TAD治疗提供了新思路。川北医学院附属医院从2010年7月至2018年5月共收治14例急性创伤性Stanford B型主动脉夹层患者,其中13例实施TEVAR,效果满意,现将治疗经过报告如下。
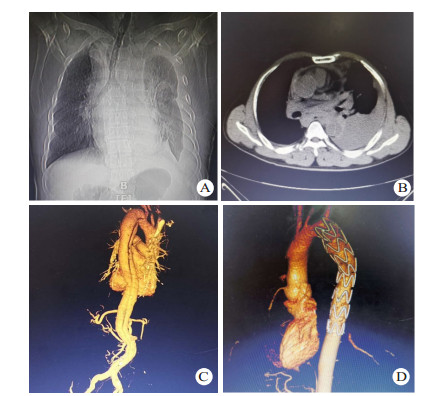
1 资料与方法 1.1 一般资料全组共14例,男性11例,女性3例,年龄23~71岁。急诊入院时间为伤后1~18 h。致伤因素包括车祸伤7例,高处坠落伤5例,重物砸伤1例,胸部击打伤1例; 车祸伤、高处坠落伤等钝性损伤患者不同程度伴有脑部受损,腹腔脏器破裂,血气胸或四肢、骨盆、肋骨、脊椎等骨折。其中伴血胸7例,肋骨骨折5例,四肢骨折3例,肝破裂1例,脾破裂1例,消化道穿孔1例,脑部受损1例,骨盆骨折1例,脊椎骨折1例。既往高血压病史5例。所有患者均由胸腹主动脉断层摄影血管造影(computed tomography angiography,CTA)明确诊断,均为Stanford B型主动脉夹层。夹层累及范围包括:胸主动脉夹层10例,胸腹主动脉夹层4例,肠系膜上动脉、肠系膜下动脉、左肾动脉受累各1例。本研究获得医学伦理委员会批准,编号:2018ER(A)037。治疗及检查均获得患者或家属知情同意。部分患者术前影像学资料见图 1。
|
| 图 1 患者男性,43岁,因车祸伤致胸背部疼痛入院,CTA诊断为TAD(A:普通胸片提示上纵隔明显增宽,隐约可见主动脉弓,左侧胸腔可见包裹性积液; B:胸部CT示降主动脉分层,可见真假腔,并可见左侧胸腔积液; C:胸腹部CTA提示自降主动脉起始部至前动脉起始部主动脉夹层,主动脉内径增宽; D:术后1年胸腹部CTA,支架位置良好,无移位,无内漏,无新发夹层或动脉瘤) |
|
|
所有患者均收入本重症监护室,对患者的意识及呼吸、血压、心率、尿量等生命体征进行严格观察。入科后立即行生命支持治疗,请相关科室积极治疗合并症。对于有高血压病史患者,联合使用β受体阻断剂和硝普钠控制血压和心率,将收缩压控制在110~120 mmHg(1 mmHg=0.133 kPa),心率控制在60~80次/min。对疼痛明显或烦躁不安的患者,间断皮下注射吗啡注射液10 mg。通过胸腹部血管CTA明确破口位置、累及范围、主动脉主要分支受累情况、双侧椎动脉供血情况; 准确测量主动脉直径及近端破口距左侧锁骨下动脉、左侧颈总动脉开口的距离。
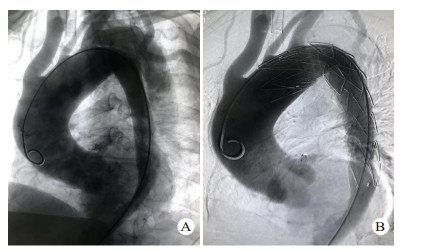
1.3 手术方法除1例主动脉夹层患者合并严重骨盆骨折及全身多处器官损伤,因失血性休克于入院后3 h死亡,其余13例患者均在全麻或局麻下行TEVAR。所有患者均在入院后48 h内完成TEVAR。TEVAR在数字减影血管造影(digital substraction antiography,DSA)室进行,转流手术及其他脏器手术在手术室进行。11例患者采用全身麻醉,2例采用局部麻醉。手术切口均腹股沟切口进行。患者取仰卧位,两侧腹股沟区充分消毒,铺无菌巾,经腹股沟切口暴露股动脉,Seldinger方法穿刺股动脉,置入5 F导管鞘,插入标记导管,将导管置于膈肌平面,注入造影剂,了解主动脉有无其他破口及腹腔重要血管分支供血情况,最后将导管尖端置于升主动脉,行正位及45°左前斜位行主动脉造影,明确主动脉破口位置及真假腔情况(图 2A),测量锚定区主动脉直径,选择合适大小的覆膜支架,进超硬导丝,取出导管及导管鞘,将支架系统输送至锚定区,定位准确后释放覆膜支架,再次造影明确夹层破口覆盖情况(图 2B),左侧锁骨下动脉供血情况,及有无内漏等。合并血胸患者行TEVAR后在介入室立即行胸腔闭式引流,并控制引流速度及引流量。伴有其他合并伤需手术的患者在进行TEVAR后转至手术室行合并伤手术; 同期脾切除、肠穿孔修补、剖胸探查止血各1例,TEVAR后2周后行骨折内固定术2例。术后所有患者均返回本重症监护室进行进一步治疗。
|
| 图 2 患者23岁,因高处坠落伤入院,入院后诊断TAD,破口大,急诊行TEVAR(A:术中主动脉造影显示破口位于降主动脉峡部,靠近左侧锁骨下动脉,真腔小,假腔大; B:术中再次主动脉造影,夹层破口封闭满意,无内漏) |
|
|
术后通过门诊及电话密切随访,随访截止时间2019年8月,随访内容包括患者症状及生活质量,术后3、6、12个月及以后每年复查1次CTA,明确有无内漏、支架移位(图 1D)、截瘫、缺血性脑卒中、左上肢缺血及新发夹层或动脉瘤等并发症。
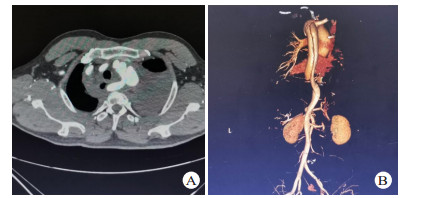
2 结果13患者接受TEVAR。11例夹层破口位于胸降主动脉峡部,2例夹层破口位于降主动脉中段; 累及左侧锁骨下动脉2例,左侧锁骨下动脉开口周围血肿1例; 合并迷走右锁骨下动脉1例(图 3)。破口距离左侧锁骨下动脉开口距离0~51 mm,(30.14±14.85)mm,累及左侧锁骨下动脉2例及左侧锁骨下动脉开口血肿1例患者完全覆盖左侧锁骨下动脉; 2例患者因破口距左锁骨下动脉开口距离近,锚定区不足,覆盖1/2左锁骨下动脉; 1例患者因合夹层累计左侧锁骨下动脉且合并迷走右锁骨下动脉,在手术室先行左侧颈总动脉-左侧锁骨下动脉、右颈总动脉-右锁骨下动脉转流,然后再到介入室行TEVAR手术并覆盖左侧锁骨下动脉。全组主动脉内径27~35 mm,(32.1±3.7)mm,所选择支架直径比CT所测锚定区直径大15%。TEVAR手术时间55~ 129 min,(83.2±21.3)min。本组手术患者死亡1例,病死率为7.7%,死亡原因为合并多根多处肋骨骨折所致呼吸衰竭,1例患者术中造影发现I型内漏,采用高压球囊扩张后内漏消失,其余患者经过治疗后均痊愈出院,住院时间(13.8±6.9)d。出院后失访1例,其余患者均随访1~4年,无支架移位、内漏、截瘫、缺血性脑卒中、左上肢缺血及新发夹层或动脉瘤等并发症,均恢复正常生活。
|
| 图 3 患者56岁,因车祸伤入院,入院后诊断TAD合并迷走右锁骨下动脉(A:胸部增强CT提示降主动夹层,右侧锁骨下动脉起源于降主动脉,沿食管后方走行,左侧胸腔大量血胸,右侧纵隔积血,B:胸腹部CTA提示降主动脉夹层,夹层累及迷走右锁骨下动脉) |
|
|
TAD病情凶险,其受伤机制复杂,可能是多种因素直接或间接共同作用的结果。TAD最常见的损伤部位为主动脉峡部,约占90%[6-7],其次为降主动脉、升主动脉、主动脉弓; 腹主动脉损伤发生率最低,其发生多伴有腰椎骨折[8]。本组病例中,12例患者损伤位于峡部,2例损伤位于降主动脉。因此TAD以Stanford B型最多见,可能与胸主动脉解剖结构与血流动力学有关[9]。
急性创伤性Stanford B型主动脉夹层患者常合并其他胸外伤,如肺挫伤,血气胸,肋骨、胸骨、肩胛骨、脊柱、膈疝[10]等部位的损伤,存在明显胸背部疼痛,主动脉夹层引起的胸痛症状容易被掩饰,容易导致漏诊; 由于多发复合伤,多数伴有高血压的患者因创伤性失血性休克导致血压不高或低血压,给诊断带来误导。漏诊或者处理不及时或不恰当时病死率极高[11]。因此,如何在复杂的伤势评估中早期诊断急性创伤性Stanford B型主动脉夹层以及及时有效的治疗是降低病死率的关键[12]。笔者认为,对于急性创伤性Stanford B型主动脉夹层的早期诊断应注意以下几方面:①若收治较为严重的胸腹部外伤或高处坠落伤患者,有明确的胸背部疼痛患者应高度警惕夹层的可能。②详细询问受伤机制及仔细查体能明显提高确诊率,若就诊时发现双侧上肢血压差别或脉搏不对称,或上下肢血压差距缩小甚至下肢血压低于上肢血压应高度怀疑此病; 若听诊时发现颈部血管杂音应考虑夹层累及颈部重要分支血管可能。③辅助检查对急性创伤性Stanford B型主动脉夹层的诊断提供了有力的依据[13]。X线对该病的诊断特异性较差,但伤者X线提示纵隔影增宽、主动脉弓及降主动脉处增粗或边缘模糊、心包积液、胸腔积液等应考虑此病可能。心脏彩超诊断夹层阳性率高,不但能清晰显示主动脉内膜的漂浮运动及真假腔内的血流,还可以观察心包积液及主动脉瓣反流情况,且价格便宜、无创,可在床旁操作,但心脏彩超仍有局限性,容易受气体、胸壁厚度、胸骨等的影响。CT平扫快速便捷,是多发复合损伤便捷有效的影像学检查,对夹层诊断有一定的指导意义,但确诊需进一步行CTA检查,CTA可以多角度全面观察有无夹层、夹层累及范围、破口位置、分支受累情况,从而准确分型,指导手术,是高度怀疑夹层患者的首选影像学检查方法。本组14例患者均行胸腹部CTA检查诊断明确。MRI对夹层诊断率极高,但耗时长,不适合血流动力学不稳定患者,因此不作为首选。
怀疑或诊断急性创伤性Stanford B型主动脉夹层患者应立即予以维持生命体征,将收缩压控制在110~120 mmHg,心率控制在60~80次/min。手术是急性创伤性Stanford B型主动脉夹层唯一确定有效的治疗方法。传统的手术方式为开放手术,需在体外循环下行主动脉修补或人工血管置换。此类手术时间长,操作复杂,出血量大,术后并发症发生率、病死率较高; 加之此类患者常合并严重的其他脏器或组织损伤,体外循环时肝素化可能加重出血,增加手术风险。研究报道,开放手术术后截瘫发生率高达13%,围手术期病死率为24%[14]。与传统手术相比较,腔内修复具有创伤小、手术时间短、恢复快、并发症少等优点,逐渐广泛应用于临床。研究表明,腔内修复术可明显降低心脑血管事件、截瘫、肺部感染、肾功能衰竭的发生率及近期病死率[15]。对于急性创伤性Stanford B型主动脉夹层,腔内修复是一种切实可行的治疗方法[16-17],其避免了体外循环的并发症及肝素化的出血,这一点对于夹层合并其他脏器损伤时尤为重要。本研究结果显示,急性创伤性Stanford B型主动脉夹层是TEVAR的绝佳适应证。与自发性主动脉夹层相比,急性创伤性Stanford B型主动脉夹层累及范围相对局限,血管条件较好,上下均为正常血管,为支架提供了良好的附着点和锚定区[18]。对于急性创伤性Stanford B型主动脉夹层行TEVAR,笔者建议夹层破口区应距左侧锁骨下动脉10 mm以上,以提供足够的锚定区; 但对于锚定区不足10 mm者并不是TEVAR的禁忌证,可以通过覆盖部分或全部左侧锁骨下动脉以获得足够的锚定区,多数病例左侧锁骨下动脉封闭后可通过侧枝循环重新供血,不会影响左上肢功能; 本组病例中3例完全覆盖左侧锁骨下动脉,2例覆盖部分左侧锁骨下动脉,均未发生左上肢缺血及缺血性脑卒中等并发症。若患者为左椎动脉优势型,应尽量避免完全覆盖左侧锁骨下动脉以减少脑部缺血并发症,可先行烟囱技术、开窗技术或左侧颈总动脉-左侧锁骨下动脉转流,再行TEVAR。对于Stanford B型主动脉夹层合并迷走右锁骨下动脉病例,若夹层累及左侧锁骨下动脉或距左侧锁骨下动脉距离较近,应先行双侧颈总动脉-锁骨下动脉转流,再行TEVAR; 若距左锁骨下动脉有足够的锚定区,则判断其是左侧椎动脉优势型还是右侧椎动脉优势型,若为左椎动脉优势型,可不转流,若为右椎动脉优势型,则行右侧颈总动脉-右侧锁骨下动脉转流; 同时,夹层合并迷走右锁骨下动脉患者均需使用弹簧圈栓塞迷走右侧锁骨下动脉开口以减少术后内漏发生。本组病例中1例患者因创伤性Stanford B型主动脉夹层合并迷走右锁骨下动脉且夹层累及左侧锁骨下动脉开口,行双侧颈总动脉-锁骨下动脉转流,并使用弹簧圈栓塞迷走右侧锁骨下动脉开口。TEVAR并发症主要有内漏、截瘫、缺血性脑卒中、左上肢缺血、支架移位等。为减少内漏的发生,应保证足够的锚定区,选择支架型号应大于主动脉内径的15%~20%[19],释放支架过程中应将收缩压严格控制在120 mmHg以下。覆膜支架长度选择以能完全覆盖瘤体破口即可,应尽量避免支架下缘达胸8水平,以减少脊髓缺血及截瘫发生。颈总动脉-锁骨下动脉转流能为TEVAR并发缺血性脑卒中和左上肢缺血提供有力保障。本组病例中1例患者术中造影发现Ⅰ型内漏,采用高压球囊扩张后内漏消失。其余患者在随访期间均未发生上述并发症,能正常生活。
急性创伤性Stanford B型主动脉夹层常伴随其他脏器、组织损伤,其中血胸最常见,术前若不影响呼吸,应避免抽液或胸腔闭式引流,以免胸腔压力骤降导致血管与胸腔压力差增加,加速夹层破裂; 若严重影响患者呼吸,可行控制性胸腔穿刺以缓解患者症状; TEVAR结束后因立即行胸腔闭式引流减轻患者呼吸症状及促进肺复张。若出现严重肝脾破裂、肠穿孔、进行性血胸等,需在TEVAR后立即转入手术室进行合并伤手术,以免耽误病情。对于合并四肢骨折患者,可先行石膏固定,待患者行TEVAR且病情稳定后择期再行骨折内固定,以最大限度挽救患者生命和减轻患者痛苦。
综上所述,急性创伤性Stanford B型主动脉夹层常合并其他器官损伤,病情复杂多样,诊断困难,若不引起重视,容易漏诊。早期诊断对该病患者预后至关重要,胸腹主动脉CTA是诊断急性创伤性Stanford B型主动脉夹层的重要方法,一旦确诊,应急诊手术治疗。TEVAR效果确切,是治疗急性创伤性Stanford B型主动脉夹层的有效方法。但创伤性所致主动脉夹层与高血压、动脉粥样硬化所致的自发性主动脉夹层患者相比,发病年龄更小,生存期更长,其远期效果及并发症方面,缺乏研究报道,需进一步随访,期待长期随访结果。
利益冲突 所有作者均声明不存在利益冲突
| [1] | Cline M, Cooper KJ, Khaja MS, et al. Endovascular management of acute traumatic aortic injury[J]. Tech Vasc Interv Radiol, 2018, 21(3): 131-136. DOI:10.1053/j.tvir.2018.06.002 |
| [2] | Li S, Cai W, Li X, et al. Thoracic endovascular aortic repair for traumatic type B aortic dissection: a 5-year experience from a single center[J]. Int Angiol, 2017, 36(4): 316-321. DOI:10.23736/S0392-9590.17.03782-8 |
| [3] | Arthurs ZM, Starnes BW, Sohn VY, et al. Functional and survival outcomes in traumatic blunt thoracic aortic injuries: an analysis of the national trauma databank[J]. J Vasc Surg, 2009, 49(4): 988-894. DOI:10.1016/j.jvs.2008.11.052 |
| [4] | Fox N, Schwartz D, Salazar JH, et al. Evaluation and management of blunt aortic injury: A practice management guideline from the eastern association for the surgery of trauma[J]. J Trauma Acute Care Surg, 2015, 78(1): 136-146. DOI:10.1097/TA.0000000000000470 |
| [5] | Agostinelli A, Carino D, Borrello B, et al. Blunt traumatic injury to the thoracic aorta treated with thoracic endovascular aortic repair: a single-centre 20-year experience[J]. Interact Cardiovasc Thorac Surg, 2019, 28(1): 17-22. DOI:10.1093/icvts/ivy211 |
| [6] | 朱中权, 潘禹辰, 卢水焕. 创伤性主动脉夹层的诊断与治疗进展[J]. 血管与腔内血管外科杂志, 2018, 4(3): 265-269. DOI:10.19418/j.cnki.issn2096-0646.2018.03.17 |
| [7] | Lee CH, Huang JK, Yang TF. Experience of endovascular repair of thoracic aortic dissection after blunt trauma injury in a district general hospital[J]. J Thorac Dis, 2016, 8(6): 1149-1154. DOI:10.21037/jtd.2016.04.15 |
| [8] | Santoro G, Ramieri A, Chiarella V, et al. Thoraco-lumbar fractures with blunt traumatic aortic injury in adult patients: correlations and management[J]. Eur Spine J, 2018, 27(2): 248-257. DOI:10.1007/s00586-018-5601-5 |
| [9] | Fattori R, Russo V, Lovato L, et al. Optimal management of traumatic aortic injury[J]. Eur J Vasc Endovasc Surg, 2009, 37(1): 8-14. DOI:10.1016/j.ejvs.2008.09.024 |
| [10] | 向军, 何玲, 刘艳, 等. 创伤性膈疝的临床特点及诊治分析[J]. 中华疝与腹壁外科杂志, 2017, 11(6): 456-459. DOI:10.3877/cma.j.issn.1674-392X.2017.06.014 |
| [11] | Sandhu HK, Leonard SD, Perlick A, et al. Determinants and outcomes of nonoperative management for blunt traumatic aortic injuries[J]. J Vasc Surg, 2018, 67(2): 389-398. DOI:10.1016/j.jvs.2017.07.111 |
| [12] | 丁锦辉, 付大鹏, 刘军乐, 等. 创伤性Stanford B型主动脉夹层早期诊断和腔内治疗体会[J]. 中华血管外科杂志, 2018, 3(1): 51-53. DOI:10.3760/cma.j.issn.2096-1863.2018.01.015 |
| [13] | Nik Azlan NM, Rossman H. A case of missed blunt traumatic aortic injury (BTAI)[J]. Med J Malaysia, 2017, 72(3): 193-194. |
| [14] | Xun Y, Andreas M, Mohammed G, et al. Conservative management versus endovascular or open surgery in the spectrum of type B aortic dissection[J]. J Vis Surg, 2018(4): 59. DOI:10.21037/jovs.2018.02.15 |
| [15] | Tetsuro U, Mitsuaki S. Thoracic endovascular aortic repair for acute aortic dissection[J]. Ann Vasc Dis, 2018, 11(4): 464-472. DOI:10.3400/avd.ra.18-00127 |
| [16] | 朱贤, 孔敏坚, 蒋守银. 创伤性主动脉损伤腔内修复治疗18例临床分析[J]. 中华急诊医学杂志, 2019, 28(2): 258-260. DOI:10.3760/cma.j.issn.1671-0282.2019.02.027 |
| [17] | Cheng YT, Cheng CT, Wang SY, et al. Long-term outcomes of endovascular and open repair for traumatic thoracic aortic injury[J]. JAMA Netw Open, 2019, 2(2): e187861. DOI:10.1001/jamanetworkopen.2018.7861 |
| [18] | Shan JG, Zhai XM, Liu JD, et al. Thoracic endovascular aortic repair for traumatic thoracic aortic injury: A single-center initial experience[J]. Ann Vasc Surg, 2016(32): 104-110. DOI:10.1016/j.avsg.2015.09.023 |
| [19] | 张荣杰, 刘军军, 冯家烜, 等. 主动脉夹层腔内修复术前动脉管径测量的现状与展望[J]. 中华普通外科杂志, 2017, 32(6): 543-545. DOI:10.3760/cma.j.issn.1007-631X.2017.06.031 |
 2020, Vol. 29
2020, Vol. 29




