脓毒症是机体对感染反应异常或失调而引起的危及生命的器官功能障碍,是重症监护病房的常见危重疾病之一,可导致多器官功能障碍、感染性休克等。急性肾损伤(acute kidney injury,AKI)是脓毒症早期最常见并发症之一,有研究表明在重症监护病房中脓毒症相关急性肾损伤的存在导致病死率增加30%~35%[1-2]。
对脓毒症相关急性肾损伤的病理生理机制不甚了解,以及无法在早期做出明确诊断,与脓毒症相关急性肾损伤的病死率较高有关。目前急性肾损伤的诊断都是基于血肌酐水平和尿量的变化[3],但是这两项指标并不能解释急性肾损伤发生的原因及病理生理学机制,而且对肾功能障碍的早期识别缺乏足够的灵敏度和特异度。检测与AKI的潜在发病机制相关的标志物可以早期识别脓毒症相关急性肾损伤。
本研究探讨脓毒症相关急性肾损伤的危险因素,比较脓毒症患者入院时炎症指标、凝血纤溶指标、内皮损伤指标及肾损伤指标在脓毒症相关急性肾损伤中的诊断价值。
1 资料与方法 1.1 一般资料单中心、回顾性研究:入组2017年2月至2018年3月武汉大学人民医院重症监护室脓毒症患者119例。根据入院48 h内是否发生急性肾损伤分为脓毒症相关急性肾损伤组(AKI组)、脓毒症非急性肾损伤组(非AKI组),其中AKI组纳入46人次,非AKI组纳入73人次。
单中心、前瞻性研究:入组2018年4月至2018年9月武汉大学人民医院重症监护室脓毒症患者46例。监测入院48 h内肌酐、尿量水平,根据是否发生急性肾损伤分为脓毒症相关急性肾损伤组(AKI组)、脓毒症非急性肾损伤组(非AKI组),其中AKI组纳入26人次,非AKI组纳入20人次。
1.2 诊断标准脓毒症和感染性休克患者的诊断标准是依据2016年美国危重病学会(SCCM)和欧洲危重病学会(ESICM)共同修订的(Sepsis3.0)[4];急性肾损伤的诊断标准为改善全球肾脏病预后组织(KDIGO)发布的AKI标准[3]:①在 48 h内血清肌酐(SCr)上升 0.3 mg/dL(≥ 26.5μmol/L);②已知或假定肾功能损害发生在 7 d之内,SCr上升至 > 基础值的 1.5 倍;③尿量 < 0.5 mL/(kg·h),持续 6 h。
1.3 排除标准年龄低于18周岁;入住ICU后24 h内死亡或自动出院患者;1周之内使用过影响凝血功能药物的患者;合并影响凝血功能的基础疾病的患者;需进行血液透析的慢性肾功能不全患者;数据不全或资料丢失的患者。
1.4 实验室检查指标单中心、回顾性研究:收集患者的一般资料(年龄、性别、既往病史、APACHEⅡ评分、SOFA评分),根据是否发生急性肾损伤分为AKI组与非AKI组。分析患者内皮细胞损伤指标(sTM、t-PAI-C)、凝血功能指标 (PLT、FDP、AT-Ⅲ、TAT、PIC、PT、PT-INR、FIB、D-Dimer)、炎症指标(WBC、NEU#、PCT)。具体如下:可溶性血栓调节蛋白(soluble thrombomodulin,sTM)、组织性纤溶酶原激活剂及其抑制物(tissue plasminogen activator and its inhibitor complex,t-PAI-C)、血小板(platelet count,PLT)、纤维蛋白原降解产物(fbrinogen degradation products,FDP)、抗凝血酶Ⅲ(antithrombin Ⅲ,AT-Ⅲ)、凝血酶-抗凝血酶复合物(thrombin antithrombin complex,TAT)、纤溶酶-α2纤溶酶降解产物(plasmin-a2 plasminogen inhibitor complex,PIC)、纤维蛋白原(fbrinogen,FIB)、D-二聚体(D-Dimer)、凝血酶原时间(prothrombin time,PT)、PT国际标准化比值(prothrombin time-international normalized ratio,PT-INR)、降钙素原质量浓度(procalcitonin,PCT)、白细胞数(white blood cell count,WBC)、中性粒细胞数(neutrophil count,Neu)。
单中心、前瞻性研究:收集患者的一般资料(年龄、性别),记录患者入院时内皮细胞损伤指标(sTM、t-PAI-C)、凝血纤溶指标(AT-Ⅲ、TAT、PIC、PT-INR、FIB、D-Dimer) 、炎症指标(PCT)、肾损伤指标(Cys C、ACR、NGAL、uNAL、uRBP)。监测入院48 h内肌酐、尿量水平,根据是否发生急性肾损伤分为脓毒症相关急性肾损伤组(AKI组)、脓毒症非急性肾损伤组(非AKI组)。具体如下:sTM、t-PAI-C、AT-Ⅲ、TAT、PIC、PT-INR、FIB、D-Dimer、PCT、血清血清胱抑素(serum cystatin C,Cys C)、尿微量白蛋白与肌酐比值(the urine albumin to creatinine ratio,uACR)、尿中性粒细胞明胶酶相关脂质运载蛋白(the urine neutrophil gelatinase-associated lipocalin,uNGAL)、N-乙酰-β-D-氨基葡萄糖苷酶(the urine N-acetyl-β-D-glucosaminidase,uNAL)、视黄醇结合蛋白(the urine retinol binding protein,uRBP)。
1.4.1 可溶性血栓调节蛋白(sTM)TM普遍存在于血管内皮细胞表面,通过与凝血酶结合和激活蛋白C系统发挥抗凝作用。正常生理状态下,TM分布于细胞质膜表面。当血管内皮细胞受到损伤后,TM分泌异常释放入血,进入血液循环即为可溶性血栓调节蛋白(sTM)。
1.4.2 血清胱抑素C(Cys C)Cys C主要经肾脏代谢,能自由通过肾小球而不被肾小管重吸收和分泌,生成速度稳定,是提示肾小管受损、肾小球滤过率下降的理想指标[5]。
1.4.3 中性粒细胞明胶酶相关脂质运载蛋白(NGAL)NGAL是预测急性肾损伤的早期生物学标志,发生急性肾损伤3 h内NGAL明显上升,尿NGAL(uNGAL)与血清NGAL(sNGAL)具有良好的相关性,临床广泛应用uNGAL预测急性肾损伤的发生[6]。
1.4.4 尿微量白蛋白与肌酐比值(uACR)蛋白尿是肾小球/肾小管损伤的直接结果,uACR在肾损伤的早期即可升高,随着肾小球功能障碍而增加,是目前评估慢性肾脏疾病进展的标志物和24 h尿蛋白排泄率的理想指标。
1.4.5 1.4.5 N-乙酰-β-D-氨基葡萄糖苷酶(NAG)NAG主要存在于肾近曲小管上皮细胞溶酶体中,不透过正常肾小球滤过膜,尿NAG主要源于肾小管上皮细胞溶酶体的释放,是急性肾损伤的敏感指标。
1.4.6 视黄醇结合蛋白(RBP)RBP主要在肝脏合成,生理状态下不通过肾小球滤过膜,极少量在肾小管以游离形式被重吸收,对肾小管损伤有诊断价值。
1.5 统计学方法采用SPSS 20.0软件进行统计学分析。采用PASS 11.0软件计算样本含量。符合正态分布计量资料用均数±标准差(Mean±SD)表示,组间比较采用成组t检验;偏态分布的数据采用中位数(M)和四分位数[第25百分位数(P25),第75百分位数(P75)]描述离散程度;两组间比较采用Mann-Whitney U检验。计数资料组间比较采用χ2检验。采用受试者工作特征曲线(ROC曲线)分析各检验指标的诊断价值。采用Logistic回归分析脓毒症相关急性肾损伤的危险因素。检验水准为P<0.05。
2 结果 2.1 119例脓毒症患者的回顾性研究 2.1.1 AKI组与非AKI组一般资料比较119例脓毒症患者依据入院48 h内是否发生急性肾损伤分为AKI组和非AKI组,两组一般资料(性别、年龄)、7 d病死率、评分(APACHEII评分、SOFA评分)、高血压、糖尿病、慢性肾功能不全、脓毒症休克发生率比较:与非AKI组相比,AKI组APACHEⅡ、SOFA评分、慢性肾功能不全病史具差异有统计学意义(见表 1)。
| 指标 | 指标 | AKI组(n=46) | Non-AKI组(n=73) | P值 |
| 性别(n,%) | 男 | 33(71.74) | 44(60.27) | 0.206 |
| 女 | 13(28.26) | 29(39.73) | ||
| 高血压(n,%) | 有 | 12(26.09) | 26(35.62) | 0.281 |
| 无 | 34(73.91) | 47(64.38) | ||
| 糖尿病(n,%) | 有 | 3(6.52) | 6(8.22) | 0.714 |
| 无 | 43(93.48) | 67(91.78) | ||
| 慢性肾脏病(n,%) | 有 | 11(23.91) | 1(1.27) | 0.001 |
| 无 | 35(76.09) | 72(98.63) | ||
| 脓毒性休克(n,%) | 有 | 24(52.17) | 26(35.62) | 0.076 |
| 无 | 22(47.83) | 47(64.38) | ||
| 7 d病死率(n,%) | 死亡 | 20(43.48) | 21(28.77) | 0.074 |
| 存活 | 26(56.62) | 52(71.23) | ||
| 年龄(岁) | 64.00(57.00, 70.50) | 58.00(38.50, 71.00) | 0.776 | |
| APACHEⅡ评分 | 21.00(18.00, 27.00) | 18.00(14.00, 22.00) | 0.001 | |
| SOFA评分 | 9.00(6.00, 13.00) | 5.00(3.00, 8.50) | 0.001 | |
| 不包含肾功能评价的SOFA评分 | 6.00(3.00, 10.00) | 4.00(2.25, 8.00) | 0.139 | |
| 注:APACHE Ⅱ急性生理学与慢性健康评分 ;SOFA 序贯器官功能衰竭评分 | ||||
两组入院时内皮细胞损伤指标(sTM、t-PAI-C)、凝血纤溶指标 (PLT、FDP、AT-Ⅲ、TAT、PIC、PT、PT-INR、FIB、D-Dimer)、炎症指标(WBC、NEU#、PCT)相比较:AKI组sTM水平(38.17 TU/mL, P<0.01)、PCT质量浓度(13.24 ng/mL, P<0.01)、D-Dimer水平(12.87 ng/L, P=0.045)、PT-INR(1.52, P=0.01)更高,PT时间更长(18.70 s, P=0.01)(见表 2)。
| 指标 | AKI组(n=46) | 非AKI组(n=73) | P值 |
| PCT(ng/mL) | 13.24(4.15, 38.22) | 4.36(2.39, 8.95) | <0.001 |
| WBC(109/L) | 12.76(7.50, 17.88) | 9.66(6.94, 15.68) | 0.306 |
| Neu(109/L) | 11.35(6.19, 16.82) | 7.67(5.13, 13.94) | 0.193 |
| PLT(109/L) | 92.00(63.00, 178.00) | 136.00(68.00, 185.00) | 0.050 |
| PT-INR | 1.52(1.26, 1.75) | 1.35(1.22, 1.51) | 0.001 |
| PT(s) | 18.70(17.45, 19.95) | 15.50(13.95, 17.25) | 0.001 |
| FIB(g/L) | 2.70(1.84, 4.45) | 3.82(2.70, 5.31) | 0.362 |
| AT-Ⅲ(%) | 59.50(50.6, 74.95) | 66.80(46.80, 80.10) | 0.452 |
| TAT(ng/mL) | 14.15(6.68, 24.79) | 11.40(4.685, 26.28) | 0.762 |
| PIC(μg/mL) | 1.52(0.80, 3.37) | 0.70(0.51, 1.55) | 0.802 |
| FDP(mg/L) | 37.20(14.50, 119.80) | 13.80(5.85, 36.00) | 0.196 |
| D-Dimer(ng/L) | 12.87(4.71, 49.12) | 3.33(1.63, 8.20) | 0.045 |
| sTM(TU/mL) | 38.17(28.72, 48.14) | 15.20(11.90, 21.69) | <0.001 |
| t-PAI-C(ng/mL) | 25.70(7.89, 38.63) | 17.88(9.81, 36.61) | 0.202 |
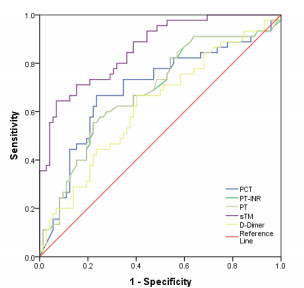
对119例脓毒症患者进行ROC曲线分析,以内皮细胞损伤指标(sTM、t-PAI-C)、凝血纤溶指标 (PLT、FDP、AT-Ⅲ、TAT、PIC、PT、PT-INR、FIB、D-Dimer)、炎症指标(WBC、NEU#、PCT)设为ROC曲线的检验变量,将发生AKI设为状态变量。sTM、PCT、PT、PT-INR、D-Dimer的曲线下面积依次为:0.857(0.790, 0.924),0.691(0.587, 0.794),0.690(0.590, 0.789),0.688(0.588, 0.787),0.609(0.504, 0.715),其中sTM的诊断阈值为29.975 TU/mL,诊断灵敏度和特异度分别为0.644、0.918(见表 3、图 1)。
| 指标 | AUC | 95% CI | 阈值 | 灵敏度 | 特异度 | P值 |
| PCT(ng/mL) | 0.691 | 0.587, 0.794 | 9.92 | 0.652 | 0.778 | 0.000 |
| PLT(109/L) | 0.393 | 0.289, 0.496 | - | - | - | 0.050 |
| PT-INR | 0.688 | 0.588, 0.787 | 1.505 | 0.565 | 0.781 | 0.001 |
| PT(s) | 0.690 | 0.590, 0.789 | 17.200 | 0.565 | 0.781 | 0.001 |
| FIB(g/L) | 0.450 | 0.343, 0.557 | - | - | - | 0.362 |
| AT-Ⅲ(%) | 0.441 | 0.290, 0.592 | - | - | - | 0.452 |
| TAT(ng/mL) | 0.517 | 0.407, 0.626 | - | - | - | 0.762 |
| PIC(μg/mL) | 0.486 | 0.375, 0.598 | - | - | - | 0.802 |
| sTM(TU/mL) | 0.857 | 0.790, 0.924 | 29.975 | 0.644 | 0.918 | 0.000 |
| t-PAI-c(ng/mL) | 0.570 | 0.460, 0.679 | - | - | - | 0.202 |
| D-Dimer(ng/L) | 0.609 | 0.504, 0.715 | 4.900 | 0.652 | 0.589 | 0.045 |
| FDP(mg/L) | 0.573 | 0.464, 0.681 | - | - | - | 0.196 |
|
| 图 1 119例脓毒症患者脓毒症相关急性肾损伤实验室指标的ROC曲线分析 Fig 1 ROC curve analysis of parameters of sepsis-induced AKI in 119 patients with sepsis |
|
|
基于以上结果,筛查出7个指标:PCT、PT-INR、PT、sTM、SOFA评分、APACHEII评分、慢性肾衰竭病史是发生AKI的可疑影响因素,进行多因素研究。多因素分析选择的统计学方法为二项分类Logistic回归分析。
结果显示:sTM和慢性肾衰竭病史是脓毒症相关急性肾损伤的独立危险因素(见表 4):
| 指标 | P值 | OR值 | OR值的95%置信区间 | |
| 下限 | 上限 | |||
| 性别 | 0.636 | 1.008 | 0.975 | 1.043 |
| 年龄 | 0.718 | 0.765 | 0.975 | 1.020 |
| sTM(TU/mL) | <0.000 | 1.146 | 1.082 | 1.214 |
| PCT(ng/mL) | 0.369 | 1.013 | 0.995 | 1.032 |
| PT(s) | 0.122 | 0.981 | 0.941 | 1.024 |
| PT-INR | 0.132 | 0.495 | 0.746 | 16.370 |
| SOFA | 0.188 | 1.106 | 0.952 | 1.285 |
| APACHEⅡ | 0.574 | 1.064 | 0.950 | 1.190 |
| 慢性肾脏病病史 | 0.009 | 35.356 | 2.470 | 506.200 |
回顾性研究结果表明sTM对脓毒症相关急性肾损伤的诊断灵敏度为0.644,特异度为0.918。采用PASS 11.0软件计算样本量,灵敏度为0.644,允许误差为5%,特异度为0.918,允许误差为10%,计算样本量为38例,本实验纳入46例脓毒症患者。
2.2.1 AKI组与非AKI组一般资料的比较监测46例脓毒症患者入院后48h内尿量及肌酐水平,按照是否发生急性肾损伤分为AKI组和非AKI组。AKI组与非AKI组的年龄、性别差异无统计学意义(见表 5)。
| 指标 | AKI组(n=26 ) | 非AKI组(n=20) | P值 |
| 年龄, (岁) | 64.70±12.17 | 60.22±17.17 | 0.721 |
| 性别 | |||
| 男 | 10(38.46%) | 6(30.00%) | 0.510 |
| 女 | 16(61.54%) | 14(70.00%) |
AKI和非AKI组,两组入院时内凝血纤溶指标(TAT、PIC、sTM、t-PAI-C、PT、FIB、D-Dimer、AT-Ⅲ)、炎症指标(PCT)、肾损伤指标(Cys C、ACR、uNAG、uRBP、uNGAL)相比较:sTM水平(24.21 TU/mL, P=0.003)、PCT质量浓度(20.34 ng/mL, P=0.042)、Cys C水平(3.30 mg/mL, P=0.043)、uNGAL水平(461.30 ng/mL, P=0.029)更高(见表 6)。
| 指标 | AKI组(n=26) | 非AKI组(n=20) | P值 |
| PCT(ng/mL) | 20.34(2.97, 100.00) | 1.78(0.52, 45.21) | 0.042 |
| TAT(ng/mL) | 14.38±15.05 | 13.57±9.24 | 0.191 |
| PIC(μg/mL) | 1.50±1.05 | 1.09±0.58 | 0.168 |
| sTM(TU/mL) | 24.21(17.25, 39.22) | 11.33(8.11, 30.04) | 0.003 |
| t-PAI-C(ng/mL) | 14.92(7.71, 24.10) | 14.28(8.40, 26.37) | 0.648 |
| PT(s) | 15.01±2.59 | 14.28±3.43 | 0.711 |
| FIB(g/L) | 3.94(2.85, 5.36) | 5.44(3.99, 48.53) | 0.180 |
| D-Dimer(ng/L) | 4.83(2.21, 13.62) | 6.50(2.02, 9.77) | 0.722 |
| AT-Ⅲ(%) | 61.54±16.16 | 73.58±16.27 | 0.703 |
| Cys C(mg/mL) | 3.30(1.68, 5.08) | 1.08(0.89, 2.93) | 0.043 |
| ACR(mg/g) | 384.11(86.95, 791.74) | 255.31(180.48, 481.67) | 0.573 |
| UNAG(U/L) | 45.70±30.22 | 31.70±19.21 | 0.407 |
| uRBP(mg/L) | 18.53(3.03, 24.01) | 2.87(1.34, 18.84) | 0.075 |
| uNGAL(ng/mL) | 461.30(129.38, 1836.38) | 81.90(33.78, 329.83) | 0.029 |
对46例脓毒症患者进行ROC曲线分析,以凝血纤溶指标(TAT、PIC、sTM、t-PAI-C、PT-INR、FIB、D-Dimer、AT-Ⅲ)、炎症指标(PCT)、肾损伤指标(Cys C、ACR、uNAG、uRBP、uNGAL)为ROC曲线的检验变量,以发生AKI为状态变量。
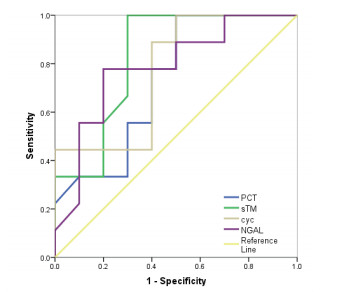
sTM, uNGAL, Cys C and PCT的曲线下面积依次为0.850(0.680, 1.000),0.785(0.569, 0.988),0.764(0.551, 0.976),0.750(0.542, 0.958)。sTM的诊断灵敏度最高(>0.999),uNGA的诊断特异度最高(0.800)(见表 7、图 2)。
| 指标 | AUC | 95%CI | 灵敏度 | 特异度 | 阈值 | P值 |
| PCT(ng/mL) | 0.750 | 0.542, 0.958 | >0.999 | 0.500 | 1.129 | 0.044 |
| TAT(ng/mL) | 0.458 | 0.217, 0.698 | - | - | - | 0.733 |
| PIC(μg/mL) | 0.620 | 0.431,0.884 | - | - | - | 0.350 |
| sTM(TU/mL) | 0.850 | 0.680, 1.000 | >0.999 | 0.700 | 14.580 | 0.005 |
| t-PAI-C(ng/mL) | 0.558 | 0.313,0.803 | - | - | - | 0.642 |
| PT(s) | 0.579 | 0.287,0.783 | - | - | - | 0.531 |
| FIB(g/L) | 0.329 | 0.096,0.563 | - | - | - | 0.176 |
| D-Dimer(ng/L) | 0.546 | 0.293,0.799 | - | - | - | 0.717 |
| AT-Ⅲ(%) | 0.279 | 0.059,0.499 | - | - | - | 0.081 |
| Cys C(mg/mL) | 0.764 | 0.551, 0.976 | 0.909 | 0.600 | 1.495 | 0.041 |
| ACR(mg/g) | 0.581 | 0.260,0.797 | - | - | - | 0.564 |
| uNAG(U/L) | 0.615 | 0.297,0.821 | - | - | - | 0.385 |
| uRBP(mg/L) | 0.735 | 0.426,0.910 | - | - | - | 0.076 |
| uNGAL(ng/mL) | 0.785 | 0.569, 0.988 | 0.800 | 0.800 | 261.55 | 0.031 |
|
| 图 2 46例脓毒症患者脓毒症相关急性肾损伤实验室指标的ROC曲线分析 Fig 2 ROC curve analysis of parameters of sepsis-induced AKI in 46 patients with sepsis |
|
|
基于以上结果,筛查出4个指标:PCT、sTM、Cys C、uNGAL是发生AKI的可疑影响因素,需进行多因素研究。多因素分析选择的统计学方法为Logistic回归分析。
sTM水平高表达是脓毒症急性肾损伤的独立危险因素(见表 8)。
| 指标 | P值 | OR值 | OR的 95%置信区间 | |
| 下限 | 上限 | |||
| 性别 | 0.366 | 1.458 | 0.252 | 8.429 |
| 年龄 | 0.120 | 1.194 | 0.955 | 1.492 |
| sTM | 0.043* | 1.117 | 1.004 | 1.243 |
| PCT | 0.930 | 1.018 | 0.993 | 1.043 |
| Cys C | 0.415 | 2.173 | 0.951 | 4.800 |
| uNGAL | 0.347 | 1.001 | 1.000 | 1.002 |
本研究结果表明:①入组119例脓毒症患者,脓毒症相关急性肾损伤组(AKI组)与脓毒症非急性肾损伤组(非AKI组)比较,PCT、PT、PT-INR、sTM、D-Dimer差异有统计学意义;PCT、PT、PT-INR、sTM、D-Dimer对脓毒症相关急性肾损伤有较好的预测作用,其中sTM有较高的诊断准确度(AUC=0.857,95%CI:0.790, 0.924)和灵敏度(0.644)、特异度(0.918);sTM高表达、慢性肾衰竭病史是脓毒症相关急性肾损伤的危险因素;②入组46例脓毒症患者,AKI组与非AKI组比较,PCT、sTM、Cys C、uNGAL差异有统计学意义;PCT、sTM、Cys C、uNGAL对脓毒症急性肾损伤具有良好的预测作用,其中sTM灵敏度(>0.999)最高,uNGAL特异度(0.800)最高;sTM高表达是脓毒症相关急性肾损伤的危险因素
传统观点认为肾脏血流量减少和缺血-再灌注损伤是脓毒症相关急性肾损伤的主要病理生理机制,但很多学者发现肾小球滤过率降低与肾血流量减少无明显相关性[7-8]。近年来更多研究证实脓毒症相关急性肾损伤可以在没有明显低灌注时发生:一项G-菌诱导脓毒症动物研究中,发现外周血管阻力降低,心输出量增加,肾血流量明显增加,但是肾脏肌酐清除率下降,血清肌酐明显升高[9];另一项研究中,给予G-所致脓毒症动物充分液体复苏及抗感染治疗后,发现肾血管收缩,肾血流量降低至正常水平,肌酐清除率升高[10]。因此肾脏微循环在肾损伤发展过程中发挥重要作用。
脓毒症时,病原相关分子模式(pathogen-associated molecular patterns,PAMPs)、危险信号分子模式(danger-associated molecular patterns,DAMPs)及炎症因子直接损伤血管内皮细胞,释放组织因子,启动凝血过程,大量微血栓形成,导致微循环功能障碍;PAMPs、DAMPs也可直接作用于肾小管上皮细胞上的模式识别受体(pattern recognition receptor,PRR),产生级联放大的炎症反应,直接损伤肾小管。微循环障碍也可以放大局部危险信号,加重肾小管上皮细胞、血管内皮细胞损伤及线粒体功能障碍等[11-12]。因此,内皮细胞损伤既是微循环功能障碍的原因也是结果。
内皮细胞对维持促凝血-抗凝平衡起关键性作用。血栓调节蛋白(TM)是普遍存在于细胞膜表面的跨膜糖蛋白,是内皮细胞膜上的特异性凝血酶受体。内皮细胞受损时,凝血酶离开损伤部位与正常血管内皮细胞上的TM结合,激活蛋白质C而发挥抗凝作用,TM断裂或脱落入血液循环成为可溶性血栓调节蛋白(sTM)。
研究证实sTM高表达预示内皮细胞损伤,与DIC的发生、多器官功能衰竭以及病死率密切相关[13]。一项多中心前瞻性研究发现sTM可作为ICU病房AKI发生的预测因子[14];另一项研究认为sTM和血管生成素-2与急性心肌梗死患者AKI的发生密切相关[15];还有研究认为高水平的sTM降低了AKI患者肾功能恢复的可能性[16]。但是这些研究都没有从内皮细胞损伤、凝血功能障碍方面进行比较分析研究。
在本研究中,AKI组不仅表现为内皮细胞损伤,还表现为凝血抗凝系统的激活和多器官功能障碍的发生。Logistic回归分析的结果提示,与其他炎症指标、凝血功能指标相比,只有sTM高表达是脓毒症相关急性肾损伤的危险因素。这提示在脓毒症中,sTM可能是损伤血管内皮细胞的启动因素[17],继而引起凝血功能紊乱、器官功能障碍。
目前尚无脓毒症患者早期诊断AKI的灵敏、特异的生物学指标,临床上无法有效预测急性肾损伤的发生,显著增加了脓毒症患者的ICU住院时间、住院花费以及病死率。外研究提示Cys C、uNGAL、uNAG、ACR、uRBP等反应肾小管损伤指标可作为AKI的早期生物学标志物[18]。
NGAL是表达于中性粒细胞表面的脂质运载体蛋白,生理状态下肝脏细胞、上皮细胞低表达。脓毒症时,大量中性粒细胞释放NGAL,同时炎症因子大量释放导致肾小管上皮细胞损伤,诱导肾小管上皮细胞NGAL高表达。NGAL可以通过肾小球滤过并在肾小管重吸收,因此血清NGAL(sNGAL)与尿NGAL(uNGAL)具有明显相关性。基于以上特点,近年来uNGAL被广泛应用于早期预测脓毒症相关急性肾损伤的发生。
前瞻性研究结果提示,sTM和uNGAL对脓毒症急性肾损伤诊断准确度较高,其中sTM的灵敏度较高,uNGAL的特异度较高。进一步多因素回顾分析并没有提示脓毒症患者入住ICU时uNGAL水平是脓毒症相关急性肾损伤的独立危险因素。分析原因如下:①血管内皮损伤是脓毒症相关AKI的病理生理基础;②血管内皮损伤导致微循环障碍,微循环障碍加重血管内皮损伤和肾小管损伤,内皮损伤标志物sTM是炎症因子损伤内皮细胞的启动因子,与脓毒症严重程度正相关[17];③动态监测入院后NGAL水平更能反应肾损伤过程。研究发现在不伴有AKI发生的脓毒症患者中,NGAL在早期也升高,可能是由大量活化的中性粒细胞释放,因此患者入住ICU时的NGAL水平可能不足以代表肾小管上皮细胞损伤程度;④样本数量有限。
由于患病率对阳性预测值的影响较大,诊断实验用于高危人群时,阳性预测值可显著升高。在回顾性研究中,AKI组与非AKI组既往慢性肾脏病病史具有统计学意义,研究结果表明慢性肾脏病病史是脓毒症急性肾损伤的独立危险因素,慢性肾脏病患者是脓毒症急性肾损伤的高危人群,sTM对高危人群脓毒症相关急性肾损伤的诊断特异度高、阳性预测值好。因此,对既往有慢性肾脏病的患者,sTM的阳性预测值优于阴性预测值。
利益冲突 所有作者均声明不存在利益冲突
| [1] | Bagshaw SM, Uchino S, Bellomo R, et al. Septic acute kidney injury in critically ill patients: clinical characteristics and outcomes[J]. Clin J Am Soc Nephro, 2007, 2: 431-439. DOI:10.2215/CJN.03681106 |
| [2] | Kolhe NV,Stevens PE,Crowe AV,et al. Case mix,outcome and activity for patients with severe acute kidney injury during the first 24 hours after admission to an adult, general critical care unit: application of predictive models from a secondary analysis of the ICNARC Case Mix Programme database[J].Crit Care.2008,12 Suppl 1:S2.DOI:10.1186/cc7003. |
| [3] | Kellum JA, Lameire N. Diagnosis,evaluation,and management of acute kidney injury:a KDIGO summary (part 1)[J]. .Crit Care, 2013, 17: 204. DOI:10.1186/cc11454 |
| [4] | Singer M, Deutschman CS, Seymour CW, et al. The third international consensus definitions for sepsis and septic shock (Sepsis-3)[J]. JAMA, 2016, 315(8): 801-810. DOI:10.1001/jama.2016.0287 |
| [5] | Deng Y, Chi R, Chen S, et al. Evaluation of clinically available renal biomarkers in critically ill adults:a prospective multicenter observational study[J]. Critical Care, 2017, 21(1): 46. DOI:10.1186/s13054-017-1626-0 |
| [6] | 尚跃丰, 李家瑞, 张继翱, 等. 中性粒细胞明胶酶相关脂质运载蛋白对脓毒症患者发生急性肾损伤的诊断研究[J]. 中华急诊医学杂志, 2017, 26(5): 538-543. DOI:10.3760/cma.j.issn.1671-0282.2017.05.011 |
| [7] | Bonventre JV, Weinberg JM. Recent advances in the pathophysiology of ischemic acute renal failure[J]. Journal of the American Society of Nephrology, 2003, 14(8): 2199-2210. DOI:10.1097/01.ASN.0000079785.13922.F6 |
| [8] | Schrier RW, Wang W. Acute renal failure and sepsis[J]. N Engl J Med., 2004, 351(2): 159-169. DOI:10.1056/NEJMra032401 |
| [9] | Langenberg C, Wan L, Egi M, et al. Renal blood flow in experimental septic acute renal failure[J]. Kidney Int, 2006, 69(11): 1996-2002. DOI:10.1038/sj.ki.5000440 |
| [10] | Langenberg C, Wan L, Egi M, et al. Renal blood flow and function during recovery from experimental septic acute kidney injury[J]. Intensive Care Med, 2007, 33(9): 1614-1618. DOI:10.1007/s00134-007-0734-8 |
| [11] | Umbro I, Gentile G, Tinti F, et al. Recent advances in pathophysiology and biomarkers of sepsis-induced acute kidney injury[J]. .Infect, 2016, 72(2): 131-142. DOI:10.1016/j.jinf.2015.11.008 |
| [12] | DOI K. Role of kidney injury in sepsis[J]. .Intensive Care, 2016, 4: 17. DOI:10.1186/s40560-016-0146-3 |
| [13] | Lin SM, Wang YM, Lin HC, et al. Serum thrombomodulin level relates to the clinical course of disseminated intravascular coagulation,multiorgan dysfunction syndrome,and mortality in patients with sepsis[J]. Crit Care Med, 2008, 36(3): 683-689. DOI:10.1097/CCM.0B013E31816537D8 |
| [14] | Bouchard J, Malhotra R, Shah S, et al. Levels of protein C and soluble thrombomodulin in critically ill patients with acute kidney injury: a multicenter prospective observational study[J]. PLoS One., 2015, 10(3): e0120770. DOI:10.1371/journal.pone.0120770 |
| [15] | Kümpers P, Hafer C, David S, et al. Angiopoietin-2 in patients requiring renal replacement therapy in the ICU: relation to acute kidney injury, multiple organ dysfunction syndrome and outcome[J]. .Intensive Care Med, 2010, 36(3): 462-470. DOI:10.1007/s00134-009-1726- |
| [16] | Itenov TS, Jensen JU, Ostrowski SR, et al. Endothelial damage signals refractory acute kidney injury in critically ill patients[J]. Shock, 2017, 47(6): 696-701. DOI:10.1097/SHK.0000000000000804 |
| [17] | 魏捷, 张东梅, 吕菁君, 等. 脓毒症相关凝血功能障碍的临床研究[J]. 中华急诊医学杂志, 2018, 27(8): 905-911. DOI:10.3760/cma.j.issn.1671-0282.2018.08.01 |
| [18] | Wang K, Xie S, Xiao K, et al. Biomarkers of sepsis-induced acute kidney injury[J].Biomed Res Int. 2018;2018:6937947.DOI:10.1155/2018/6937947. |
 2020, Vol. 29
2020, Vol. 29




