2 湖北医药学院附属东风总医院妇产科 十堰 442000
心脏骤停后综合征(post-cardiac arrest syndrome, PCAS)是心肺复苏后由于缺血-再灌注损伤引起的全身多器官功能障碍,其病理生理学基础是缺血后导致的全身炎性反应[1]。如何抑制PCAS的炎性反应成为治疗的关键。心肺脑复苏后脑功能障碍最难恢复,目前公认的PCAS脑保护的有效治疗仍是亚低温[2],开发有效的神经保护剂应用于PCAS脑保护治疗成为心肺复苏研究的热点。尤瑞克林(urinary kallidinogenase, UK)主要成分为人尿激肽原酶,能选择性扩张脑缺血部位细小动脉,增加缺血脑组织血流量,促进缺血区新生血管生成,减轻炎症反应,其机制与抑制缺血区细胞凋亡有关[3-4]。本研究拟研究尤瑞克林对PCAS后脑炎性因子的影响及可能机制,为UK在PCAS中脑保护的应用提供依据。
1.1 材料与方法 1.1.1 动物与分组所有动物实验遵照1996版《美国实验动物使用指引》 (NIH Publication No:80-23)要求,获得湖北医药学院动物伦理委员会的批准。48只日本大耳白兔由湖北省实验动物研究中心提供,6月龄,雄性,平均体质量(2.29±0.18)kg。随机数字法分为4组:①sham组;②PCAS组;③UK大剂量组(high-dose group, UK-H);④UK小剂量组(low-dose group, UK-L)。
1.1.2 主要设备飞利浦心电监护仪,有创动脉血压压力转换器,小动物呼吸机(瑞沃德生命科技有限公司,11012VMR),24号留置针,新生儿气管插管、导尿管及胃管,净化工作台、离心机。
1.1.3 主要试剂尤瑞克林(0.15PNAU/瓶,广东天普生化医药股份有限公司)、ELISA试剂盒(武汉博士德公司)、定量PCR试剂盒(美国MBI公司),Caspase-9、NF-κB等抗体(美国杰美基因公司)、司可林、速眠新、肾上腺素、苏3号、5%碳酸氢钠、多聚甲醛等。
1.2 方法 1.2.1 模型建立气管夹闭窒息法制备PCAS动物模型[5]:速眠新0.24 mL/kg麻醉后固定,行心电监护,24号留置针穿刺股动脉,飞利浦监护仪监测血压和心率。逆行气管插管,固定气管导管。sham组仅麻醉和插管,PCAS组和尤瑞克林组经耳缘静脉静注司可林(1 mg/kg),夹闭气管导管至心搏骤停。以动脉血压失去波动呈一条直线或平均动脉压 < 18 mmHg作为心脏骤停的判断标准。心搏停止5 min后进行复苏,行人工胸外心脏按压,频率180~220次/min(按压频率采用节拍器控制),同时呼吸机辅助呼吸(频率35次/min,潮气量10 mL/kg,气道压力0~1 cmH2O),静注肾上腺素0.25 mg/kg,1次/3 min;5%碳酸氢钠2 mL/kg,1次/30 min,连续4次;陆醒灵肌注0.24 mL/kg。复苏成功标准:心肺复苏持续10 min,动物恢复自主循环(ROSC)持续10 min以上。注射用尤瑞克林以灭菌生理盐水稀释,复苏成功后大、小剂量立即经耳缘静脉给予17.5×10-3PNAU/kg、3.5×10-3PNAU/kg,1次/d;PCAS组注射同等剂量生理盐水[6]。
1.2.2 炎性因子检测采用酶联免疫吸附试验(ELISA)法检测血清IL-1、IL-6、TNF-α水平。
1.2.3 免疫组织化学检测复苏成功后48 h麻醉处死动物,先用200 mL生理盐水快速冲洗,然后用4℃ 4%多聚甲醛500 mL继续灌注内固定至少1.5 h。每组随机(随机数字法)选5只家兔,断头取脑,包埋成蜡片,免疫组织化学染色后,高倍镜下观察脑组织中IL-1、IL-6阳性细胞数。
1.2.4 Caspase-9、P-Akt、NF-κB表达检测每组剩余5只,迅速剥离颅骨取出脑组织至于冰器皿上,分离出大脑皮层,置于液氮罐冻存。检测前先将脑组织称质量,约100 mg,常规方法提取脑组织蛋白,8%SDS-PAGE电泳后转膜和封闭。分别加入相应一抗4℃孵育过夜,辣根过氧化物酶标记二抗孵育30 min,DAB显色;37℃PBS终止显色、照像。结果用分析软件Image J处理,β-Actin为内参照对比,分析目标条带的光密度值,比值结果表示其蛋白相对含量。
1.3 统计学方法采用SPSS 18.0进行数据分析,所有指标,符合正态性的计量资料均采用单因素方差分析Dunnett-t检验,以均数±标准差表示(Mean±SD),P < 0.05有统计学意义。
2 结果 2.1 基本情况各组家兔基本生理学质量、手术操作时间、48h存活情况见表 1。
| 组别 | 数量 (n, 只) |
体质量 (kg) |
手术操作时间 (min) |
48hROSC存活情况 (只) |
| Sham组 | n=12 | 2.21±0.19 | 15±4 | 12 |
| PCAS组 | n=12 | 2.32±0.22 | 82±12 | 10 |
| UK-L组 | n=12 | 2.29±0.19 | 78±13 | 11 |
| UK-H组 | n=12 | 2.24±0.18 | 81±12 | 10 |
PCAS组、UK-H组、UK-L组血清IL-1、IL-6、TNF-α水平在复苏后48 h较sham组均明显升高(P < 0.05);UK-H组、UK-L组在复苏后48 h与PCAS组比血清IL-1、IL-6、TNF-α升高水平明显减少(P < 0.05);且UK-H组减少更为明显(P < 0.05)(见表 2)。
| 组别 | 数量 | IL-1 | IL-6 | TNF-α |
| Sham组 | n=12 | 0.12±0.04 | 0.09±0.03 | 20.23±2.47 |
| PCAS组 | n=10 | 0.28±0.06a | 0.29±0.07a | 41.58±6.34a |
| UK-L组 | n=11 | 0.22±0.05ab | 0.21±0.06ab | 32.07±5.21ab |
| UK-H组 | n=10 | 0.17±0.04abc | 0.15±0.03abc | 24.03±4.24abc |
| 注:与假手术组比较,aP < 0.05;#与PCAS组比较, bP < 0.05;与UK-L组比较, cP < 0.05 | ||||
与sham组相比,PCAS组、UK-H组、UK-L组,IL-1、IL-6高倍镜下阳性细胞数明显增多(P < 0.05),UK-H组、UK-L组与PCAS组比IL-1、IL-6高倍镜下阳性细胞数显著降低(P < 0.05);且UK-H组与UK-L组比降低更为明显(P < 0.05),见表 3。
| 组别 | 数量 | IL-1阳性 细胞数 |
IL-6阳性 细胞数 |
| (只) | (个/高倍镜) | (个/高倍镜) | |
| Sham组 | n=5 | 3.39±0.31 | 2.35±0.42 |
| PCAS组 | n=5 | 29.06±3.34a | 26.73±4.12a |
| UK-L组 | n=5 | 20.51±2.98ab | 19.25±2.64ab |
| UK-H组 | n=5 | 12.17±2.04abc | 10.89±2.16abc |
| 注:与假手术组比较,aP < 0.05;#与PCAS组比较, bP < 0.05;与UK-L组比较, cP < 0.05 | |||
sham组、PCAS组、UK-H组、UK-L组Caspase-9、P-Akt、NF-κB蛋白表达(见图 1)。引入Actin为内参定量分析显示(见图 2):PCAS组、UK-H组、UK-L组较sham组比,NF-κB、Caspase-9显著增加;UK-H组、UK-L组与PCAS组相比,NF-κB、Caspase-9表达显著降低(P < 0.05),且UK-H组较UK-L组明显(P < 0.05)。与sham组比,P-Akt在PCAS组表达升高;与PCAS组相比,P-Akt在UK-H组、UK-L组表达显著升高(P < 0.05),且UK-H组表达更为明显(P < 0.05)。
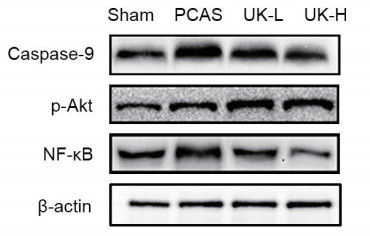
|
| 图 1 各组Caspase-9、P-Akt、NF-κB表达 |
|
|
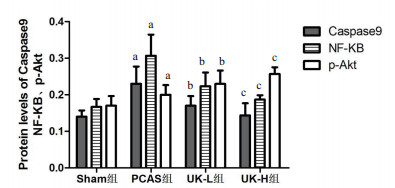
|
| a与假手术组比较, P < 0.05; b与PCAS组比较, P < 0.05; c与UK-L组比较, P < 0.05 图 2 各组Caspase-9、P-Akt、NF-κB表达定量分析 |
|
|
心肺脑复苏过程实质上是全身组织缺血-再灌注的过程,可促进多种炎症介质释放,导致器官功能障碍或衰竭[7],其中脑功能障碍恢复难度最大,严重影响PCAS患者的预后。脑缺血再灌注损伤会引起脑组织局部大量炎性细胞和炎性因子聚集,是造成脑再灌注损伤主要原因之一[8]。炎性反应的标志是白细胞浸润,其中白细胞介素(interleukin,IL) 1、IL-6及肿瘤坏死因子α(tumor necrosis factor -α,TNF-α)是重要的细胞炎性因子[9-10]。
注射用尤瑞克林是一种从人的尿液中提取的人组织型激肽原酶,是激肽释放酶-激肽系统的一个正向调节物质,能分解产生血管缓激肽和血管舒张素,在脑缺血时发挥减少脑梗死体积、改善神经功能损伤等作用[11]。其机制可能与UK抑制氧化应激,减少细胞炎性反应,减少Caspase-3及NF-κB表达等有关[12-13]。
本研究发现,与PCAS组相比,药物干预组血清IL-1、IL-6、TNF-α升高水平明显减少,脑组织IL-1、IL-6含量明显减低,说明尤瑞克林能够抑制CPR后脑损伤炎性反应,推测其对PCAS有脑保护作用。
Caspase-9[14]属于半胱氨酸蛋白酶家族成员,参与启动并执行凋亡程序。缺血性脑损伤时,细胞内外各死亡信号激活Caspase-9引起细胞凋亡[15],神经保护剂可抑制其表达[16]。NF-κB是一种具有多向性转录激活功能的调节因子,其主要是参与免疫、炎症、细胞凋亡等生理和病理过程中的基因表达调控[17]。Akt是分子质量约57 kDa的丝/苏氨酸蛋白激酶,Akt信号转导途径作为引起细胞凋亡的外源性途径之一,通过磷酸化作用激活或抑制其下游靶蛋白Bad、Caspase -9、NF-κB、Mdm-2表达,是重要的抗凋亡调节因子。本研究发现,ROSC48h后UK干预组P-Akt表达明显升高,Caspase-9、NF-κB表达水平明显降低,推测UK可能通过激活Akt途径,抑制Caspase-9、NF-κB表达发挥脑保护作用。本研究同时观测到,与UK-L组比,UK-H组ROSC后48 h各检测指标便化更为显著,推测UK对PCAS后脑保护作用存在剂量依赖性。
利益冲突 所有作者均声明不存在利益冲突
| [1] | Nitta M, Kitamura T, Iwami T, et al. Out-of-hospital cardiac arrest due to drowning among children and adults from the Utstein Osaka Project[J]. Resuscitation, 2013, 84(11): 1568-1573. DOI:10.1016/j.resuscitation.2013.06.017 |
| [2] | Yenari MA, Han HS. Neuroprotective mechanisms of hypothermia in brain ischaemia[J]. Nat Rev Neurosci, 2012, 13(4): 267-278. DOI:10.1038/nrn3174 |
| [3] | Chao JL, Bledsoe G, Chao L. Tissue kallikrein-kinin therapy in hypertension and organ damage[M]. //Recent Developments in the Regulation of Kinins. Cham: Springer International Publishing,, 2014: 37-57. |
| [4] | Su JJ, Tang YP, Zhou HG, et al. Tissue kallikrein protects neurons from hypoxia/reoxygenation-induced cell injury through Homer1b/C[J]. Cell Signal, 2012, 24(11): 2205-2215. DOI:10.1016/j.cellsig.2012.04.021 |
| [5] | 杨敬宁, 肖敏, 王学军, 等. 蛋白酶激活受体-1拮抗剂降低心脏骤停后综合征兔血清炎性细胞因子的水平[J]. 中国急救医学, 2014(10): 935-937. |
| [6] | 李昌盛, 闵喆, 湛彦强, 等. 利用激光散斑成像技术观察尤瑞克林对脑梗死大鼠脑血流的影响[J]. 中华神经科杂志, 2010, 43(10): 732-736. |
| [7] | Mani R, Schmitt SE, Mazer M, et al. The frequency and timing of epileptiform activity on continuous electroencephalogram in comatose post-cardiac arrest syndrome patients treated with therapeutic hypothermia[J]. Resuscitation, 2012, 83(7): 840-847. DOI:10.1016/j.resuscitation.2012.02.015 |
| [8] | 林庆明, 唐夏泓, 林世荣, 等. 坏死性凋亡在干细胞移植改善心搏骤停后神经功能的作用[J]. 中华急诊医学杂志, 2018, 27(1): 39-43. DOI:10.3760/cma.j.issn.1671-0282.2018.01.008 |
| [9] | Ma Y. Dose-related effects of dexmedetomidine on immunomodulation and mortality to septic shock in rats[J]. World J Emerg Med, 2018, 9(1): 56. DOI:10.5847/wjem.j.1920-8642.2018.01.009 |
| [10] | Montero-Julian FA, Klein B, Gautherot E, et al. Pharmacokinetic study of anti-interleukin-6 (IL-6) therapy with monoclonal antibodies: enhancement of IL-6 clearance by cocktails of anti-IL-6 antibodies[J]. Blood, 1995, 85(4): 917-24. DOI:10.1182/blood.V85.4.917.bloodjournal854917 |
| [11] | Chao JL, Chao L. Kallikrein-kinin in stroke, cardiovascular and renal disease[J]. Exp Physiol, 2005, 90(3): 291-298. DOI:10.1113/expphysiol.2004.028464 |
| [12] | Wang Z, Han X, Cui M, et al. Tissue kallikrein protects rat hippocampal CA1 neurons against cerebral ischemia/reperfusion-induced injury through the B2R-Raf-MEK1/2-ERK1/2 pathway[J]. J Neurosci Res, 2014, 92(5): 651-657. DOI:10.1002/jnr.23325 |
| [13] | Liu YP, Lu ZY, Cui M, et al. Tissue kallikrein protects SH-SY5Y neuronal cells against oxygen and glucose deprivation-induced injury through bradykinin B2 receptor-dependent regulation of autophagy induction[J]. J Neurochem, 2016, 139(2): 208-220. DOI:10.1111/jnc.13690 |
| [14] | Golovatscka V, Ennes H, Mayer EA, et al. Chronic stress-induced changes in pro-inflammatory cytokines and spinal Glia markers in the rat: A time course study[J]. Neuroimmunomodulation, 2012, 19(6): 367-376. DOI:10.1159/000342092 |
| [15] | Caldeira MV, Salazar IL, Curcio M, et al. Role of the ubiquitin–proteasome system in brain ischemia: Friend or foe?[J]. Progress Neurobiology, 2014, 112: 50-69. DOI:10.1016/j.pneurobio.2013.10.003 |
| [16] | Liu YP, Cui M, Lu ZY, et al. Tissue kallikrein promotes survival and β-catenin degradation in SH-SY5Y cells under nutrient stress conditions via autophagy[J]. Mol Med Rep, 2016, 13(2): 1389-1394. DOI:10.3892/mmr.2015.4664 |
| [17] | Li WL, Yu SP, Chen D, et al. The regulatory role of NF-κB in autophagy-like cell death after focal cerebral ischemia in mice[J]. Neuroscience, 2013, 244: 16-30. DOI:10.1016/j.neuroscience.2013.03.045 |
 2020, Vol. 29
2020, Vol. 29




