2 镇江市第一人民医院, 镇江 212001
2 Zhenjiang First People's Hospital, Zhenjiang 212001, China
性别是动脉粥样硬化性心血管疾病的独立危险因素,研究显示血浆睾酮水平下降会增加男性主动脉硬化的程度,增加心血管疾病的风险[1-4];且睾酮参与调控血管的生成与损伤后修复过程[5-6]。内皮祖细胞(endothelial progenitor cells, EPCs)不仅在胚胎期参与血管发生,还可在成体从骨髓动员入外周血,促进新生血管生成、修复损伤血管。因此,雄激素对心血管系统的保护作用可能在很大程度上与其改善EPCs功能相关。但其具体机制尚不清楚。本研究初步探讨了双氢睾酮(DHT)对人外周血内皮祖细胞(PB-EPCs)增殖、迁移功能的影响及RhoA/ROCK信号通路在其中的作用。以期揭示雄激素上调EPCs生物学功能的可能机制。
1 材料和方法 1.1 主要材料及试剂人淋巴细胞分离液购自天津灏洋公司;EGM-2MV培养液购自美国LONZA公司;人纤维连接蛋白(human fibronectin, HFN)购自Chemicon公司;PBS缓冲液、胎牛血清(fetal bovine serum,FBS)及1:250胰蛋白酶购自上海生物工程技术有限公司;乙酰化低密度脂蛋白(DiI-ac-LDL)购自Invitrogen公司;双氢睾酮购自美国sigma公司;VEGF的ELISA试剂盒购自美国R & D systems公司;RhoA抑制剂C3 exoenzyme购自美国Alexis公司;ROCK抑制剂Y-27632购自美国Calbiochem公司;全自动酶标扫描仪为美国BioTek公司产品。
1.2 EPCs的分离、培养与鉴定收集健康成人空腹外周静脉血20 mL,EDTA抗凝。密度梯度离心法分离出外周血单个核细胞(mononuclear cells,MNCs),EGM-2MV稀释后接种于HFN包埋的培养板。37℃、5%CO2、湿度95%条件下培养4 d后更换培养液,此后隔天更换培养液1次。倒置相差显微镜下动态观察细胞形态学变化。培养至第7天收集贴壁细胞,加入2.4 mg/L的DiL-ac-LDL, 37℃孵育;2%多聚甲醛固定,PBS浸洗3次后吹干,经多波长激光共聚焦显微镜鉴定,FITC-UEA-I和DiI-ac-LDL双染色阳性细胞为正在分化的早期EPCs。将上述早期EPCs经过无血清细胞培养液同步化24 h进行下一步实验。
1.3 DHT对EPCs增殖、迁移能力评价收集贴壁细胞,随机(随机数字法)分对照组、DHT不同浓度处理组(1、10、100 nmol/L),干预24 h;检测各组EPCs的增殖、迁移能力变化,根据EPCs增殖、迁移情况选择最佳DHT作用浓度。以最佳作用浓度的DHT干预EPCs,检测0、6、12、24、36、48 h各时间点细胞增值、迁移能力变化,得出最佳作用时间。
MTT法检测EPCs增殖能力:将同步化后的EPCs用0.25%胰酶消化,接种到包被有HFN的96孔板,接种密度为1×103/孔。加入MTT 10μL/孔(5 mg/mL)。37℃ 5% C02条件下培养4 h;置酶标仪于波长490 nm处测OD值。
采用Transwell小室检测EPCs迁移能力:将稀释后的细胞悬液接种于Transwell小室的上室(100μl/孔),每组常规设三个复孔,下室中加入100μl细胞培养液,37℃、5% CO2条件下孵育24 h;取出中间层纤维膜,刮去上层未移动细胞,苏木精染色30 min,双蒸水冲洗3次,晾干,加盖波片倒置显微镜下观察并计数迁移到Transwell小室下层的细胞数(×100倍下,计数8个随机视野)。
1.4 EPCs上清液液中VEGF的表达水平细胞培养至第7天,消化收集贴壁细胞,将上述各组细胞用无血清、不含VEGF的培养液于37℃ 5% CO2培养箱内孵育,48 h后收集细胞培养上清液。1 000 r/min离心10 min去除颗粒及聚合物,严格按照ELISA试剂盒操作步骤实施检测。酶标仪上450 nm波长测定吸光度值。
1.5 RhoA/ROCK信号通路的作用根据1.3实验结果,使用最佳作用浓度及时间的DHT和RhoA/ROCK信号通路抑制剂共同干预EPCs。EPCs在无血清培养液中同步化24 h后加入C3 exoenzyme (30 ng/mL)或Y-27632(10 µmol/L)作用30 min后再加入DHT共同作用48 h。按如下干预方案分五组:空白对照组、DHT组、RhoA抑制剂C3 exoenzyme+DHT组、ROCK抑制剂Y-27632+DHT组。同1.3项下方法检测细胞增殖、迁移功能变化。同1.4项下方法检测各组EPCs上清液液中VEGF的表达水平。
1.6 统计学方法采用SPSS 16.0统计学软件。计量资料均数±标准差(Mean±SD)表示,计数资料用百分数表示(%),两组间比较采用配对样本t检验。以P < 0.05为差异有统计学意义。
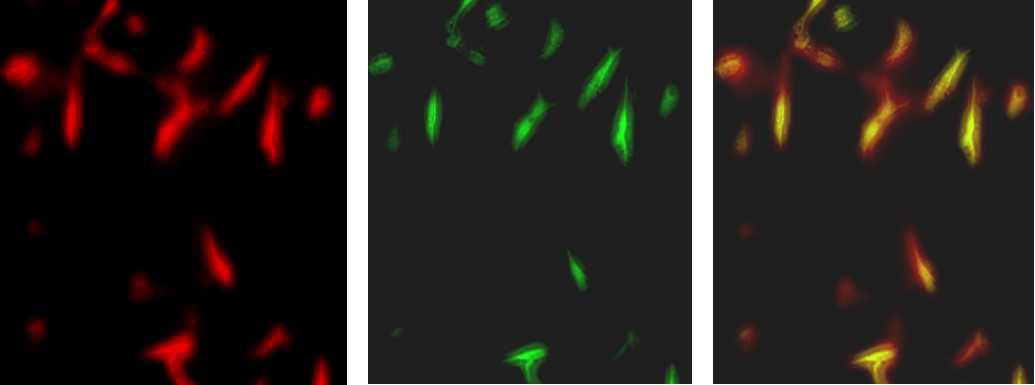
2 结果 2.1 EPCs的鉴定细胞培养至第4天可以观察到椭圆形、短梭形的EPCs细胞集落;第7天可观察到早期EPCs集落,主要特征为圆形细胞周边围绕向外爬行生长的多角形或梭状细胞群。激光共聚焦显微镜下细胞双荧光染色鉴定观察:EPCs吸附Dil-ac-LDL呈红色(图 1A);吸附FITC-UEA-1呈绿色(图 1B);同时吸附FITC-UEA-I和Dil-ac-LDL呈黄色(图 1C),双染阳性率为(86.13±1.59)%。
|
| 图 1 早期内皮祖细胞双荧光染色鉴定结果: A为EPCs吸附Dil-ac-LDL呈红色(×200);B为EPCs吸附FITC-UEA-I呈绿色(×200);C为EPCs同时吸附FITC-UEA-I和Dil-ac-LDL呈黄色(×200)。 Fig 1 The results of identification of early endothelial progenitor cells |
|
|
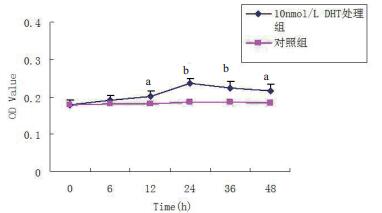
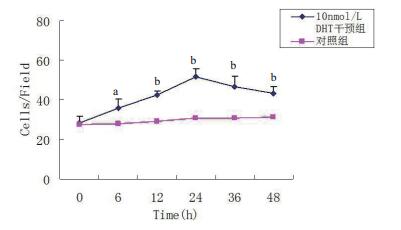
本研究各浓度DHT处理组的EPCs增值、迁移能力均较空白对照组提高,DHT浓度为1 nmol/L时即显示出对EPCs功能的促进作用,最佳作用浓度为10 nmol/L,差异有统计学意义(P < 0.05)。提示睾酮可能在一定范围内(0~10 nmol/L)呈浓度依赖性促进EPCs的增殖、迁移能力。随着浓度的增长,以上能力逐步减弱,但在100 nmol/L时仍高于对照组。此外,随着DHT浓度的增加,VEGF水平亦有相应提高,与对照组比较,差异均有统计学意义(P < 0.05)。在DHT浓度达到100 nmol/L时,VEGF分泌量较10 nmol/L时有轻度下降,差异无统计学意义(P > 0.05),见表 1。DHT对EPCs增值能力的促进作用呈时间依赖性,与对照组相比,在6 h时即升高,但差异无统计学意义(P > 0.05),在12、36、48 h差异有统计学意义(P < 0.05)。在24 h达到最大效果,在24 h之后轻度下降,但仍高于0 h。见图 2-3。
| 组别 | 细胞增殖 490 nmol/L | 细胞迁移 Cells×100 | VEGF分泌量 pg/mL |
| 空白对照组 | 0.16±0.03 | 26.37±2.39 | 82.61±23.64 |
| 1 nmol/L DHT | 0.19±0.04a | 32.61±4.59a | 109.32±29.35a |
| 10 nmol/L DHT | 0.26±0.05a | 46.92±5.46a | 156.80±21.74a |
| 100 nmol/L DHT | 0.24±0.03a | 35.81±9.24a | 141.26±19.63a |
| 注:与对照组相比, aP < 0.05 |
|
| 与对照组比较, aP < 0.05;bP < 0.01 图 2 DHT干预不同时间对EPCs增值能力的影响 Fig 2 Effect of DHC on proliferation of EPCs at different time-points. |
|
|
|
| 与对照组比较, aP < 0.05;bP < 0.01 图 3 DHT干预不同时间对EPCs迁徙能力的影响 Fig 3 Effect of DHC on EPCs migration ability at different time-points |
|
|
DHT在10 nmol/L时对外周血EPCs刺激作用最强。以10 nmol/L的DHT分别与RhoA抑制剂C3 exoenzyme和ROCK抑制剂Y-27632共同作用于EPCs。探讨RhoA/ROCK信号通路在DHT调控EPCs功能变化中的作用。结果显示:与单纯10 nmol/L的DHT刺激组相比,C3 exoenzyme[(0.22±0.02) vs (0.26±0.05), t=1.642, P > 0.05]和Y-27632[(0.21±0.04) vs (0.26±0.05), t=1.596, P > 0.05]能够减弱DHT诱导的EPCs增殖,但差异无统计学意义。DHT对EPCs迁移能力的促进作用可被C3 exoenzyme[(35.26±4.27) vs (46.92±5.46), t=2.533, P < 0.05]和Y-27632[(33.61±5.33) vs (46.92±5.46), t=3.014, P < 0.01]抑制。DHT对EPCs分泌VEGF能力的促进作用可被C3 exoenzyme [(116.75±7.42) vs (156.80±21.74), t=2.092, P < 0.05]和Y-27632[(121.73±5.33) vs (156.80 ±21.74), t=3.217, P < 0.01]抑制,见表 2。
| 组别 | 细胞增殖 490 (nmOD) | 细胞迁移 (Cells×100) | VEGF分泌量 (pg/mL) |
| 空白对照组 | 0.16±0.03 | 26.37±2.39 | 82.61±23.64 |
| 10nmol/LDHT | 0.26±0.05a | 46.92±5.46a | 156.80 ±21.74a |
| C3 exoenzyme+DHT | 0.22±0.02a | 35.26±4.27ab | 116.75±7.42ab |
| Y-27632+DHT | 0.21±0.04a | 33.61±5.33b | 121.73±5.33ab |
| 注:与对照组相比,aP < 0.05;与10 nmol/L DHT组相比, bP < 0.05 | |||
内皮损伤及功能障碍贯穿于动脉粥样硬化性疾病发生、发展的全过程,尤其在斑块破裂过程中起重要作用。内皮功能障碍的本质是内皮损伤和修复之间动态平衡的破坏,但成熟的血管内皮再生和修复能力极弱。因此,内皮细胞修复明显需要其他来源细胞的支持。EPCs亦称为成血管细胞(angioblast),是一类能增殖并分化为血管内皮细胞但尚未表达成熟血管内皮细胞表型,也未形成血管的前体细胞。已有大量研究显示,EPCs不仅参与新生血管的形成,同时也在损伤血管的修复中扮演重要角色。EPCs对心血管系统具有保护作用已得到公认[7-10]。我们的前期研究也发现[11-12]:冠心病患者EPCs的数量、迁移和增殖能力下降,当发生急性心肌梗死应急时,外周血早期EPCs的数量可以迅速动员增加,但其分泌功能和晚期EPCs的数量下降,迁移增殖能力不足。因此,如何通过调控内皮祖细胞功能修复损伤血管、改善心肌血供成为研究热点。
研究[13-14]显示:雄激素过高或缺乏均对心血管系统产生不利影响,血浆雄激素水平下降与男性冠心病的发病及预后密切相关。睾酮水平低的慢性心衰男性患者运动康复期间使用睾酮可改善主要健康结局[15]。本研究以不同浓度DHT干预EPCs并检测其增值、迁移功能和分泌VEGF水平变化。结果显示:DHT理组的EPCs增值、迁移能力均较空白对照组提高,DHT浓度为1 nM时即显示出对EPCs功能的促进作用,最佳作用浓度为10 nmol/L,差异均有统计学意义(P < 0.05)。随着浓度的增长,以上能力减弱,但在100 nM时仍高于对照组。提示睾酮可能在一定范围内(0~10 nM)呈浓度依赖性促进EPCs的增殖、迁移能力。提示过高或过低的睾酮浓度对EPCs作用下降。这似乎解释了临床研究中的相似发现。但出现这一现象的具体机制尚不完全明确。
近期有学者研究证实[16]:睾酮通过PI3-K/Akt信号通路促进EPCs的增殖和黏附。本课题组前期研究发现[17]:睾酮通过雄激素受体途径及PI3K/Akt信号通路和SDF-1α/CXCR4轴上调人外周血EPCs的VEGF表达并促进EPCs的增殖、迁移。但PI3-K/Akt抑制剂和CXCR4抑制剂均不能单独完全阻断上述作用。提示雄激素可能同时通过多条途径调控EPCs功能进而对心血管系统产生保护作用。RhoA/ROCK是细胞内信号转导通路的重要成分,参与调节细胞的多种生命过程。并且该通路从多角度调控VEGF介导的血管新生作用[18-19]。杨锦秀等[20]研究发现:RhoA/ROCK信号通路在血管紧张素Ⅱ介导的EPCs成血管作用中起重要作用。本研究发现RhoA抑制剂C3 exoenzyme和ROCK抑制剂Y-27632能够不同程度抑制DHT诱导的EPCs迁移功能,但对增殖影响不大。提示DHT通过RhoA/ROCK信号通路调控EPCs迁移功能。
此外,本研究也发现随着DHT浓度的增加,VEGF水平亦有相应提高,与对照组比较,差异均有统计学意义(P < 0.05)。在DHT浓度达到100 nmol/L时,VEGF分泌量较10nM时有轻度下降,差异无统计学意义(P > 0.05)。C3 exoenzyme和Y-27632能够在不同程度上抑制DHT的上述促进作用。VEGF是一种有丝分裂原,能够特异性地促进内皮细胞的生长和血管新生,增加血管内皮通透性。EPCs通过自分泌或旁分泌方式分泌的VEGF参与EPCs从骨髓动员到外周血的过程,外源性补充VEGF能够上调外周血中的EPCs功能。因此,结合本实验结果,VEGF可能是睾酮调控EPCs功能变化的重要环节。
利益冲突 所有作者均声明不存在利益冲突
| [1] | Srinath R, Hill G S, Carson K A, et al. Endogenous Testosterone and its relationship to preclinical and clinical measures of cardiovascular disease in the Atherosclerosis Risk in Communities (ARIC) Study[J]. J Clin Endocrinol Metab, 2015, 100(4): 1602-8. DOI:10.1210/jc.2014-3934 |
| [2] | Laughlin G A, Barrett-Connor E, Bergstrom J. Low serum testosterone and mortality in older men[J]. Journal of Clinical Endocrinology & Metabolism, 2008, 93(1): 68-75. DOI:10.1210/jc.2007-1792 |
| [3] | Ruige J B, Mahmoud A M, De Bacquer D, et al. Endogenous testosterone and cardiovascular disease in healthy men: a meta-analysis[J]. Heart, 2011, 97(11): 870-875. DOI:10.1136/hrt.2010.210757 |
| [4] | Dockery F, Bulpitt CJ, Agarwal S, et al. Effect of androgen suppression compared with androgen receptor blockade on arterial stiffness in men with prostate cancer[J]. Journal of Andrology, 2009, 30(4): 410-415. DOI:10.2164/jandrol.108.006924 |
| [5] | 李曦哲, 杨君杰, 叶一舟, 等. 雄激素通过上调血管内皮生长因子表达调控内皮祖细胞的功能[J]. 中华实验外科杂志, 2016, 33(2): 432-435. DOI:10.3760/cma.j.issn.1001-9030.2016.02.045 |
| [6] | Jones T H. Testosterone and cardiovascular disease[J]. Lancet Diabetes & Endocrinology, 2016, 5(5): S18-S20. DOI:10.1016/j.jomh.2008.03.010 |
| [7] | Deng Y, Wang J, He G, et al. Mobilization of endothelial progenitor cell in patients with acute ischemic stroke[J]. Neurological Sciences, 2018, 39(3): 437-443. DOI:10.1007/s10072-017-3143-y |
| [8] | 孙克玉, 解梓琛, 王继芹, 等. MiR-132-3p介导FOXO1对内皮祖细胞增殖的调控作用[J]. 中华急诊医学杂志, 2018, 27(6): 652-656. DOI:10.3760/cma.j.issn.1671-0282.2018.06.016 |
| [9] | Sun Z Y, Wang F J, Guo H, et al. Shuxuetong injection protects cerebral microvascular endothelial cells against oxygen-glucose deprivation reperfusion[J]. Neural Regeneration Research, 2019, 14(05): 49-59. DOI:10.1002/stem.2856 |
| [10] | Hayakawa K, Chan S J, Mandeville E T, et al. Protective Effects of Endothelial Progenitor Cell-Derived Extracellular Mitochondria in Brain Endothelium[J]. Stem Cells, 2018, 36(9): 1404-1410. DOI:10.1002/stem.2856 |
| [11] | 任国庆, 汪奕斌, 张浩, 等. 急性心肌梗死患者外周血内皮祖细胞早晚期集落数目和功能的变化[J]. 中国循环杂志, 2010, 25(6): 428-431. DOI:10.3969/j.j.issn.1000-3614.2010.06.008 |
| [12] | 汪奕斌, 任国庆, 张浩, 等. 冠心病患者外周血晚期内皮祖细胞集落数量与功能的变化[J]. 中国动脉硬化杂志, 2010, 18(2): 137-140. |
| [13] | Wehr E, Pilz S, Boehm BO, et al. Low free testosterone is associated with heart failure mortality in older men referred for coronary angiography[J]. Eur J Heart Fail, 2011, 13(5): 482-488. DOI:10.1093/eurjhf/hfr007 |
| [14] | Ikeda Y1, Aihara K, Yoshida S, et al. Matsumoto,Effects of androgens on cardiovascular remodeling[J]. J Endocrinol, 2012, 214(1): 1-10. DOI:10.1530/JOE-12-0126 |
| [15] | Stout M, Tew GA, Doll H, et al. Testosterone therapy during exercise rehabilitation in male patients with chronic heart failure who have low testosterone status: a double-blind randomized controlled feasibility study[J]. American heart journal, 2012, 164(6): 893-901. DOI:10.1016/j.ahj.2012.09.016 |
| [16] | Rui Liu, Li Ding, Ming-Hua Yu, et al. Effects of dihydrotestosterone on adhesion and proliferation via PI3-K/Akt signaling in endothelial progenitor cells[J]. Endocrine, 2014, 46(3): 634-643. DOI:10.1007/s12020-013-0081-1 |
| [17] | 薛亚威, 任国庆, 张浩, 等. 睾酮通过上调血管内皮生长因子表达促进外周血内皮祖细胞的增殖[J]. 中国动脉硬化杂志, 2013, 18(2): 132-142. |
| [18] | Muntasar A E. Effect of angioembolisation versus surgical packing on mortality in traumatic pelvic haemorrhage: A systematic review and meta-analysis[J]. World Journal of Emergency Medicine, 2018, 9(2): 85-92. DOI:10.5847/wjem.j.1920–8642.2018.02.001 |
| [19] | Bryan BA, Dennstedt E, Mitchell DC, et al. RhoA/ROCK signaling is essential for multiple aspects of VEGF-mediated angiogenesis[J]. The FASEB Journal, 2010, 24(9): 3186. DOI:10.1096/fj.09-145102 |
| [20] | Yang JX, Chen B, Pan YY, et al. Zoledronate Attenuates Angiogenic Effects of Angiotensin II-Stimulated Endothelial Progenitor Cells via RhoA and MAPK Signalin g[J]. PloS one, 2012, 7(10). DOI:10.1371/journal.pone.0046511 |
 2020, Vol. 29
2020, Vol. 29




