2 华南理工大学 医学院, 广州 510006
2 Department of Emergency and Critical Care Medicine, Guangdong Provincial People's Hospital Guangdong Medical Academy, Guangzhou 510080, China
新生儿脓毒症不仅严重威胁新生儿的生命[1],还可造成新生儿脑损伤,影响新生儿脑发育,导致患儿远期神经功能障碍,具有较高的致残率和致死率[2-3],且目前尚缺乏行之有效的治疗方法[4]。脑室周边白质内神经炎症反应导致少突胶质前体细胞分化成熟障碍和轴突低髓鞘化是导致远期神经功能障碍的主要原因[5]。神经元和少突胶质细胞参与了脑室周边白质内轴突髓鞘化的过程,其中少突胶质细胞是中枢神经系统中包绕轴突形成髓鞘的重要细胞,少突胶质细胞的异常会导致轴突的低髓鞘化,从而影响神经功能[6]。促进脑室周边白质内少突胶质前体细胞(OPC)的分化和成熟,可能对脓毒症新生儿远期神经功能障碍有一定的治疗作用。褪黑素是由哺乳动物松果体分泌的一类神经内分泌激素,易通过血脑屏障和血胎盘屏障,具有较高的中枢神经系统亲和性[7]。褪黑素在调节生物节律、延缓衰老、改善睡眠障碍方面已有明确的作用,但近年来,其抗炎、抗氧化、调节线粒体功能以及神经系统保护作用越来越受到重视[8-9]。本研究中我们通过观察褪黑素对脓毒症幼鼠胼胝体内神经炎症反应和少突胶质细胞分化成熟相关转录因子olig1、olig2表达的影响,探究其是否能通过抑制神经炎症反应和促使少突胶质细胞分化成熟的途径,改善脓毒症幼鼠脑胼胝体内轴突低髓鞘化过程,以期为褪黑素治疗新生儿脓毒症后期神经功能障碍提供科学的理论依据。
1 材料与方法 1.1 动物研究所需的SD大鼠(P1天)由南方医科大学实验动物中心提供。动物随机(随机数字法)分为对照组、脓毒症模型组和褪黑素治疗组(每组动物10只)。对照组动物以1 mg/kg剂量腹腔注射0.01 mol/L磷酸盐缓冲液(PBS), 脓毒症组模型动物按1 mg/kg剂量腹腔注射LPS,脓毒症+褪黑素干预组动物先以1 mg/kg剂量腹腔注射LPS,0.5 h后以10 mg/kg剂量腹腔注射褪黑素,之后1次/d注射,持续至出生后第7天。动物注射后放回母鼠身边喂养,选取给药后6 h、1、3、7、14、28 d个时间点动物用于实验。
1.2 主要试剂褪黑素(4', 6-diamidino-2-phenylindole,M5250)、LPS(lipopolysaccharide,L4391)购自美国Sigma公司,褪黑素受体抑制剂Luzindole(ab145232)购自abcam公司。一抗抗体:白介素-6(IL-6,ab9324)、olig1(ab124908)、olig2(ab109186)、MAG(ab89780)购自abcam公司。二抗抗体;anti-rabbit IgG (7074S)和anti-mouse IgG(7076S)购自美国Cell Signaling Technology公司。细胞培养所需基础培养基购自美国Gibco公司,胎牛血清(Sh30406.05)购自美国Hyclone公司。
1.3 实验方法 1.3.1 BV2细胞培养及干预方法BV-2小胶质细胞株的培养:BV-2小胶质细胞由新加坡国立大学医学院解剖系实验室提供,BV-2细胞培养在含10%胎牛血清(FBS)的DMEM培养基,置于37℃,CO2饱和度5%,空气含量95%的培养箱中培养,2 d更换一次培养基,3 d进行一次传代,选取对数生长期状态优良的细胞用于实验干预。BV-2细胞的干预方法:分为五组:①Control组,②LPS组,加入1 μg/mL LPS干预,③LPS+褪黑素组,先加入100μmol/L褪黑素,1 h后换液加1 μg/mL LPS干预,④LPS+褪黑素+MT1抑制剂组,先加入褪黑素受体抑制剂luzindole 10 μmol/L,干预半h后换液加入褪黑素100 μmol/L,干预1 h后再次换液,加入1 μg/mL LPS干预,⑤MT1抑制剂组,加褪黑素受体抑制剂luzindole 10 μmol/L,⑥褪黑素组,加入100 μmol/L褪黑素。②③④组加入LPS后干预6 h,⑤组干预0.5 h,⑥组干预1 h。并收集①②③组的BV-2细胞培养基上清液用于下一步实验。
1.3.2 原代OPC细胞培养及干预方法原代OPCs培养:新生SD大鼠P1d进行原代细胞培养。实验开始前用多聚赖氨酸(PLL,0.1 mg/mL)包被培养瓶。新生鼠先用酒精消毒后,取脑,分离出皮层,剔除脑膜,将皮层组织剪碎成1 mm2大小的组织块,用0.125%胰蛋白酶于37℃水浴消化10 min,用FBS终止消化。将细胞悬液轻柔吹打,静置5 min后用200目滤网过滤。滤过的细胞悬液以1 000 r/min离心5 min,弃去上清液液,将细胞重悬于含10%胎牛血清的DMEM/F12培养基中,种植于预先用PLL包被的培养瓶中。24 h后,换全液,之后每隔一天换液,培养7~8 d。第8~9天,用两次恒温摇床振荡法分离纯化OPC细胞,具体步骤如下:置培养瓶于37℃摇床中摇1 h,转速180 r/min,先去除混合胶质细胞表面贴壁力较差的小胶质细胞。1 h后重新换液,重新置培养瓶于37℃摇床中,调整转速为250 r/min,摇16~18 h得到纯化的OPC细胞。分离纯化后的OPC细胞分别用收集的①②③组BV-2细胞条件培养基干预48 h。
1.3.3 免疫蛋白印迹(Western blot)用蛋白提取试剂盒提取各组大鼠胼胝体组织、BV2细胞以及原代OPC细胞的总蛋白。BCA法测各组蛋白浓度。用10%分离胶,在200 mA恒定电流下转膜150 min。5%牛奶室温封闭1 h,孵育对应一抗于4度过夜(一抗稀释浓度1:1 000)。二抗室温孵育1 h或4度孵育2 h(二抗稀释浓度1:3 000)。用ECL化学发光液显影。使用Image J程序定量Western blot条带。
1.3.4 组织及细胞免疫荧光及图像分析组织免疫荧光:各时间点动物灌流固定后取脑组织,用冰冻切片机切片。冰冻切片标本,在PBS中漂洗3次,10 min/次后,用10%驴血清于室温封闭1 h,孵育相应一抗(Olig2、MAG及IL-6,稀释浓度1:200)过夜。第二天,用相应二抗:488驴抗兔IgG(H+L)、488驴抗鼠IgG(H+L)、594驴抗鼠IgG(H+L)以及lectin(二抗,小胶质细胞特异性抗原),稀释浓度1:200,于室温孵育1 h。DAPI染核及封片后拍照观察。阳性细胞计数方法:选取每组至少3只动物冰冻切片标本,每个标本选取胼胝体部位5个不同视野观察,在40倍镜下拍照,使用Image J程序进行阳性细胞计数,计数结果用于统计学分析。
细胞免疫荧光:BV2细胞爬片各组干预结束后,吸取培养基,在PBS中漂洗3次后,用4%多聚甲醛固定15 min后,用10%驴血清于室温封闭1 h,孵育IL-6抗体(稀释浓度1:200)过夜,第2天,用相应二抗594驴抗鼠IgG(H+L),稀释浓度1:200,于室温孵育1 h。DAPI染核及封片后拍照观察。
1.4 统计学方法应用SPSS 20.0统计软件对数据进行分析处理,使用Graphpad Priam 7.0做图,计量资料以均数±标准差(Mean±SD)表示。实验涉及的数据均采用方差分析(双因素及单因素方差分析),如果数据方差齐,则通过LSD-t多重比较,否则Dunnett-T3方法分析。以P < 0.05为差异有统计学意义。
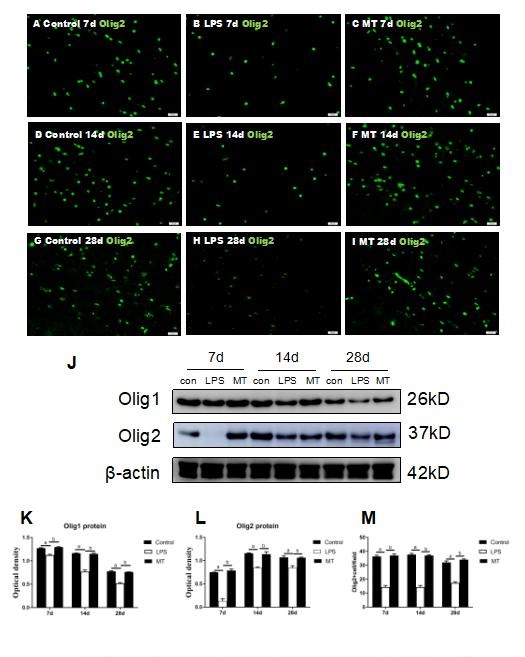
2 结果 2.1 胼胝体内Olig1、Olig2的表达Western blot显示,与对照组相比,脓毒症模型组在7、14、28 d的胼胝体内Olig1、Olig2蛋白表达明显减少且差异有统计学意义(P < 0.05),而褪黑素治疗组与脓毒症模型组相比,Olig1、Olig2蛋白表达明显升高且差异有统计学意义(P < 0.05)。对照组与褪黑素治疗组则差异无统计学意义(P > 0.05)(见图 1 J-L )。用免疫荧光染色上述三组动物脑组织冰冻切片观察胼胝体内Olig2蛋白表达,发现脓毒症模型组在7、14、28 d的胼胝体内Olig2阳性细胞数较对照组减少,而褪黑素治疗组Olig2阳性细胞数较较脓毒症模型组增多(见图 1 A-I, M)。这表明:褪黑素治疗可增加脓毒症幼鼠胼胝体内促少突胶质细胞分化因子Olig1、Olig2的表达。(Olig1/Olig2, two-way ANOVA, 两两比较:7 d control vs 7 d LPS, P=0.038/P < 0.001, 7 d LPS vs 7 d MT, P < 0.001/P < 0.001, 7 d control vs 7 d MT, P=0.0982/P=0.3708, 14 d control vs 14 d LPS, P < 0.001/, P < 0.001, 14 d LPS vs 14 d MT. P < 0.001/, P < 0.001, 14 d control vs 14 d MT, P=0.3594/P=0.7547, 28 d control vs 28 d LPS, P < 0.001/, P < 0.001, 28 d LPS vs 28 d MT, P < 0.001/P < 0.001, 28 d control vs 28 d MT, P=0.4963/P=0.9602)。
|
| 与健康对照组相比,aP < 0.05,与模型组相比,bP < 0.05,n=5 图 1 褪黑素对脓毒症幼鼠胼胝体内Olig1、Olig2的表达影响 Fig 1 The effect of melatonin on the expression level of 0lig1、0lig2 in corpus callosum of septic neonatal rats. |
|
|
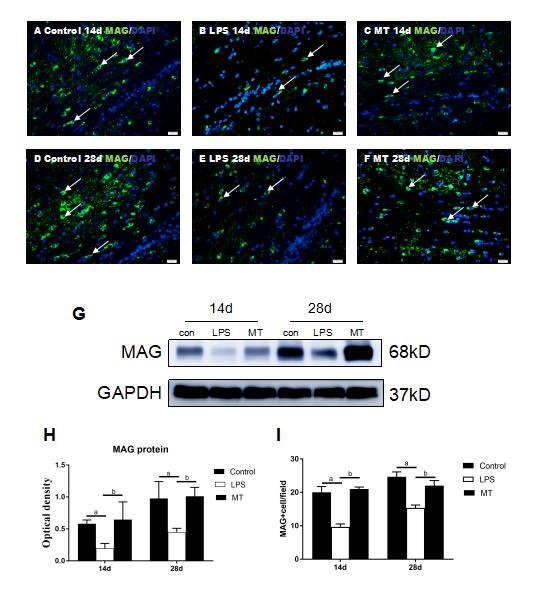
免疫荧光染色三组实验动物14d、28d脑组织冰冻切片,观察胼胝体部位,显示:脓毒症模型组与对照组相比,MAG阳性细胞数量减少且差异有统计学意义(P < 0.05),而褪黑素组与脓毒症模型组对比,MAG阳性细胞数量升高且差异有统计学意义(P < 0.05), 对照组与褪黑素组对比差异无统计学意义(P > 0.05)(见图 2 A-F, I)。蛋白印迹显示脓毒症模型组14、28 d胼胝体内MAG蛋白表达较对照组减少,而褪黑素治疗组MAG表达较脓毒症模型组升高,差异均有统计学意义(P < 0.05)(见图G, H)。这表明:褪黑素治疗可增加脓毒症幼鼠后期胼胝体内髓鞘相关糖蛋白MAG的表达。(two-way ANOVA, interaction, F=0.2752, P=0.7641, row factor, F=17024, P=0.0013, Column factor, F=15.56, P=0.0005;两两比较:14 d control vs 14 d LPS, P=0.0448, 14 d LPS vs 14 d MT, P=0.0199, 14 d control vs 14 d MT, P=0.8932, 28 d control vs 28 d LPS, P=0.0075, 28 d LPS vs 28 d MT, P=0.0049, 28 d control vs 28 d MT, P=0.9695)。
|
| 与健康对照组相比,aP < 0.05,与模型组相比,bP < 0.05,n=5 图 2 褪黑素对脓毒症幼鼠胼胝体内MG表达的影响 Fig 2 The effect of melatonin on the expression level of MLG in corpus callosum of septic neonatal rats |
|
|
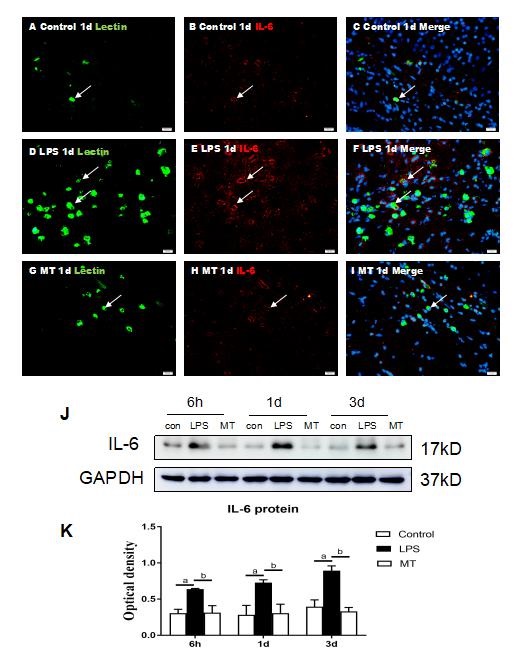
Western blot检测胼胝体内炎症因子IL-6蛋白表达发现:腹腔注射LPS 6 h、1 d、3 d后SD幼鼠胼胝体内IL-6蛋白表达与对照组相比明显升高且差异有统计学意义(P < 0.05),而褪黑素治疗组与脓毒症模型组相比,IL-6蛋白表达明显降低且差异有统计学意义(P < 0.05),对照组与褪黑素治疗组则差异无统计学意义(P > 0.05)(见图 3 J, K)。免疫荧光中,lectin是小胶质细胞特异性抗原的标记物,本实验使用lectin与IL-6双荧光染色,定位胼胝体内分泌IL-6的主要细胞。结果显示:IL-6可与lectin共定位表达,且在褪黑素治疗组中,lectin+/IL-6+的细胞数明显比脓毒症模型数少(见图 3 A-I)。这表明:褪黑素治疗可减少脓毒症幼鼠胼胝体内初期促炎因子的表达,改善炎症反应,胼胝体内小胶质细胞是分泌炎症因子的主要细胞,褪黑素可减少小胶质细胞的激活。(two-way ANOVA, interaction, F=0.5672, P=0.6896, row factor, F=1.805, P=0.1929, Column factor, F=26.83, P < 0.001;两两比较:6 h control vs 6 h LPS, P=0.0281, 6 h LPS vs 6 h MT, P=0.0326, 6 h control vs 6 h MT, P=0.9971, 1 d control vs 1 d LPS, P=0.0038, 1 d LPS vs 1 d MT, P=0.0057, 1 d control vs 1 d MT, P=0.9801, 3 d control vs 3 d LPS, P=0.0014, 3 d LPS vs 3 d MT. P=0.0004, 3 d control vs 3 d MT, P=0.8395)。
|
| 与健康对照组相比,aP < 0.05,与模型组相比,bP < 0.05,n=5 图 3 褪黑素对脓毒症幼鼠胼胝体内炎症因子IL-6表达的影响 Fig 3 The effect of melatonin on the expression level of IL-6 in corpus callosum of septic neonatal rats |
|
|
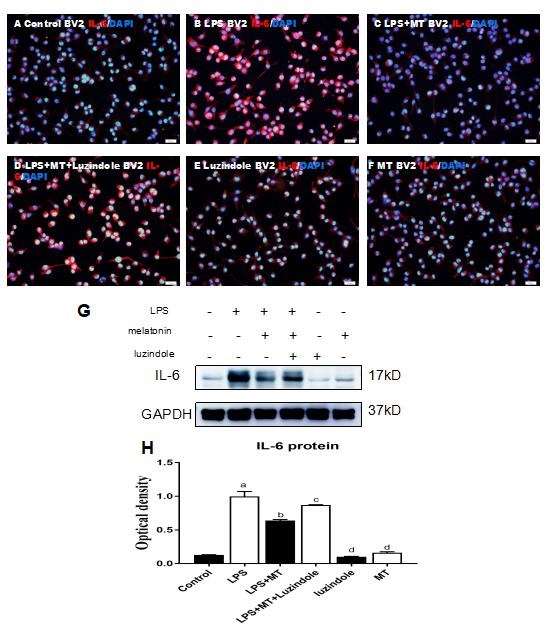
使用LPS干预小胶质细胞细胞株(BV2细胞),通过Western blot检测各组炎症因子IL-6蛋白的表达。与对照组相比,LPS干预BV2细胞6h后,IL-6蛋白表达升高,而褪黑素+LPS干预组,IL-6蛋白表达较LPS干预组下降,给予褪黑素受体抑制剂luzindole后,IL-6蛋白表达较褪黑素+LPS组表达升高,MT1抑制剂组和褪黑素组中IL-6蛋白表达与control组差异无统计学意义(见图 4 G-H)。免疫荧光显示:LPS干预组BV-2细胞IL-6表达增加,经褪黑素干预后IL-6表达下降,此作用可被褪黑素受体抑制剂阻断, 而褪黑素抑制剂组和褪黑素组中IL-6蛋白表达与control组差异无统计学意义(见图 4 A-F)。这表明:褪黑素可降低LPS刺激下BV-2细胞炎症因子的表达,并且这一作用可被褪黑素受体抑制剂所阻断。(方差齐性检验,P > 0.05, F=492.052, P < 0.001,两两比较,control vs LPS,LPS vs LPS+MT, LPS+MT vs LPS+MT+luzindole, P < 0.05,control vs luzindole, control vs MT, P > 0.05)。
|
| 与对照组相比,aP < 0.05;与LPS组相比,bP < 0. 05;与LPS+MT组相比,cP < 0.05, 与对照组相比,dP > 0.05, n=5 图 4 褪黑素对脓毒症幼鼠胼胝体内炎症因子IL-6表达的影响 Fig 4 The effect of melatonin on the expression level of IL-6 in corpus callosum of septic neonatal rats |
|
|
收集对照组、LPS组以及褪黑素+LPS组BV2细胞条件培养基,分别处理原代OPC细胞,干预48 h后,发现:LPS条件培养基干预组Olig1、Olig2以及MAG蛋白表达与对照条件培养基干预组相比减少,褪黑素+LPS条件培养基干预组Olig1、Olig2以及MAG蛋白表达较LPS条件培养基干预组增加,差异均有统计学意义(P < 0.05)(见图 5 A-D)。结合上一步的结果表明:褪黑素可通过降低炎症反应,从而促进OPC细胞的分化成熟过程,并增加炎症条件下髓鞘相关蛋白的表达。(方差齐性检验,P > 0.05, F=27.069/9.449/14.070,P=0.001/0.014/0.005,各组组内两两比较,对照组条件培养基vs LPS组条件培养基,P值均 < 0.05,, LPS组条件培养基vs褪黑素组条件培养基,P值均 < 0.05,对照组条件培养基vs褪黑素组条件培养基,P值均 > 0.05)。
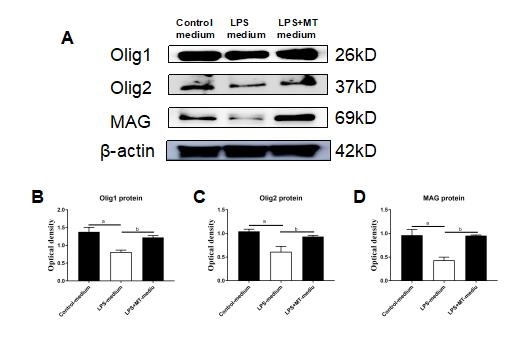
|
| 与对照-medium组相比,aP < 0.05; LPS-medium组相比,bP < 0.05, n=5 图 5 BV2细胞条件培养基对原代0PC细胞分化、成熟的影响 Fig 5 The effect of BV2 conditioned medium on differentiation nd maturation of primary OPC cells |
|
|
少突胶质细胞(OLs)由少突胶质细胞前体细胞(OPCs)分化而来,除了具有对神经元提供营养支持的作用外,最主要的功能是包绕神经纤维的轴突形成髓鞘,与脑白质的完整性和认知功能紧密相关[10]。Olig1、Olig2是Olig编码碱性螺旋-环-螺旋结构(basic-helix-loop-helix, bHLH)转录因子家族的主要成员。据研究表明,小鼠敲除Olig1基因后,发育过程中存在OLs成熟时间延迟;敲除Olig2基因后,小鼠出生即死亡,解剖发现小鼠脊髓中OPCs未发育,同时其后脑中运动神经元缺乏;而共同敲除Olig1和Olig2基因后,小鼠不能存活,并且在脑内任何区域OPCs缺失[10-12]。这些研究证明了Olig1、Olig2在OLs分化成熟过程中起决定性作用, 因此本研究选定Olig1、Olig2作为OLs分化成熟的标记物。少突胶质细胞对多种刺激高度敏感,比如氧化应激、神经毒性以及炎症反应,这些都可能导致少突胶质前体细胞分化成熟障碍,引起轴突低髓鞘化而导致神经系统病变[13-14]。髓鞘相关糖蛋白(MAG)可增强少突胶质细胞存活并促进髓鞘样膜的产生,在CNS中髓鞘发育的起始阶段起到了关键作用[15]。因此MAG可作为髓鞘发育的标记物。新生儿脓毒症易导致脑损伤,患儿出现运动、认知等远期神经功能障碍,可能与脓毒症早期脑内小胶质细胞激活后释放大量炎症介质,导致中枢神经系统的损伤密切相关。小胶质细胞是脑内炎症反应的主要细胞,小胶质细胞的激活增加了促炎因子如TNF-α、IL-1β、IL-6的释放,进一步加剧了体内的炎症反应[16]。本课题研究表明,脓毒症幼鼠在前期出现强烈的炎症反应,表现为LPS腹腔注射后6 h、1 d、3 d胼胝体内炎症因子IL-6表达升高,通过组织免疫荧光共定位发现小胶质细胞可与IL-6荧光共定位,提示脓毒症幼鼠IL-6分泌的增高可能来自激活的小胶质细胞。脓毒症模型幼鼠在发育过程中存在少突胶质细胞分化成熟障碍,表现为少突胶质细胞分化因子Olig1、Olig2表达减少,且脓毒症幼鼠存在髓鞘发育受损,表现为髓鞘相关糖蛋白MAG表达减少。
褪黑素可调节生理节律、抗氧化、抗炎等,特别是褪黑素受体在体内分布广泛,且其易通过血脑屏障,具有较高的神经系统亲和性的特点,为其在神经系统疾病的治疗方面提供了潜在可能性[17-18]。本研究表明,褪黑素干预脓毒症模型幼鼠,在初期可抑制小胶质细胞激活,减少炎症因子IL-6表达,同时,褪黑素干预对脓毒症幼鼠后期髓鞘化的形成存在明显改善作用,表现为促进少突胶质细胞分化成熟的因子Olig1、Olig2表达、髓鞘相关糖蛋白MAG表达较脓毒症模型组升高。
依据组织免疫荧光共定位的结果,本研究采用BV2小胶质细胞进行体外实验,在LPS刺激下,BV2细胞IL-6蛋白表达增加,加入褪黑素可降低LPS诱导的IL-6蛋白表达,但此作用可被褪黑素受体抑制剂所阻断。在用BV2条件培养基干预原代OPC细胞的实验中,经LPS刺激的BV2细胞条件培养基组,OPC细胞Olig1、Olig2、MAG蛋白表达降低,而在经褪黑素干预的BV2细胞条件培养基组,Olig1、Olig2、MAG蛋白表达升高。因此,本研究可推测褪黑素可通过其受体降低炎症反应,抑制小胶质细胞的激活,减少促炎因子表达,同时进一步促进少突胶质细胞分化成熟过程,促进脓毒症幼鼠后期髓鞘化,为褪黑素作为新生儿脓毒症后期神经功能障碍的治疗药物提供了科学依据。
利益冲突 所有作者均声明不存在利益冲突
| [1] | 杨梅, 钱素云. 儿童脓毒症优化抗感染治疗:细节决定成败[J]. 中华急诊医学杂志, 2019, 28(6): 666-669. DOI:10.3760/cma.j.issn.1671-0282.2019.06.002 |
| [2] | Shane AL, Sánchez PJ, Stoll BJ. Neonatal Sepsis[J]. Lancet, 2017, 390(10104): 1770-1780. DOI:10.1016/s0140-6736(17)31002-4 |
| [3] | Barichello T, Sayana P, Giridharan VV, et al. Long-term cognitive outcomes after Sepsis: a translational systematic review[J]. Mol Neurobiol, 2019, 56(1): 186-251. DOI:10.1007/s12035-018-1048-2 |
| [4] | 陈振英, 何小军. 2018中国脓毒症研究发展蓝皮书及未来展望[J]. 中华急诊医学杂志, 2019, 28(10): 1332-1334. DOI:10.3760/cma.j.issn.1671-0282.2019.10.032 |
| [5] | Armstrong RC, Mierzwa AJ, Sullivan GM, et al. Myelin and oligodendrocyte lineage cells in white matter pathology and plasticity after traumatic brain injury[J]. Neuropharmacology, 2016, 110: 654-659. DOI:10.1016/j.neuropharm.2015.04.029 |
| [6] | Dulamea AO. Role of oligodendrocyte dysfunction in demyelination, remyelination and neurodegeneration in multiple sclerosis[M]. Cham: Springer International Publishing, 2017: 91-127. |
| [7] | Tamtaji OR, Mirhosseini N, Reiter RJ, et al. Melatonin, a calpain inhibitor in the central nervous system: Current status and future perspectives[J]. J Cell Physiol, 2019, 234(2): 1001-1007. DOI:10.1002/jcp.27084 |
| [8] | Kaur C, Rathnasamy G, Ling eng-ang. Biology of microglia in the developing brain[J]. J Neuropathol Exp Neurol, 2017, 76(9): 736-753. DOI:10.1093/jnen/nlx056 |
| [9] | Corpas R, Griñán-Ferré C, Palomera-ávalos V, et al. Melatonin induces mechanisms of brain resilience against neurodegeneration[J]. J Pineal Res, 2018, 65(4): e12515. DOI:10.1111/jpi.12515 |
| [10] | Lu Q, Sun T, Zhu ZM, et al. Common developmental requirement for olig function indicates a motor neuron/oligodendrocyte connection[J]. Cell, 2002, 109(1): 75-86. DOI:10.1016/s0092-8674(02)00678-5 |
| [11] | Maire CL, Wegener A, Kerninon C, et al. Gain-of-function of olig transcription factors enhances oligodendrogenesis and myelination[J]. Stem Cells, 2010, 28(9): 1611-1622. DOI:10.1002/stem.480 |
| [12] | 齐琦, 张玉心, 胡建国. Olig基因在少突胶质细胞的发生和中枢神经系统损伤修复中的作用[J]. 中华全科医学, 2016, 14(4): 649-651. DOI:10.16766/j.cnki.issn.1674-4152.2016.04.044 |
| [13] | Peymani M, Ghaedi K, Hashemi MS, et al. Ameliorating the effect of pioglitazone on LPS-induced inflammation of human oligodendrocyte progenitor cells[J]. Cell Mol Neurobiol, 2018, 38(2): 517-527. DOI:10.1007/s10571-017-0500-6 |
| [14] | Lin XJ, Zhao TB, Walker M, et al. Transplantation of pro-oligodendroblasts, preconditioned by LPS-stimulated microglia, promotes recovery after acute contusive spinal cord injury[J]. Cell Transplant, 2016, 25(12): 2111-2128. DOI:10.3727/096368916x692636 |
| [15] | Schachner M, Bartsch U. Multiple functions of the myelin-associated glycoprotein MAG (siglec-4a) in formation and maintenance of myelin[J]. Glia, 2000, 29(2): 154-165. DOI:10.1002/(sici)1098-1136(20000115) |
| [16] | Zrzavy T, Höftberger R, Berger T, et al. Pro-inflammatory activation of microglia in the brain of patients with Sepsis[J]. Neuropathol Appl Neurobiol, 2019, 45(3): 278-290. DOI:10.1111/nan.12502 |
| [17] | Kaur C, Sivakumar V, Yong Z, et al. Blood–retinal barrier disruption and ultrastructural changes in the hypoxic Retina in adult rats: the beneficial effect of melatonin administration[J]. J Pathol, 2007, 212(4): 429-439. DOI:10.1002/path.2195 |
| [18] | Hardeland R, Cardinali DP, Brown GM, et al. Melatonin and brain inflammaging[J]. Prog Neurobiol, 2015, 127/128: 46-63. DOI:10.1016/j.pneurobio.2015.02.001 |
 2020, Vol. 29
2020, Vol. 29




