2 青岛大学附属医院心脏超声科 266555;
3 青岛大学附属医院心脏外科重症监护室 266003;
4 青岛大学附属医院麻醉科 266061
2 Department of Echocardiography, the Affiliated Hospital of Qingdao University, Qingdao 266555, China;
3 Intensive Care Unit of Cardiac Surgery, the Affiliated Hospital of Qingdao University, Qingdao 266003, China;
4 Anesthesiology Department, the Affiliated Hospital of Qingdao University, Qingdao 266061, China
急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)是各种肺内和(或)肺外因素导致的以顽固性低氧血症、呼吸窘迫为临床表现,肺泡毛细血管通透性增加、透明膜形成为病理生理改变的临床综合征[1-2],是重症医学科常见危重症。机械通气是治疗ARDS的有效临床措施[3],尽管临床已广泛应用肺保护性通气策略,但病死率并没有明显下降[4]。随着对呼吸机相关性肺损伤以及ARDS病理生理改变的再认识,右心功能在疾病发生发展中的变化逐渐引起关注。Albert等[5]的研究提出ARDS患者的死因并非顽固性低氧血症,而是循环衰竭。右心室的解剖及生理特征决定其对后负荷非常敏感,呼吸机参数设置不恰当易加重肺动脉高压,造成急性肺源性心脏病乃至右心衰竭[6]。本研究从徐滕宵等[7]的一项关于不同呼气末正压(PEEP)对ARDS患者每搏量变异度的影响的研究得到启示,拟通过构建ARDS动物模型,采用相同的PEEP调整形式,探讨不同PEEP在ARDS机械通气治疗过程中呼吸力学参数/肺顺应性与右心功能/肺循环压力的关系,以期对临床治疗ARDS提供理论依据。
1 材料与方法 1.1 实验材料健康比格犬6只,雌雄皆有,体质量(13.21±3.1)kg,均由青岛大学中心实验室动物实验中心提供[动物合格编号:SCXK(鲁)20170006]。油酸购自美国Sigma公司。本研究动物实验设计和实施过程符合实验动物伦理要求。
1.2 动物准备比格犬称重后,经比格犬左前臂静脉推注丙泊酚3 mg/kg诱导麻醉,成功诱导后置入内径6 mm气管导管,仰卧位固定于试验台,持续丙泊酚3~4 mg/(kg·h)及顺式阿曲库铵0.1 mg/(kg·h)静脉泵入,实验过程中输液速度维持在5 mL/(kg·h)。气管插管接呼吸机(瑞士,HAMILTON·G5)辅助呼吸。予以基础通气:呼吸频率12次/min,控制压力10 cmH2O,吸入氧体积分数为40%,PEEP为2 cmH2O(1 cmH2O =0.098kPa)。
经右侧颈内静脉置入肺动脉漂浮导管(中国爱德华公司,型号131F7),接压力传感器并与多通道监护仪连接;右侧股动脉置管测量MAP。经鼻在导丝引导下插入食道测压管(美国CareFusion公司提供,型号7003500),并将食管测压管另一端接呼吸机。
1.3 实验实施 1.3.1 调整PEEP保持控制压力、呼吸频率、吸入氧体积分数不变,将PEEP逐步调至2、4、6、8、10、12、14 cmH2O,每次调整均保持通气参数固定30 min,待比格犬各项监测指标平稳后,记录在此过程中呼吸力学及血流动力学、右心功能监测指标,结束后恢复基础通气模式1 h,待犬生命体征平稳后制备模型。
1.3.2 制备模型将油酸(0.1 mL/kg)和动脉血等量混合,经中心静脉微量泵持续输注10 min注完,每隔30 min取动脉血行血气分析,当氧合指数(PaO2/FiO2) < 150 mmHg时建模成功。造模成功后用相同方法将PEEP从2 cmH2O逐步上调至14 cmH2O,记录呼吸力学及血流动力学、右心功能监测指标。
1.4 观察指标 1.4.1 呼吸力学参数监测呼吸机屏幕上可直接显示出气道峰压(Ppeak)、平台压(Pplat)、潮气量(Vt)、吸气末食道内压(PES-I)、呼气末食道内压(PES-E)、吸气跨肺压(Ptrans-I)、呼气跨肺压(Ptrans-E)、肺静态顺应性(Cstat)。
1.4.2 有创血流动力学参数监测犬心率(HR)、平均动脉压(MAP)及指脉血氧饱和度(SpO2),肺动脉漂浮导管接压力传感器并与动物实验多通道监护仪连接,可测出中心静脉压(CVP)、平均肺动脉收缩压(MPAP)。
1.4.3 床旁超声采集右心功能指标应用M型超声心动图与心尖四腔界面测量。将取样线置于三尖瓣环侧壁根部,随着心脏规律地收缩和舒张,可得到三尖瓣根部的运动曲线,测量三尖瓣环收缩期位移(TAPSE)。切割图像选择清晰的右心室四腔和两腔切面,软件自动重构右心室内膜容积立体图像,自动处理得到每搏输出量(SV)、右心面积变化分数(FAC)。以上指标均由同一医师记录完成,每一指标均测量3次取平均值。
1.4.4 呼吸力学指标记录不同PEEP水平下机械通气30 min犬呼吸力学指标Ppeak、Pplat、Vt、PES-I、PES-E、Ptrans-I、Ptrans-E、Cstat;右心功能指标TAPSE、SV、FAC;血流动力学指标MAP、HR、SpO2、CVP、MPAP。
1.5 统计学方法采用SPSS 21.0进行数据处理及分析,其中计量资料符合正态分布的以均数±标准差(Mean±SD)表示,应用单因素方差分析;计数资料以频数(百分率)表示,采用卡方检验。造模前后不同PEEP条件下各项指标比较采用方差分析,其中事后比较采用Student-Newman-Keuls检验。造模前后各项指标比较采用自身配对t检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 对呼吸力学的影响 2.1.1 造模前不同PEEP时呼吸力学的变化PEEP递增时,造模前Ppeak、Pplat、PES-I、PES-E增加,Ptrans-I、Ptrans-E、Cstat、Vt变小,差异有统计学意义(P < 0.05)。事后比较检验,指标Ppeak、Pplat、PES-I、PES-E、Ptrans-I、Ptrans-E不同PEEP之间,以及Cstat除在PEEP为4 cmH2O、6 cmH2O之外差异均有统计学意义(P < 0.05),见表 1。
|
| A:为瑞士HAMILTON·G5呼吸机;B:肺动脉漂浮导管位置 图 1 本实验所用呼吸机及心脏超声机 Fig 1 Ventilator and echocardiography used in this experiment |
|
|
| PEEP (cmH2O) |
时点 | Ppeak (cmH2O) |
Pplat (cmH2O) |
Vt (mL/kg) |
PES-I (cmH2O) |
PES-E (cmH2O) |
Ptrans-I (cmH2O) |
Ptrans-E (cmH2O) |
Cstat (mL/cmH2O) |
| 2 | 造模前 | 12.7±0.6 | 11.7±0.6 | 23.3±1.7 | 2.8±0.5 | 0.3±0.2 | 9.9±0.1 | 2.2±0.3 | 19.2±1.1 |
| 造模后 | 15.7±0.6a | 14.7±0.6a | 14.0±2.2a | 4.7±2.2 | 3.0±0.3a | 8.6±0.9 | -0.9±0.2a | 8.4±1.3a | |
| 4 | 造模前 | 14.7±0.6 | 14.0±0.0 | 23.0±3.8 | 4.5±1.3 | 1.5±0.4 | 9.8±1.0 | 2.5±0.4 | 18.1±1.4 |
| 造模后 | 16.7±1.5 | 15.3±1.2 | 19.1±3.8 | 4.9±2.0 | 2.8±0.4a | 10.8±0.7 | 1.2±0.4a | 13.3±1.5a | |
| 6 | 造模前 | 17.0±0.0 | 16.0±0.0 | 21.8±3.7 | 6.9±2.6 | 3.2±1.8 | 9.8±2.8 | 2.8±1.8 | 17.7±1.7 |
| 造模后 | 18.7±1.5 | 17.7±1.5 | 19.8±3.2 | 5.6±2.4 | 4.0±0.6 | 12.7±0.6 | 2.1±0.7 | 14.3±1.6a | |
| 8 | 造模前 | 19.0±0.0 | 18.0±0.0 | 21.1±2.1 | 9.7±0.6 | 5.9±0.7 | 8.9±1.1 | 2.1±0.7 | 16.4±1.4 |
| 造模后 | 20.7±1.5 | 19.7±1.5 | 19.7±1.8 | 10.3±9.9 | 6.5±1.8 | 9.4±8.6 | 1.5±1.8 | 14.2±1.9a | |
| 10 | 造模前 | 20.7±0.6 | 19.7±0.6 | 20.2±1.0 | 18.0±4.7 | 9.5±0.8 | 2.3±5.2 | 0.5±0.8 | 15.6±1.4 |
| 造模后 | 22.3±1.5 | 21.7±1.2 | 19.8±1.0 | 17.0±8.6 | 10.2±1.1 | 4.6±8.1 | 0.3±0.7 | 13.0±1.5a | |
| 12 | 造模前 | 22.7±0.6 | 21.7±0.6 | 18.7±1.6 | 20.3±4.0 | 12.0±0.7 | 2.3±4.5 | 0.03±0.7 | 14.5±1.1 |
| 造模后 | 24.7±1.5 | 23.7±0.6a | 16.8±1.5 | 24.9±1.6 | 12.5±0.5 | 0.5±0.46 | -0.5±0.5 | 11.3±1.3a | |
| 14 | 造模前 | 24.7±0.6 | 24.0±1.0 | 17.2±1.7 | 22.4±3.7 | 14.2±0.8 | 2.0±4.0 | 0.4±0.6 | 13.4±1.2 |
| 造模后 | 26.0±1.0 | 25.3±0.6 | 15.8±1.5 | 26.3±1.0 | 14.6±0.4 | 0.6±0.4 | -0.6±0.4 | 10.3±1.1a | |
| F值 | 造模前 | 232.73 | 196.33 | 2.31 | 22.02 | 105.278 | 4.524 | 6.499 | 64.803 |
| 造模后 | 24.829 | 41.95 | 2.91 | 9.87 | 87.86 | 4.29 | 5.84 | 48.89 | |
| P值 | 造模前 | < 0.01 | < 0.01 | 0.043 | < 0.01 | < 0.01 | 0.009 | 0.002 | < 0.01 |
| 造模后 | < 0.01 | < 0.01 | 0.047 | < 0.01 | < 0.01 | 0.012 | 0.003 | < 0.01 | |
| 注:Ppeak为气道峰压,Pplat为平台压,Vt为潮气量,PES-I为吸气末食道内压,PES-E为呼气末食道内压,Ptrans-I为吸气跨肺压,Ptrans-E为呼气跨肺压,Cstat为肺静态顺应性;与造模前比较,aP < 0.05 | |||||||||
造模前后Ppeak、Pplat、Vt、PES-E、Ptrans-E、Cstat基线水平时(即PEEP =2 cmH2O)差异均有统计学意义,提示ADRS本身对呼吸力学造成的影响。PEEP递增时,造模后的Cstat始终低于造模前,差异有统计学意义(P < 0.05)。造模后在PEEP递增时Ppeak、Pplat、PES-I、PES-E增加,Vt、Ptrans-I、Ptrans-E、Cstat先增大后减小,差异有统计学意义(P < 0.05)。事后比较检验,Cstat除在PEEP为6 cmH2O、8 cmH2O之外差异均有统计学意义(P < 0.05)。其中PEEP =6 cmH2O时Ptrans-E、Cstat均达最大值。PEEP =14 cmH2O时Cstat较基础状态时改善,差异有统计学意义(P < 0.05),见表 1。
2.2 对右心功能的影响 2.2.1 造模前不同PEEP时右心功能指标变化PEEP递增时,造模前FAC总体趋势变小,SV先增大后减小,差异有统计学意义(P < 0.05)。其中PEEP =6 cmH2O时,SV达到最大值,见表 2。
| PEEP (cmH2O) |
时点 | TAPSE(cm) | FAC(%) | SV(mL) |
| 2 | 造模前 | 0.8±0.4 | 49.6±2.1 | 11.9±0.6 |
| 造模后 | 0.5±0.1 | 25.0±1.4a | 4.4±1.0a | |
| 4 | 造模前 | 0.8±0.2 | 42.1±5.8 | 13.1±1.3 |
| 造模后 | 0.4±0.0a | 29.7±0.7a | 6.6±0.4a | |
| 6 | 造模前 | 0.8±0.3 | 42.7±1.8 | 14.3±1.0 |
| 造模后 | 0.5±0.1 | 31.8±1.6a | 6.3±0.4a | |
| 8 | 造模前 | 1.1±0.2 | 45.0±5.3 | 13.4±1.8 |
| 造模后 | 0.6±0.1a | 28.1±7.4a | 6.4±0.6a | |
| 10 | 造模前 | 0.9±0.2 | 43.5±6.9 | 12.0±2.5 |
| 造模后 | 0.5±0.1a | 31.6±2.8a | 6.6±1.4a | |
| 12 | 造模前 | 0.8±0.1 | 38.1±5.9 | 13.9±0.3 |
| 造模后 | 0.6±0.1 | 28.8±1.6 | 5.2±0.6a | |
| 14 | 造模前 | 0.8±0.2 | 33.1±5.8 | 9.1±2.8 |
| 造模后 | 0.4±0.1a | 25.8±1.2 | 5.1±1.1a | |
| F值 | 造模前 | 0.74 | 3.09 | 3.24 |
| 造模后 | 6.22 | 2.03 | 6.54 | |
| P值 | 造模前 | 0.624 3 | 0.038 5 | 0.032 8 |
| 造模后 | 0.002 4 | 0.129 8 | 0.001 9 | |
| 注:TAPSE为三尖瓣环收缩期位移,FAC为右心面积变化分数,SV为每搏输出量;与造模前比较,aP < 0.05 | ||||
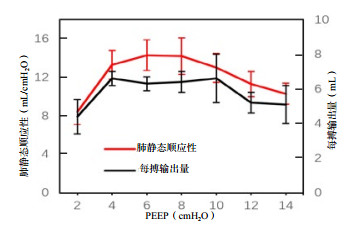
造模前后FAC、SV基线水平时差异均有统计学意义(P < 0.05),提示是ARDS本身造成的影响。PEEP递增时,造模后的SV、TAPSE低于造模前,差异有统计学意义(P < 0.05)。PEEP递增时,造模后TAPSE、SV先增大后减小,差异有统计学意义(P < 0.05)。其中SV分别在PEEP =4 cmH2O及10 cmH2O时最大;TASPE变化反复波动,见表 2。如图 2所示,造模后SV和Cstat随PEEP增加其变化趋势比较,SV和Cstat呈现同向变化关系。
|
| 图 2 造模后不同PEEP时每搏输出量和肺静态顺应性变化比较 Fig 2 Comparison of SV and Cstat at different PEEP after modeling |
|
|
|
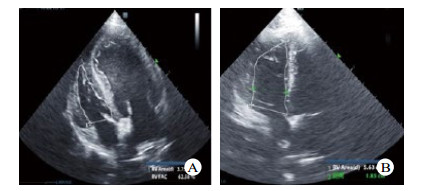
| A、B中细白线勾勒图形为右室切面内腔面积大小比较,与A图比较,B图右心室腔显著扩张 图 3 造模前后犬心脏心尖四腔心超声切面 Fig 3 Comparison of echocardiography before and after modeling |
|
|
|
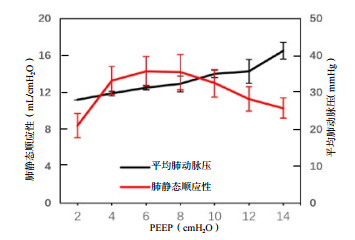
| 图 4 造模后不同PEEP时平均肺动脉压和肺静态顺应性变化 Fig 4 Comparison of MPAP and Cstat at different PEEP after modeling |
|
|
PEEP递增时,造模前MAP、HR及SpO2差异无统计学意义(P > 0.05)。CVP、MPAP变大,差异有统计学意义(P < 0.05),见表 3。
| PEEP(cmH2O) | 时点 | MAP(mmHg) | HR(次/min) | SPO2(%) | CVP(mmHg) | MPAP(mmHg) |
| 2 | 造模前 | 107.7±5.5 | 97.3±2.9 | 98.7±2.3 | 8.7±0.8 | 22.0±2.0 |
| 造模后 | 108.0±2.6 | 97.3±5.1 | 63.3±2.5a | 6.7±0.6a | 28.0±0.0a | |
| 4 | 造模前 | 110.7±5.5 | 94.0±2.0 | 100.0±0.0 | 9.5±0.5 | 23.7±1.5 |
| 造模后 | 114.3±7.6 | 91.7±6.4 | 68.0±4.6a | 6.7±0.6a | 29.7±0.6a | |
| 6 | 造模前 | 103.0±7.0 | 93.7±8.1 | 99.7±0.6 | 10.3±0.8 | 25.7±1.5 |
| 造模后 | 125.3±6.1a | 90.3±2.3 | 70.7±5.0a | 7.7±0.6a | 31.3±0.6 | |
| 8 | 造模前 | 101.7±3.8 | 96.0±3.6 | 99.3±1.2 | 11.0±1.0 | 27.0±1.7 |
| 造模后 | 125.3±4.0a | 87.0±4.0a | 71.3±8.1a | 9.0±1.0 | 32.3±2.1a | |
| 10 | 造模前 | 109.0±3.6 | 96.7±6.7 | 98.7±1.2 | 12.2±1.3 | 28.7±1.5 |
| 造模后 | 124.3±6.1a | 86.0±3.0 | 75.7±6.7a | 9.3±0.6a | 35.0±1.0a | |
| 12 | 造模前 | 111.0±7.0 | 94.3±2.5 | 99.0±1.7 | 13.3±1.3 | 30.3±1.2 |
| 造模后 | 121.0±5.0 | 85.7±15.1 | 77.3±4.2a | 11.3±3.2 | 35.7±3.2 | |
| 14 | 造模前 | 112.3±6.7 | 79.0±12.8 | 98.7±1.5 | 15.2±0.3 | 31.3±1.2 |
| 造模后 | 113.7±4.2 | 85.0±6.2 | 78.0±6.1a | 10.3±0.6a | 41.3±2.3a | |
| F值 | 造模前 | 1.54 | 0.53 | 0.45 | 19.07 | 14.81 |
| 造模后 | 5.02 | 1.13 | 2.77 | 5.23 | 19.24 | |
| P值 | 造模前 | 0.238 | 0.776 | 0.835 | < 0.01 | < 0.01 |
| 造模后 | < 0.01 | 0.394 | 0.045 | 0.005 | < 0.01 | |
| 注:MAP为平均动脉压,HR为呼吸频率,SPO2为指脉血氧饱和度,CVP为中心静脉压,MPAP为平均肺动脉收缩压;与造模前比较,aP < 0.05 | ||||||
造模前后MAP、HR基线水平时差异无统计学意义(P > 0.05),PEEP增加过程中差异无统计学意义(P > 0.05)。造模前后基础状态时SpO2、CVP及MPAP差异均有统计学意义(P < 0.05),是ARDS本身造成的影响。PEEP变化时造模后的SpO2、CVP低于造模前,MPAP高于造模前。PEEP递增时,造模后CVP、MPAP、SpO2变大,MAP先变大后变小,差异有统计学意义(P < 0.05),见表 3。其中MAP在PEEP为14 cmH2O和2 cmH2O时通过事后比较,差异无统计学意义(P > 0.05)。MPAP相对于CVP在PEEP增加过程中增加幅度更为显著。
3 讨论机械通气是改善ARDS患者低氧血症的关键治疗手段。ARDS患者特点表现为正常通气肺泡与塌陷肺泡共存。适当的PEEP可使塌陷的肺泡复张,改善氧合。不适合的PEEP水平易使肺泡过度膨胀和平台压过高,肺泡毛细血管床关闭,肺动脉压升高。如何选择一个合适的PEEP是ARDS患者机械通气治疗的难点。当机械通气时,肺膨胀使肺血管阻力增加,右心室后负荷随之增加。而右心解剖生理特点为腔室结构不规则,收缩压为体循环压力的1/6,所以右心对压力负荷非常敏感。早期右心室的收缩压可代偿性增加,但如果肺循环阻力继续增加将会导致右心室急剧扩张,增加肺动脉高压及右心室后负荷,导致进行性肺心病和右心功能衰竭[9],增加病死率[10-11]。目前大部分ARDS治疗指南未提及右心功能保护问题。从功能上看右心不但要保持足够的肺灌注压使静脉血液得到充分的氧合,而且要保持低压来防止器官淤血[12-13]。故呼吸机参数设置不当,就会对右心功能产生影响,所以右心功能衰竭在中重度ARDS中常见,病死率可达60%[14],并且右心功能不全是ARDS病死率增加的独立危险因素[15]。
本实验观察到ARDS造模后在PEEP递增时,SpO2增加,Vt、Ptrans-E先增大后减小,说明随着PEEP在一定范围内的增加,潮气量和呼气末跨肺压随之增大。跨肺压是真正作用于肺泡的驱动压力,代表呼气末肺泡是膨胀或塌陷的状态[16-17],通常呼气末跨肺压大于0 cmH2O提示肺泡处于开放状态,小于0 cmH2O提示呼气末肺泡处于塌陷状态。潮气量、指脉血氧饱和度及呼气末跨肺压增加意味着呼吸功能正在改善,但PEEP继续增加会导致潮气量和呼气末跨肺压变小,在此过程中,潮气量变化滞后于呼气末跨肺压,可能提示临床,虽然潮气量、氧合看似在“好转”,但是呼气末跨肺压在下降,真正作用于肺泡的应力在减小,塌陷的肺泡并没有随着PEEP的增加而复张。
实验中结果示随着PPEP增加,潮气量增大,肺顺应性增大,但迅速保持在14 mL/cmH2O左右,之后肺的顺应性及呼气末跨肺压并没有继续同步优化。PEEP越高,肺动脉压越升高[18]。而肺动脉压增高,肺血管阻力过大,肺内血流少,另外肺动脉压高致右心室后负荷增大,致室间隔左移,左心室充盈受限,心输出量减小,同步床旁心脏超声证实这一变化,以上变化均导致肺内血流变小,故肺泡通气血流比例没有得到真正的改善。提示除了改善肺泡通气,应重视肺内血流变化。Pelosi和Abreu[19]认为动脉氧合是肺泡通气与血流灌注共同的结果,拥有良好血流灌注的肺泡区域可以阻止氧合的恶化,即便是在塌陷的肺泡区域。Richter等[20]通过观察正电子发射断层成像法测定ARDS鼠2 h后肺内血流分布的实验,发现在肺损伤2 h后损伤区域肺血流减少,实验证明了区域肺血流量对ARDS病理生理学变化的重要性。所以氧合的改善需要通气和血流相结合,并且肺血流分布更重要。本研究结果提示呼气末跨肺压与肺顺应性、潮气量相对有较好的协调关系,跨肺压更加敏感、有效,验证了监测跨肺压的可实施性与可靠性。
PEEP增加时TAPSE变化趋势不定,最终变小,CVP、MPAP变大,SV是先变大后变小,以上数据说明右心功能较早出现变化。SV在一定PEEP范围内增大,是由于肺顺应性增加,肺血管阻力降低;随着PEEP继续增大,肺血管阻力增大,SV变小。吸气早期由于跨肺压增加, 胸腔负压增大,使更多肺静脉血液回流, 左心前负荷、右心后负荷增加[21];以及胸腔压力增加导致左心室后负荷下降, 总效应为心脏射血维持不变或略微增加。高PEEP水平时,呼气末由于右心排血量的减少,使左心前负荷下降, 导致左心排血量随之下降。临床上如果忽略此时的变化,没有及时调整呼吸机参数,急剧扩张的右心室会使室间隔左移,使左心室受到压迫,充盈受限,导致心输出量进一步减低,最终发生循环衰竭[22, 24]。虽然PEEP可以使塌陷的肺泡复张,但由于ARDS肺的不均一性,可能造成整体的肺血管阻力增加[25],Enson等[26]提出氧合指数越高,平均肺动脉压越高,导致心输出量下降,本实验结果也验证这一点。Lansdorp等[27]的关于潮气量和顺应性对ARDS患者机械通气时胸内压影响实验,发现大约三分之二的气道压被转移到了胸膜,余下三分之一则转移到心包和上腔静脉,导致上腔静脉压下降及右心房压不变,以上可以解释在PEEP增加时中心静脉压反应性不如肺动脉压,故监测肺动脉压变化更为重要。本实验选择TAPSE作为右心室收缩功能监测指标,主要是因其重复性好,容易获取,比较少受到其他因素影响,被美国心脏超声协会推荐作为右室收缩功能评估指标之一。但本实验结果TAPSE反应性不理想,一是与犬基础心率快有关,且犬心脏小,为心脏超声测量增加了难度;二是犬的心脏与人的心脏超声有区别,但这不影响其成为临床上监测右心功能指标之一[28-29]。
本实验全程使用床旁心脏超声监测犬心脏结构功能变化,非常确定的是右心室变化可以很大。随着机械通气条件的改变,胸腔内压以及压力阶差也在发生变化[30]。即使心输出量变化不大,瞬时静脉回心血流也会变化非常大,已经证实相同左室充盈压下,由于左右心室相互依赖、心脏体积限制,在吸气时静脉回心血流增加引起右心室舒张末期容积增加将会使左室舒张末期容积更低[31]。ARDS本身就对心功能影响显著,且右心为著,因此更应重视PEEP对右心功能的影响。
虽然临床上肺保护性通气策略已普及,但其未能显著降低患者病死率,部分原因是忽略了循环系统特别是右心功能在其中变化的意义,改善呼吸功能却以牺牲循环功能为代价。调整PEEP使尽可能多的可复张的塌陷肺泡膨胀并监测跨肺压,降低肺动脉压,减少急性肺心病的发生,可提高患者生存率。除了潮气量、氧合指数,同步监测跨肺压及肺顺应性指标更能保证肺复张的有效性,并且两者有良好的协同性,改善通气/血流时,肺内血流更重要;PEEP的增加最先影响右心收缩功能,SV代偿性增大,但PEEP继续增大会导致右心功能障碍及心输出量变小。
机械通气治疗ARDS过程中心肺交互作用极其复杂,且不同病因导致的ARDS机械通气过程中心肺功能变化各不相同,本实验只完成了肺外因素致ARDS的动物试验,需补充肺内因素所致ARDS的动物实验及临床试验研究,从而提出新的右心功能保护标准,建立以右心功能保护为核心的通气目标及呼吸机滴定方法,进一步完善并丰富肺保护性通气策略,降低ARDS的病死率。
利益冲突 所有作者均声明不存在利益冲突
| [1] | 葛均波, 徐永健, 王辰, 等. 内科学[M]. 9版. 北京: 人民卫生出版社, 2018. |
| [2] | Gattinoni L, Marini JJ, Pesenti A, et al. The "baby lung" became an adult[J]. Intensive Care Med, 2016, 42(5): 663-673. DOI:10.1007/s00134-015-4200-8 |
| [3] | 吕向鹏, 丛竹凯, 李丹, 等. α肾上腺素能受体在脓毒症致ARDS中的作用机制[J]. 中华危重病急救医学, 2018, 30(1): 83-87. DOI:10.3760/cma.j.issn.2095-4352.2018.01.016 |
| [4] | Jesús V, Kacmarek RM. What is new in refractory hypoxemia?[J]. Intensive Care Med, 2013, 39(7): 1207-1210. DOI:10.1007/s00134-013-2905-0 |
| [5] | Albert RK, Keniston A, Baboi L, et al. Prone position-induced improvement in gas exchange does not predict improved survival in the acute respiratory distress syndrome[J]. Am J Respir Crit Care Med, 2014, 189(4): 494-496. DOI:10.1164/rccm.201311-2056LE |
| [6] | 江伟, 翁利. 急性呼吸窘迫综合征血流动力学管理:聚焦机械通气[J]. 中华重症医学电子杂志, 2016, 2(4): 287-290. DOI:10.3877/cma.j.issn.2096-1537.2016.04.014 |
| [7] | 徐腾霄, 杨建中, 彭鹏. 急性呼吸窘迫综合征机械通气时不同呼气末正压水平对每搏量变异度的影响[J]. 中华急诊医学杂志, 2016, 25(3): 305-309. DOI:10.3760/cma.j.issn.1671-0282.2016.03.009 |
| [8] | Lazzeri C, Cianchi G, Bonizzoli M, et al. Right ventricle dilation as a prognostic factor in refractory ARDS requiring VV-ECMO[J]. Minerva Anestesiol, 2016, 82(10): 1043-1049. |
| [9] | Gwenaëlle L, Legras A, Agnès C, et al. Prevalence and prognostic value of acute cor pulmonale and patent foramen ovale in ventilated patients with early acute respiratory distress syndrome: a multicenter study[J]. Intensive Care Med, 2013, 39(10): 1734-1742. DOI:10.1007/s00134-013-3017-6 |
| [10] | Legras A, Caille A, Begot E, et al. Acute respiratory distress syndrome (ARDS) associated acute cor pulmonale and patent foramen ovale: A multicenter noninvasive hemodynamic study[J]. Crit Care, 2015, 19(1): 174. DOI:10.1186/s13054-015-0898-5 |
| [11] | Mekontso DA, Repessé X, Boissier F, et al. Acute cor pulmonale during protective ventilation for acute respiratory distress syndrome: Prevalence, predictors, and clinical impact[J]. Intensive Care Med, 2016, 42(5): 862 870. DOI:10.1007/s00134-015-4141-2 |
| [12] | Nobre C, Thomas B. Right ventricle in ARDS[J]. Chest, 2017, 152(1): 215-216. DOI:10.1016/j.chest.2017.04.163 |
| [13] | Repessé X, Charron C, Vieillardbaron A. Right ventricular failure in acute lung injury and acute respiratory distress syndrome[J]. Minerva Anestesiol, 2012, 78(8): 941-948. |
| [14] | Zochios V, Parhar K, Tunnicliffe W, et al. The right ventricle in ARDS[J]. Chest, 2017, 152(1): 181-193. DOI:10.1016/j.chest.2017.02.019 |
| [15] | Repessé X, Antoine VB. Right heart function during acute respiratory distress syndrome[J]. Anna Transl Med, 2017, 5(14): 295-295. DOI:10.21037/atm.2017.06.66 |
| [16] | Nuckton TJ, Alonso JA, Kallet RH, et al. Pulmonary deadspace fraction as a risk factor for death in the acute respiratory distress syndrome[J]. N Engl J Med, 2002, 346(17): 1281-1286. DOI:10.1056/NEJMoa012835 |
| [17] | Mekontso DA, Charron C, Devaquet J, et al. Impact of acute hypercapnia and augmented positive end-expiratory pressure on right ventricle function in severe acute respiratory distress syndrome[J]. Intensive Care Med, 2009, 35(11): 1850-1858. DOI:10.1007/s00134-009-1569-2 |
| [18] | Nunes S, Ruokonen E, Takala J. Pulmonary capillary pressures during the acute respiratory distress syndrome[J]. Intensive Care Med, 2003, 29(12): 2174-2179. DOI:10.1007/s00134-003-2036-0 |
| [19] | Pelosi P, Abreu M. Acute respiratory distress syndrome: we can' t miss regional lung perfusion![J]. BMC Anesthesiol, 2015, 15(1): 35. DOI:10.1186/s12871-015-0014-z |
| [20] | Richter T, Bellani G, Harris RS, et al. Effect of prone position on regional shunt, aeration, and perfusion in experimental acute lung injury[J]. Am J Respir Crit Care Med, 2005, 172(4): 480-487. DOI:10.1164/rccm.200501-004OC |
| [21] | Alexis P, Xavier R, Antoine VB. Rationale and description of right ventricle-protective ventilation in ARDS[J]. Respir Care, 2016, 61(10): 1391-1396. DOI:10.4187/respcare.04943 |
| [22] | 马绍磊, 王宇杰, 曹权, 等. ICU急性右心室功能衰竭的治疗进展[J]. 中华危重症医学杂志(电子版), 2017, 10(3): 207-213. DOI:10.3877/cma.j.issn.1674-6880.2017.03.014 |
| [23] | Price LC, Wort SJ, Finney SJ. Pulmonary vascular and right ventricular dysfunction in adult critical care: current and emerging options for management: a systematic literature review[J]. Crit Care, 2010, 14(5): R169. DOI:10.1186/cc9264 |
| [24] | 裴亮, 刘春峰. 急性呼吸窘迫综合征的右心保护性通气策略研究进展[J]. 中国小儿急救医学, 2019, 26(8): 614-617. DOI:10.3760/cma.j.issn.1673-4912.2019.08.013 |
| [25] | Nunes S, Ruokonen E, Takala J. Pulmonary capillary pressures during the acute respiratory distress syndrome[J]. Intensive Care Med, 2003, 29(12): 2174-2179. DOI:10.1007/s00134-003-2036-0 |
| [26] | Enson Y, Giuntini C, Lewis ML, et al. The influence of hydrogen ion concentration and hypoxia on the pulmonary circulation[J]. J Clin Invest, 1964, 43(6): 1146-1162. DOI:10.1172/JCI104999 |
| [27] | Lansdorp B, Hofhuizen C, Van LM, et al. Mechanical ventilation induced intrathoracic pressure distribution and heart-lung interactions[J]. Crit Care Med, 2014, 42(9): 1983-1990. DOI:10.1097/CCM.0000000000000345 |
| [28] | Dessap AM, Charron C, Devaquet J, et al. Impact of acute hypercapnia and augmented positive end-expiratory pressure on right ventricle function in severe acute respiratory distress syndrome[J]. Intensive Care Med, 2009, 35(11): 1850-1858. DOI:10.1007/s00134-009-1569-2 |
| [29] | Otto CM. Practice of clinical echocardiography[M]. 3rd ed. Elsevier LTD, Oxford, 2012. |
| [30] | Pinsky MR. Instantaneous venous return curves in an intact canine preparation[J]. J Appl Physiol Respir Environ Exerc Physiol, 1984, 56(3): 765-771. DOI:10.1152/jappl.1984.56.3.765 |
| [31] | 赵俊杰, 许爱国. 正压机械通气对ARDS患者右心功能的影响[J]. 河南医学研究, 2016, 25(12): 2176-2178. DOI:10.3969/j.issn.1004-437X.2016.12.027 |
 2020, Vol. 29
2020, Vol. 29




