2 嘉兴市第一医院急危重症中心,314000
肺炎在普通人群和危重病患者中均是高发病率和高病死率的疾病[1-5]。特别是医院获得性肺炎是危重病患者最常见的院内获得性感染,明显增加危重病患者ICU滞留时间、治疗费用甚至整体预后[6]。危重病患者由于病情等原因,往往外出检查受限,肺炎往往不能被及时发现和评估,近年来,肺部超声的兴起为肺炎的诊断提供了一种高效、无创的手段[7-8],但对于肺炎病情的动态观察以及预后的评估方面,尚缺乏系统深入的研究。因此本研究旨在探讨LUS在危重症患者肺部感染病情评估及预后判断中的价值。
1 资料与方法 1.1 一般资料选2016年7月至2016年12月入本院ICU的44例肺炎患者,诊断符合中华人民共和国卫生部肺炎诊断(WS382-2012)标准[9]。入组标准:年龄≥18岁,性别不限;危重病医学科(ICU)内存在肺炎患者;预计ICU驻留时间超过5 d。排除标准:年龄<18岁;妊娠;慢性阻塞性肺疾病;间质性肺疾病;肺栓塞;肺结核;严重心衰状态(PAWP>18 mmHg,1 mmHg=0.133 kPa或CVP>15 mmHg);未引流的大量血胸、气胸;自身免疫性疾病;合并其他部位感染。
本研究符合医学伦理学标准,经医院伦理委员会批准,所有检查均取得患者或家属的知情同意。
收集患者的一般临床资料,记录所有患者的急性生理学与慢性健康状况评分Ⅱ(APACHE Ⅱ)。
1.2 肺部超声评估患者入院第1天至患者入院第7天,每间隔1 d,由不知晓患者病情并经过专门急危重病超声培训的医师使用SonositeTurbo型便携式超声仪(美国索诺声公司,宽频弧形探头,2~7MHz),快速截取患者双侧供12个BLUE点的肺部超声影像(呼气末,共12个点),并在超声机上储存图像,由操作者及不知晓实验设计的另2位同样经过专门急危重病超声培训的医师对存储的图像进行肺超声评分(lung ultrasound score,LUS)。检查区域见文献[10]。LUS评定分为4个等级:(1)正常通气:表现为平滑的A线或者少于2条孤立的B线(记0分);(2)中度肺通气减少:大量的清晰B线(间距大于7 mm,B1线)(记1分);(3)重度肺通气减少:大量临近(间距<3mm)或融合的B线(B2线)(记2分);(4)肺实变:表现为具有动态的支气管充气影的组织(记3分)。正常肺部超声评分总分为0分,最高为36分。最后每个时点的LUS值采用3位医师的平均值而得出(图 1)。
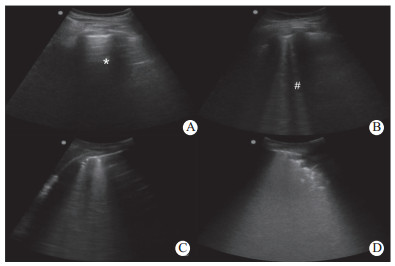
|
| (A)正常通气区,为肺滑动征伴A线(*)或少于2个单独的B线(#),0分;(B)中度肺通气减少区,影像为多发、典型B线(B1线),1分;(C)重度肺通气减少区,为多发融合的B线(B2线),2分;(D)肺实变区,见组织影像伴典型的支气管充气征为3分 图 1 肺部超声评分(LUS) |
|
|
CPIS评分[11]包括体温(0~2分)、白细胞计数(0-2分)、气道24 h吸出物的性状及数量(0-2分)、氧合指数(0~2分)、胸部x线片浸润影(0~2分)、气管吸取物培养(0-2分),总分12分。患者入院第1天至患者入院第7天,每间隔一天,均进行评分。
1.3 血浆PCT、CRP、WBC检测患者入院第1天至患者入院第7天,每间隔一天,均监测血浆PCT、CRP、WBC。PCT采用双抗体夹心法检测,CRP采用胶乳免疫比浊法检测,WBC采用电阻法+流式细胞术检测。
1.4 氧合指数检测患者入院第1天至患者入院第7天,每间隔1 d,均采用Roche cobas123血气分析仪检测血气分析。
将入选患者按临床结局分成死亡组及存活组,比较两组初始LUS及LUS变化趋势的差异, 采用ROC曲线分析LUS对预后判断的意义。
1.5 统计学方法采用SPSS 20.0统计软件,计量资料采用均数±标准差(Mean±SD)表示。相关性分析采用Pearson相关分析。不同时间点及不同组别的比较采用独立样本t检验。使用ROC曲线等临床诊断性能评价指标评价LUS评分的临床诊断效能。LUS > 12.5分组与LUS > 12.5分组病死率的比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果44例患者入选本研究,男29例,女15例,年龄(63±17)岁。APACHEⅡ(17.77±5.57)分。死亡组19例,男13例,女6例,年龄(63±18)岁,APACHEⅡ(17.32±6.15)分。存活组25例,男16例,女9例,年龄(63±17)岁,APACHE Ⅱ(18.12±5.18)分。两组差异无统计学意义(P > 0.05)(表 1)。
| 特征 | 死亡组(n=21) | 存活组(n=23) | P值 |
| 性别男(女) | 15(6) | 14(9) | 0.766 |
| 年龄(岁) | 63±18 | 63±17 | 0.924 |
| APACHE Ⅱ评分 | 17.32±6.15 | 18.12±5.18 | 0.809 |
| 吸烟史有(无) | 13(8) | 12(11) | 0.526 |
| PCT | 0.65±0.02 | 0.59±0.03 | 0.875 |
| 基础疾病 | |||
| 脑血管疾病 | 8 | 11 | 0.515 |
| 肺部疾病 | 4 | 7 | 0.384 |
| 创伤 | 4 | 1 | 0.125 |
| 其他 | 5 | 4 | 0.598 |
相关性分析:LUS与CPIS呈正相关(r=0.765,P<0.001)(图 2);LUS与CRP呈正相关(r=0.736,P<0.001)(图 3);LUS与氧合指数(PaO2/FiO2)呈负相关(r=- 0.560,P<0.001)(图 4);LUS与PCT(r=0.148,P=0.075)、WBC(r=0.088,P=0.29)、T(r=0.050,P=0.544)无相关性。
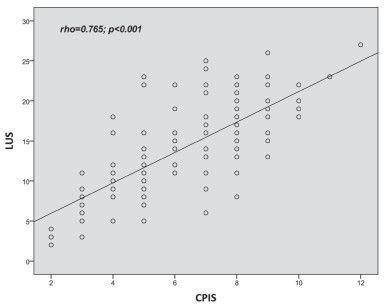
|
| 图 2 LUS与CPIS呈正相关(r=0.765,P<0.01) |
|
|
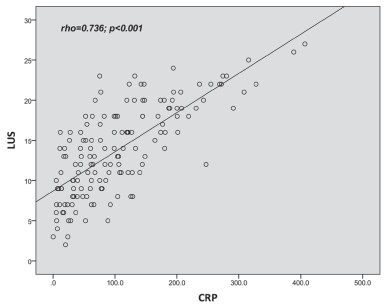
|
| 图 3 LUS与CRP呈正相关(r=0.736,P<0.01) |
|
|
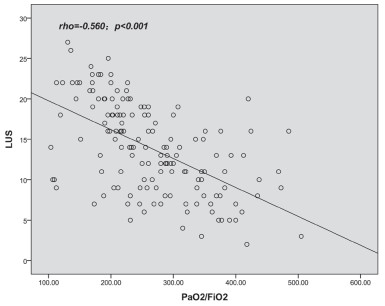
|
| 图 4 LUS与PaO2/FiO2呈负相关(r=-0.560,P<0.01) |
|
|
死亡组与存活组LUS评分:第1天,死亡组与存活组LUS评分差异无统计学意义(P > 0.05)。第3天,死亡组LUS评分高于存活组,差异有统计学意义(P<0.05)。存活组第3天LUS下降,而死亡组第3天LUS升高(表 2)。
| LUS | 死亡组(n=21) | 存活组(n=23) |
| LUS(第1天) | 13.89±5.606a | 14.28±4.818 |
| LUS(第3天) | 15.74±1.297b | 10.96±0.871 |
| 注:LUS为肺部超声评分。与存活组第1天比,aP > 0.05;与存活组第3天比,bP<0.05。 | ||
LUS预测危重病患者肺炎死亡的ROC曲线及最佳判断点:采用ROC曲线评价LUS预测危重病患者肺炎死亡的临床诊断效能,其敏感度为72.0%,特异性为52.6%,AUC为0.565(表 3)。以入ICU第3天LUS为12.5作为预测危重病患者肺炎死亡的临床诊断临界点。入ICU第3天LUS<12.5的24例患者中8例(33.3%,8/24)死亡,第3天LUS > 12.5的20例患者中13例(65.0%,13/20)死亡,病死率差异有统计学意义(χ2=4.385,P=0.036)(表 4)。
| 诊断实验评价指标 | LUS |
| ROC下的面积 | 0.565 |
| 最佳诊断点(分) | 12.5 |
| 敏感度(%) | 72.0 |
| 特异性(%) | 52.6 |
| 约登指数(YI) | 0.246 |
| 注:LUS为肺部超声评分。 | |
| 组别 | 死亡 | 存活 | 合计 | χ2值 | P值 |
| LUS<12.5 | 8 | 13 | 21 | 4.385 | 0.036 |
| LUS > 12.5 | 16 | 7 | 23 | ||
| 合计 | 24 | 20 | 44 | ||
| 注:LUS为肺部超声评分。 | |||||
肺部超声的应用及肺部超声评分系(LUS)的建立,使动态评价危重病患者肺炎病情及治疗效果成为可能。近年来大量研究证实[12-13],LUS在肺炎的诊断上具有优势,尤其是在CAP儿童中可作为一线检查手段,LUS诊断成人肺炎的敏感性为90.4%,特异性为88.4%,但关于其在肺炎的动态评估及对预后评价方面鲜有研究。因此本研究中选用肺部12分区总分为36分的LUS评分,对肺水及肺部通气面积进行全面且充分的评估。
肺部通气的缺失在早期阶段不易被胸部X线等发现,而LUS主要是基于肺部分区的多少和超声影像学分值的多少计算总分来量化肺部通气面积的变化。应用LUS来评估呼气末正压水平(PEEP)诱导的肺实变区再通气面积的变化,已有研究证实,CT下肺通气的改善和LUS之间具有密切和重要的相关性。因此LUS对于早期肺炎的评估优于传统检查方法如胸部X线。PaO2/FiO2是ARDS严重程度的评判标准之一,LUS可以通过评估ARDS肺部通气面积的变化来早期评估脓毒性休克并发ARDS液体复苏时肺通气丧失的改变,而这种改变发生在氧合指数改变之前,同时本研究结果显示,LUS与PaO2/FiO2呈负相关(r=- 0.560)。故LUS能早期、简单、快速地评估肺炎严重程度。
CPIS是目前广泛使用的肺炎筛查和动态监测工具,可用于肺炎疗效的动态评估并指导抗生素治疗。VAP患者在发病当天CPIS分值明显增高,经过治疗后,如CPIS分值明显下降,则预后良好;如CPIS分值始终维持在较高水平,则预后不良。研究结果显示,在VAP的抗菌药物治疗中,床旁肺部超声通过精确评估肺实变后再通气面积的变化,可以与CPIS评分一起指导VAP的治疗。本研究发现LUS与CPIS呈明显正相关(r=0.765),提示LUS可用于肺炎病情的动态评估及对治疗效果的预测。但CPIS反映的是肺炎患者整体病情变化,无法评估肺部局部病灶的动态变化。肺部超声显示肺部通气改变比床旁x线胸片更为精确。因此,LUS较CPIS能更简便、早期、精确的反映肺炎病情变化。
此外,CRP也是评估炎性疾病发展的重要指标。CRP的上升速度与病原菌感染严重程度呈正相关。许多学者认为,CRP可以作为一个独立的指标用于检测病菌感染严重程度。本研究发现:LUS与CRP呈明显正相关(r=0.736),较其他研究所示CPIS与CRP之间(r=0.609)有更高的相关性。表明LUS较CPIS能更精确的动态评估肺部感染的严重程度。
另外本研究发现,按患者住院期间结局分成死亡组和存活组,入ICU第1天时两组LUS评分差异无统计学意义。然而在入ICU第3天,存活组LUS下降,而死亡组LUS明显升高,表明LUS动态变化可能有助于预测患者预后。以入ICU第3天LUS为12.5分作为预测死亡发生的最佳临床诊断临界点,本研究发现,LUS<12.5分的24例患者中8例(33.3%,8/24)死亡,第3天LUS > 12.5分的20例患者中13例(65.0%,13/20)死亡,病死率差异有统计学意义。因此,LUS可辅助用于危重病患者肺炎的动态监测及预后评估。
但本研究亦发现,LUS预测危重病患者肺炎死亡的敏感度为72.0%,特异性仅为52.6%。因为危重病患者常合并多种疾病或多脏器功能损伤,仅通过LUS来预测病死率易形成偏差;其次,LUS是通过肺部通气变化来评估,易受多种因素干扰,如对于肺气肿患者灵敏度低等。
本研究仍存在一些不足,比如:研究中并未就是否存在辅助机械通气进行分组。在今后研究中,笔者将继续扩大样本量并进一步行分层分析,如机械通气因素,院内院外感染因素等。
| [1] | File TM Jr, Marrie TJ. Burden of community-acquired pneumonia in north American adults[J]. Postgrad Med, 2010, 122(2): 130-141. DOI:10.3810/pgm.2010.03.2130 |
| [2] | Welte T, Torres A, Nathwani D. Clinical and economic burden of community-acquired pneumonia among adults in Europe[J]. Thorax, 2012, 67(1): 71-79. DOI:10.1136/thx.2009.129502 |
| [3] | Wiemken T, Peyrani P, Ramirez J. Global changes in the epidemiology of community-acquired pneumonia[J]. Semin Respir Crit Care Med, 2012, 33(3): 213-219. DOI:10.1055/s-0032-1315633 |
| [4] | Murray CJ, Vos T, Lozano R, et al. Disability-adjusted life years (DALYs) for 291 diseases and injuries in 21regions, 1990-2010: a systematic analysis for the Global Burden of Disease Study 2010[J]. Lancet, 2012, 380(9859): 2197-2223. DOI:10.1016/S0140-6736(12)61689-4 |
| [5] | [CDATA[WHO: The top 10 causes of death 2013. 2013. Available from: http://www.who.int/mediacentre/factsheets/fs310/en/.]]> |
| [6] | Ferrer M, Torres A. Epidemiology of ICU-acquired pneumonia[J]. Curr Opin Crit Care, 2018, 24(5): 325-331. DOI:10.1097/mcc.0000000000000536 |
| [7] | Bouhemad B, Zhang M, Lu Q, et al. Clinical review: Bedside lung ultrasound in critical care practice[J]. Crit Care, 2007, 11(1): 205. DOI:10.1186/cc5668 |
| [8] | Volpicelli G, Elbarbary M, Blaivas M, et al. International evidence-based recommendations for point-of-care lung ultrasound[J]. Intensive Care Med, 2012, 38(4): 577-591. DOI:10.1007/s00134-012-2513-4 |
| [9] | 中华人民共和国卫生部.ICS11.020C05, WS382-2012中华人民共和国卫生行业标准肺炎诊断[S].2012. |
| [10] | Bouhemad B, Liu ZH, Arbelot C, et al. Ultrasound assessment of antibiotic-induced pulmonary reaeration in ventilator-associated pneumonia[J]. Crit Care Med, 2010, 38(1): 84-92. DOI:10.1097/ccm.0b013e3181b08cdb |
| [11] | Pugin J, Auckenthaler R, Mili N, et al. Diagnosis of ventilator-associated pneumonia by bacteriologic analysis of bronchoscopic and nonbronchoscopic "blind" bronchoalveolar lavage fluid[J]. Am Rev Respir Dis, 1991, 143(5_pt_1): 1121-1129. DOI:10.1164/ajrccm/143.5_pt_1.1121 |
| [12] | Medford ARL. Chest ultrasonography as a replacement for chest radiography for community-acquired pneumonia[J]. Chest, 2013, 143(3): 877-878. DOI:10.1378/chest.12-2653 |
| [13] | Mongodi S, Via G, Girard M, et al. Lung ultrasound for early diagnosis of ventilator-associated pneumonia[J]. Chest, 2016, 149(4): 969-980. DOI:10.1016/j.chest.2015.12.012 |
 2020, Vol. 29
2020, Vol. 29




