2 解放军69240部队医院, 新疆 830000
2 PLA 69240 Army Hospital, Xinjiang 830000, China
中暑是一种严重危及生命的疾病,据不完全统计我国中暑患者平均死亡率约10% ~15%,其中重症中暑(热射病)患者死亡率 > 40%[1]。尽管通过降温和补液等积极的临床措施迅速恢复患者的体温及中枢神经功能,仍有约30%的热射病患者造成了永久性的神经系统和周围组织损伤[2]。姜黄素是一种黄色色素,存在于香料姜黄的根茎中。在印度阿育吠陀(印度传统医学)中已经使用了几个世纪,用于治疗多种疾病,其治疗作用逐渐被阐明[3]。有研究发现姜黄素的多效性能够与众多分子靶点相互作用参与炎症反应的调节[4]。本研究及既往研究提示沙漠干热环境中暑及热射病可引起急性肺损伤[5-6],由此我们采用不同剂量的姜黄素灌胃干热环境预处理大鼠,初探不同剂量姜黄素对干热环境热射病大鼠肺损伤的保护作用特点及可能机制。
1 材料与方法 1.1 实验动物及实验环境SD大鼠,SPF级雄性50只,购自新疆维吾尔自治区实验动物研究中心,出售许可证编号[SCXK(新)2011-0001],体质量(240±20)g。动物饲养在(温度:(21±1)℃,湿度:(45±5)%RH),SPF级动物实验室,自由摄取食水,使用许可证编号[SYXK(新)2016-0003]。实验方案获新疆军区总医院动物伦理委员会批准。实验取材等相关工作在中国人民解放军新疆军区总医院实验动物科屏障动物实验设施进行[SCXK(新)2011-0003]。并按照实验动物使用的3R原则给予人道的关怀。
1.2 主要设备与试剂西北地区特殊环境人工实验舱(新疆军区总医院研制,中国)、全自动血液分析仪(购自Mindray,美国)、姜黄素(购自日本化成株式会社,日本)、羧甲基纤维素钠(购自源叶生物,中国)、戊巴比妥钠(购自上海化学试剂厂,中国)。
1.3 建模、实验分组及处理取材SD大鼠放置在SPF室内适应性饲养1周,温度(25±2)℃,相对湿度40%~50%,每12 h明暗交替。大鼠随机将50只SD大鼠分为5组:
① 常温对照组(Normal control,NC组),②干热对照组(Dry-heat control,DHC组),③50 mg/kg姜黄素组,④100 mg/kg姜黄素组,⑤200 mg/kg姜黄素组。NC、DHC组生理盐水灌胃,姜黄素各组将姜黄素溶于5%羧甲基纤维素钠溶液配置成混悬液灌胃。
每天1次,连续灌胃7 d,大鼠自由饮食饮水(均经灭菌处理)。实验的第8 d,除常温对照组,其余4组大鼠转移至西北特殊环境人工实验舱内,环境温度(41±0.5)℃,相对湿度(10±1)%,禁食禁水。复制以前建立的热射病大鼠模型[6],在实验开始的150 min,将大鼠麻醉后取材,下腔静脉采血,室温静置10~20 min,离心后留取上清液-80℃保存备用(若达不到检测所需血液量,大鼠弃用重新建模)。取部分右肺上叶组织用4%甲醛固定,石蜡包埋。
1.4 肺组织湿干质量比值(W/D)剪取右肺下叶,滤纸拭干水分及血渍,称量湿质量,记录数值(W),将组织放入75℃烤箱烘干48 h后,取出再次称质量记录干质量(D),处理统计肺湿干质量比值(W/D)。
1.5 肺组织病理评分常规病理HE染色,进行肺损伤病理评分,在光镜下观察各肺组织水肿、炎性细胞浸润、出血和小气道损伤等项病理改变,分为5个等级:无病理改变或极轻(0);病理变化轻且局限(1);病理变化中等(2);病变中等但广泛或局部明显(3);病变显著且广泛(4)。在每张切片随机选取10个高倍视野,各项评分之和作为每个视野的病理评分,10个视野的平均值为肺损伤病理评分[7]。
1.6 肺泡灌洗液BALF中总蛋白含量、白细胞数及中性粒细胞数测定(BCA法)用文献方法制备BALF液[8]。取BALF液,12 000 r/min,离心10 min。按照总蛋白定量测定试盒说明书步骤操作,于562 nm处测定各管OD值,根据公式计算最终剂量,统计处理数据。白细胞计数法计数肺BALF中白细胞数量,血细胞分析仪测定中性粒细胞数。
1.7 统计学方法符合正态分布的计量资料采用均数±标准差(Mean±SD)表示,应用SPSS23.0软件进行统计分析,两样本符合正态分布数据采用成组t检验,各组间采用单因素方差分析,若差异有统计学意义使用LSD检验,以P<0.05为差异有统计学意义。
2 结果 2.1 肺组织病理学改变及肺损伤病理评分光镜下发现DHC组肺泡间隔增宽,肺泡腔变狭窄,支气管壁及部分肺泡间隔中可见大量炎症细胞浸润,肺泡壁毛细血管明显充血、渗出,支气管散在出血,NC组肺组织结构基本完整,无明显变化,姜黄素组随着姜黄素剂量的增加,其肺病理学损伤逐渐减轻,见图 1。结果提示,NC组、DHC组、50 mg/kg姜黄素组、100 mg/kg姜黄素组、200 mg/kg姜黄素组肺损伤病理评分分别为:0.99±0.15,8.01±0.84,6.78±0.74,5.37±0.98,4.06±0.72,随着姜黄素剂量增加肺损伤病理学评分逐渐下降,NC组、3个姜黄素组与DHC组差异有统计学意义(P<0.01),3个剂量的姜黄素组之间肺损伤病理学评分差异有统计学意义(P<0.01),见图 2。
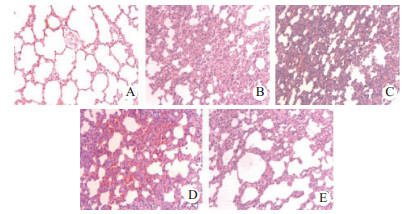
|
| A:NC组; B:DHC组; C:50 mg/kg姜黄素组; D:100 mg/kg姜黄素组E:200 mg/kg姜黄素组 图 1 姜黄素预处理对热射病大鼠肺组织病理改变(HE×100) Fig 1 Lung pathological changes at different curcumin pretreatment groups of heat stroke rats under dry heat environment (HE×100) |
|
|
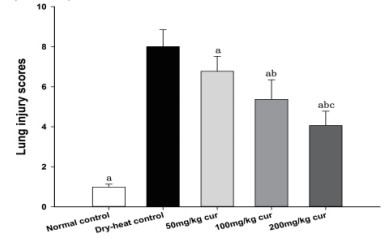
|
| 与DHC组比较,aP<0.01;与50 mg/kg姜黄素组比较,bP<0.01;与100 mg/kg姜黄素组比较,cP<0.01 图 2 姜黄素预处理对热射病大鼠肺损伤病理学评分影响 Fig 2 The effect of lung injury scores at different curcumin pretreatment groups of heat stroke rats under dry heat environment |
|
|
NC组、DHC组、50 mg/kg姜黄素组、100 mg/kg姜黄素组、200 mg/kg姜黄素组肺湿干质量比值(W/D)分别为:4.27±0.12,10.07±1.49,8.12±0.35,6.50±0.45,5.30±0.18,随着姜黄素剂量增加肺湿干质量比值逐渐下降,NC组、3个姜黄素组与DHC组差异有统计学意义(P<0.01),3个剂量的姜黄素组之间的肺湿干质量比值差异有统计学意义(P<0.01),见图 3。
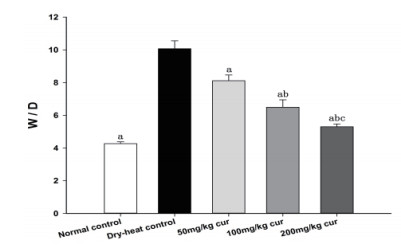
|
| 与DHC组比较aP<0.01;与50 mg/kg姜黄素组比较bP<0.01;与100 mg/kg姜黄素组比较cP<0.01 图 3 姜黄素预处理对热射病大鼠肺组织W/D的比较 Fig 3 Comparison of W/D weight ratio in the lung tissue of rat with curcumin pretreatment |
|
|
肺泡灌洗液蛋白定量结果显示,NC组蛋白定量为4.27±0.12,DHC组为10.07±1.49,明显高于NC组(P<0.01),随着姜黄素剂量的增加,蛋白定量逐渐降低,50 mg/kg姜黄素组、100 mg/kg姜黄素组、200 mg/kg姜黄素组的蛋白定量分别为8.12±0.35,6.50±0.45,5.30±0.18,3个剂量组之间及与DHC组之间差异有统计学意义(P<0.01),肺泡灌洗液白细胞计数、中性粒细胞数的变化趋势与蛋白定量相同,且各组之间统计学差异与蛋白定量相同,见图 4。
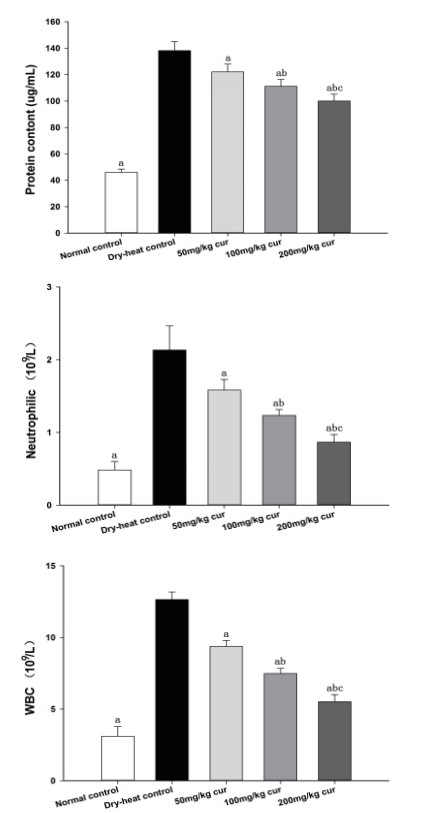
|
| 图 4 肺泡灌洗液BALF总蛋白、白细胞数及中性粒细胞数 Fig 4 The percentage of BALF total protein, white blood cell count and neutrophil count in alveolar lavage |
|
|
Pearson相关分析提示,肺病理损伤评分与肺组织W/D比值之间存在相关性(r=0.879,P<0.01),肺病理损伤评分与肺BALF中总蛋白含量之间存在相关性(r=0.935,P<0.01),肺病理损伤评分与肺BALF中白细胞数之间存在相关性(r=0.916,P<0.01),肺病理损伤评分与肺BALF中中性粒细胞百分比之间存在相关性(r=0.880,P<0.01)。
3 讨论组织损伤是中暑综合征常见的病理生理变化表现,并发症包括热调节功能障碍、急性呼吸窘迫综合征、DIC、休克、横纹肌溶解等[9-11]。中暑早期高热产生的热细胞毒性可以造成组织器官不可逆的损伤和死亡,严重时,导致致命的全身炎症反应综合征(SIRS)或多器官功能障碍综合征(MODS)[12]。
肺脏是创伤休克、重度感染等最易侵害的脏器,伴随基础病变发生、发展的过程均会引起肺脏组织和细胞的损伤,产生肺水肿,出现急性肺损伤ALI和急性呼吸窘迫综合征ARDS[13]。在恶劣的沙漠干热环境中,由于干燥炎热的气候直接影响呼吸系统,会使通气功能受到较为明显的影响,不仅增加水分丢失、降低血容量,还可以因较高温度损伤肺泡内皮细胞,导致肺脏屏障功能破坏,加重肺水肿、渗出、炎症浸润等肺脏病理生理学变化[14]。而现有研究表明,中暑引起的病理生理变化类似于脓毒症引起的变化[15]。
本研究病理结果显示,干热造成肺组织损伤,肺内液体渗出和回吸收无法正常进行,导致液体在血管外潴留产生水肿。这可能与肺泡上皮和肺毛细血管通透性的增高,大分子的蛋白质渗入到血管外有关。姜黄素预处理组随着姜黄素剂量的增加,其肺病理学损伤逐渐减轻,表明姜黄素具有改善沙漠干热环境下热射病大鼠肺损伤的作用,并呈剂量依赖性。W/D和BALF中的蛋白含量还可评价肺泡上皮和肺微血管通透性变化[16]。Wittier等[17]也把W/D值作为肺水肿的黄金指标,用来反映肺脏细胞膜损伤严重程度。3个姜黄素组,在不同程度上延长了肺脏发生肺水肿的时间,并阻止肺组织血管中的微量蛋白渗出到肺泡腔内,从而保持肺泡上皮完整性和通透性。研究表明,水肿是炎症的典型表现,而中性粒细胞是急性肺损伤炎症反应中重要的效应细胞,是数量最多的人免疫细胞[18]。
中性粒细胞被迅速激活黏附到血管壁或者聚集到靶器官加重微循环障碍,可导致和加重急性肺损伤,是急性炎症反应的主要环节。活化的中性粒细胞可释放多种细胞毒性物质,包括活性氧和蛋白酶,参与炎症反应的调节[19-20]。抑制和消除局部的中性粒细胞可能会减弱急性肺损伤。本研究结果显示,白细胞数及中性粒细胞数随着姜黄素剂量的增加逐渐减低,三个姜黄素剂量组白细胞数及中性粒细胞数明显高于DHC组,呈梯度递减。反映姜黄素在保护肺脏的同时,有效防御了肺组织炎症细胞的大量浸润。
姜黄素是一种活跃的酚类物质,具有抗癌、抗炎、神经保护等作用[21]。Liu等[22]研究显示姜黄素能够减少中性粒细胞浸润和渗出,通过NO形成、氧化应激、炎症产物和炎症细胞渗出,减少组织损伤,减少MODS大鼠模型的NF-κB活性,提示姜黄素可能通过抑制NF-κB的表达减轻MODS,另外姜黄素的应用可致全身毒性和体质量丢失减少,死亡率降低,从而减轻MODS严重程度。Zhang等[23]研究证明,新型姜黄素对LPS诱导的ALI具有显著的保护作用,这些影响可能与它通过ERK通路抑制炎性细胞因子产生的能力有关。Nehra等[24]研究纳米姜黄素在改善HH诱发的肺损伤,通过WB的Akt/Erk信号级联检测,由肺血管收缩引起的肺损伤(1/2/2/3和B)和跨血管液体平衡中介(Na+/K+ATPase)分析肺损伤的原因。上调的ET-1,ET-2,ET-3及内皮素受体A、B及下调跨血管平衡介质(Na+/K+ATPase)证实了肺液清除的缺陷,促进了水肿的形成。在恢复血液分析、循环细胞因子和肺部氧化还原状态的过程中,纳米姜黄素治疗可防止肺水肿形成,并恢复其受体的表达水平。akt/erk信号通路的调制证实了纳米姜黄素具有肺脏保护作用[24]。Zhang等[25]研究发现,姜黄素显著降低了COPD大鼠BALF中总细胞、中性粒细胞和巨噬细胞的数量,改善了COPD大鼠肺泡上皮细胞的肺气肿和超微结构损伤。
| [1] | 苏磊, 童华生. 重症中暑转化医学研究回顾与展望[J]. 解放军医学杂志, 2017, 42(2): 103-108. DOI:10.11855/j.issn.0577-7402.2017.02.03 |
| [2] | Pearce SC, Mani V, Boddicker RL, et al. Heat stress reduces intestinal barrier integrity and favors intestinal glucose transport in growing pigs[J]. Plos One, 2013, 8(8): e70215. DOI:10.1371/journal.pone.0070215 |
| [3] | Lelli D, Sahebkar A, Johnston TP, et al. Curcumin use in pulmonary diseases: State of the art and future perspectives[J]. Pharmacol Res, 2017, 115: 133-148. DOI:10.1016/j.phrs.2016.11.017 |
| [4] | Zhang XX, Wu J, Ye B, et al. Protective effect of curcumin on TNBS-induced intestinal inflammation is mediated through the JAK/STAT pathway[J]. BMC Complement Altern Med, 2016, 16: 299. DOI:10.1186/s12906-016-1273-z |
| [5] | 郭峻峭, 刘江伟, 张波, 等. 沙漠干热环境中暑大鼠肺损伤与NO、iNOS mRNA的变化研究[J]. 中华保健医学杂志, 2016, 18(1): 45-48. DOI:10.3969/.issn.1674-3245.2016.01.013 |
| [6] | Ren OZ, Liu JW, Zhang D, et al. Heatstroke model for desert dry-heat environment and observed organ damage[J]. Am J Emerg Med, 2014, 32(6): 573-579. DOI:10.1016/j.ajem.2014.02.017 |
| [7] | Yan YE, Zhao YQ, Wang H, et al. Pathophysiological factors underlying heatstroke[J]. Med Hypotheses, 2006, 67(3): 609-617. DOI:10.1016/j.mehy.2005.12.048 |
| [8] | Kuo MY, Liao MF, Chen FL, et al. Luteolin attenuates the pulmonary inflammatory response involves abilities of antioxidation and inhibition of MAPK and NFκB pathways in mice with endotoxin-induced acute lung injury[J]. Food Chem Toxicol, 2011, 49(10): 2660-2666. DOI:10.1016/j.fct.2011.07.012 |
| [9] | 刘江伟, 沈才福, 康燕, 等. 干热环境创伤失血性休克猪钾离子变化特点[J]. 中华急诊医学杂志, 2018, 27(5): 480-485. DOI:10.3760/cma.j.issn.1671-0282.2018.05.005 |
| [10] | Ji J, Zhou FH, Yue H, et al. Protective mechanism of Xuebijing injection against heat stroke in rats[J]. Exp Ther Med, 2014, 7(6): 1745-1751. DOI:10.3892/etm.2014.1639 |
| [11] | Shevtsov M, Dobrodumov A, Mikhrina A, et al. Neurotherapeutic activity of the recombinant heat shock protein Hsp70 in a model of focal cerebral ischemia in rats[J]. DDDT, 2014: 639. DOI:10.2147/dddt.s62024 |
| [12] | Leon LR, Blaha MD, DuBose DA. Time course of cytokine, corticosterone, and tissue injury responses in mice during heat strain recovery[J]. J Appl Physiol, 2006, 100(4): 1400-1409. DOI:10.1152/japplphysiol.01040.2005 |
| [13] | Junger WG, Rhind SG, Rizoli SB, et al. Resuscitation of traumatic Hemorrhagic shock patients with hypertonic saline: without dextran: inhibits neutrophil and endothelial cell activation[J]. Shock, 2012, 38(4): 341-350. DOI:10.1097/shk.0b013e3182635aca |
| [14] | Samim F, Auluck A, Zed C, et al. Erythema multiforme: a review of epidemiology, pathogenesis, clinical features, and treatment[J]. Dent Clin North Am, 2013, 57(4): 583-596. DOI:10.1016/j.cden.2013.07.001 |
| [15] | Liu K, Shen L, Wang J, et al. The preventative role of curcumin on the lung inflammatory response induced by cardiopulmonary bypass in rats[J]. Surg Res, 2012: 174. DOI:10.1016/j.jss.2010.12.002 |
| [16] | Lelli D, Sahebkar A, Johnston TP, et al. Curcumin use in pulmonary diseases:State of the art and future perspectives[J]. Pharmacol Res, 2017, 115: 133-148. DOI:10.1016/j.phrs.2016.11.017 |
| [17] | Wittwer T, Franke UFW, Ochs M, et al. Inhalative pre-treatment of donor lungs using the aerosolized prostacyclin analog iloprost ameliorates reperfusion injury[J]. J Heart Lung Transplant, 2005, 24(10): 1673-1679. DOI:10.1016/j.healun.2004.11.014 |
| [18] | He ZG, Huang J, Zhou SG, et al. Peripheral leukocytapheresis at-tenuates acute lung injury induced by lipopolysaccharide in vivo[J]. Mediators Inflamm, 2012: 694635. DOI:10.1155/2012/694635 |
| [19] | 孙力超, 陈旭, 姚尧, 等. 木犀草素对脓毒症小鼠急性肺损伤的保护作用[J]. 中华急诊医学杂志, 2019, 28(6): 717-723. DOI:10.3760/cma.j.issn.1671-0282.2019.06.012 |
| [20] | Luna-Gomes T, Filardy AA, Rocha JDB, et al. Neutrophils increase or reduce parasite burden in Trypanosoma cruzi- infected macrophages, depending on host strain: role of neutrophil elastase[J]. Plos One, 2014, 9(3): e90582. DOI:10.1371/journal.pone.0090582 |
| [21] | Han SG, Xu J, Guo XJ, et al. Curcumin ameliorates severe influenza pneumonia via attenuating lung injury and regulating macrophage cytokines production[J]. Clin Exp Pharmacol Physiol, 2018, 45(1): 84-93. DOI:10.1111/1440-1681.12848 |
| [22] | Liu SS, Zhang JY, Pang Q, et al. The protective role of curcumin in zymosan-induced multiple organ dysfunction syndrome in mice[J]. Shock, 2016, 45(2): 209-219. DOI:10.1097/shk.0000000000000502 |
| [23] | Zhang YL, Liang DD, Dong LL, et al. Anti-inflammatory effects of novel curcumin analogs in experimental acute lung injury[J]. Respir Res, 2015, 16: 43. DOI:10.1186/s12931-015-0199-1 |
| [24] | Nehra S, Bhardwaj V, Bansal A, et al. Nanocurcumin accords protection against acute hypobaric hypoxia induced lung injury in rats[J]. J Physiol Biochem, 2016, 72(4): 763-779. DOI:10.1007/s13105-016-0515-3 |
| [25] | Xie Y, Yan R, Shan H, et al. Curcumin ameliorates alveolar epithelial injury in a rat model of chronic obstructive pulmonary disease[J]. Life Sci, 2016, 164: 1-8. DOI:10.1016/j.lfs.2016.09.001 |
 2020, Vol. 29
2020, Vol. 29




