严重大面积的心肌梗死可导致心力衰竭,致使患者猝死[1]。尽早实施缺血心肌再灌注是目前最为有效的临床救治方法。但是再灌注救治是把双刃剑,既可以及时恢复心肌血供,改善心肌功能,又可在少数情况下却加重心肌坏死[2]。研究表明,缺血-再灌注所导致的心肌坏死与再灌注后出现大量炎性因子密切相关[3]。心肌缺血-再灌注损伤过程中巨噬细胞大量浸润在心肌组织内,巨噬细胞可分泌大量炎性因子,参与缺血-再灌注损伤[4]。
巨噬细胞是一群异质性的免疫细胞,依据其功能的不同分为经典活化巨噬细胞(M1)和替代活化巨噬细胞(M2)[5]。以往的研究表明[6],M1型巨噬细胞所分泌的IL-1、IL-6、IL-8、TNF-α、iNOS、MCP-1等炎性因子促进缺血-再灌注部位的炎性反应,加重心肌损伤。而M2型巨噬细胞通过分泌TGF-β、IL-10等抑制过度免疫反应[7]。因此,抑制巨噬细胞向M1极化,促进其向M2偏移,对于减缓心肌缺血-再灌注损伤有着非常重要的意义。
微小RNA(microRNA)是一类非编码RNA,长度在21-23nt,其通过与靶mRNA的3‘非编码区结合,抑制其正常翻译[8]。microRNA在肿瘤、、代谢、炎症等疾病发生发展中起到非常重要的作用[9]。既往研究提示[10]microRNA125a在巨噬细胞功能的调控中起关键作用。本研究将检测在大鼠心肌缺血-再灌注心肌组织中巨噬细胞内microRNA125a表达水平,同时进一步探讨microRNA125a对巨噬细胞极化的影响及机制。
1 材料与方法 1.1 实验动物实验用清洁级6~8周雄性SD大鼠20只购于上海必凯实验动物中心。
1.2 试剂Trizol RNA抽提试剂盒购于美国life公司; 定量PCR检测试剂盒购于美国life公司; microRNA125a inhibitor和mimics由上海吉玛生物科技有限公司合成; Lipofectamine 2000转染试剂购于美国life公司; 大鼠重组M-CSF购自美国peprotech; DMEM培养液,胎牛血清,胰酶均购于美国life公司。大鼠CD11b-FITC,F4/80-PE抗体购于美国BD公司。各基因引物由苏州金维智生物科技有限公司合成。
1.3 实验方法 1.3.1 缺血-再灌注损伤模型的建立将SD大鼠以每组10只随机(随机数字法)分为I/R组和假手术组,所有大鼠经10%水合氯醛麻醉后,固定,行气管插管,接通呼吸机机械通气。对I/R组大鼠结扎冠状动脉30 min后松开建立心肌缺血大鼠模型,在恢复供血后再灌注2 h。实验过程中采用心电图进行监测,在结扎后,出现心电图ST段抬高、T波高耸等表现,而松开动脉夹开放供血后,出现抬高的ST段开始降低、T波慢慢恢复的现象,则表示I/R建模成功。
1.3.2损伤心肌组织巨噬细胞分离:取大鼠受损心肌组织,用胶原蛋白酶I和IV以及透明质酶37℃处理两h,研磨至单个细胞悬液。加入大鼠CD11b-FITC,F4/80-PE抗体避光孵育20 min,FACS液洗涤后,流式细胞仪进行分选CD11b+F4/80+巨噬细胞。
1.3.3 RNA提取将分离收集到的巨噬细胞用Trizol裂解,加氯仿进行震荡。13 000转离心5 min后取上清液,加入无水乙醇沉淀。75%乙醇洗涤后,晾干加双蒸无菌水溶解。
1.3.4 定量PCR检测将上述质量检测良好的总RNA样本采用逆转录试剂盒转录成cDNA,接着按照SubGreen PCR Mix说明书进行qRT-PCR,所有反应均设立3个复孔。记录每个反应管中标本的CT值。本研究结果采用qRT-PCR中的相对定量法进行分析,采用2-△△CT法表示大鼠心肌缺血-再灌注组织巨噬细胞内microRNA125a以及IL-8,TNF-α,iNOS,MCP-1,TGF-β,IL-10 mRNA表达水平相对于骨髓巨噬细胞表达水平的变化倍数。
1.3.5 原代骨髓巨噬细胞制备取大鼠股骨,用PBS将骨髓腔冲净,体外将骨髓制备成单细胞悬液。红细胞裂解液破坏红细胞后,接种培养皿中加入重组因子M-CSF进行巨噬细胞的诱导。48 h后去除所有悬浮细胞,继续加入带有M-CSF的培养液继续培养48h。所得到细胞即为巨噬细胞。
1.3.6 细胞转染及分组将制备的原代巨噬细胞,调整细胞密度为1×106个/ml后接种于24孔细胞板上,置于CO2培养箱中常规培养24h。将其随机(随机数字法)分为对照组,microRNA125a NC组,microRNA125a mimics组,miR-125a inhibitor组,每组含有3个复孔。以Lipofectamine2000将上述RNA分别转染至相应巨噬细胞细胞中,空白对照组细胞不做转染。转染6 h后,更换培养液后继续培养48 h。定量PCR验证转染成功后,加入TNF-α诱导M1型巨噬细胞。24 h后,收集细胞行定量PCR实验检测TNF-α,iNOS,MCP-1,TGF-β,IL-10 mRNA表达水平。
1.3.7 统计学方法采用Graph Prism 5.0统计软件进行统计学分析。心肌缺血-再灌注组织中巨噬细胞和骨髓巨噬细胞内microRNA125a以及IL-8,TNF-α,iNOS,MCP-1,TGF-β,IL-10 mRNA表达水平组间比较采用两组间样本均数t检验。以P<0.05表示差异有统计学意义。
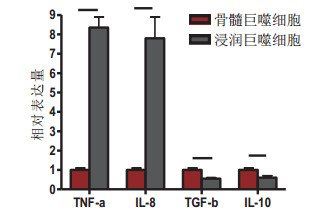
2 结果 2.1 缺血-再灌注心肌组织浸润巨噬细胞为M1型巨噬细胞为了检测缺血-再灌注心肌组织浸润巨噬细胞的类型,首先从缺血-再灌注大鼠心肌组织中分离浸润巨噬细胞,定量PCR检测心肌组织浸润巨噬细胞内M1和M2相关细胞因子的表达。其中TNF-α和IL-8属于M1型巨噬细胞相关细胞因子,TGF-β和IL-10属于M2型巨噬细胞相关细胞因子。结果显示,TNF-α和IL-8在缺血-再灌注心肌组织浸润巨噬细胞的表达与骨髓巨噬细胞相比,明显上升; 而TGF-β和IL-10比骨髓巨噬细胞呈现显著降低。这预示缺血-再灌注心肌组织浸润巨噬细胞为M1型巨噬细胞,所产生的细胞因子可以促进缺血-再灌注部位炎症发生和心肌损伤。
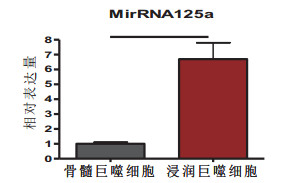
2.2 缺血-再灌注心肌组织浸润巨噬细胞高表达microRNA125a为了观察缺血-再灌注后心肌组织浸润巨噬细胞内是否高表达microRNA125a,首先从大鼠缺血-再灌注模型心肌组织内分离巨噬细胞,抽提其中RNA后,定量PCR分析microRNA125a的表达。大鼠骨髓巨噬细胞作为对照。结果显示,心肌组织浸润巨噬细胞内的microRNA125a的表达水平明显高于骨髓巨噬细胞。这预示microRNA125a与巨噬细胞向M1极化相关联。
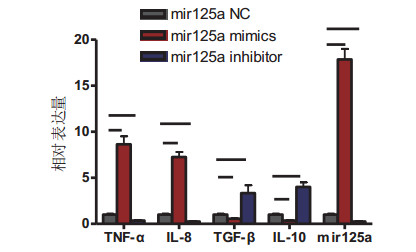
2.3 microRNA125a促进心肌组织浸润巨噬细胞向M1方向偏移为了进一步验证microRNA125a可以促进巨噬细胞向M1方向极化,分离培养原代骨髓巨噬细胞,分别用microRNA125a NC,microRNA125a mimics,microRNA125a inhibitor进行转染。在确定microRNA125a在巨噬细胞的表达水平后,定量PCR检测M1和M2相关细胞因子的表达。如图 3显示,与microRNA125a NC转染组相比,microRNA125a mimic转染组的TNF-α和IL-8的表达水平明显升高,而TGF-β和IL-10的表达水平明显下降。同时,microRNA125a inhibitor抑制TNF-α和IL-8的表达,促进TGF-β和IL-10的表达。这一结果提示,microRNA125a在巨噬细胞的极化中起关键作用,促进巨噬细胞向M1方向偏移。
|
| 图 1 缺血-再灌注心肌组织浸润巨噬细胞高表达M1标志分子 Fig 1 The high expression of M1 marker in the infiltrating macrophages during myocardial ischemia reperfusion |
|
|
|
| 图 2 缺血-再灌注心肌组织浸润巨噬细胞高表达microRNA125a Fig 2 Up-regulation of microRNA125a in the infiltrating macrophages during myocardial ischemia reperfusion |
|
|
|
| 图 3 microRNA125a促进心肌组织浸润巨噬细胞向M1方向偏移 Fig 3 microRNA125a promoting migration of infiltrating macrophages to M1 during myocardial ischemia reperfusion |
|
|
缺血-再灌注损伤是急性心肌梗死治疗后常见症状,通常伴随大量免疫细胞浸润,诱发炎症反应,加重心肌损伤[2]。大量的研究表明,单核/巨噬细胞是其中重要的免疫细胞。单核/巨噬细胞可长期存在于心肌损伤部位,一方面参与心肌损伤后心肌重构,血管形成以及损伤部位修复,另一方面它可引起持续的炎症反应,阻碍心肌修复进程。而巨噬细胞的不同作用与它的表型密切相关。通常M1型巨噬细胞不利于心肌组织修复,M2型巨噬细胞促进心肌重构[11-12]。
因此有效诱导巨噬细胞向M2方向偏移是降低心肌缺血-再灌注损伤的有效途径,也是近来研究的热点。近来,化合物诱导、输注间充质干细胞以及注射带有诱导M2巨噬细胞基因的病毒等方法在抑制缺血-再灌注损伤方面取得了一定的疗效,也为后续的研究指明了方向。本研究在大鼠心肌缺血-再灌注模型中发现,mirRNA125a在心肌损伤部位的巨噬细胞中高表达,干预microRNA125a的表达可以有效诱导心肌损伤部位的巨噬细胞由M1表型向M2表型偏移,同时能明显改善心肌的缺血-再灌注损伤。
MicroRNA125a在肿瘤发生、代谢障碍、炎症发生中均起到重要作用[13]。有研究表明[14],MicroRNA125a在缺血-再灌注损伤时在心肌内也呈高表达,损伤心肌的凋亡也起促进作用。我们研究进一步表明,microRNA125a不仅仅能直接影响心肌细胞,而且可以间接通过调节巨噬细胞的极化来改变炎症反应促进缺血-再灌注损伤。
在缺血-再灌注过程中,大量的巨噬细胞浸润在损伤部位。大量巨噬细胞可以通过分泌大量细胞因子诱导血管收缩,释放氧自由基,促进炎症反应等机制加速心肌细胞坏死和血栓形成。浸润在心肌缺血-再灌注损伤部位的巨噬细胞体现出M1表型[15]。因此诱导这些巨噬细胞向M2偏移,一方面可以抑制炎症反应的发生,另一方面M2型巨噬细胞有利于损伤心肌的修复。
| [1] | 吴晓燕, 苗琳, 郑蕊, 等. 心肌缺血再灌注损伤的研究进展[J]. 中国临床药理学杂志, 2016, 32(11): 1043-1045. DOI:10.13699/j.cnki.1001-6821.2016.11.026 |
| [2] | 胡丽英, 李桂梅, 陈凤英. 急性心肌梗死再灌注治疗现状分析[J]. 重庆医学, 2017, 46(16): 2290-2292. DOI:10.3969/j.issn.1671-8348.2017.16.042 |
| [3] | Westman PC, Lipinski MJ, Luger D, et al. Inflammation as a driver of adverse left ventricular remodeling after acute myocardial infarction[J]. J Am Coll Cardiol, 2016, 67(17): 2050-2060. DOI:10.1016/j.jacc.2016.01.073 |
| [4] | Lu WB, Cong F, Xin W, et al. TCTAP A-041 inhibiting mobilization of Ly6Chigh monocytes after acute myocardial infarction enhanced the efficacy of mesenchymal stromal cells transplantation and curbed myocardial remodeling[J]. J Am Coll Cardiol, 2015, 65(17): S20-S21. DOI:10.1016/j.jacc.2015.03.094 |
| [5] | Cao Y, Xu Y, Auchoybur ML, et al. Regulatory role of IKKɑ in myocardial ischemia/reperfusion injury by the determination of M1 versus M2 polarization of macrophages[J]. J Mol Cell Cardiol, 2018, 123: 11-12. DOI:10.1016/j.yjmcc.2018.08.021 |
| [6] | Wang LX, Zhang SX, Wu HJ, et al. M2b macrophage polarization and its roles in diseases[J]. J Leukoc Biol, 2019, 106(2): 345-358. DOI:10.1002/JLB.3RU1018-378RR |
| [7] | Kasikara C, Doran AC, Cai BS, et al. The role of non-resolving inflammation in atherosclerosis[J]. J Clin Investig, 2018, 128(7): 2713-2723. DOI:10.1172/jci97950 |
| [8] | Mirna M, Paar V, Rezar R, et al. MicroRNAs in inflammatory heart diseases and sepsis-induced cardiac dysfunction: A potential scope for the future?[J]. Cells, 2019, 8(11): 1352. DOI:10.3390/cells8111352 |
| [9] | Moloney GM, Dinan TG, Clarke G, et al. Microbial regulation of microRNA expression in the brain–gut Axis[J]. Curr Opin Pharmacol, 2019, 48: 120-126. DOI:10.1016/j.coph.2019.08.005 |
| [10] | Schulert GS, Fall N, Harley JB, et al. Monocyte MicroRNA expression in active systemic juvenile idiopathic arthritis implicates MicroRNA-125a-5p in polarized monocyte phenotypes[J]. Arthritis Rheumatol, 2016, 68(9): 2300-2313. DOI:10.1002/art.39694 |
| [11] | Jing R, Long TY, Pan W, et al. IL-6 knockout ameliorates myocardial remodeling after myocardial infarction by regulating activation of M2 macrophages and fibroblast cells[J]. Eur Rev Med Pharmacol Sci, 2019, 23(14): 6283-6291. DOI:10.26355/eurrev_201907_18450 |
| [12] | Westman PC, Lipinski MJ, Luger D, et al. Inflammation as a driver of adverse left ventricular remodeling after acute myocardial infarction[J]. J Am Coll Cardiol, 2016, 67(17): 2050-2060. DOI:10.1016/j.jacc.2016.01.073 |
| [13] | Essandoh K, Li YT, Huo JZ, et al. MiRNA-mediated macrophage polarization and its potential role in the regulation of inflammatory response[J]. Shock, 2016, 46(2): 122-131. DOI:10.1097/shk.0000000000000604 |
| [14] | Sun T, Dong YH, Du W, et al. The role of MicroRNAs in myocardial infarction: from molecular mechanism to clinical application[J]. IJMS, 2017, 18(4): 745. DOI:10.3390/ijms18040745 |
| [15] | Epelman S, Liu PP, Mann DL. Role of innate and adaptive immune mechanisms in cardiac injury and repair[J]. Nat Rev Immunol, 2015, 15(2): 117-129. DOI:10.1038/nri3800 |
 2020, Vol. 29
2020, Vol. 29




