脓毒症(sepsis)是由感染引起的全身炎症反应综合征,具有高发病率及高死亡率特点[1],至今仍是重症医学科研究难题之一。大量研究表明免疫功能紊乱为脓毒症发生及进展的中心环节,在脓毒症致死性作用中起重要作用。胸腺肽(Thymosins THY)为胸腺激素的小分子蛋白家族,根据等电点主要可分为3个组(α,β和γ)[2-4],胸腺肽最初于1966年由Goldstein和White在对小牛研究中从小牛胸腺中分离纯化[5],在免疫系统的发育和维持尤其在T淋巴细胞的分化和成熟中起至关重要的作用[6-7]。其中Tα1是一种由28个氨基酸组成的天然的小分子多肽[8],可促进T淋巴细胞和抗体结合,从而进一步调节细胞因子和趋化因子的产生[9-10]。关于Tα1对于脓毒症保护作用近年来研究较多,本研究通过Tα1对脓毒症小鼠分子机制研究进行探讨Tα1对脓毒症小鼠的保护性作用。
1 材料与方法所有实验涉及动物均由郑州大学实验动物中心提供。经郑州大学第一附属医院动物保护使用委员会批准进行的。选用C57雌性小鼠30只,体质量19~22 g, 采用随机数表法将C57小鼠分为空白对照组、LPS组、LPS+胸腺肽α1三组,每组10只, 空白对照组采用0.9% Nacl 10 mL/kg腹腔注射,LPS组采用LPS溶于PBS终浓度5 mg/mL 10 mL/kg腹腔注射,LPS+胸腺肽α1组采用LPS溶于PBS终浓度5 mg/mL 10 mL/kg腹腔注射,随后给予胸腺肽α1 500 μg/kg,静脉注射,分别于0 h、24 h、48 h、72 h、96 h计算小鼠生存率。另取C57雌性小鼠24只,体质量19~22 g, 同采用随机数表法将C57分为空白对照组、LPS组、LPS+胸腺肽α1三组,每组8只,三组小鼠模型制作方法同前,于12 h麻醉后摘眼球取血并取肺组织,肺组织在1:10 PBS液冲洗至表面无血液,滤纸拭干后称质量,每20 mg肺组织中加入200 μl已配置RIPA裂解液(每1 mL RIPA裂解液加10 μl蛋白酶抑制剂)于4℃匀浆,离心机10 000 r/min离心10 min后取上清液。血液样本室温自然凝固15 min,3 000 r/min离心20 min后取上清液。所有标本液氮迅速冷冻,-20℃冻存。
采用Elisa测定肺组织及血浆中IL-17A(试剂盒购于美国明尼苏达州,R3000C)、IL-10(试剂盒购于美国明尼苏达州,R1000),同时采用流式细胞分析仪(美国艾森公司)计数血浆中T淋巴细胞及T淋巴细胞分化细胞数目。
实验数据采用graphpad 7.0软件进行处理,计量资料采用均数±标准差(Mean±SD)表示。比较两组独立配对资料样本采用成组t检验,三组间比较采用单因素方差分析,计数资料采取卡方检验(Chi-square test),采用U检验对非正态分布单次测量值进行比较。采用Kruskal-Wallis生存曲线和Logrank检验分析小鼠生存率,部分数据以图形方式呈现为矩形图及单个数据点,水平线代表每组的平均值。以P <0.05为差异有统计学意义,采用双边检验。
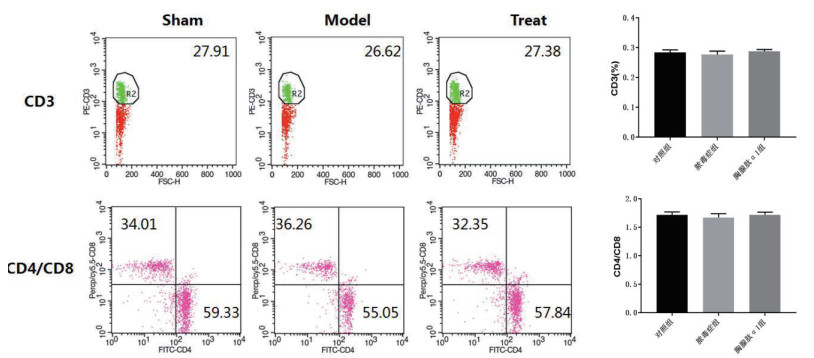
2 结果 2.1 胸腺肽α1对脓毒症小鼠T细胞计数无影响。通过对三组小鼠血浆中T淋巴细胞进行流式细胞计数以分析胸腺肽α1对T淋巴细胞数目的影响, 发现三组间CD3及CD4/CD8数量均差异无统计学意义(P > 0.05)(图 1,表 1)
|
| sham空白对照组;model脓毒症组;Treat胸腺肽组 图 1 小鼠血浆T淋巴细胞流式细胞分析。 Fig 1 Flow cytometric analysis of T lymphocytes in mice |
|
|
| 淋巴细胞 | 对照组 | 脓毒症组 | 胸腺肽α1组 | P值 |
| CD3(%) | 28.43±0.86 | 27.66±1.20 | 28.76±0.63 | 0.07 |
| CD4/CD8 | 1.72±0.05 | 1.67±0.07 | 1.72±0.04 | 0.14 |
| 注:小鼠血浆T淋巴细胞计数。 | ||||
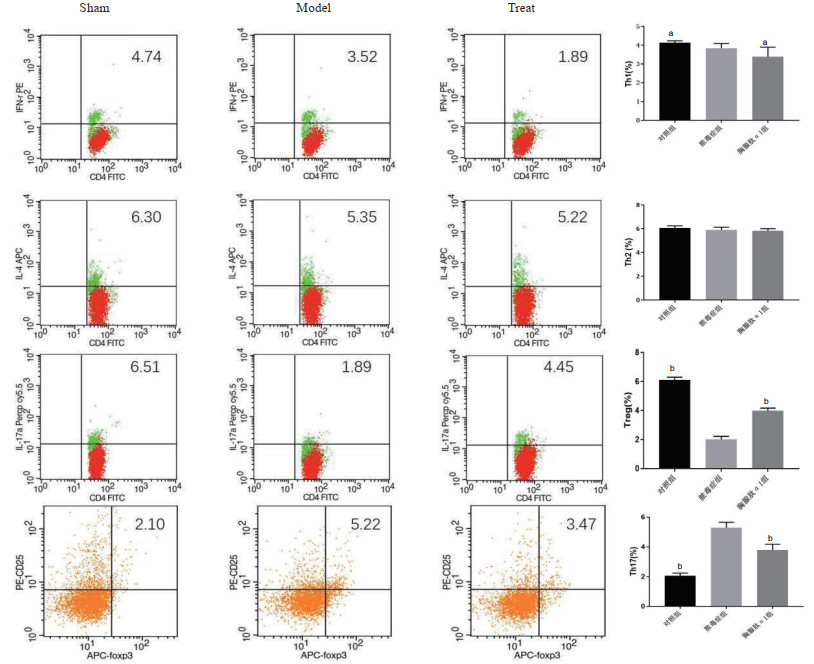
三组小鼠各取8份血浆进行流式细胞分析胸腺肽α1对三组小鼠中T辅助细胞分化影响,发现Th1(%)细胞在脓毒症未治疗组3.84±0.25较空白对照组4.12±0.11减少(P=0.01,t=2.97),较胸腺肽α1治疗组3.38±0.51增多(P=0.04,t=2.28)(图 2)。Th2(%)在三组间变化差异差异无统计学意义(P=0.07)(图 2)。Treg(%)在胸腺肽α1治疗组4.00±0.18及空白对照组(6.13±0.17)均较脓毒症组(2.01±0.21)明显增加(P<0.01)(图 2)。Th17(%)在脓毒症组(5.30±0.36)较空白对照组(2.06±0.18)明显增加(P<0.01, t=22.5), 胸腺肽α1组(3.80±0.39)较脓毒症组(5.30±0.36)明显减少(P<0.01, t=7.99),脓毒症组较其他两组变化均差异有统计学意义(P<0.01)(图 2)。
|
| sham:空白对照组;model:脓毒症组;Treat:胸腺肽组(aP<0.05;bP<0.01) 图 2 小鼠血浆T细胞分化流式分析 Fig 2 Flow cytometric analysis of T lymphocyte differentiation in mice |
|
|
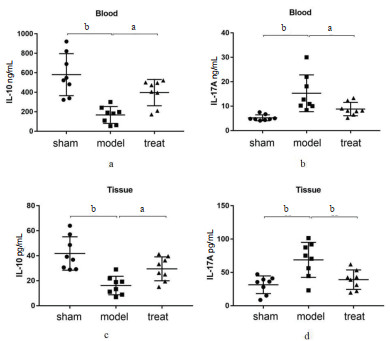
三组中各取8份血浆及肺组织采用ELISA进行分析。血浆中IL-10在脓毒症组(210.80±120.81)ng/mL较空白对照组为(597.70±207.50)ng/mL明显减少(P<0.01, t=56),而IL-10在胸腺肽α1治疗组为(403.30±145.82)ng/mL较脓毒症组(210.80±120.81)ng/mL明显增加,差异具有统计学意义(P=0.02,t=2.86)(图 3A)。肺组织中IL-10在脓毒症组为(18.60±6.24)ng/mL较空白对照组为(40.90±11.34)ng/mL明显减少(P<0.01, t=4.87),肺组织IL-10在胸腺肽α1治疗组(32.70±19.27)ng/mL较脓毒症组(18.60±6.24)ng/mL明显增加,差异具有统计学意义(P=0.02, t=2.74)(图 3C)。血浆中IL-17A在脓毒症组(15.40±6.41)ng/mL较空白对照组为(5.10±1.83)ng/mL明显增加(P<0.01, t=4.37),较胸腺肽α1治疗组(9.60±2.84)ng/mL明显减少,差异具有统计学意义(P=0.03, t=2.34)(图 3B)。肺组织中IL-17A在脓毒症组为(54.60±15.56)ng/mL较空白对照组(30.10±10.53)ng/mL明显减少(P<0.01, t=3.69),较胸腺肽α1治疗组(36.23±6.57)ng/mL明显减少,差异具有统计学意义(P<0.01, t=3.10)(图 3D)。
|
| sham空白对照组;model脓毒症组;Treat胸腺肽组;blood血浆;Tissue肺组织(上横线为最大值,下横线为最小值,中间横线为均值,aP<0.05;bP<0.01) 图 3 小鼠血浆、肺组织中IL-10、IL-17(Elisa)。 Fig 3 Determination of IL-10 and IL-17 in mice (Elisa) |
|
|
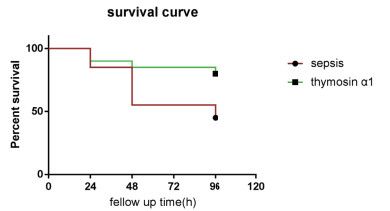
注射LPS后1h给予小鼠注射胸腺肽α1(500 μg/kg)。观察脓毒症组和胸腺肽α1治疗组小鼠的生存率。每24 h观察一次,持续至96 h。生存曲线显示治疗组生存率较脓毒症组增高25%(P <0.05)(图 4)。
|
| LPS诱导的脓毒症大鼠的存活率在使用胸腺肽α1后得到改善。对Kruskal-Wallis生存曲线进行Log-rank检验结果胸腺肽α1治疗组(n=10)生存率明显高于LPS诱导脓毒症组(n=10)(P = 0.029)。Survival curve生存曲线;Percent survival生存率;Fellow up time随访时间;Sepsis脓毒症;Thymosin α1. 图 4 小鼠生存曲线 Fig 4 Survival curve of mice |
|
|
研究表明胸腺肽α1通过对免疫细胞分化的影响进而对脓毒症小鼠具有保护作用。笔者发现胸腺肽α1通过影响T淋巴细胞分化主要减少辅助性T细胞17型(T help cell 17, Th17)、增加向调节性T细胞(regulatory T cell,Treg)分化进一步改变血浆及肺组织匀浆中炎症因子IL-10、IL-17A表达,最终对脓毒症小鼠起保护性作用,从而减轻肺组织病变、增加患者生存率。研究结果中CD3和CD4/CD8在三组中差异无统计学意义而CD细胞进一步分化中Th1、Th17、Treg细胞差异均有统计学意义,考虑为胸腺肽α1对CD细胞分类无明显影响,而是通过影响CD细胞进一步分化,尤其表现为增加CD细胞向Treg细胞分化及减少向Th17细胞分化来进一步调节炎症因子以进一步对脓毒症起保护性作用。Feng等研究发现在自身免疫性肝病中处于活动期的患者Th17百分比及Th17/Treg比值较稳定期均明显增加,提示Th17百分比和Th17/Treg比值的增加在AILD发病机制和发展中起重要作用[11]。Th17淋巴细胞现在被广泛认为是各种慢性肺部疾病的关键,外周血Th17细胞百分比可能有益于未来对支气管哮喘的靶向治疗[12]。Ding等[13]发现Treg/Th17的平衡对冠心病患者至关重要。
IL-17A特异性由Th17细胞分泌,与本研究中IL-17A差异性变化与Th17差异性变化同步相一致,属于IL-17中最常见亚型之一[14],Nadeem等[15]发现IL-17A能有效地介导中性粒细胞,从而与炎症性肺部疾病密切相关。近期研究亦表明对于急性肺损伤患者,给予LED(light emitting diode)照射治疗后检测小鼠血浆中IL-17水平明显下降,表明IL-17水平下降与急性肺损伤患者症状好转密切相关[16]。与本研究治疗组IL-17A水平下降结果相一致。Lewkowicz等[17]研究表明以LPS刺激小鼠Treg细胞可诱导IL-10产生,与我们研究结果中小鼠血浆及肺组织匀浆中IL-10水平波动与Treg分化产生水平一致相符。Wei等[18]研究发现Treg激活状态调节产生不同效应Treg亚群的证据,这些亚群协同工作以维持免疫耐受。IL-10对于机体炎症反应及免疫作用调节目前已有文献[19-21]证明,与本研究结果治疗组IL-10水平升高对脓毒症进行保护相一致。由此可得出结论,胸腺肽α1通过影响脓毒症小鼠CD细胞进一步分化及血浆及肺组织中炎症因子的产生对脓毒症小鼠进行调节及保护,为临床中脓毒症患者的诊断及治疗具有一定的积极指导意义。从本研究得出胸腺肽α1通过对脓毒症小鼠免疫分化影响而增加脓毒症小鼠生存率,对脓毒症小鼠具有保护作用,对于临床用药具有一定程度的指导意义。
| [1] | Zhu T, Zhao YS, Hu H, et al. TRPM2 channel regulates cytokines production in astrocytes and aggravates brain disorder during lipopolysaccharide-induced endotoxin sepsis[J]. Int Immunopharmacol, 2019, 75: 105836. DOI:10.1016/j.intimp.2019.105836 |
| [2] | Pica F, Chimenti MS, Gaziano R, et al. Serum thymosin α 1 levels in patients with chronic inflammatory autoimmune diseases[J]. Clin Exp Immunol, 2016, 186(1): 39-45. DOI:10.1111/cei.12833 |
| [3] | Wei C, Kim IK, Li L, et al. Thymosin Beta 4 protects mice from monocrotaline-induced pulmonary hypertension and right ventricular hypertrophy[J]. Plos One, 2014, 9(11): e110598. DOI:10.1371/journal.pone.0110598 |
| [4] | Liang J, Cai WJ, Han T, et al. The expression of thymosin β4 in chronic hepatitis B combined nonalcoholic fatty liver disease[J]. Medicine, 2016, 95(52): e5763. DOI:10.1097/md.0000000000005763 |
| [5] | Goldstein AL, Slater FD, White A. Preparation, assay, and partial purification of a thymic lymphocytopoietic factor (thymosin)[J]. Proc Natl Acad Sci, 1966, 56(3): 1010-1017. DOI:10.1073/pnas.56.3.1010 |
| [6] | Zhang C, Wang YD, Fang Q, et al. Thymosin fromBombyx morⅡs down-regulated in expression by BmNPV exhibiting antiviral activity[J]. J Insect Sci, 2016, 16(1): 75. DOI:10.1093/jisesa/iew039 |
| [7] | Payen D, Monneret G, Hotchkiss R. Immunotherapy-a potential new way forward in the treatment of sepsis[J]. Crit Care, 2013, 17(1): 118. DOI:10.1186/cc12490 |
| [8] | Wang FW, Yu TT, Zheng H, et al. Thymosin alpha1-fc modulates the immune system and down-regulates the progression of melanoma and breast cancer with a prolonged half-life[J]. Sci Rep, 2018, 8: 12351. DOI:10.1038/s41598-018-30956-y |
| [9] | Garaci E. From Thymus to cystic fibrosis:the amazing life of thymosin alpha 1[J]. Expert Opin Biol Ther, 2018, 18(sup1): 9-11. DOI:10.1080/14712598.2018.1484447 |
| [10] | Pei F, Guan XD, Wu JF. Thymosin alpha 1 treatment for patients with sepsis[J]. Expert Opin Biol Ther, 2018, 18(sup1): 71-76. DOI:10.1080/14712598.2018.1484104 |
| [11] | Feng TT, Zou T, Wang X, et al. Clinical significance of changes in the Th17/Treg ratio in autoimmune liver disease[J]. WJG, 2017, 23(21): 3832. DOI:10.3748/wjg.v23.i21.3832 |
| [12] | Velikova T, Lazova S, Perenovska P, et al. Th17 cells in Bulgarian children with chronic obstructive lung diseases[J]. Allergol Et Immunopathol, 2019, 47(3): 227-233. DOI:10.1016/j.aller.2018.07.004 |
| [13] | Ding JW, Zhou T, Zheng XX, et al. The effects of high mobility group box-1 protein on peripheral Treg/Th17 balance in patients with atherosclerosis[J]. Acta Cardiol Sin, 2018, 34(5): 399-408. DOI:10.6515/ACS.201809_34(5).20180419A |
| [14] | Muntaka S, Almuhanna Y, Jackson D, et al. Gamma interferon and interleukin-17A differentially influence the response of human macrophages and neutrophils to pseudomonas aeruginosa infection[J]. Infect Immun, 2018, 87(2): e00814-18. DOI:10.1128/iai.00814-18 |
| [15] | Nadeem A, Al-Harbi NO, Alfardan AS, et al. IL-17A-induced neutrophilic airway inflammation is mediated by oxidant-antioxidant imbalance and inflammatory cytokines in mice[J]. Biomed Pharmacother, 2018, 107: 1196-1204. DOI:10.1016/j.biopha.2018.08.123 |
| [16] | Da-Palma-cruz M, da Silva RF, Monteiro D, et al. Photobiomodulation modulates the resolution of inflammation during acute lung injury induced by sepsis[J]. Lasers Med Sci, 2019, 34(1): 191-199. DOI:10.1007/s10103-018-2688-1 |
| [17] | Lewkowicz N, Mycko P, Przygodzka P, et al. Induction of human IL-10-producing neutrophils by LPS-stimulated Treg cells and IL-10[J]. Mucosal Immunol, 2016, 9(2): 364-378. DOI:10.1038/mi.2015.66 |
| [18] | Wei XD, Zhang JH, Gu QC, et al. Reciprocal expression of IL-35 and IL-10 defines two distinct effector treg subsets that are required for maintenance of immune tolerance[J]. Cell Rep, 2017, 21(7): 1853-1869. DOI:10.1016/j.celrep.2017.10.090 |
| [19] | Jin RM, Warunek J, Wohlfert EA. Therapeutic administration of IL-10 and amphiregulin alleviates chronic skeletal muscle inflammation and damage induced by infection[J]. IH, 2018, 2(5): 142-154. DOI:10.4049/immunohorizons.1800024 |
| [20] | Xu YJ, Tang XY, Yang M, et al. Interleukin 10 gene-modified bone marrow-derived dendritic cells attenuate liver fibrosis in mice by inducing regulatory T cells and inhibiting the TGF-β/smad signaling pathway[J]. Med Inflam, 2019, 2019: 1-15. DOI:10.1155/2019/4652596 |
| [21] | Bunn PT, Montes de Oca M, de Labastida Rivera F, et al. Distinct roles for CD4+foxp3+regulatory T cells and IL-10-mediated immunoregulatory mechanisms during experimental visceral leishmaniasis caused by Leishmania donovani[J]. JI, 2018, 201(11): 3362-3372. DOI:10.4049/jimmunol.1701582 |
 2020, Vol. 29
2020, Vol. 29




