脓毒症(sepsis)是感染时宿主反应失调导致的致命性器官功能障碍[1]。该病发病率高,起病急,迅速出现多器官功能衰竭,是住院患者死亡最主要的原因[2]。早期天然免疫反应阶段,多种小分子分泌蛋白大量释放,激活中性粒细胞等免疫细胞并调节其功能。一方面,促使中性粒细胞向感染部位募集,发挥吞噬、脱颗粒、释放活性氧物质(reactive oxygen species, ROS)等功能,是机体清除病原体、控制感染最主要的机制[3]。但另一方面,中性粒细胞被持续激活过度释放大量ROS,损伤内皮细胞、破坏内皮屏障的完整性、造成毛细血管渗漏、组织缺血,却导致多器官功能衰竭[4]。而抗氧化治疗,则能改善器官损伤[5]。因此,探索天然免疫反应阶段调控中性粒细胞功能的机制,对于进一步明确脓毒症发病机制,探索治疗新靶点有重要的意义[6]。
细胞因子样蛋白1(cytokine-like protein 1,CYTL1)是一种在人体内广泛表达的小分子分泌蛋白,进化保守,由136个氨基酸编码[7]。CYTL1具备一些趋化因子的特点,其受体是经典的趋化因子受体CCR2B[8],可以通过结合该受体对单核巨噬细胞产生趋化活性。但CYTL1不具备经典的趋化因子结构,有研究证实其在功能方面与经典的细胞因子类似[9]。这类分泌蛋白是具有调控细胞生长分化、调节免疫功能和生理病理反应的小分子蛋白质,是免疫细胞间交流的语言,对天然免疫应答和适应性免疫应答均发挥重要调控作用。因此,探索其在脓毒症中的作用,有利于进一步了解疾病宿主反应失调的机制。本研究在盲肠结扎穿孔术(cecal ligation and puncture,CLP)制备的经典脓毒症模型中,探索CYTL1对中性粒细胞功能影响。为进一步了解天然免疫反应阶段调控中性粒细胞功能的机制,为深入探索脓毒症的病理生理机制提供新的理论依据和研究基础。
1 材料与方法 1.1 实验材料重组CYTL1蛋白由本研究组成员开发获得[10]。甲酰肽(N-formyl-Met-Leu-Phe, fMLF)、白细胞介素(interleukin-8,IL-8)和基本实验室耗材购自北京索莱宝生物科技有限公司。FITC-E.coli, PBS和细胞培养材料购自美国Invitrogen公司。
1.2 方法 1.2.1 脓毒症小鼠模型建立C57BL/6小鼠购自军事医学科学院动物实验中心。周龄8~10 w,体质量19~23 g。适应性饲养至少3 d(5只/笼)。用CLP法制备脓毒症模型[11]。5%水合氯醛0.8 mL/kg腹腔注射麻醉小鼠,消毒后腹正中切口。暴露盲肠,经回盲瓣以远中点用4-0丝线结扎,远端用25 gauge针贯通穿刺1次,诱导多重细菌感染的腹膜炎。术后皮下注射生理盐水1 mL进行液体复苏。该动物实验已通过北京大学人民医院动物伦理委员会审批(No. 20176PHB160-01)。
1.2.2 外周血中性粒细胞分离采用密度梯度离心法从外周血中分离中性粒细胞[12]。根据试剂(Biomedical Technologies,美国)说明书将细胞分层。将尖吸管深入到中层和下层之间吸取粒细胞。接着将吸出的细胞用大体积的无血清RPMI 1640培养基清洗两次。此时得到的即为中性粒细胞。
1.2.3 中性粒细胞趋化功能测定使用Boyden趋化小室(Falcon,北京,中国)完成。分别取对照组和CLP组小鼠分离外周血中性粒细胞,利用PBS、CYTL1、fMLF和IL-8进行趋化。CYTL1用含0.1% BSA RPMI 1 640培养基进行稀释至10 ng/mL;fMLF和IL-8为阳性对照(前者为“终点型”趋化因子代表,后者为“中间型”趋化因子代表);PBS为阴性对照。将Boyden趋化小室的底层板放在水平台面上,将稀释的趋化物加入小孔中。粒细胞使用3μm孔径的PVPF聚碳膜分隔。细胞悬液加入上层板的孔中。趋化小室置于湿盒中放入37 ℃,5% CO2孵箱中孵育0.5 h。趋化的细胞在每个小孔随机选择5个高倍镜视野(×400)计数取平均值计算。
1.2.4 中性粒细胞吞噬能力检测按照荧光素标记大肠杆菌吞噬试剂盒说明书(Phagotest试剂盒,BD公司,美国),解冻0.5 mLHBSS与FITC标记的E. coli k-12微粒干粉充分混合。中性粒细胞(每孔0.5 mL)±微粒(每孔0.5 mL)37 ℃避光孵育30 min后,去除上清液,加入100 μL 1.25 g/L台盼蓝(pH 4.4)1 min(淬灭多余E. coli k-12微粒),通过流式细胞仪检测FITC荧光强度,对发生吞噬作用细胞的百分比和其平均荧光强度(细胞吞噬细菌数量)进行分析。细胞用固定液固定后,共聚焦显微镜观察细胞吞噬大肠杆菌数量。
1.2.5 ROS释放的检测用氧化敏感的荧光探针DCFH-DA(BestBio,上海,中国)检测ROS产生,按照1:1 000用无血清培养液稀释DCFH-DA,使终浓度为10 μmol/L。中性粒细胞收集后悬浮于稀释好的DCFH-DA中,37 ℃细胞培养箱内孵育20 min。用无血清细胞培养液洗涤细胞三次,使用流式细胞仪检测其发光强度。
1.3 统计学方法使用SPSS 20.0统计软件对实验数据进行分析。符合正态分布的计量资料采用均数±标准差(Mean±SD)表示,组间比较采用成组t检验;计数资料采用率表示,组间比较采用卡方检验。以P <0.05为差异的显著性有统计学意义。
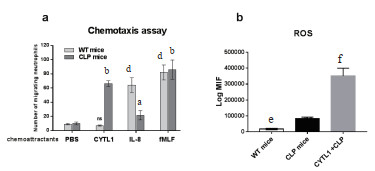
2 结果 2.1 CYTL1对脓毒症小鼠中性粒细胞的趋化活性CYTL1对对照组小鼠中性粒细胞趋化活性极低,但对脓毒症小鼠中性粒细胞趋化活性较高,趋化的细胞数两组间差异有统计学意义[(10.0 ± 2.0)vs(66.3 ± 4.0),t =-21.6,P<0.01]。与不同类型趋化因子的进行比较,结果显示,CYTL1的趋化活性显著高于“中间型”趋化因子IL-8[(66.3 ± 4.0)vs (21.7 ± 6.5),t = 10.1,P = 0.001];与“终点型”趋化因子fMLF的差别没有统计学意义[(66.3 ± 4.0)vs (86.0 ± 13.5),t =-2.4,P = 0.073](图 1A)。
|
| A:与CLP组PBS比较, aP<0.05,bP<0.01;与WT组PBS比较, cP<0.05,dP <0.01。B:与CLP组比较, eP<0.05,fP <0.01。CLP,cecal ligation and puncture,盲肠结扎穿孔术;ROS,reactive oxygen species,氧活性物质。 图 1 CYTL1对小鼠中性粒细胞的趋化活性和对ROS释放水平的影响。 Fig 1 The chemotactic activity of CYTL1 on mouse neutrophils and its influence on ROS release |
|
|
分离对照组和CLP组小鼠外周血中性粒细胞,用CYTL1蛋白进行刺激后,流式细胞术检测各组中性粒细胞ROS释放水平。结果显示CLP组小鼠中性粒细胞ROS释放显著高于对照组[(17 562.0 ± 2 156.6)vs(84 340.1 ± 5 353.5),t =-20.0,P<0.0001]。CYTL1则可以显著促进CLP小鼠中性粒细胞的ROS释放水平【(84 340.1 ± 5 353.5)vs (351 018.7 ± 72 291.7),t = 6.4,P = 0.003](图 1B)。
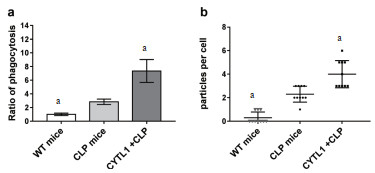
2.3 CYTL1对脓毒症小鼠中性粒细胞吞噬能力的影响分离对照组和CLP组小鼠外周血中性粒细胞,用CYTL1蛋白进行刺激。流式细胞术检测显示,CYTL1蛋白作用后的CLP小鼠中性粒细胞内标记大肠杆菌的荧光强度较CLP组显著增强[(7.35 ± 1.66)vs(2.84 ± 0.62),t = 4.4,P = 0.012](图 2A);通过共聚焦显微镜观察也显示,CYTL1蛋白作用后,CLP小鼠中性粒细胞吞噬的大肠杆菌颗粒数较CLP组显著增多[(4.0 ± 1.2) vs(2.3 ± 0.7),t = 4.02,P = 0.01](图 2B)。
|
| 与CLP组比较, aP<0.05。CLP,cecal ligation and puncture,盲肠结扎穿孔术 图 2 CYTL1对各组小鼠中性粒细胞吞噬能力的影响 Fig 2 Effect of CYTL1 on the phagocytosis of neutrophils in mice of each group |
|
|
脓毒症发病率及死亡率极高,目前发病机制尚不清楚[13],且尚无有效的针对性治疗药物[14]。早期天然免疫反应阶段,多种小分子蛋白如细胞因子、趋化因子等大量释放,双向调节中性粒细胞等免疫细胞的功能,既是清除细菌、促进感染恢复的重要调节机制,也是诱发剧烈的过度炎症反应,造成机体器官组织损伤的原因。探索这类小分子蛋白的作用机制,有利于进一步明确脓毒症的发病机制并探寻新的治疗靶点。本研究检测了CYTL1对脓毒症小鼠中性粒细胞的生物学功能,结果显示该分泌蛋白可以促进细胞活化参与炎症反应,对细胞有显著的趋化活性,可以促进细胞吞噬大肠杆菌颗粒和释放ROS。提示在脓毒症早期天然免疫反应阶段,CYTL1可能对中性粒细胞作用有重要的调控作用。
既往体外研究的文献报道,CYTL1通过结合经典的趋化因子受体CCR2B对单核巨噬细胞有趋化活性[8]。本研究进一步证实了该分泌蛋白在脓毒症中对中性粒细胞有较强的趋化活性。感染状态下,中性粒细胞趋化至感染部位,活化并清除病原体,是宿主控制感染的关键环节。在感染过程中,多种趋化因子对中性粒细胞产生趋化活性,包括细菌产物及内源性小分子蛋白等。趋化因子可以分为两类,“中间型”(intermediary)趋化因子(如IL-8),以及“终点型”(end target)趋化物质(如fMLF)[15]。不同的趋化分子在不同的调节因素下,形成网络化效应,诱导中性粒细胞的募集能力。脓毒症时,细菌成分LPS可以抑制经典的趋化因子受体CXCR2表达,而中性粒细胞膜表面CCR2受体表达上调。CCR2受体激活后,诱导中性粒细胞向肺等非感染器官募集[16]。趋化受体的表达异常,导致中性粒细胞的趋化功能失调,对中间型趋化物质的趋化活性下降[17],向感染部位的趋化能力下降;但是对终点趋化物质的趋化活性不受影响[18]。因此,中性粒细胞不能向感染部位募集,反而向远隔器官募集,造成感染控制不良、器官功能损伤以至于患者预后不良。本研究发现,在脓毒症状态下,CYTL1对中性粒细胞仍然具有较强的趋化活性。这一结论与CYTL1对细胞的趋化活性是通过其受体CCR2B发挥是一致的。因此,我们认为CYTL1在脓毒症中,可能是调节中性粒细胞的趋化活性的重要因素之一,可能成为调节中性粒细胞趋化能力的新靶点。
脓毒症时,中性粒细胞是外周血中机体清除病原体最重要、数量最多的吞噬细胞。它们通过吞噬相关受体以及酪氨酸激酶来识别病原体并形成吞噬小体。本研究发现CYTL1可以显著增强脓毒症小鼠外周血中性粒细胞的吞噬能力。CYTL1的受体是趋化因子受体CCR2B,但是其分子结构并不是经典的趋化因子结构。而且本研究显示CYTL1对细胞吞噬功能的作用,提示其可能具有更多的细胞因子功能,可能有其他的受体介导其生物学功能,需要在进一步的研究中进行研究。吞噬作用可以激活中性粒细胞一系列的后续功能,包括释放抗菌肽、蛋白酶、髓过氧化物酶以及ROS。这些物质在中性粒细胞杀伤并清除病原体的过程中发挥了至关重要的作用。因此,可以认为CYTL1是调节中性粒细胞吞噬杀灭细菌重要的内源性因素。
中性粒细胞活化吞噬病原体的过程中,往往释放大量ROS。ROS既是杀灭病原体及坏死组织的重要物质,也是造成宿主器官组织损伤的原因。外周血循环中的成熟中性粒细胞有三种状态,静息状态(resting),预备状态(primed)和活化状态(activated)。感染初期,极少量的细菌成分和内源性物质就可以使中性粒细胞从静息状态进入预备状态。在趋化因子的作用下,预备状态的中性粒细胞募集至感染局部,然后活化释放ROS发挥清除病原体的作用。适当的预备状态中性粒细胞的存在,有利于机体迅速而精准的对抗病原体。但是,在脓毒症中,中性粒细胞过度激活释放过量的ROS到细胞外环境,是造成机体损伤器官功能障碍的重要原因[19]。脓毒症患者外周血中,存在相当数量的预备状态中性粒细胞[20]。本研究结果显示,CYTL1可以显著增强脓毒症小鼠中性粒细胞释放ROS。因此,CYTL1对中性粒细胞ROS释放的促进作用,可能是宿主对抗感染时,调节中性粒细胞杀菌和细胞损伤双重作用的重要因素。
综上所述,CYTL1可以促进脓毒症小鼠中性粒细胞的趋化、吞噬和ROS释放功能。该因子作为内源性小分子分泌蛋白,可能在脓毒症早期天然免疫反应中对炎症反应有重要的调节作用。本研究结果为进一步探讨脓毒症时中性粒细胞募集部位和作用的调控机制提供了新的理论依据,为深入探索脓毒症时调控中性粒细胞发挥对抗感染和损伤机体双重作用的分子生物学机制,提供了新的研究靶点。
| [1] | Rello J, Valenzuela-Sánchez F, Ruiz-Rodriguez M, et al. Sepsis:A review of advances in management[J]. Adv Ther, 2017, 34(11): 2393-2411. DOI:10.1007/s12325-017-0622-8 |
| [2] | Ehlenbach WJ, Gilmore-Bykovskyi A, Repplinger MD, et al. Sepsis survivors admitted to skilled nursing facilities[J]. Crit Care Med, 2018, 46(1): 37-44. DOI:10.1097/ccm.0000000000002755 |
| [3] | Mortaz E, Alipoor SD, Adcock IM, et al. Update on neutrophil function in severe inflammation[J]. Front Immunol, 2018, 9: 2171. DOI:10.3389/fimmu.2018.02171 |
| [4] | El-Benna J, Hurtado-Nedelec M, Marzaioli V, et al. Priming of the neutrophil respiratory burst:role in host defense and inflammation[J]. Immunol Rev, 2016, 273(1): 180-193. DOI:10.1111/imr.12447 |
| [5] | 陈隆望, 罗以楠, 蔡文超, 等. 组蛋白去乙酰化酶2调节Nrf2乙酰化水平在脂多糖诱导Ⅱ型肺泡上皮细胞损伤中的抗氧化作用机制[J]. 中华急诊医学杂志, 2019, 28(3): 328-334. DOI:10.3760/cma.j.issn.1671-0282.2019.03.011 |
| [6] | 吴淡森, 石松菁, 张瑞, 等. 脓毒症并多器官功能不全综合征患者的新型抑制性细胞因子IL-35表达及其临床意义[J]. 中华急诊医学杂志, 2019, 28(2): 175-180. DOI:10.3760/cma.j.issn.1671-0282.2019.02.009 |
| [7] | Liu X, Rapp N, Deans R, et al. Molecular cloning and chromosomal mapping of a candidate cytokine gene selectively expressed in human CD34± cells[J]. Genomics, 2000, 65(3): 283-292. DOI:10.1006/geno.2000.6170 |
| [8] | Wang XL, Li T, Wang WY, et al. Cytokine-like 1 chemoattracts monocytes/macrophages via CCR2[J]. JI, 2016, 196(10): 4090-4099. DOI:10.4049/jimmunol.1501908 |
| [9] | Tomczak A, Singh K, Gittis AG, et al. Biochemical and biophysical characterization of cytokine-like protein 1(CYTL1)[J]. Cytokine, 2017, 96: 238-246. DOI:10.1016/j.cyto.2017.04.023 |
| [10] | Wang XL, Liu HH, Yuan WQ, et al. Efficient production of CYTL1 protein using mouse IgGκ signal peptide in the CHO cell expression system[J]. Acta Biochim Biophys Sin, 2016, 48(4): 391-394. DOI:10.1093/abbs/gmw007 |
| [11] | Li S, Zhu FX, Zhao XJ, et al. The immunoprotective activity of interleukin-33 in mouse model of cecal ligation and puncture-induced sepsis[J]. Immunol Lett, 2016, 169: 1-7. DOI:10.1016/j.imlet.2015.11.009 |
| [12] | Maini A, Foote JR, Hayhoe R, et al. Monocyte and neutrophil isolation, migration, and phagocytosis assays[J]. Curr Protoc Immunol, 2018, 122(1): e53. DOI:10.1002/cpim.53 |
| [13] | Chambers KA. Outcomes of severe sepsis and septic shock patients after stratification by initial lactate value[J]. World J Emerg Med, 2018, 9(2): 113. DOI:10.5847/wjem.j.1920-8642.2018.02.005 |
| [14] | Ma Y, Yu XY, Wang Y. Dose-related effects of dexmedetomidine on immunomodulation and mortality to septic shock in rats[J]. World J Emerg Med, 2018, 9(1): 56-63. DOI:10.5847/wjem.j.1920-8642.2018.01.009 |
| [15] | Heit B, Robbins SM, Downey CM, et al. PTEN functions to'prioritize'chemotactic cues and prevent'distraction'in migrating neutrophils[J]. Nat Immunol, 2008, 9(7): 743-752. DOI:10.1038/ni.1623 |
| [16] | Souto FO, Alves-Filho JC, Turato WM, et al. Essential role of CCR2 in neutrophil tissue infiltration and multiple organ dysfunction in sepsis[J]. Am J Respir Crit Care Med, 2011, 183(2): 234-242. DOI:10.1164/rccm.201003-0416oc |
| [17] | O'Neill LAJ, Golenbock D, Bowie AG. The history of Toll-like receptors:redefining innate immunity[J]. Nat Rev Immunol, 2013, 13(6): 453-460. DOI:10.1038/nri3446 |
| [18] | Wang X, Qin WT, Zhang YS, et al. Endotoxin promotes neutrophil hierarchical chemotaxis via the p38-membrane receptor pathway[J]. Oncotarget, 2016, 7(45): 74247-74258. DOI:10.18632/oncotarget.12093 |
| [19] | Horiguchi H, Loftus TJ, Hawkins RB, et al. Innate immunity in the persistent inflammation, immunosuppression, and catabolism syndrome and its implications for therapy[J]. Front Immunol, 2018, 9: 595. DOI:10.3389/fimmu.2018.00595 |
| [20] | Chapela SP, Burgos I, Congost C, et al. Parenteral succinate reduces systemic ROS production in septic rats, but it does not reduce creatinine levels[J]. Oxidative Med Cell Longev, 2018, 2018: 1-6. DOI:10.1155/2018/1928945. |
 2020, Vol. 29
2020, Vol. 29




