急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)是短时间内(1周内),由心源性以外的各种肺内外致病因素例如严重感染、创伤、休克等导致的进行性低氧性呼吸衰竭。其主要病理改变为肺部毛细血管通透性增加以及充气肺组织的减少[1]。ARDS是ICU的常见病,从被提出至今已经50年,但病死率依旧维持在一个较高的水平[2]。氧合指数作为传统的评估ARDS病情的指标开始体现出了其局限性,相比于1994年的AECC标准,2012年的Berlin标准加入了呼气末正压(PEEP)≥5 cmH2O(1 cmH2O=0.098 kPa)的限制,但对于预后的提升有限。其中的原因可能是氧合指数无法全面地反映呼吸机支持力度,无法评估呼吸机相关肺损伤风险等。因此,对于ARDS预测指标的改良将在医生的临床实践、医疗资源的合理分配及相关政策制定等领域起重要作用。
近年来的一些研究表示,机械通气压力参数,包括平台压(plateau pressure, Pplat),驱动压(driving pressure, ΔP),平均气道压(mean airway pressure,Pmean)被证实与ARDS患者的预后相关[3-5]。机械通气压力是呼吸力学的基本参数,通常可以通过呼吸机直接测量得出,是用来管理机械通气患者气道及实施肺保护通气策略的重要指标。Balzer等[6]则进一步将平均气道压与传统的氧合指数相结合,所产生的氧指数(oxygenation index, OI=Pmean×100×FiO2/PaO2)来评估ARDS患者的预后,发现OI值大于15的患者病死率、ICU住院天数及机械通气天数增加,因此认为OI值比氧合指数更适合评估患者预后。
本研究在此基础上,进一步将OI值中的Pmean替换为其他有文献支持与ARDS预后相关的平台压或者驱动压并得到相应指标,并探究这些新指标与传统的氧合指数相比能否取得类似甚至更好的评估患者预后的效果,并试图找出其中的最优指标。
1 资料与方法 1.1 一般资料收集从2018年1月1日至2018年12月31日在中国医科大学附属第一院的急诊科监护室(EICU)符合Berlin定义ARDS诊断标准的患者的年龄,性别,体质量指数,患者入室时的SOFA评分,非呼吸系统SOFA评分(nR-SOFA)及患者诊断为ARDS后的首次动脉血pH、PaO2、PaCO2、Lac,以及机械通气相关的参数,包括吸入氧体积分数、呼气末正压、吸气末正压、气道平均压。本研究通过医院伦理委员会审核(科伦审【2017】2017-153-2号),治疗及检测均获得患者或家属知情同意。
1.2 排除标准(1) 于EICU及院内治疗时间少于48 h的患者;(2)未行有创机械通气的患者;(3)由于患者个人原因无法配合,放弃诊疗的患者;(4)年龄小于16岁的儿童及新生儿患者;(5)数据不全的患者。
1.3 治疗策略在整个治疗过程中,所有的患者使用肺保护通气策略:将潮气量设置在6~8 mL/kg预计体质量,根据NIH NHLBI ARDS Clinical Network(ARDSnet)的机械通气规范卡片[7]调整吸入氧体积分数和PEEP水平,维持动脉血气PaO2在55~80 mmHg(1 mmHg=0.133 kPa), SpO2在88%~95%之间,并控制平台压在30 cmH2O以下。
1.4 分组与计算根据患者的28 d生存情况,分为生存组与死亡组,并计算患者的氧合指数,氧指数,平台压氧指数(plateau pressure oxygenation index, PPOI= Pplat×100×FiO2/PaO2)和驱动压氧指数(driving pressure oxygenation index, PDOI= ΔP×100×FiO2/PaO2)。
1.5 统计学方法采用SPSS 23.0进行统计学分析。连续性变量用均数±标准差(Mean±SD)表示,分类变量则通过频数(率)表示。正态分布变量使用独立样本t检验、分类变量使用卡方检验或Fisher确切概率法;偏态分布的变量则使用Mann-Whitney U检验进行均数比较。相关性分析使用Spearman秩相关系数进行分析。通过描绘受试者操作特性曲线(ROC)的曲线下面积(AUC)来分析其对ARDS患者预后评估的价值,并计算敏感度、特异度和最佳截断值。以P < 0.05为差异有统计学意义。
2 结果 2.1 患者一般情况共有147例患者纳入到本次研究,其中14例由于个人原因无法继续配合治疗,7例患者缺少重要信息,7例患者在院治疗时间 < 48 h,2例患者失访,未能观察到最终预后,共计30例患者被排除。剩余的117例中,根据Berlin定义对其进行病情评估,轻度组31.62%(n=37),中度组50.43%(n=59),重度组17.95%(n=21),总的28 d病死率为31.62%(n=37)。其中肺炎患者58例,多发创伤患者为25例,非肺炎脓毒症导致的ARDS共8例(包括皮肤软组织感染1例,泌尿系统感染2例,颅内感染1例,急性重症胰腺炎3例,纵隔脓肿1例),其他原因包括误吸、气体中毒、药物中毒等共26例。
2.2 单因素分析生存组和死亡组在SOFA评分、nR-SOFA、动脉血pH、氧合指数及乳酸值差异有统计学意义(P < 0.05)。两组的平均气道压、平台压及驱动压以及OI、PPOI及PDOI的差异有统计学意义。而两组在性别、年龄、体质量指数,初始动脉血氧分压及PaCO2上差异无统计学意义(均P > 0.05),见表 1。
| 指标 | 全部(n=117) | 生存组(n=80) | 死亡组(n=37) | 统计值 | P值 |
| 年龄(岁) | 60.96±14.99 | 60.88±15.33 | 61.14±14.44 | t=0.087 | 0.931 |
| 男性(例,%) | 81(0.69) | 63(0.64) | 22(0.85) | χ2=0.027 | 0.868 |
| 体质量指数 | 23.82±4.59 | 24.17±5.07 | 23.04±3.26 | t=-1.453 | 0.149 |
| SOFA | 7.20±3.12 | 6.53±2.96 | 8.65±3.00 | t=3.589 | < 0.01 |
| nR-SOFA | 4.02±3.05 | 3.44±2.98 | 5.27±2.86 | t=3.131 | 0.002 |
| PEEP(cmH2O) | 6.31±2.85 | 5.55±1.97 | 7.97±3.68 | t=3.774 | < 0.01 |
| Pmean(cmH2O) | 12.34±4.47 | 10.86±3.17 | 15.56±5.16 | t=5.111 | < 0.01 |
| Pplat(cmH2O) | 21.38±6.41 | 19.33±5.45 | 25.84±6.11 | t=5.777 | < 0.01 |
| ΔP(cmH2O) | 15.08±5.48 | 13.79±5.14 | 17.86±5.22 | t=3.973 | < 0.01 |
| pH | 7.41±0.09 | 7.42±0.08 | 7.37±0.11 | t=-2.713 | 0.003 |
| PaO2(mmHg) | 83.14±38.03 | 83.84±33.31 | 78.46±46.96 | t=-0.710 | 0.479 |
| PaCO2(mmHg) | 44.91±15.25 | 44.86±15.25 | 45.03±15.46 | t=0.054 | 0.957 |
| Lac(mmol/L) | 2.31±1.25 | 2.07±1.07 | 2.84±1.47 | t=2.834 | 0.002 |
| 氧合指数 | 163.02±66.97 | 181.02±59.24 | 124.11±66.90 | t=-4.636 | < 0.01 |
| OI | 10.66±11.03 | 7.32±5.62 | 17.89±15.63 | U=2448.5 | < 0.01 |
| PPOI | 17.58±14.77 | 12.65±8.04 | 28.25±19.75 | U=2452.0 | < 0.01 |
| PDOI | 11.80±8.48 | 8.71±4.86 | 18.48±10.62 | U=2422.0 | < 0.01 |
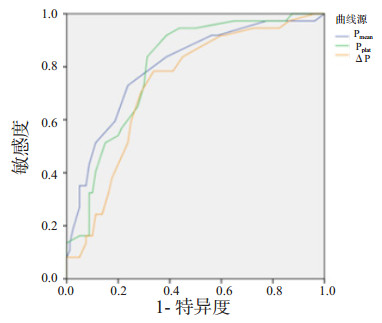
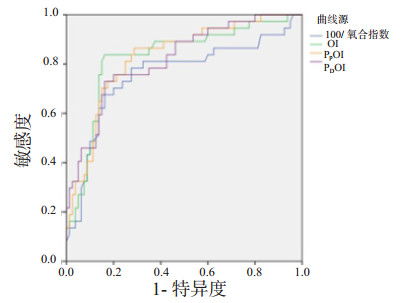
机械通气压力参数中平均气道压(AUC=0.800)和平台压(AUC=0.797)的预测能力最佳,ΔP(AUC=0.731)稍差,见图 1。在评价指标的比较中,传统的氧合指数的预测效果最差(图 2),ROC曲线下面积为0.757,在氧合指数为120 mmHg时取得最佳截断值,敏感度为67.6%,特异度为83.7%。PPOI及OI则拥有较好的预测效果,ROC曲面下面积分别是0.828及0.827。这其中OI在8.72处取得最佳截断值,敏感度为83.8%,特异度为83.7%。PPOI则在12.58处取得最佳截断值,敏感度为86.5%,特异度为71.2%。PPOI的敏感度较好而OI的特异度较强,见表 2。
|
| 图 1 气道压力受试者工作特征曲线 Fig 1 ROC curves for airway pressure parameters |
|
|
|
| 图 2 OI,PPOI,PDOI与100/氧合指数的受试者工作特征曲线 Fig 2 ROC curves for OI, PPOI, PDOI and 100×FiO2/PaO2 |
|
|
| 指标 | AUC(95%CI) | 最佳截断值 | 敏感度(%) | 特异度(%) |
| 100/氧合指数 | 0.757(0.652~0.862) | 0.83 | 67.6 | 83.7 |
| OI | 0.827(0.741~0.913) | 8.72 | 83.8 | 83.7 |
| PPOI | 0.828(0.749~0.908) | 12.58 | 86.5 | 71.2 |
| PDOI | 0.818(0.736~0.901) | 11.27 | 73.0 | 83.7 |
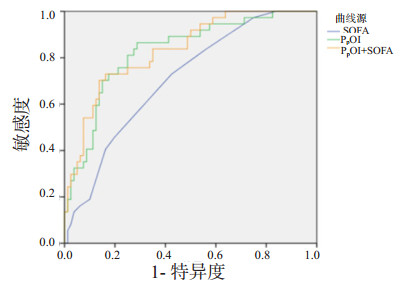
| SOFA | 0.707(0.612~0.803) | 6.50 | 73.0 | 57.5 |
| PPOI+SOFA | 0.833(0.757~0.910) | 23.03 | 73.0 | 83.8 |
将产生的新指标与传统的评价SOFA评分进行分析及比较,OI,PPOI与PDOI均与SOFA评分具有相关性(ρ=0.277,0.273,0.266;均P < 0.05),PPOI对ARDS患者28 d病死率有较好的预测能力(AUC= 0.828)。而PPOI联合SOFA评分对预后的预测能力则会进一步提升(AUC=0.833), 见图 3。
|
| 图 3 PPOI,SOFA评分及PPOI+SOFA评分的受试者工作特征曲线 Fig 3 ROC curves for PPOI, SOFA and SOFA+PPOI |
|
|
ARDS是急诊科的常见危重病,传统的氧合指数在预测ARDS患者的预后上效果尚不理想。而机械通气压力参数以其较好的床旁观测性和连续观测能成为预测ARDS预后及指导ARDS临床管理、评估疗效相对简便的指标。
平均气道压力是整个通气周期的平均气道压力,受吸呼比例、PEEP及平台压等因素影响。本研究中,平台压对ARDS患者28 d预后的预测能力要优于传统的氧合指数,其与氧合能力结合形成的OI值的预测能力进一步提高。有其他研究证实,在ARDS的患者中,平均气道压高的患者病死率以及肌松药物的使用量均高于对照组[8]。虽然平均气道压可以较好地评估患者预后,但其影响因素众多,且具体含义较为模糊,难以为进一步研究提供具体指导。
平台压是指在吸气后屏气或者人为阻塞呼气口时的管路压力,代表此时的肺泡内压,通常用吸气末后≥0.5 s的压力值来表示。本研究中,平台压和平均气道压一样,表现出优于氧合指数的预测能力。这可能与较高的平台压会提高通气相关肺损伤(VLI)的发生率有关[9]。而平台压与氧合指数结合所产生的PPOI预测能力相较于平台压则有进一步提升。
驱动压ΔP =Ers×ΔV,表示克服呼吸系统弹性回缩力所需要的压力大小,在数值上等于Pplat-PEEP。整个呼吸系统的弹性与跨肺弹性及胸壁弹性相关。在ARDS患者中,若采取较低的PEEP支持,由于存在肺不张,导致肺整体顺应性下降,驱动压升高。而当采用较高的PEEP支持时,由于病肺的不均一性,正常通气肺组织会过度通气,也导致整体肺顺应性的下降,提高驱动压[10-11]。本研究显示驱动压在ARDS的预测上的ROC曲线下面积为0.731,并不优于平台压与平均气道压。PDOI值较POI值和OI值并没能体现出优势。Villar等[3]的研究也得出了类似的结论,在接受肺保护通气策略的ARDS患者中,平台压预测预后的能力要略优于驱动压。但另有研究发现,驱动压每增加7 cmH2O,ARDS患者的60 d病死率就会相应增加(RR=1.41,95%CI:1.31~1.51),驱动压可能是评估ARDS预后的最佳指标之一[4]。这一结论存在一定的争议,2017年一项纳入1 010例患者的RCT研究显示,与低PEEP策略相比,根据最佳顺应性滴定的PEEP增加了患者的28 d病死率和6个月病死率,气胸发生率、气管创伤风险以及机械通气时间均相应增加[12]。其原因可能包括:(1)驱动压不仅与跨肺弹性相关,也与胸廓弹性相关,一些影响胸廓弹性的因素包括肥胖、胸腔积液、胸壁水肿、腹内压增高等均可能影响胸廓弹性[13]。还有一些研究提出,肺外因素导致的ARDS患者的胸廓顺应占整个呼吸系统顺应性的比重较肺内因素更大[14]。(2)有研究认为当患者肺部顺应性最大时,表示在给定的压力下,肺部容积变化最大,此时反复张开及闭合的肺泡最多,可能对其产生损伤[15]。因此有关于驱动压在ARDS患者临床管理的作用还需要进一步研究证实。
本试验中,OI,PPOI与PDOI均与SOFA评分具有相关性,这可能是由于:(1)更高的气道压力,会导致更多的肺泡过度膨胀或者已经过度膨胀的肺泡加重损伤,造成更严重的气压伤[16-17];(2)更严重的气压伤可能导致肺泡结构功能受损,包括肺泡-毛细血管通透性增加,肺水肿加重甚至形成透明膜或者纤维化[18];(3)肺泡过度膨胀及结构功能的改变将会导致包括肿瘤坏死因子-α(TNF-α)、白介素-1β(IL-1β)在内的炎症因子大量生成[19-20]。炎症因子进入循环系统,则会造成或加重远隔脏器损伤[21]。而相比于SOFA评分,床旁机械通气压力参数的检测具有无创、可实时连续监测的优点, 可更早期发现和纠正影响预后的不良因素,预防或减低通气相关肺损伤,将其与SOFA评分结合可能对ARDS预后的预测起到重要的补充作用。
综上所述,机械通气压力参数可以辅助预测ARDS患者的预后,将平台压与氧合指数相结合所衍生的指标可能更及时、简便、实时地评估ARDS预后。将PPOI与SOFA评分联合使用,预测能力则会进一步提升。
| [1] | Ranieri VM, Rubenfeld GD, Thompson BT, et al. Acute respiratory distress syndrome: the Berlin Definition[J]. JAMA, 2012, 307(23): 2526-2533. DOI:10.1001/jama.2012.5669 |
| [2] | Bellani G, Laffey JG, Pham T, et al. Epidemiology, patterns of care, and mortality for patients with acute respiratory distress syndrome in intensive care units in 50 countries[J]. JAMA, 2016, 315(8): 788-800. DOI:10.1001/jama.2016.0291 |
| [3] | Villar J, Martin-Rodriguez C, Dominguez-Berrot AM, et al. A quantile analysis of plateau and driving pressures: effects on mortality in patients with acute respiratory distress syndrome receiving lung-protective ventilation[J]. Crit Care Med, 2017, 45(5): 843-850. DOI:10.1097/CCM.0000000000002330 |
| [4] | Amato MB, Meade MO, Slutsky AS, et al. Driving pressure and survival in the acute respiratory distress syndrome[J]. N Engl J Med, 2015, 372(8): 747-755. DOI:10.1056/NEJMsa1410639 |
| [5] | DesPrez K, McNeil JB, Wang C, et al. Oxygenation saturation index predicts clinical outcomes in ARDS[J]. Chest, 2017, 152(6): 1151-1158. DOI:10.1016/j.chest.2017.08.002 |
| [6] | Balzer F, Menk M, Ziegler J, et al. Predictors of survival in critically ill patients with acute respiratory distress syndrome (ARDS): an observational study[J]. BMC Anesthesiol, 2016, 16(1): 108. DOI:10.1186/s12871-016-0272-4 |
| [7] | NHLBI ARDS network. Mechanical ventilation protocol summary of low tidal volume used in the ALVEOLI study[EB/OL] http://www.ardsnet.org/files/ventilator_protocol_2008-07.pdf. |
| [8] | Naorungroj T, Vilaichone W, Tongyoo S, et al. High-frequency oscillatory ventilation for patients during exudative phase of severe ARDS[J]. J Med Assoc Thai, 2015, 98(4): 343-351. |
| [9] | Petrucci N, De Feo C. Lung protective ventilation strategy for the acute respiratory distress syndrome[J]. Cochrane Database Syst Rev, 2013(2): D3844. DOI:10.1002/14651858.CD003844.pub4 |
| [10] | Russotto V, Bellani G, Foti G. Respiratory mechanics in patients with acute respiratory distress syndrome[J]. Ann Transl Med, 2018, 6(19): 382. DOI:10.21037/atm.2018.08.32 |
| [11] | Bugedo G, Retamal J, Bruhn A. Driving pressure: a marker of severity, a safety limit, or a goal for mechanical ventilation?[J]. Crit Care, 2017, 21(1): 199. DOI:10.1186/s13054-017-1779-x |
| [12] | Cavalcanti AB, Suzumura EA, Laranjeira LN, et al. Effect of lung recruitment and titrated positive end-expiratory pressure (PEEP) vs low PEEP on mortality in patients with acute respiratory distress syndrome: a randomized clinical trial[J]. JAMA, 2017, 318: 1335-1345. DOI:10.1001/jama.2017.14171 |
| [13] | Baedorf KE, Loring SH, Talmor D. Mortality and pulmonary mechanics in relation to respiratory system and transpulmonary driving pressures in ARDS[J]. Intensive Care Med, 2016, 42(8): 1206-1213. DOI:10.1007/s00134-016-4403-7 |
| [14] | Chiumello D, Carlesso E, Cadringher P, et al. Lung stress and strain during mechanical ventilation for acute respiratory distress syndrome[J]. Am J Respir Crit Care Med, 2008, 178(4): 346-355. DOI:10.1164/rccm.200710-1589OC |
| [15] | Sahetya SK, Goligher EC, Brower RG. Fifty years of research in ards. setting positive end-expiratory pressure in acute respiratory distress syndrome[J]. Am J Respir Crit Care Med, 2017, 195(11): 1429-1438. DOI:10.1164/rccm.201610-2035CI |
| [16] | Xie H, Zhou ZG, Jin W, et al. Ventilator management for acute respiratory distress syndrome associated with avian infl uenza A (H7N9) virus infection: a case series[J]. World J Emerg Med, 2018, 9(2): 118-124. DOI:10.5847/wjem.j.1920-8642.2018.02.006 |
| [17] | Dreyfuss D, Soler P, Basset G, et al. High inflation pressure pulmonary edema. Respective effects of high airway pressure, high tidal volume, and positive end-expiratory pressure[J]. Am Rev Respir Dis, 1988, 137(5): 1159-1164. DOI:10.1164/ajrccm/137.5.1159 |
| [18] | Slutsky AS, Ranieri VM. Ventilator-induced lung injury[J]. N Engl J Med, 2013, 369(22): 2126-2136. DOI:10.1056/NEJMra1208707 |
| [19] | Hoegl S, Boost KA, Flondor M, et al. Short-term exposure to high-pressure ventilation leads to pulmonary biotrauma and systemic inflammation in the rat[J]. Int J Mol Med, 2008, 21(4): 513-519. |
| [20] | Tremblay L, Valenza F, Ribeiro SP, et al. Injurious ventilatory strategies increase cytokines and c-fos m-RNA expression in an isolated rat lung model[J]. J Clin Invest, 1997, 99(5): 944-952. DOI:10.1172/JCI119259 |
| [21] | Slutsky AS, Tremblay LN. Multiple system organ failure. Is mechanical ventilation a contributing factor?[J]. Am J Respir Crit Care Med, 1998, 157(6 Pt 1): 1721-1725. DOI:10.1164/ajrccm.157.6.9709092 |
 2020, Vol. 29
2020, Vol. 29




