创伤、急性心肌梗死、手术等应激性事件往往伴随着血糖浓度升高,称为应激性高血糖。美国糖尿病协会和美国临床内分泌学家协会将没有任何证据表明存在糖尿病的情况下,任何血糖浓度大于7.8 mmol/L定义为应激性高血糖,它的发生与急性胰岛素抵抗,糖皮质激素的释放等多种机制有关[1],且更多的机制仍在不断探究。骨钙素(osteocalcin,OC)是一种成骨细胞分泌的非胶原蛋白,研究表明其是一种影响能量代谢的内分泌激素。OC基因敲除小鼠表现异常的糖代谢和胰岛功能,这种异常的表型可被外源性OC所纠正,这表明OC能影响胰岛细胞功能和糖代谢[2]。
多项观察性研究已经发现OC与糖代谢指标的关系。比如在糖尿病、冠心病患者中,血清OC呈低水平,与血糖,胰岛素抵抗呈明显的负相关,而且血清OC水平是预测糖尿病发生的独立影响因素[3-6]。糖化血红蛋白(hemoglobin Alc,HbA1c)是评价血糖控制的重要指标之一,HbA1c ≥ 6%被认为是糖耐量异常或者新发糖尿病的重要参考依据[7]。糖耐量异常或者糖尿病患者血清中低浓度的血清OC水平与糖脂代谢指标存在明显相关性[8]。目前大多数关于OC与糖代谢的观察性研究主要集中在慢性疾病中展开,对于急性疾病却鲜有报道。为了排除雌激素和创伤前血糖控制不良对骨代谢的影响,以及急诊手术对机体各项血液指标检测的影响,本研究将观察非急诊手术的非糖尿病创伤男性患者血清OC水平与糖代谢指标的关系。
1 资料与方法 1.1 一般资料收集2017年10月至2019年2月就诊于上海交通大学附属第六人民医院急诊医学科创伤男性病例,入选标准:≥ 18岁,受伤至次日抽血时间间隔 < 24 h;排除标准:急诊手术;HbA1c ≥ 6%;脑外伤;高血压、糖尿病、冠心病史;严重肝功能、肾功能损害;既往有慢性贫血病史;恶性肿瘤病史;甲状旁腺功能亢进或甲状腺功能紊乱;1年内有骨折病史;近期服用已知能影响骨代谢的药物,如维生素D、降钙素等。本研究获上海交通大学附属第六人民医院伦理委员会审核批准(审批号:2017-146),所有入选对象签署知情同意书。
1.2 标本的采集与检测记录研究对象的姓名、年龄、身高、体质量、血压、心率、受伤至次日抽血时间间隔,创伤严重度评分(injury severity score, ISS)、既往史、既往药物使用情况。所有研究对象禁食12 h后收集外周静脉血样送上海交通大学附属第六人民医院医学检验中心检测所需指标,包括血常规、肝功能、肾功能、电解质组合、甲状腺功能、肿瘤标志物、HbA1c、血糖(fasting plasma glucose,FPG)、胰岛素(fasting insulin,FINS)、C-肽(C-peptid,C-P),同时抽取肘静脉血样3~5 mL进行离心,取血清并将其保存在冰箱里的温度- 20 ℃用于OC的检测。OC采用瑞士罗氏(Roche)公司生产的Cobas-e-601型全自动电化学发光免疫分析仪进行电化学发光免疫(ECLIA)检测,试剂采用上海罗氏诊断产品有限公司的骨钙素检测试剂(德国产)。
1.3 统计学方法用SPSS 21.0软件进行统计分析,服从正态分布的计量资料用均数±标准差(Mean±SD)表示,采用LSD- t检验分析,偏态分布的计量资料用中位数(四分位数)[M (QL, QU)]表示,采用秩和检验;多组间计量资料比较采用单因素方差分析。两变量之间的相关关系采用偏相关分析;多元线性回归分析血清OC水平与糖代谢指标的关系。以P < 0.05为差异有统计学意义。
2 结果 2.1 入选创伤患者一般资料如表 1所示,本研究入选395例创伤男性患者,其中非应激性高血糖组(no-stress hyperglycemia, NO-SH)(FPG ≤ 7.8 mmol/L)组213例,应激性高血糖(stress hyperglycemia, SH)(FPG > 7.8 mmol/L)组182例。除FPG外(P < 0.01),总的研究人群在年龄、ISS、白细胞、血红蛋白、血小板、谷丙转氨酶、谷草转氨酶、血清总蛋白、血清白蛋白、总胆红素、肌酐、钙离子、HbA1c、FINS、C-P、OC指标上,与NO-SH组和SH组患者差异无统计学意义。SH组在年龄(P = 0.041)、HbA1c(P= 0.037)、FPG(P < 0.01)较NO-SH组高,而OC水平较NO-SH组低(P= 0.023),两组人群在ISS、白细胞、血红蛋白, 血小板、谷丙转氨酶、谷草转氨酶、清总蛋白、血清白蛋白、总胆红素、肌酐、钙离子和C-P指标上差异无统计学意义(P > 0.05)。
| 指标 | 全部患者(n= 395) | NO-SH组(n= 213) | SH组(n= 182) | P值 |
| 年龄[岁, M (QL, QU)] | 48.50(38.75, 59.00) | 47.00(37.00, 58.00) | 53.00(45.00, 63.00) | 0.124 |
| ISS评分[M (QL, QU)] | 17.0(9.00, 25.00) | 16.00(8.00, 21.00) | 18.00(12.00, 26.00) | 0.996 |
| 白细胞[×1012 /L, M (QL, QU)] | 9.76(8.10, 11.50) | 9.500(7.850, 11.35) | 9.900(8.300, 12.00) | 0.606 |
| 血红蛋白[g/L, M (QL, QU)] | 117.00(98.25, 132.50) | 118.00(99.50, 133.00) | 115.00(90.00, 126.00) | 0.385 |
| 血小板[×109 /L, M (QL, QU)] | 154.50(114.75, 187.75) | 156.00(120.50, 192.00) | 147.00(95.00, 184.00) | 0.455 |
| 谷丙转氨酶(U/L, Mean±SD) | 56.31±65. 92 | 60.65±73.35 | 40.52±17.18 | 0.321 |
| 谷草转氨酶(U/L, Mean±SD) | 67.99±60.69 | 69.30±61.97 | 63.19±56.49 | 0.884 |
| 血清总蛋白[g/L, M (QL, QU)] | 58.00(52.00, 61.00) | 58.00(52.00, 62.00) | 57.00(51.00, 61.00) | 0.637 |
| 血清白蛋白[g/L, M (QL, QU)] | 33.00(28.25, 36.00) | 33.00(28.00, 36.00) | 33.00(30.00, 35.00) | 0.964 |
| 总胆红素(μmol/L, Mean±SD) | 23.49±11.24 | 23.19±11.13 | 24.58±11.76 | 0.831 |
| 肌酐[μmol/L, M (QL, QU)] | 62.50(56.00, 70.00) | 62.00(56.00, 70.00) | 65.00(53.00, 73.00) | 0.981 |
| 钙离子[mmol/L, M (QL, QU)] | 2.08(1.98, 2.18) | 2.08(1.99, 2.16) | 2.08(1.98, 2.19) | 0.963 |
| HbA1c (%, Mean±SD) | 5.46±0.40 | 5.42±0.38 | 5.59±0.44 | 0.115 |
| FPG (mmol/L, Mean±SD) | 6.13±1.56 | 5.54±0.72 | 8.32±1.87 | < 0.01 |
| FINS (mU/L, Mean±SD) | 10.93±7.05 | 11.00±7.30 | 10.70±6.24 | 0.979 |
| C-P[pmol/L, M (QL, QU)] | 2.67(2.02, 3.59) | 2.67(2.01, 3.36) | 2.77(2.12, 4.14) | 0.764 |
| OC (μg/L, Mean±SD) | 9.60±4.55 | 10.04±4.62 | 7.95±3.89 | 0.074 |
| 注: NO-SH(NO-Stress hyperglycemia), 非应激性高血糖; SH(Stress hyperglycemia), 应激性高血糖; ISS(injury severity score), 创伤严重度评分; HbA1c, 糖化血红蛋白; FPG(fasting plasma glucose), 血糖; FINS(fasting insulin), 胰岛素; C-P(C-peptid), C-肽; OC(osteocalcin), 骨钙素;NO-SH组vs SH组,P < 0.05为差异有统计学意义 | ||||
对创伤人群的各项指标进行偏相关分析,发现血清OC水平与年龄、ISS、白细胞、血红蛋白、血清白蛋白、C-P呈负相关关系,与血清总蛋白呈正相关关系,与血小板、谷丙转氨酶、谷草转氨酶、肌酐、钙离子、HbA1c、FPG、FINS则无明显相关关系,见表 2。
| 指标 | OC水平 | |
| r值 | P值 | |
| 年龄 | -0.253 | 0.019 |
| ISS | -0.291 | 0.003 |
| 白细胞 | -0.204 | 0.042 |
| 血红蛋白 | -0.200 | 0.046 |
| 血清总蛋白 | 0.220 | 0.028 |
| 血清白蛋白 | -0.225 | 0.025 |
| HbA1c | -0.111 | 0.273 |
| FPG | -0.017 | 0.870 |
| FINS | 0.128 | 0.204 |
| C-P | -0.262 | 0.008 |
| 注:ISS(injury severity score), 创伤严重度评分; HbA1c, 糖化血红蛋白; FPG(fasting plasma glucose), 血糖; FINS(fasting insulin), 胰岛素; C-P(C-peptid), C-肽; OC(osteocalcin), 骨钙素 | ||
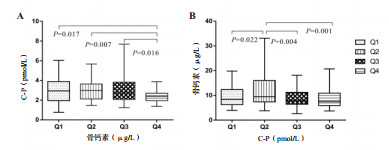
为进一步探究血清OC水平与C-P存在的关系,分别以血清OC水平和血清C-P水平的四分位数进行分组(Q1~Q4组),比较不同组别间血清C-P水平和血清OC水平的差异,发现血清OC水平的Q4组C-P水平明显低于Q1(P= 0.017),Q2(P = 0.006)和Q3(P= 0.016)组,而血清C-P水平的Q2组OC水平明显高于Q3(P= 0.004)和Q4(P= 0.001)组,见图 1。
|
| A:血清骨钙素四分位数组中C-P水平的比较; B:血清C-P四分位数组中骨钙素水平的比较;C-P(C-peptid),C-肽; 以P < 0.05为差异有统计学意义 图 1 四分位数组中不同指标的比较 Fig 1 Comparison of different indicators in the quantile array |
|
|
创伤人群中以血清OC水平为因变量,控制年龄、ISS、白细胞、血红蛋白、血清总蛋白、谷丙转氨酶、谷草转氨酶、C-P等因素后进行多元线性回归分析,发现年龄(β = -0.118,P < 0.01)、白细胞(β = -0.412,P= 0.002)和C-P(β = - 0.655,P= 0.043)是影响创伤男性血清OC水平的独立影响因素,见表 3。
| 变量 | β | S.E. | 标准化β | t值 | P值 |
| 年龄 | -0.118 | 0.025 | -0.367 | -4.764 | < 0.01 |
| 白细胞 | -0.412 | 0.130 | -0.262 | -3.159 | 0.002 |
| C-P | -0.655 | 0.321 | -0.159 | -2.042 | 0.043 |
| 注:C-P(C-peptid),C-肽; OC(osteocalcin),骨钙素;以P < 0.05为差异有统计学意义 | |||||
OC是一种沉积于骨基质中的非胶原蛋白,主要由成骨细胞分泌。人类的OC由1号染色体(1q25-q31)编码,受1, 25-二羟胆钙化醇调节。OC肽链的17、21、24号位含3个γ-羧基谷氨酸残基,它们与钙离子亲和力高,有利于结合羟磷灰石沉积于骨基质中[9]。研究发现OC是一种可以调节糖代谢的内分泌激素。OC基因敲除小鼠表现出胰岛体积缩小,胰岛素细胞的数量下降,外周血糖升高,皮下脂肪增厚,外周组织胰岛素抵抗的增加,相反,注射重组OC能改变OC基因敲除小鼠的这些表型,这主要是由于内源性或外源性骨钙素通过作用于胰岛β-细胞上的受体[2],或直接增加胰岛细胞中Ins1、Ins2、CyclinD1、CyclinD2和Cdk4的表达[10],刺激胰岛细胞增生,增加胰岛素的分泌,增加外周组织的胰岛素敏感性从而增加细胞葡萄糖的摄取降低血糖,且不引起胰岛细胞中除胰岛素以外的其他激素的分泌。这表明OC影响胰岛细胞功能是其参与糖代谢调节的途径之一。
本研究中,应激性高血糖组较非应激性高血糖组的年龄、FPG、HbA1c高,而血清OC水平更低。在一些关于糖代谢异常的研究报道中,不仅发现糖代谢异常者FPG、HbA1c较糖代谢正常者高,OC呈低水平,而且OC与FPG、HbA1c、FINS存在明显负相关关系[3-7],血清OC浓度被视为预测是否发生糖尿病的重要因素之一[3]。慢性疾病中血清OC水平与糖代谢的这种关系可能与成骨细胞长期暴露在高血糖环境下有关。高血糖环境中,成骨细胞内缓激肽受体B1(bradykinin receptor B1,BK1R)/缓激肽受体B2(bradykinin receptor B2,BK2R)的mRNA和EphB2/EphrinB2蛋白表达水平明显下降,使成骨细胞的生物活性下降[11],高血糖损害成骨细胞内质网的稳态,激活C/EBP-同源蛋白(CHOP)介导成骨细胞的凋亡[12],同时升高的血糖使成骨细胞表面胰岛素受体(insulin oeceptor,IR)的敏感性下降,亦或直接抑制成骨细胞生长和骨钙素的表达[13]。虽然在本研究中没有发现血清OC与FPG存在明显相关关系,这可能与创伤后多种机制引起血糖浓度升高有关,但是创伤后降低的血清OC水平是否也会影响血糖的变化,还需进一步研究。
虽然本研究中应激性高血糖组和非应激性高血糖组的FINS和C-P差异无统计学意义,但是相关分析中发现血清OC水平与C-P呈负相关。通过OC四分位数分组比较,发现随着OC浓度升高,血清C-P浓度降低得越明显,而低的C-P浓度表现出现相对高的血清OC水平。多元线性回归分析发现在糖代谢指标中,C-P是影响血清OC水平的独立影响因素。在之前研究人群中没有发现血清中FINS和C-P存在差异,但在HbA1c < 8%的人群中,血清OC与C-P存在明显的正相关关系[14]。胰岛β细胞分泌等相对分子质量的胰岛素和C-P,血液循环中的胰岛素容易被分解,而C-P则相对稳定且无生物活性,也不与细胞膜上的受体结合,其半衰期为胰岛素的3~4倍,使得检测C-P能更好地反映胰岛细胞的功能[15]。在体外研究中发现OC通过作用于胰岛细胞上的G protein-coupled receptor class C group 6 memberA(GPRC6A)受体,刺激胰岛素细胞内的信号传导,影响胰岛素的转录和翻译,最终促进胰岛素的分泌[2],为OC与C-P的相互关系提供理论依据。不同的是,本研究发现血清OC与C-P存在负相关关系,这可能与创伤后胰岛细胞功能受影响有关,但是具体的机制需要进一步研究。
综上所述,本试验探究非糖尿病创伤男性患者血清OC水平在不同血糖表现状况下的差异,同时也发现糖代谢指标中的C-P是影响OC水平的独立因素,并随着OC浓度的升高,C-P降低的越快,这补充说明血清OC是一种调节血糖代谢的内分泌激素。但是更多的机制需要完善,且尚不清楚究竟是OC还是血糖,或者其他的因素触发胰岛素-OC信号前馈调节途径。
利益冲突 所有作者均声明不存在利益冲突
| [1] | Farrokhi F, Smiley D, Umpierrez GE. Glycemic control in non-diabetic critically ill patients[J]. Best Pract Res Clin Endocrinol Metab, 2011, 25(5): 813-824. DOI:10.1016/j.beem.2011.05.004 |
| [2] | Lee NK, Sowa H, Hinoi E, et al. Endocrine regulation of energy metabolism by the skeleton[J]. Cell, 2007, 130(3): 456-469. DOI:10.1016/j.cell.2007.05.047 |
| [3] | Zhou M, Ma XJ, Li HT, et al. Serum osteocalcin concentrations in relation to glucose and lipid metabolism in Chinese individuals[J]. Eur J Endocrinol, 2009, 161(5): 723-729. DOI:10.1530/EJE-09-0585 |
| [4] | Chen Y, Zhao Q, Du G, et al. Association between serum osteocalcin and glucose/lipid metabolism in Chinese Han and Uygur populations with type 2 diabetes mellitus in Xinjiang: two cross-sectional studies[J]. Lipids Health Dis, 2017, 16(1): 139. DOI:10.1186/s12944-017-0512-8 |
| [5] | Sanchez-Enriquez S, Ballesteros-Gonzalez IT, Villafán-Bernal JR, et al. Serum levels of undercarboxylated osteocalcin are related to cardiovascular risk factors in patients with type 2 diabetes mellitus and healthy subjects[J]. World J Diabetes, 2017, 8(1): 11-17. DOI:10.4239/wjd.v8.i1.11 |
| [6] | Sheng L, Cao W, Cha B, et al. Serum osteocalcin level and its association with carotid atherosclerosis in patients with type 2 diabetes[J]. Cardiovasc Diabetol, 2013, 12: 22. DOI:10.1186/1475-2840-12-22 |
| [7] | World Health Organization. Use of glycated haemoglobin (HbA1c) in the diagnosis of diabetes mellitus[R].Geneva: WHO, 2011. |
| [8] | Liang Y, Tan A, Liang D, et al. Low osteocalcin level is a risk factor for impaired glucose metabolism in a Chinese male population[J]. J Diabetes Investig, 2016, 7(4): 522-528. DOI:10.1111/jdi.12439 |
| [9] | Zoch ML, Clemens TL. New insights into the biology of osteocalcin[J]. Bone, 2016, 82: 42-49. DOI:10.1016/j.bone.2015.05.046 |
| [10] | Ferron M, Hinoi E, Karsenty G, et al. Osteocalcin differentially regulates beta cell and adipocyte gene expression and affects the development of metabolic diseases in wild-type mice[J]. Proc Natl Acad Sci U S A, 2008, 105(13): 5266-5270. DOI:10.1073/pnas.0711119105 |
| [11] | Wu M, Ai W, Chen L, et al. Bradykinin receptors and EphB2/EphrinB2 pathway in response to high glucose-induced osteoblast dysfunction and hyperglycemia-induced bone deterioration in mice[J]. Int J Mol Med, 2016, 37(3): 565-574. DOI:10.3892/ijmm.2016.2457 |
| [12] | Liu W, Zhu X, Wang Q, et al. Hyperglycemia induces endoplasmic reticulum stress-dependent CHOP expression in osteoblasts[J]. Exp Ther Med, 2013, 5(5): 1289-1292. DOI:10.3892/etm.2013.978 |
| [13] | Wang WW, Zhang XL, Zheng JQ, et al. High glucose stimulates adipogenic and inhibits osteogenic differentiation in MG-63 cells through cAMP/protein kinase A/extracellular signal-regulated kinase pathway[J]. Mol Cell Biochem, 2010, 338(1/2): 115-122. DOI:10.1007/s11010-009-0344-6 |
| [14] | Takashi Y, Koga M, Matsuzawa Y, et al. Undercarboxylated osteocalcin can predict insulin secretion ability in type 2 diabetes[J]. J Diabetes Investig, 2017, 8(4): 471-474. DOI:10.1111/jdi.12601 |
| [15] | Leighton E, Sainsbury CA, Jones GC. A practical review of c-peptide testing in diabetes[J]. Diabetes Ther, 2017, 8(3): 475-487. DOI:10.1007/s13300-017-0265-4 |
 2020, Vol. 29
2020, Vol. 29




