2016年国际专家共识更新了脓毒症的定义[1-2],脓毒症是感染后发生的机体反应失调,可以导致免疫功能抑制和多脏器功能衰竭,继而威胁患者的生命[3]。机体免疫功能失衡参与了脓毒症的发生发展[4],由于细胞凋亡和免疫抑制等因素,脓毒症患者外周血T细胞数量发生变化[5-6]。白细胞介素-35(IL-35)是一种新型的抑制性细胞因子,属于IL-12细胞因子家族,主要发挥调控T细胞功能的作用,参与自身免疫性疾病、感染和肿瘤的发病[7]。但是有关IL-35对脓毒症患者T细胞调控作用的研究较少。因此,本研究检测脓毒症患者血浆IL-35水平,利用体外细胞培养系统观察IL-35对脓毒症患者CD4+和CD8+T细胞活性的影响,探讨IL-35在脓毒症发病中的可能机制。
1 资料与方法 1.1 一般资料本研究为前瞻性队列研究。选取2018年1月至2018年9月山西省人民医院重症医学科收治的脓毒症患者。纳入标准:(1)年龄≥18岁且 < 65岁;(2)诊断符合2016年国际脓毒症专家共识标准[1-2]:可疑感染者、序贯器官衰竭评分(SOFA)增加2分。排除标准:(1)长期使用免疫抑制剂;(2)恶性肿瘤;(3)妊娠期或哺乳期妇女;(4)重要脏器功能不全;(5)自身免疫性疾病;(6)慢性病毒感染性疾病。共纳入41例脓毒症患者,男24例,女17例,年龄20~63岁,(51.4±11.2)岁。感染部位:呼吸系统19例,消化系统13例,泌尿系统5例,皮肤软组织2例,其他部位2例。SOFA评分:2~6分15例,7~12分21例,13~18分5例,≥19分0例。选择同期在我院进行查体的健康对照者19例,男13例,女6例,年龄23~64岁,(47.6±9.9)岁。本研究已获得山西省人民医院伦理委员会批准,所有患者及家属均行告知并签署知情同意书。
1.2 仪器与试剂美国Sigma 3-16K离心机;美国Bio-Rad iMark微孔读板仪;美国BD公司FACS Calibur流式细胞仪和Trucount绝对计数管;德国美天旎公司MACS适配细胞磁力分离架;美国Applied Biosystems公司ABI 7500实时定量PCR仪。人外周血淋巴细胞分离液(密度:1.077 g/mL)(货号:P8610)购自北京索莱宝科技有限公司;抗CD4 FITC/CD8 PE/CD3 PerCP单克隆抗体(货号:340298)购自美国BD公司;肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)(货号:CSB-E04740h)、干扰素-γ(interferon-γ, IFN-γ)(货号:CSB-E04577h)、IL-4(货号:CSB-E04633h)、IL-10(货号:CSB-E04593h)、IL-17(货号:CSB-E12819h)和IL-35(货号:CSB-E13126h)酶联免疫吸附实验(enzyme linked immunosorbent assay, ELISA)检测试剂盒购自武汉华美公司;CD4+细胞分选试剂盒(货号:130-096-533)和CD8+细胞分选试剂盒(货号:130-096-495)购自德国美天旎公司;重组人IL-35(货号:200-37)购自美国Peprotech公司;Trizol试剂(货号:15596018)购自美国Invitrogen公司;PrimeScript RT Master Mix反转录试剂盒(货号:RR036A)和TB Green实时定量PCR试剂盒(货号:RR82LR)购自北京宝日生物公司,引物由上海生工合成。
1.3 方法 1.3.1 标本采集和分离脓毒症患者于就诊本院1 h内、对照组于清晨空腹采集EDTA抗凝静脉外周血10 mL。2 880 r/min离心10 min,留取上层血浆冻存于-80 ℃备用。使用人外周血淋巴细胞分离液、采用密度梯度离心法分离外周血单个核细胞(PBMC),冻存于液氮中备用。
1.3.2 指标检测对CDs3+、CD4+和CD8+T细胞计数进行检测,使用Trucount绝对计数管加入抗CD4 FITC/CD8 PE/CD3 PerCP单克隆抗体在FACS Calibur流式细胞仪自动分析软件中测定。ELISA法检测血浆IL-35水平,按说明书进行操作。使用CD4+和CD8+细胞分选试剂盒、采用磁力分离法对PBMC中的CD4+T细胞和CD8+T细胞进行分选,分别取105个CD4+T细胞和105个CD8+T细胞,加入抗CD3/CD28抗体(终浓度1 μg/mL)刺激培养,同时加入重组人IL-35(终浓度1 ng/mL)共刺激培养48 h,收集细胞,使用Trizol试剂提取总RNA,反转录为cDNA,实时定量PCR法对CD4+T细胞中T-bet、GATA-3、FoxP3、RORγt mRNA和CD8+T细胞中穿孔素、颗粒酶B和FasLmRNA 的 相对表达量进行检测,引物序列参考既往文献[8-9]合成。PCR扩增反应为20 μL反应体系,反应条件:预变性:95 ℃ 30 s;PCR反应:95 ℃ 5 s,60 ℃ 30 s。应用2-ΔΔCT法分析目的基因相对表达量。收集培养上清,ELISA法检测CD4+T细胞培养上清中的IFN-γ、IL-4、IL-10和IL-17和CD8+T细胞培养上清中的IFN-γ和TNF-α,按说明书进行操作。
1.4 统计学方法数据均采用SPSS 21.0软件进行分析。首先对数据正态性进行检测,对符合正态分布的计量资料采用均数±标准差(Mean±SD)表示,组间比较采用t检验或配对t检验,两个连续变量的相关性分析采用Pearson相关分析。对于不符合正态分布的计量资料采用中位数[四分位间距][M(QL, QU)]表示,组间比较采用Mann-Whitney检验,两个连续变量的相关性分析采用Spearman相关分析。采用受试者工作者特征(receiver operating characteristic, ROC)分析IL-35和T细胞计数预测患者28 d生存结局。以P < 0.05为差异有统计学意义。
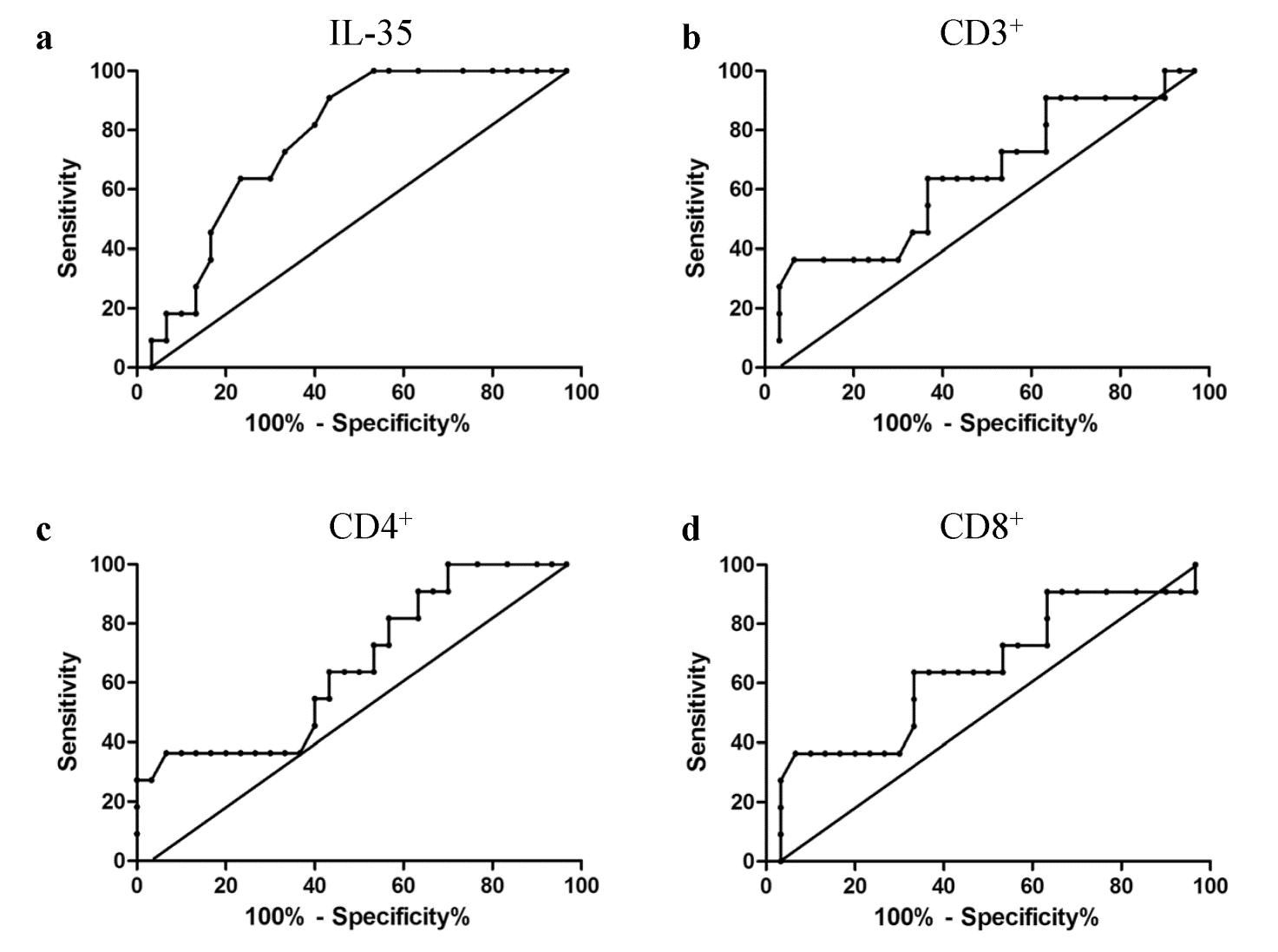
2 结果 2.1 脓毒症患者血浆IL-35水平及其对预后的诊断脓毒症患者血浆IL-35水平较健康对照者显著升高(表 1),但与入院时SOFA评分无显著相关性(r=0.172,P=0.281)。根据患者入院后28 d生存结局,将41例患者分为存活组(n=30)和死亡组(n=11),死亡组患者血浆IL-35水平显著高于存活组(表 2)。将存活组和死亡组患者血浆IL-35水平进行ROC曲线分析,得ROC曲线,如图 1A,曲线下面积(area under curve, AUC)为0.770,P=0.009,提示血浆IL-35的生存结局预测效能较好。
| 指标 | 脓毒症(n=41) | 健康对照(n=19) | 统计值 | P值 |
| IL-35 (pg/mL) | 76.76±10.33 | 27.53±8.31 | t=18.20 | < 0.01 |
| CD3+T细胞(个/μL) | 1 481(1 085, 2 142) | 1 487(1 121, 2 154) | Z=0.146 | 0.994 |
| CD4+T细胞(个/μL) | 562(411, 804) | 490(391, 842) | Z=0.649 | 0.395 |
| CD8+T细胞(个/μL) | 942(691, 1 344) | 951(683, 1 143) | Z=0.156 | 0.721 |
| 指标 | 存活组(n=30) | 死亡组(n=11) | 统计值 | P值 |
| IL-35 (pg/mL) | 74.40±10.55 | 83.18±6.48 | t=2.577 | 0.014 |
| CD3+T细胞(个/μL) | 1 540(1 178, 2 435) | 1 380(810, 1 680) | Z=1.561 | 0.158 |
| CD4+T细胞(个/μL) | 586(442, 926) | 524(208, 622) | Z=1.691 | 0.116 |
| CD8+T细胞(个/μL) | 967(731, 1 510) | 854(502, 1 058) | Z=1.473 | 0.162 |
|
| A:AUC=0.770,P=0.009;B:AUC=0.647,P=0.154;CAUC=0.664,P=0.112;D:AUC=0.646,P=0.158 图 1 预测脓毒症预后的ROC曲线 Fig 1 The ROC curve of prognosis of sepsis |
|
|
脓毒症患者CD3+、CD4+和CD8+T细胞计数与健康对照者的差异无统计学意义(表 1),但CD3+、CD4+和CD8+T细胞计数与入院时SOFA评分均呈显著负相关(r=-0.415,P=0.007;r=-0.437,P=0.004;r=-0.405,P=0.009),与血浆IL-35水平无显著相关性(均P > 0.05)。但CD3+、CD4+和CD8+T细胞计数在存活组和死亡组之间的差异无统计学意义(表 2)。ROC曲线分析发现,CD3+、CD4+和CD8+T细胞计数的AUC分别为0.647、0.664和0.646,P值分别为0.154、0.112和0.158,提示T细胞计数的生存结局预测效能较差(图 1B、1C和1D)。
2.3 IL-35对脓毒症患者CD4+T细胞和CD8+T细胞活性的调控作用分选22例脓毒症患者外周血CD4+T细胞和CD8+T细胞,使用重组人IL-35刺激培养48 h后收集培养上清和细胞。IL-35刺激的CD4+T细胞中Th1转录因子T-bet和Th17转录因子RORγtmRNA的相对表达量较无IL-35刺激的CD4+T细胞显著降低,调节性T细胞(regulatory T cells, Treg)转录因子FoxP3 mRNA的相对表达量则显著升高,Th2转录因子GATA-3 mRNA的相对表达量在IL-35刺激和无IL-35刺激的CD4+T细胞中的差异无统计学意义(表 3)。与之相似的是,IL-35刺激的CD4+T细胞分泌Th1细胞因子IFN-γ和Th17细胞因子IL-17的水平较无IL-35刺激的CD4+T细胞显著降低,Treg细胞因子IL-10的分泌水平明显升高,Th2细胞因子IL-4的水平在IL-35刺激和无IL-35刺激的CD4+T细胞中的差异则无统计学意义(表 3)。IL-35刺激的CD8+T细胞中穿孔素和颗粒酶B mRNA相对表达量较无IL-35刺激的CD8+T细胞显著降低,而FasL mRNA相对表达量则无显著变化。IL-35刺激的CD8+T细胞分泌IFN-γ和TNF-α的水平较无IL-35刺激的CD8+T细胞显著降低(表 4)。
| 指标 | 无IL-35刺激 (n=22) |
IL-35刺激 (n=22) |
t值 | P值 |
| T-bet mRNA | 2.78±0.61 | 1.07±0.13 | 12.860 | < 0.0001 |
| GATA-3 mRNA | 1.12±0.37 | 1.09±0.22 | 0.327 | 0.745 |
| FoxP3 mRNA | 0.98±0.30 | 3.01±0.87 | 10.346 | < 0.0001 |
| RORγt mRNA | 4.74±1.48 | 1.23±0.47 | 10.602 | < 0.0001 |
| IFN-γ (pg/mL) | 17.12±5.88 | 13.77±4.62 | 2.101 | 0.042 |
| IL-4 (pg/mL) | 114.2±37.08 | 107.9±29.49 | 0.624 | 0.536 |
| IL-10 (pg/mL) | 88.71±27.22 | 134.1±40.38 | 4.732 | < 0.0001 |
| IL-17 (pg/mL) | 41.98±11.30 | 30.71±9.96 | 3.509 | 0.001 |
| 指标 | 无IL-35刺激 (n=22) |
IL-35刺激 (n=22) |
t值 | P值 |
| 穿孔素mRNA | 1.48±0.52 | 1.07±0.32 | 3.149 | 0.003 |
| 颗粒酶B mRNA | 1.54±0.47 | 0.99±0.35 | 4.402 | < 0.0001 |
| FasL mRNA | 1.07±0.31 | 1.09±0.18 | 0.262 | 0.795 |
| IFN-γ (pg/mL) | 29.22±5.13 | 23.97±8.62 | 2.455 | 0.018 |
| TNF-α (pg/mL) | 239.6±61.87 | 201.8±40.65 | 2.350 | 0.021 |
本研究发现,脓毒症患者外周血IL-35水平较健康对照者显著升高,这与既往在脓毒症患者和脓毒症动物模型中的结果一致[10-11]。IL-35水平在脓毒症早期诊断和预后预测中的价值高于常规检查指标(如白细胞、降钙素原)[12]。由于IL-35可促进细菌感染播散、减少中性粒细胞浸润、抑制核因子-κB活性、降低细胞因子和趋化因子分泌[7, 13],上述因素均可促进脓毒症的疾病进展。因此,IL-35升高表达可能成为脓毒症患者生存预后不良的重要预测因素之一。
IL-35主要通过抑制T细胞活性发挥生物学功能。本研究发现脓毒症患者外周血T细胞计数与对照组无显著差异,这与既往结果不尽相同[5]。但T细胞计数与SOFA评分呈显著负相关,提示脓毒症患者中可能存在T细胞功能障碍。初始CD4+T细胞在抗原刺激和转录因子作用下可分化为不同亚群,主要包括Th1、Th2、Treg和Th17细胞。在恶性肿瘤和病毒感染过程中,IL-35对CD4+T细胞的调控作用主要通过促进Treg和抑制Th17细胞功能而实现,主要表现为IL-35刺激不但诱导CD4+T细胞中FoxP3表达、促进IL-10/IL-35分泌[14],还可抑制RORγt表达和IL-17/IL-22分泌[15]。本研究结果提示,脓毒症患者外周血升高表达的IL-35也可促进Treg功能,抑制Th1和Th17细胞活性,进而可诱导效应免疫细胞增殖减弱,细胞因子分泌减少,在脓毒症中发挥免疫抑制作用。
CD8+T细胞不但可通过穿孔素-颗粒酶、Fas-FasL两条途径发挥直接细胞杀伤功能,亦可分泌IFN-γ、TNF-α等细胞因子通过非细胞杀伤作用诱导靶细胞死亡[16]。IL-35刺激脓毒症患者的CD8+T细胞仅抑制穿孔素和颗粒酶B mRNA,对FasL mRNA则无显著影响,提示在脓毒症中IL-35可能主要通过影响穿孔素-颗粒酶途径抑制CD8+T细胞的直接细胞杀伤功能。IL-35刺激后脓毒症患者CD8+T细胞分泌IFN-γ和TNF-α的水平显著降低,提示IL-35亦可影响CD8+T细胞的非细胞杀伤作用,这与在骨肿瘤中的研究结果一致[17]。因此,脓毒症患者外周血中升高表达的IL-35可能直接抑制CD8+T细胞的直接细胞杀伤和非细胞杀伤功能。
总之,血浆IL-35的表达升高对脓毒症患者的预后不佳有重要提示意义。IL-35抑制脓毒症患者CD4+T细胞和CD8+T细胞活性,可能参与脓毒症的发病过程。
| [1] | Singer M, Deutschman CS, Seymour CW, et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3)[J]. JAMA, 2016, 315(8): 801-810. DOI:10.1001/jama.2016.0287 |
| [2] | Seymour CW, Liu VX, Iwashyna TJ, et al. Assessment of Clinical Criteria for Sepsis: For the Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3)[J]. JAMA, 2016, 315(8): 762-774. DOI:10.1001/jama.2016.0288 |
| [3] | 何新华, 陈云霞, 李春盛. 论重症感染[J]. 中华急诊医学杂志, 2015, 24(4): 349-351. DOI:10.3760/cma.j.issn.1671-0282.2015.04.001 |
| [4] | van der Poll T, van de Veerdonk FL, Scicluna BP, et al. The immunopathology of sepsis and potential therapeutic targets[J]. Nat Rev Immunol, 2017, 17(7): 407-420. DOI:10.1038/nri.2017.36 |
| [5] | 潘东峰, 李富荣, 梁诗颂, 等. 淋巴细胞亚群联合检测对脓毒症患者不良预后的评估价值[J]. 中华急诊医学杂志, 2015, 24(5): 524-529. DOI:10.3760/cma.j.issn.1671-0282.2015.05.018 |
| [6] | 胡彩珍, 叶立刚, 徐善祥. T细胞亚群检测在基于Sepsis-3的创伤性脓毒症患者中的应用[J]. 中华急诊医学杂志, 2019, 28(2): 181-184. DOI:10.3760/cma.j.issn.1671-0282.2019.02.010 |
| [7] | Teymouri M, Pirro M, Fallarino F, et al. IL-35, a hallmark of immune-regulation in cancer progression, chronic infections and inflammatory diseases[J]. Int J Cancer, 2018, 143(9): 2105-2115. DOI:10.1002/ijc.31382 |
| [8] | Lin ZW, Wu LX, Xie Y, et al. The expression levels of transcription factors T-bet, GATA-3, RORγt and FOXP3 in peripheral blood lymphocyte (PBL) of patients with liver cancer and their significance[J]. Int J Med Sci, 2015, 12(1): 7-16. DOI:10.7150/ijms.8352 |
| [9] | Madsen CB, Nørgaard A, Iversen M, et al. Elevated mRNA levels of CTLA-4, FoxP3, and granzyme B in BAL, but not in blood, during acute rejection of lung allografts[J]. Transpl Immunol, 2010, 24(1): 26-32. DOI:10.1016/j.trim.2010.06.011 |
| [10] | Cao J, Xu F, Lin S, et al. IL-35 is elevated in clinical and experimental sepsis and mediates inflammation[J]. Clin Immunol, 2015, 161(2): 89-95. DOI:10.1016/j.clim.2015.08.016 |
| [11] | 吴淡森, 石松菁, 张瑞, 等. 脓毒症并多器官功能不全综合征患者的新型抑制性细胞因子IL-35表达及其临床意义[J]. 中华急诊医学杂志, 2019, 28(2): 175-180. DOI:10.3760/cma.j.issn.1671-0282.2019.02.009 |
| [12] | Du WX, He Y, Jiang HY, et al. Interleukin 35: A novel candidate biomarker to diagnose early onset sepsis in neonates[J]. Clin Chim Acta, 2016, 462: 90-95. DOI:10.1016/j.cca.2016.09.005 |
| [13] | Hu L, Chen C, Zhang J, et al. IL-35 Pretreatment Alleviates Lipopolysaccharide-Induced Acute Kidney Injury in Mice by Inhibiting NF-κB Activation[J]. Inflammation, 2017, 40(4): 1393-1400. DOI:10.1007/s10753-017-0582-9 |
| [14] | Wang HM, Zhang XH, Feng MM, et al. Interleukin-35 suppresses the antitumor activity of T cells in patients with non-small cell lung cancer[J]. Cell Physiol Biochem, 2018, 47(6): 2407-2419. DOI:10.1159/000491615 |
| [15] | Teng DK, Liu Y, Lv YF, et al. Elevated interleukin-35 suppresses liver inflammation by regulation of T helper 17 cells in acute hepatitis B virus infection[J]. Int Immunopharmacol, 2019, 70: 252-259. DOI:10.1016/j.intimp.2019.02.048 |
| [16] | Wang C, Singer M, Anderson AC. Molecular dissection of CD8+ T-cell dysfunction[J]. Trends Immunol, 2017, 38(8): 567-576. DOI:10.1016/j.it.2017.05.008 |
| [17] | Liu MX, Liu QY, Liu Y, et al. Interleukin-35 suppresses antitumor activity of circulating CD8+ T cells in osteosarcoma patients[J]. Connect Tissue Res, 2019, 60(4): 367-375. DOI:10.1080/03008207.2018.1552267 |
 2019, Vol. 28
2019, Vol. 28




