2 温州医科大学研究生院 325000;
3 杭州医学院 310000
蛛网膜和其下的脑脊液构成中枢神经系统的基本外环境。蛛网膜下腔出血(subarachnoid hemorrhage,SAH)发生后,导致中枢系统基本外环境的剧烈变化;其中迟发性脑缺血(delayed cerebral ischemia,DCI)是SAH重要的并发症之一,病死率和致残率高,尚无有效的防治措施。DCI的发生机制也不完全清楚。一般认为与血细胞的分解产物如氧合血红蛋白或凝血酶导致的的蛛网膜下腔内的炎症反应相关[1-5],因此,进一步研究SAH后炎症的发生机制,有利于找到有效的治疗手段。
单核巨噬细胞分为定居型和迁移型两大类,是启动和调节炎症反应的关键细胞。在不同的环境下,单核巨噬细胞可以分化为M1(经典活化)和M2(替代活化)两个类型,这两种细胞具有明显不同的特性,这种双重可塑性的功能与局部免疫发生机制密切相关[6-9]。有研究表明,蛛网膜细胞具有抗原递呈细胞功能[10-14],能够参与凝血启动炎症机制[15]。因此,研究Ar细胞的极化状态有助于阐明蛛网膜下腔的炎症反应和SAH后Ar细胞的作用。
目前,巨噬细胞(macrophages,Mφ)的极化状态多通过表型分析和其高分泌细胞因子的情况进行鉴定[6, 16-19]。本研究采用临床与实验相互印证的方法,即先确定临床SAH脑脊液中单核Mφ样细胞是哪类细胞及其极化状态;然后,采用凝血酶和IL-6诱导培养的Ar细胞,进一步对其体外极化进行验证对比。目前有关SAH后Ar细胞的极化状态未见研究报道。
1 材料与方法 1.1 SAH脑脊液中单核Mφ样细胞及其极化状态 1.1.1 SAH患者脑脊液标本采集收集西安交通大学第二附属医院从2015年到2016年收治患者,选取34例患者脑脊液进行研究(19例女性,15例男性),年龄36~75岁(平均年龄54.9岁)。患者均为动脉瘤性蛛网膜下腔出血、Hunt指数等级为1~3、无高颅压及明显脑损伤,脑脊液中的炎症反应主要由出血引起。所有患者存活且于SAH后72 h内行动脉瘤夹闭术或血管内栓塞。排除不符标准的样本,分别在第1、3、7、14及15天得到6、8、9、4、3例样本。样本收集中,患者及其家属已知情同意,且得到医学伦理委员会批准。
1.1.2 对照组脑脊液标本采集对照组为16例因血管压迫神经根所致面肌痉挛患者(无神经系统其他病变,脑脊液无改变)。手术过程中,用生理盐水冲洗硬脑膜,确保完全无血,用注射器直接目视穿刺蛛网膜,获得10 mL脑脊液。部分脑脊液采用常规生化和细菌培养方法检测,以验证无异常。排除异常标本。
1.1.3 样本处理及检测方法将脑脊液标本以1 500 r/min离心获得脑脊液细胞颗粒和上清液。将红细胞裂解缓冲液以1:8的比例加入新鲜脑脊液细胞微丸中通透6 min,溶解并破坏红细胞,然后以2 000 r/min离心10 min洗涤,去除红细胞。15例新鲜脑脊液细胞样本进行HE染色和流式细胞术,30份SAH-CSF上清液样品和16份对照CSF上清液样品在-80 ℃保存,进行ELISA分析。
1.1.4 HE染色将CSF细胞悬浮于PBS中,在玻片上进行HE染色。在显微镜(Nikon TS100)下观察脑脊液中细胞的形态、数量和类型。
1.1.5 流式细胞仪以上皮细胞骨架的组成成分细胞角蛋白8和18(CK8 & 18)作为蛛网膜细胞标记[20-22]。重悬细胞浓度约106/ 100 µL,经固定渗透后,同型对照管加入10 µL纯化鼠抗人IgG1藻红蛋白类标记抗体,试验管加入10 µL鼠单克隆CK8 & 18抗体,室温孵育15 min。PBS漂洗后,在室温下用山羊抗小鼠IgG二抗在PBS中孵育15 min。PBS漂洗后,加入2%多聚甲醛,4 ℃下保存,24 h内通过流式细胞仪进行分析。
1.1.6 ELISA分析前被解冻CSF上清液样品。IL-23、IL-10、TGF-β1、CD163检测限分别为4.0 pg/mL、8.8 pg/mL、1.8 pg/mL和30 pg/mL。根据试剂盒说明书进行具体步骤,初步测SAH后不同时间的两组Ar细胞的极化标记物浓度。
1.2 体外培养Ar细胞的极化 1.2.1 Ar细胞培养参照Ar细胞培养的方法[21],取1~2 d的SD乳鼠,剥离颅骨后取蛛网膜层,PBS冲洗后剪碎成≤1 mm3切片,置于胎牛血清中浸泡5 min,移入含有10%(v/v)FCS(100 U/mL青霉素和100 U/mL链霉素)的DMEM培养瓶,滴加少许培养液,置于培养箱12 h待组织块贴壁后,再补加培养液2 mL培养(37 ℃、95%湿度、5% CO2)。2~3 d换液一次,7~14 d后可见细胞铺满培养瓶底总面积的70%~80%,传代至12孔板中或其中的载玻片上。待12孔培养板的Ar细胞爬满孔底总面积的60%~70%时,弃去细胞上清,用PBS洗三遍,每次5 min。
1.2.2 Ar细胞的鉴定用单克隆小鼠Ck8 & 18抗体(1:300,Abcam公司)和山羊抗小鼠异硫氰酸荧光素(fluorescein isothiocyanate,FITC)抗体(1:200,Abcam公司)在指定的稀释液中进行免疫荧光分析。4%的多聚甲醛固定培养的Ar细胞30 min,PBS冲洗;0.2% Trition作用10 min,冲洗;5%牛血清白蛋白(Bovine serum albumin,BSA,西安依科生物有限公司)封闭FC段受体。再加200 μL一抗:小鼠抗人CK8 & 18(Abcam公司),4 ℃下隔夜培养。PBS冲洗后加200 μL二抗:羊抗小鼠FITC(Abcam公司),37 ℃,45 min,PBS冲洗,200 μL DAPI(碧云天公司)反染细胞3 min,PBS冲洗,甘油封片。在荧光显微镜(Nikon Ti-E)下,对每批细胞均进行鉴定,以确保实验所有细胞的特性,并观察培养细胞CK8 & 18的表达情况。
1.2.3 Ar细胞在模拟SAH时的极化状态(1) 凝血酶刺激模拟SAH对Ar细胞极化状态凝血酶已成为实验性SAH的常用诱导剂[16, 23]。参照吴碧华等[24]的方法,向每孔加入1 mL凝血酶(50 U/mL), 在第3天收集细胞。
(2) IL-6刺激模拟SAH状况对Ar细胞极化状态IL-6刺激与分组:SAH后患者CSF中IL-6的浓度介于100~600 pg/mL之间[25-26];IL-6为270~300 pg/mL时可预测迟发性脑缺血和颅内高压,而大于500 pg/mL水平则提示血管痉挛[6, 24, 27-28]。据此选取0、100、300、600 pg/mL作为空白、低、中、高剂量组,加入未激活(正常Ar细胞)和活化(Ar细胞用0.50 U/mL凝血酶激活3 d)的培养板中。实验第3、7和14天留取培养板的上清液和细胞后再加入与之前相同剂量IL-6。分别在第3、7、14天保存3个培养孔的上清液和细胞。
1.3 qRT-PCR各标记基因引物见表 1。根据制造商的说明,使用Trizol从培养的Ar细胞中提取总RNA。使用PrimeScript™RT试剂盒反转录合成cDNA。以cDNA为模板扩增各待测基因的编码片段,以大鼠肌动蛋白β-actin为内参照,实时PCR检测系统(SYBR® Premix Ex Taq™)进行PCR反应,采用ΔΔCT数学模式对结果进行分析。通过3个培养孔测定平均mRNA相对表达量。
| 基因 | GenBank编号 | 引物序列(FP:正义链RP:反义链) | PCR片段(bp) |
| β-actin | NM_031144.2 | FP: GGAGATTACTGCCCTGGCTCCTA RP: GACTCATCGTACTCCTGCTTGCTG |
150 |
| Ck18 | NM_053976 | FP: CGC AAG GTG GTG GAT GAC A RP: CCA GTT CCT CAC GGT TCT TCT |
247 |
| CD68 | NM_001031638.1 | FP: CCTACAACCACCGGAAGCA RP: GTAGTTTCCAAGAGCCCCAGTAGA |
291 |
| IL-12p35 | NM_053390.1 | FP: CTTCAGAGCCACAATCATCAGCA RP:CATGGAGCAGGATACAGAGCTTCA |
169 |
| IL-12p40 | NM_022611.1 | FP: AATGGAATTTGGTCCACCGAGA RP: ACCAGCCATGAGCAGGTGAA |
104 |
| IL-23 | NM_130410.2 | FP: TCCCGGAATCTCTGCACACT RP: CAGACCTTGGCGGATCCTT |
186 |
| Arg-I | NM_007482.3 | FP: GTCTGTG GGAAAAGCCAATG RP: TTGCCATACTGTGGTCTCC A |
250 |
| IL-6 | NM_031168.2 | FP:GATTCCCACTGCCACACTCTGGGGT RP:GGGGGTGGGGGGATATTAAGTGGTG |
1030 |
| IL-10 | NM_010548.2 | FP:AAATGTAACTAGAAGGGGCGGGGAT RP; GGGGGGGTCCCTAGGAACAGGACAG |
1306 |
Grahpad Prism 5.0或SPSS17.0软件对数据进行统计分析,采用线性相关分析确定其相关性,两组间差异采用Student's t检验,多组间差异比较采用多组独立样本秩和检验或方差分析,P < 0.05为差异具有统计学意义。
2 结果 2.1 临床研究结果本研究所有SAH患者入院时平均Hunt和Hess评分均为1~3分,颅内压力不高,无明显脑损伤表现。因此,设有脑脊液极化因子的变化主要是出血引起的,即反映的是出血本身的状况。
2.1.1 HE染色单核细胞/ Mφ-like细胞(如大与多极细胞形状、不规则的边缘、核大一个或两个核仁,细胞质中有各种大量的吞噬颗粒),占CSF细胞的(32.00±7.09)% (图 1)。
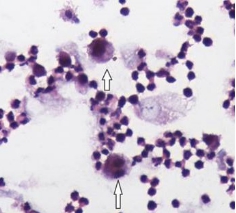
|
| 图 1 HE染色示CSF中巨噬样细胞(白色箭头) |
|
|
在脑脊液细胞中,(31.10±29.36)%是Ar细胞标志物CK8 & 18 +细胞(图 2),与单核Mφ-like细胞的百分比差异无统计学意义(P=0.87)。
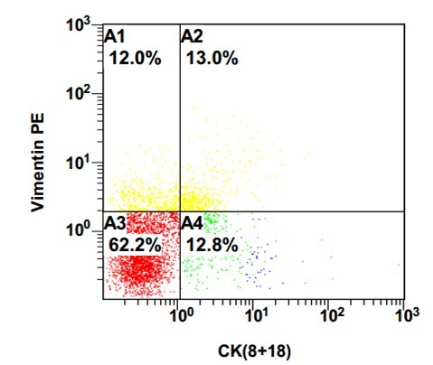
|
| A1: Vimentin(+)CK8 & 18+(-);A2:Vimentin(+)CK8 & 18+(+);A3:Vimentin(-)CK8 & 18+(-);A4:Vimentin(-)CK8 & 18+(+);CK8 & 18+标志Ar细胞占25.8% 图 2 流式细胞仪测定脑脊液细胞中CK8 & 18+ Ar细胞 |
|
|
M1标志IL-23的浓度在SAH组显著高于对照组(P < 0.05)(图 3);M2的CD163标志的浓度也显著增加(P < 0.05),峰值在8~14 d(图 4), 但M2标记IL-10和TGF-β1未测出。由于脑损伤轻微或脑屏障未改变,脑脊液中巨噬细胞样细胞应很少有异物浸润。因此,这种极化可能更能反映定居在蛛网膜下腔的巨噬细胞即Ar细胞的情况。
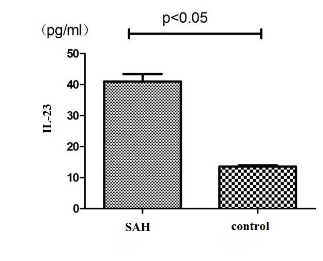
|
| 图 3 M1极化因子IL-23表达水平的变化 |
|
|
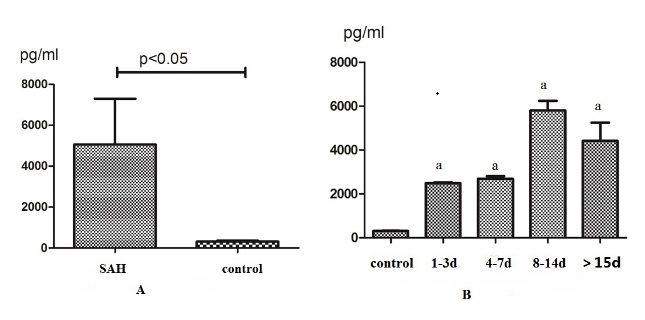
|
| A:SAH组CD163水平显著升高;B:CD163表达水平随SAH出血天数变化,并在8~14 d达到峰值;与对照组比较,aP < 0.05 图 4 M2极化因子CD163表达水平的变化 |
|
|
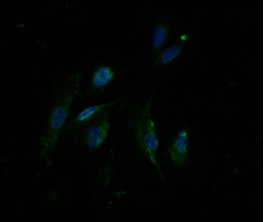
荧光显微镜(Nikon Ti-E)下细胞呈多角形,约97%的培养细胞表达CK8 & 18,呈丝状分布于胞浆内,胞核内未见表达(图 5)。可见,大多数培养的细胞是Ar细胞。
|
| 图 5 免疫荧光示Ar细胞标志CK8 & 18阳性的绿色荧光分布于胞浆内(×200) |
|
|
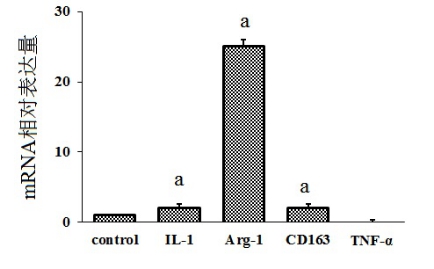
3 d时M1标记物IL-1 mRNA表达低,无TNF-α; M2标记Arg-I显著升高,CD163轻度升高(图 6)。
|
| 与对照组比较,aP<0.05 图 6 M1和M2因素在凝血酶刺激后表达量的比较 |
|
|
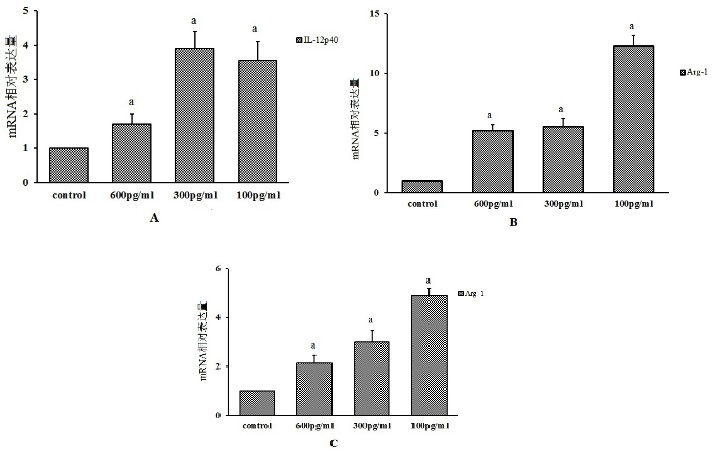
M1标志物IL-23和IL-12p40的mRNA表达均在14 d时升高(图 7A); 且IL-23表达与剂量呈正相关(图 8B)。M2标记Arg-I的表达在14 d时也升高,且与剂量呈负相关(图 7C)。提示IL-6诱导正常Ar细胞极化需要较长的时间。进一步提示,单独的每种极化诱导剂凝血酶和白细胞介素(IL)-6可能不是全面或彻底诱导Ar细胞极化的关键因素。
|
| A:IL-12p40(M1因子)表达增加,最高刺激剂量时表达最低;B:IL-23(M1因子)表达增加,与刺激剂量呈正相关;C:Arg-I(M2因子)表达增加,与刺激剂量呈负相关;与对照组比较,aP < 0.05 图 7 不同剂量的IL-6诱导未激活的Ar细胞14 d |
|
|
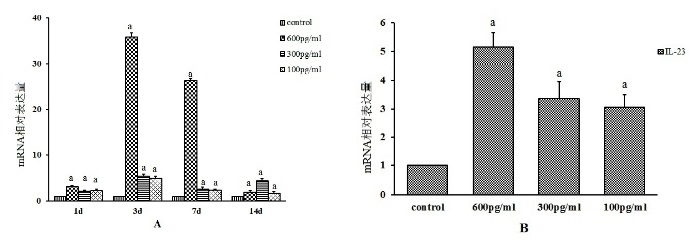
M1标志物IL-23在第1、3、7、14天均升高,在最大刺激剂量下第3、7天显著升高(图 8A)。而M2标记物Arg-I的表达在第3天显著升高,且与剂量呈负相关(图 8B)。
|
| A:IL-23(M1因子)在第1、3、7和14天较高,最大刺激剂量下在第3和7天极度升高;B:IL-6诱导激活的Ar细胞后3 d,Arg-I(M2因子)表达升高,且与刺激剂量呈负相关;与对照组比较,aP < 0.05 图 8 不同剂量的IL-6诱导激活的Ar细胞 |
|
|
虽然许多关于SAH的报道都涉及蛛网膜下腔细胞因子的水平、机制和功能,但很少研究这些细胞因子与极化的关系。目前CSF中单核细胞/Mφ样细胞的起源仍存在争议。已有研究认为,Ar细胞是蛛网膜下腔内的固有巨噬细胞(Mφ),与周围组织一样,发挥着免疫监视和应答的功能[29]。本研究中,HE染色测定单核Mφ样细胞的百分率与FCM测定的Ck8 & 18+Ar细胞的百分率相似,与文献报道的SAH后单核细胞/Mφ样细胞占脑脊液细胞的30%也相似。可以推测,SAH后脑脊液中Ar细胞是重要的单核Mφ样细胞,尤其在轻度SAH时,因无脑组织的或者说无血脑屏障的破坏,脑脊液中单核Mφ样细胞的极化因子状态,就主要反映的是Ar细胞的极化状态。
一般认为,经典的M1表现为高分泌IL-23、IL-12、IL-1和TNF-α等,低表达IL-10,参与急性促炎反应,调节并促进Th1型免疫;而M2细胞主要分泌或表达IL-10、CD163、精氨酸酶-I(Arg-I)和TGF-β1,参与诱导T细胞低反应性[6, 16-17, 27, 30-31]。
在培养的Ar细胞模型中,凝血酶诱导Ar细胞的极化,呈不表达、低或高表达极化因子的多种表现,单独IL-6诱导的Ar细胞也有类似情况。与临床标本显示SAH后脑脊液中高浓度IL-23的M1极化,高CD163且无IL-10和TGF-β1的M2极化状态类似。本研究发现IL-6能快速诱导凝血酶激活的Ar细胞M1极化,且与其剂量呈正相关。表明IL-6和凝血酶是Ar细胞M1极化诱导的完美结合,也为IL-6水平是SAH严重程度预测因子提供了新证据。
IL-10是外周M2极化最典型的标志因子,Lang等[32-33]发现IL-10可通过STAT3通路上调IL-4Rα促进M2型巨噬细胞发育,然而包括本研究在内的多组动物实验性SAH模型和临床的脑脊液标本和血清标本研究中,IL-10水平并无变化或仅检测到微量(0~8 pg/mL),而且在M-CSF诱导和凝血酶刺激后也均未能改变IL-10的mRNA表达。推测认为,Ar细胞可能不具备产生IL-10的能力,这可能也是Ar细胞M2极化不良的主要原因之一[21, 25, 32, 34]。
CD163分子是一个重要的清道夫受体蛋白,也是M2极化的标志。它表达于吞噬细胞表面,可以清除机体的内源性和一些外源性物质。虽然在正常脑膜和脉络丛中均发现了CD163阳性细胞[35],但Lang等[32]认为,蛛网膜下腔内CD163-结合珠蛋白-血红蛋白清除系统能力比外周循环系统低5万倍,无法清除SAH时大量增加的红细胞溶解产物。在外周,IL-10能大幅度上调单核细胞CD163的表达;但蛛网膜下腔中与外周不同的低IL-10、低CD163的M2型极化状态,将不利于血性产物的消除而导致相关SAH后炎症的发生发展。
Arg-I可以抑制T细胞增殖相关的机体免疫抑制状态。静息巨噬细胞中,ARG-I几乎不表达[36],本实验中,IL-6刺激非活化的Ar细胞,14 d内的Arg-I相对表达量均有显著性升高,而刺激活化的Ar细胞仅在刺激第3天时Arg-I相对表达量升高,且表达量与IL-6的刺激剂量则呈负相关。Arg-I在低剂量IL-6作用下,M2的极化特性将更明显地有利于恢复。在外围,IL-6可以抑制Mφs中M1到M2的转换,高水平的IL-6也被认为能导致持续的M1极化而不利于恢复[37]。提示ARG-I水平可能是潜在的恢复指标。
当然,究竟哪些细胞因子和水平可以准确地代表巨噬细胞的极化状态,这一点仍然还存在很大争议。只有验证了脑脊液中所有细胞因子的表达谱,才能得到蛛网膜下腔Ar细胞完整的极化图像。
综上所述,Ar细胞的极化研究为蛛网膜下腔蛛网膜下腔出血后炎性改变提供了更清晰的解释,或者可以更容易地阐明蛛网膜下腔许多因素的联合作用。IL-6是影响Ar细胞极化的重要机制,M2极化不足是SAH后的重要事件。将来靶向SAH的治疗方法必须从抑制炎症转变为微妙地改变不同表型之间的平衡,例如在某些阶段改变Ar细胞的极化状态,如抑制IL-6以减弱M1的过度转化。或提供关键的M2因子IL-10,这将为治疗提供新的靶点。
| [1] | Dankbaar JW, Rijsdijk M, van der Schaaf IC, et al. Relationship between vasospasm, cerebral perfusion, and delayed cerebral ischemia after aneurysmal subarachnoid hemorrhage[J]. Neuroradiology, 2009, 51(12): 813-819. DOI:10.1007/s00234-009-0575-y |
| [2] | Eddleman CS, Hurley MC, Naidech AM, et al. Endovascular options in the treatment of delayed ischemic neurological deficits due to cerebral vasospasm[J]. Neurosurg Focus, 2009, 26(3): E6. DOI:10.3171/2008.11.focus08278 |
| [3] | Carrera E, Kurtz P, Badjatia N, et al. Cerebrovascular carbon dioxide reactivity and delayed cerebral ischemia after subarachnoid hemorrhage[J]. Arch Neurol, 2010, 67(4): 434-439. DOI:10.1001/archneurol.2010.43 |
| [4] | Wang HC, Lin WC, Yang TM, et al. The association between symptomatic delayed cerebral infarction and serum adhesion molecules in aneurysmal subarachnoid hemorrhage[J]. Neurosurgery, 2011, 68(6): 1611-1617. DOI:10.1227/NEU.0b013e318210c871 |
| [5] | Geraghty JR, Testai FD. Delayed cerebral ischemia after subarachnoid hemorrhage: Beyond vasospasm and towards a multifactorial pathophysiology[J]. Curr Atheroscler Rep, 2017, 19(12): 50. DOI:10.1007/s11883-017-0690-x |
| [6] | Martinez FO, Gordon S. The m1 and m2 paradigm of macrophage activation: Time for reassessment[J]. F1000 Prime Rep, 2014, 6(1): 13. DOI:10.12703/p6-13 |
| [7] | Gordon S, Martinez FO. Alternative activation of macrophages: Mechanism and functions[J]. Immunity, 2010, 32(5): 593-604. DOI:10.1016/j.immuni.2010.05.007 |
| [8] | Rhee I. Diverse macrophages polarization in tumor microenvironment[J]. Arch Pharm Res, 2016, 39(11): 1588-1596. DOI:10.1007/s12272-016-0820-y:10.1007/s12272-016-0820-y |
| [9] | Bashir S, Sharma Y, Elahi A, et al. Macrophage polarization: The link between inflammation and related diseases[J]. Inflamm Res, 2016, 65(1): 1-11. DOI:10.1007/s00011-015-0874-1 |
| [10] | McMenamin PG, Wealthall RJ, Deverall M, et al. Macrophages and dendritic cells in the rat meninges and choroid plexus: Three-dimensional localisation by environmental scanning electron microscopy and confocal microscopy[J]. Cell Tissue Res, 2003, 313(3): 259-269. DOI:10.1007/s00441-003-0779-0 |
| [11] | Kivisakk P, Imitola J, Rasmussen S, et al. Localizing central nervous system immune surveillance: Meningeal antigen-presenting cells activate t cells during experimental autoimmune encephalomyelitis[J]. Ann Neurol, 2009, 65(4): 457-469. DOI:10.1002/ana.21379 |
| [12] | Chinnery HR, Ruitenberg MJ, McMenamin PG. Novel characterization of monocyte-derived cell populations in the meninges and choroid plexus and their rates of replenishment in bone marrow chimeric mice[J]. J Neuropathol Exp Neurol, 2010, 69(9): 896-909. DOI:10.1097/NEN.0b013e3181edbc1a |
| [13] | Wieseler-Frank J, Jekich BM, Mahoney JH, et al. A novel immune-to-cns communication pathway: Cells of the meninges surrounding the spinal cord csf space produce proinflammatory cytokines in response to an inflammatory stimulus[J]. Brain Behav Immun, 2007, 21(5): 711-718. DOI:10.1016/j.bbi.2006.07.004 |
| [14] | Engelhardt B. Cluster: Barriers of the central nervous system[J]. Acta Neuropathol, 2018, 135(3): 307-310. DOI:10.1007/s00401-018-1816-0 |
| [15] | Frank E. Hla-dr expression on arachnoid cells. A role in the fibrotic inflammation surrounding nerve roots in spondylotic cervical myelopathy[J]. Spine (Phila Pa 1976), 1995, 20(19): 2093-2096. DOI:10.1097/00007632-199510000-00004 |
| [16] | Verreck FA, Boer T, Langenberg DM, et al. Human il-23-producing type 1 macrophages promote but il-10-producing type 2 macrophages subvert immunity to (myco)bacteria[J]. Proc Natl Acad Sci U S A, 2004, 101(13): 4560-4565. DOI:10.1073/pnas.0400983101 |
| [17] | Badylak SF, Valentin JE, Ravindra AK, et al. Macrophage phenotype as a determinant of biologic scaffold remodeling[J]. Tissue Eng Part A, 2008, 14(11): 1835-1842. DOI:10.1089/ten.tea.2007.0264 |
| [18] | 廖瑾莉, 熊艳, 刘志豪, 等. 慢性华支睾吸虫感染极化m2型巨噬细胞对脓毒症大鼠肺脏保护作用的研究[J]. 中华急诊医学杂志, 2017, 26(5): 533-537. DOI:10.3760/cma.j.issn.1671-0282.2017.05.010 |
| [19] | 李康, 郭强, 王翠妮, 等. M1和m2型巨噬细胞表型的比较分析[J]. 现代免疫学, 2008, 28(3): 177-183. DOI:10.3969/j.issn.1001-2478.2008.03.001 |
| [20] | Holman DW, Grzybowski DM, Mehta BC, et al. Characterization of cytoskeletal and junctional proteins expressed by cells cultured from human arachnoid granulation tissue[J]. Cerebrospinal Fluid Res, 2005, 2(1): 9. DOI:10.1186/1743-8454-2-9 |
| [21] | Xin ZL, Wu XK, Xu JR, et al. Arachnoid cell involvement in the mechanism of coagulation-initiated inflammation in the subarachnoid space after subarachnoid hemorrhage[J]. J Zhejiang Univ Sci B, 2010, 11(7): 516-523. DOI:10.1631/jzus.B1000099 |
| [22] | Michael K. Cytokeratins in intracranial and intraspinal tissues[J]. Adv Anat Embryol Cell Biol, 1992, 126(1): 1-82. DOI:10.1007/978-3-642-77298-6 |
| [23] | Kai Y, Maeda Y, Sasaki T, et al. Basic and translational research on proteinase-activated receptors: The role of thrombin receptor in cerebral vasospasm in subarachnoid hemorrhage[J]. J Pharmacol Sci, 2008, 108(4): 426-432. DOI:10.1254/jphs.08r05fm |
| [24] | 吴碧华. 凝血酶诱导培养星形胶质细胞炎症细胞因子的表达[J]. 神经疾病与精神卫生, 2008, 8(2): 132-135. |
| [25] | Schoch B, Regel JP, Wichert M, et al. Analysis of intrathecal interleukin-6 as a potential predictive factor for vasospasm in subarachnoid hemorrhage[J]. Neurosurgery, 2007, 60(5): 828-836. DOI:10.1227/01.neu.0000255440.21495.80 |
| [26] | Hollig A, Thiel M, Stoffel-Wagner B, et al. Neuroprotective properties of dehydroepiandrosterone-sulfate and its relationship to interleukin 6 after aneurysmal subarachnoid hemorrhage: A prospective cohort study[J]. Crit Care, 2015, 19(1): 231. DOI:10.1186/s13054-015-0954-1 |
| [27] | Xiong S. Macrophage polarization of the disease: Mechanisms and function[J]. Current Immunology, 2010, 5(1): 353-360. |
| [28] | Fleetwood AJ, Lawrence T, Hamilton JA, et al. Granulocyte-macrophage colony-stimulating factor (csf) and macrophage csf-dependent macrophage phenotypes display differences in cytokine profiles and transcription factor activities: Implications for csf blockade in inflammation[J]. J Immunol, 2007, 178(8): 5245-5252. DOI:10.4049/jimmunol.178.8.5245 |
| [29] | Barry B, Mook K, Madelijn G, et al. Pathogenesis and pathophysiology of pneumococcal meningitis[J]. Clinical Microbialogy, 2011, 24(3): 557-591. DOI:10.1016/S1473-3099(02)00450-4 |
| [30] | Girard S, Brough D, Lopez-Castejon G, et al. Microglia and macrophages differentially modulate cell death after brain injury caused by oxygen-glucose deprivation in organotypic brain slices[J]. Glia, 2013, 61(5): 813-824. DOI:10.1002/glia.22478 |
| [31] | Durafourt BA, Moore CS, Zammit DA, et al. Comparison of polarization properties of human adult microglia and blood-derived macrophages[J]. Glia, 2012, 60(5): 717-727. DOI:10.1002/glia.22298 |
| [32] | Lang R, Patel D, Morris JJ, et al. Shaping gene expression in activated and resting primary macrophages by il-10[J]. J Immunol, 2002, 169(5): 2253-2263. DOI:10.4049/jimmunol.169.5.2253 |
| [33] | Yoshimura A, Naka T, Kubo M. Socs proteins, cytokine signalling and immune regulation[J]. Nat Rev Immunol, 2007, 7(6): 454-465. DOI:10.1038/nri2093 |
| [34] | Nishimura T, Hattori K, Inoue A, et al. Bacteremia or pseudobacteremia? Review of pseudomonas fluorescens infections[J]. World J Emerg Med, 2017, 8(2): 151-154. DOI:10.5847/wjem.j.1920-8642.2017.02.013 |
| [35] | Kim WK, Alvarez X, Fisher J, et al. Cd163 identifies perivascular macrophages in normal and viral encephalitic brains and potential precursors to perivascular macrophages in blood[J]. Am J Pathol, 2006, 168(3): 822-834. DOI:10.2353/ajpath.2006.050215 |
| [36] | Mosser DM, Edwards JP. Exploring the full spectrum of macrophage activation[J]. Nat Rev Immunol, 2008, 8(12): 958-969. DOI:10.1038/nri2448 |
| [37] | Schaefer E, Wu W, Mark C, et al. Intermittent hypoxia is a proinflammatory stimulus resulting in il-6 expression and m1 macrophage polarization[J]. Hepatol Commun, 2017, 1(4): 326-337. DOI:10.1002/hep4.1045 |
 2019, Vol. 28
2019, Vol. 28




