2 浙江大学药学院,杭州 310058;
3 浙江中医药大学生命科学学院,杭州 310053
随着急性脑血管病发病率和病死率明显增高,其出现的一系列并发症尤其是心血管并发症也越来越受到人们关注。这种由急性脑血管和急性颅脑损伤患者在急性期引发出现类似心肌缺血、急性心肌梗死或心力衰竭等一系列心脏功能的异常,称为“脑心综合征”[1-2]。脑心综合征是急性脑梗死最常见的并发症,也是导致高病死率的主要因素,目前临床脑心综合征的治疗效果欠佳,严重影响患者预后,因此对颅脑损伤引起的心肌损伤要及早发现并积极干预,以减少颅脑外伤的病死率[3]。
中药在治疗心脑血管病中的应用越来越广泛,对脑心综合征的治疗具有良好的应用前景[4-5]。参麦注射液由红参、麦冬提纯制备而成,具有安神、益气、养阴生津等功效,可以强心升压、扩张冠脉、增加心肌供血、减少心肌耗氧量、清除氧自由基等[6]。参麦注射液可通过抗凋亡以减轻神经细胞缺血所致损伤[7],并且可以通过调节血小板源生长因子(platelet derived growth factor, PDGF)等途径保护脑损伤[8],广泛应用于脑梗死的临床治疗。但是参麦注射液对脑血管病变所致心脏功能的损伤是否有保护作用鲜有文献报道。因此本研究通过建立脑心综合征动物模型,观察参麦注射液对急性脑损伤导致的心肌损伤的保护作用,为参麦注射液防治脑心综合征的临床应用提供理论支撑。
1 材料与方法 1.1 实验动物C57BL/6雄性小鼠60只,体质量22~25 g,购自上海斯莱克实验动物有限公司(合格证号:20160004000123),自由饮水进食,适应性饲养一周后用于实验。本研究动物实验设计和实施过程符合实验动物福利和伦理要求。
1.2 仪器与试剂脑立体定位打击仪(Hatteras Instruments,美国),Vevo 2100小动物超声仪(Visual Sonics, 加拿大),PV-Loop血流动力学检测仪(AD Instrument,澳大利亚),体视拍照显微镜(Olympus,日本),石蜡切片机(Leica,德国),正置显微镜(Leica,德国)。
参麦注射液(正大青春宝药业有限公司,浙江),水合氯醛(国药集团化学试剂有限公司,上海),甲醛溶液(上海凌峰化学试剂有限公司,上海),一氧化氮试剂盒(碧云天生物技术有限公司,上海)
1.3 实验方法 1.3.1 小鼠急性颅脑损伤模型的建立4%水合氯醛腹腔注射麻醉小鼠。固定小鼠,剪去小鼠头部毛发,使手术视野充分暴露。剪开脑部皮肤,于左顶叶上方用骨钻钻孔,不伤到脑组织。取下颅骨,采用控制性皮质撞击方法制作外伤性颅脑损伤模型[9],打击速度3.0 m/s,挫伤时间40 ms,打击深度分别为0.5 mm、1.0 mm和1.5 mm。打击结束后将颅骨放回原位,用5-0丝线将皮肤缝合,并将小鼠转移至保温毯复苏。
1.3.2 实验分组实验小鼠按随机数字法分为四组:假手术组(Sham),模型组(TBI),参麦注射液低剂量组(TBI+SMI Low)和高剂量组(TBI+SMI High)。其中假手术组只开颅不撞击,参麦注射液设置5 mL/(kg·d)和10 mL/(kg·d)两组,于术前3 d尾静脉注射给药,模型组和假手术组尾静脉给予同等剂量生理盐水。
1.3.3 心功能评价分别于TBI造模后0 h和1 h应用Vevo2100小动物超声仪进行经胸心脏超声检查,小鼠固定后,于胸骨旁左心室乳头肌水平短轴切面采集M型超声心动图,测定各组小鼠心脏左心室射血分数(ejection fractions, EF%)和左室短轴缩短率(fractional shortening, FS%)。
1.3.4 血流动力学检测分别于TBI造模后1 h和24 h应用Millar导管经右颈总动脉逆向插管,插入左心室,检测记录小鼠心脏血流动力学参数,测定左室收缩压(left ventricular systolic pressure, LVSP),左室舒张末压(left ventricular end diastolic pressure, LVEDP),左心室压力最大上升速率(+dp/dtmax)和左心室压力最大下降速率(-dp/dtmax)。
1.3.5 血清一氧化氮(NO)检测TBI模型建立24 h后,收集小鼠血液,室温放置2 h后于3 000 r/min,4℃离心15 min后取上清液,试剂盒检测血清中一氧化氮NO的含量。
1.3.6 凋亡蛋白mRNA表达TBI模型建立24 h处死动物,取100 mg心肌组织于1 mL Trizol溶液中进行组织匀浆,加入200 μL三氯乙烷震荡混匀后室温静置2~3 min,12 000 g,4℃离心15 min取上清液,加入500 μL异丙醇,混匀后静置10 min,10 000 g 4℃离心10 min,弃去上清液,加入1 mL 75%乙醇充分震荡后10 000 g 4℃离心5 min,弃去乙醇,室温干燥后加入20 μL双蒸水,55℃加热15 min。Nanodrop测定RNA浓度后进行RNA反转录,后用ViiA 7 Q-PCR仪检测Bax的mRNA表达。
1.3.7 组织病理结构检测小鼠处死后,经心脏灌注预冷PBS溶液清洗血液,后取出心脏和大脑置于甲醛溶液中固定。大脑经体视显微镜拍照后和心脏一起脱水并进行石蜡包埋,石蜡切片机切片后通过HE染色观察各组大脑和心脏病理结构变化。
1.4 统计学方法采用GraphPad Prism 6软件分析数据,计量资料以均数±标准差(Mean±SD)表示,组间比较采用SNK-q检验,以P < 0.05为差异有统计学意义。
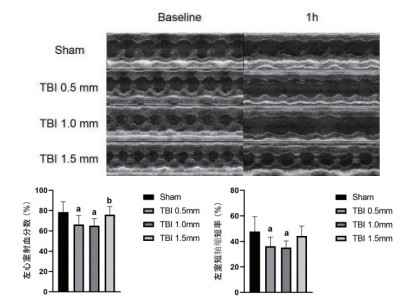
2 结果 2.1 模型构建条件优化TBI造模时,分别采用挫伤深度0.5、1.0和1.5 mm进行撞击制作外伤性颅脑损伤模型。术后1 h进行超声心动检测测定各组动物心脏功能,对比不同撞击条件对颅脑损伤小鼠心功能的影响。超声结果显示,在TBI术后1 h,0.5 mm组和1.0 mm组小鼠的EF%和FS%与假手术组相比均显著降低(P < 0.05),1.5 mm组与假手术组差异无统计学意义(图 1),因此选用挫伤深度1.0 mm进行模型制备用于后续研究。
|
| 与Sham组比较,aP < 0.05;与TBI 1.0 mm组比较,bP < 0.05 图 1 不同挫伤深度对小鼠心功能的影响 |
|
|
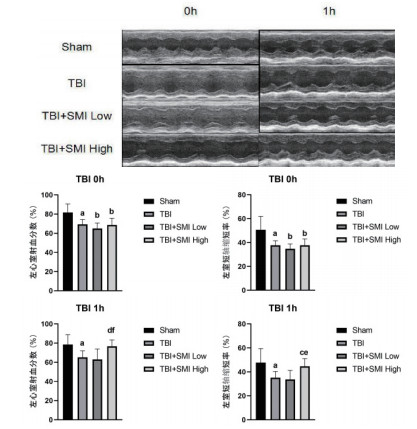
尾静脉给予小鼠参麦注射液预处理3 d后,根据优化后的1.0 mm挫伤深度进行TBI造模,并分别于术后0 h和1 h进行高频超声心动检测小鼠心功能。结果显示术后0 h,造模损伤组与假手术组相比,EF%和FS%均显著降低,提示脑心综合征造模成功。术后1 h,与TBI模型组相比,参麦注射液高剂量组能够显著改善TBI小鼠的EF%(P < 0.01)和FS%(P < 0.05),而参麦注射液低剂量组与模型组相比无明显改善(图 2)。
|
| 与Sham组比较,aP < 0.05;bP < 0.01;与TBI组比较,cP < 0.05;dP < 0.01;与TBI+SMI Low组比较,eP < 0.05;fP < 0.01 图 2 术后各组小鼠心功能测定 |
|
|
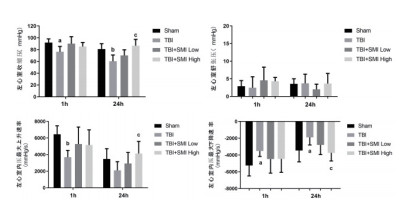
分别于TBI术后1 h及24 h测定各组小鼠心脏血流动力学指标,结果显示TBI术后1 h造模组的血流动力学指标相比于假手术组有下降的趋势。术后24 h时,造模组小鼠LVSP和-dp/dtmax均显著降低,与假手术组比差异有统计学意义。而参麦注射液高剂量预处理可以改善小鼠的心脏血流动力学,提高LVSP、+dp/dtmax和-dp/dtmax的水平,与TBI造模组相比差异有统计学意义(图 3)。
|
| 与Sham组比较,aP < 0.05;bP < 0.01;与TBI组比较,cP < 0.01 图 3 TBI术后1 h和24 h小鼠心脏血流动力学检测 |
|
|
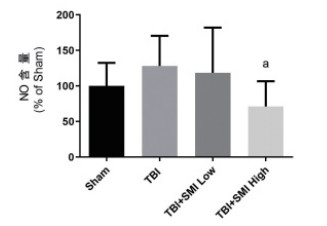
给予小鼠尾静脉注射参麦注射液预处理3 d后,进行TBI造模,于术后24 h眼眶静脉取血,收集上清液后用NO测定试剂盒检测各组小鼠血清中NO的含量,结果显示,参麦注射液高剂量组能够显著降低TBI小鼠血清中的NO,与模型组相比差异有统计学意义(P < 0.05)(图 4)。
|
| 与TBI组比较,aP < 0.05 图 4 TBI术后24 h小鼠血清NO含量 |
|
|
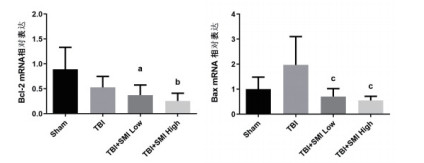
PCR定量结果显示参麦注射液预处理后,小鼠急性脑损伤24 h的心脏组织中促凋亡蛋白Bax的mRNA表达与模型组相比显著降低,但是抑凋亡蛋白Bcl-2的mRNA表达与模型组相比没有明显变化(图 5)。
|
| 与Sham组比较,aP < 0.05;bP < 0.01;与TBI组比较,cP < 0.05 图 5 TBI术后24 h凋亡相关蛋白Bcl-2及Bax的基因表达 |
|
|
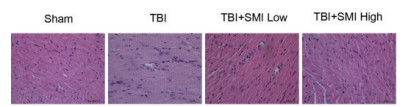
HE染色结果显示,TBI模型组小鼠心脏炎症浸润较多,参麦注射液预处理后能够减少心肌细胞的炎症浸润(图 6)。
|
| 图 6 TBI术后24 h小鼠心脏HE染色(400×) |
|
|
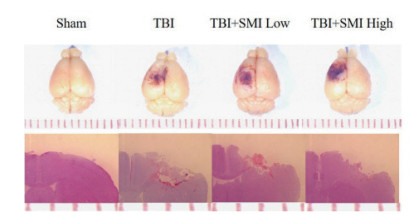
体视显微镜拍照结果显示,TBI损伤小鼠脑皮质后,大脑皮质呈现明显的塌陷。进一步HE染色结果显示,TBI模型组小鼠皮质明显受损,参麦注射液预处理后能够减少大脑皮质的损伤面积(图 7)。
|
| 图 7 TBI术后24 h小鼠大脑整体拍照(10×)和HE染色(40×) |
|
|
脑心综合征是指各种脑血管疾病所致的继发性心脏功能改变,具有发病急、进展快、病死率高等特点。急性脑损伤发生后,大脑在急性应激状态下会造成心脏左心室功能的短暂抑制[10],颅脑损伤所致心脏影响与其损伤程度有关。不同条件造模导致小鼠心脏功能的变化也不一样。本研究发现在挫伤深度1.0 mm的条件下,术后1 h小鼠EF%和FS%与假手术组相比均显著降低(P < 0.05)。尾静脉给予小鼠高低两个剂量的参麦注射液预处理3 d后再进行TBI造模,术后1 h,与模型组相比,参麦注射液高剂量组显著提高了小鼠的EF%和FS%,说明参麦注射液高剂量对急性脑损伤小鼠的早期心脏功能具有良好的保护作用。
颅脑损伤急性期机体的血流动力学变化较大,通过监测血流动力学指标对判断预后及指导治疗具有重要意义[11]。通过检测TBI术后1 h和24 h的心脏血流动力学变化,研究发现TBI造模组小鼠的血流动力学指标在术后1 h有下降趋势,至24 h时模型组与假手术组相比显著性降低。参麦注射液高剂量预处理小鼠则能够改善心脏的LVSP、+dp/dtmax和-dp/dtmax,对维持心脏功能起到明显的保护作用。
NO是体内重要的生物活性物质,具有多种生理作用。在急性脑损伤患者血清中,NO的含量明显增加。过量的NO会对神经细胞产生毒性,也会导致血管内皮细胞损伤[12-13]。本研究发现参麦注射液高剂量预处理能够显著降低脑损伤小鼠血清中的NO水平。Bcl-2和Bax是参与细胞凋亡的两个核心因子,分别具有抑制和促进细胞凋亡的作用[14-15]。本研究发现参麦注射液预处理后,小鼠急性脑损伤24 h的心脏组织中促凋亡蛋白Bax的mRNA表达与模型组相比显著降低,提示参麦注射液具有抑制急性脑损伤导致的心肌细胞凋亡的作用。此外,组织病理HE染色结果显示,TBI模型组小鼠大脑皮质明显受损,参麦注射液预处理后能够减少大脑皮质的损伤面积。同时高剂量参麦注射液能够减轻心肌细胞的炎症浸润,说明参麦注射液对急性脑损伤后的心脏具有保护作用。
急性颅脑损伤时心肌损伤的机制可能与心脏直接受损、神经体液因素影响、颅内高压的影响、血流动力学和水电解质平衡紊乱和全身炎症反应的影响有关[3]。本研究通过建立控制性皮质撞击所致脑心综合征模型,发现参麦注射液预处理可以通过降低血清NO含量,抑制心肌细胞凋亡而改善损伤早期小鼠的心功能和血流动力学,对急性脑损伤所致的心脏功能受损具有明显的保护作用,但是其具体的作用机制还有待进一步深入研究。
| [1] | Byer E, Ashman R, Toth LA. Electrocardiograms with large, upright T waves and long Q-T intervals[J]. Am Heart J, 1947, 33(6): 796-806. DOI:10.1016/0002-8703(47)90025-2 |
| [2] | Escobedo LVS, Habboushe J, Kaafarani H, et al. Traumatic brain injury: A case-based review[J]. World J Emerg Med, 2013, 4(4): 252. DOI:10.5847/wjem.j.issn.1920-8642.2013.04.002 |
| [3] | 陈华文, 祝伟, 李树生. 重型颅脑损伤患者心肌损伤的临床研究[J]. 中华急诊医学杂志, 2012, 21(6): 577-580. DOI:10.3760/cma.j.issn.1671-0282.2012.06.004 |
| [4] | 吴生兵, 周美启, 杨骏. 中医药治疗脑心综合征的研究进展[J]. 安徽中医学院学报, 2007, 26(1): 62-64. DOI:10.3969/j.issn.1000-2219.2007.01.027 |
| [5] | 刘德浪, 余洪, 刘卫花. 血塞通对脑梗死并脑心综合征患者心肌损伤指标和左心室功能的影响[J]. 中国药业, 2018, 27(21): 67-69. DOI:10.3969/j.issn.1006-4931.2018.21.021 |
| [6] | 张圣塨, 白玉, 王良荣, 等. 参麦注射液对外伤性脑损伤大鼠血清神经元烯醇化酶一氧化氮内皮素水平的影响[J]. 中华中医药学刊, 2010, 28(3): 583-585. DOI:10.13193/j.archtcm.2010.03.136.zhangshg.040 |
| [7] | 于艳秋. 参麦注射液治疗老年急性脑梗死[J]. 中国新药与临床杂志, 2000, 19(2): 96-98. DOI:10.3969/j.issn.1007-7669.2000.02.006 |
| [8] | Cheng JY, Huang JC, Liu GY, et al. Effect of shenmai injection on the expression of hippocampal cfos gene of rats with ischemic cerebral injury[J]. Chin J Clin Rehabilit, 2005, 9: 228-229. |
| [9] | 张曼, 滕陈怀, 吴芳芳, 等. 依达拉奉对小鼠创伤性脑损伤后氧化应激反应的影响[J]. 中华急诊医学杂志, 2019, 28(3): 323-327. DOI:10.3760/cma.j.issn.1671-0282.2019.03.010 |
| [10] | Ako J, Sudhir K, Farouque HMO, et al. Transient left ventricular dysfunction under severe stress: brain-heart relationship revisited[J]. Am J Med, 2006, 119(1): 10-17. DOI:10.1016/j.amjmed.2005.08.022 |
| [11] | 王海燕, 赵天龙, 秦宗和, 等. 重型颅脑损伤急性期血流动力学和脑氧摄取的监测及意义[J]. 蚌埠医学院学报, 2000, 25(6): 409-410. DOI:10.3969/j.issn.1000-2200.2000.06.013 |
| [12] | 朱剑功, 杨喜民. 黄芪对颅脑外伤患者一氧化氮含量变化的影响[J]. 中国中医药现代远程教育, 2009, 7(7): 96. DOI:10.3969/j.issn.1672-2779.2009.07.086 |
| [13] | 张国栋, 段静彦. 急性颅脑损伤患者血清NO浓度变化[J]. 中国血液流变学杂志, 2006, 16(1): 135-136. DOI:10.3969/j.issn.1009-881X.2006.01.052 |
| [14] | 秦琦, 李文杰, 王有雪, 等. 益气养阴通络法对急性心肌梗死大鼠心肌细胞凋亡Bax、Bcl-2、Caspase3表达的影响[J]. 中华中医药学刊, 2019, 37(6): 1392-1395. DOI:10.13193/j.issn.1673-7717.2019.06.028 |
| [15] | Khanzadeh T, Hagh MF, Talebi M, et al. Investigation of BAX and BCL2 expression and apoptosis in a resveratrol- and prednisolone-treated human T-ALL cell line, CCRF-CEM[J]. Blood Res, 2018, 53(1): 53. DOI:10.5045/br.2018.53.1.53 |
 2019, Vol. 28
2019, Vol. 28




