近些年随着我国急救医疗体系的完善和心肺复苏(cardiopulmonary resuscitation, CPR)技术的提高,患者发生心脏骤停(cardiac arrest, CA)经最初CPR后恢复自主循环(return of spontaneous circulation, ROSC)成功率有所提高,但出院存活率仍然很低。即使在医疗技术较发达的北京地区,院外发生的因心源性病因导致CA患者中,被急救人员发现时也仅有7.7%存在可除颤心律,只有5%能ROSC,4.2%存活住院,而存活出院的仅占1.3%[1]。
影响ROSC患者预后的主要因素是CA后综合征,包括伴随循环休克的心肌功能障碍,伴随凝血系统激活的系统性炎症,不断进展的脑损伤以及持续存在的病理学变化[2]。复苏后心肌功能障碍是导致患者早期死亡的主要原因之一[3-4],其中机械因素包括严重的心肌收缩力损伤和心肌舒张功能不全;电生理因素包括各种心律失常,甚至交感电风暴[5]。这些因素引起血流动力学不稳定,最终可能导致多器官功能衰竭[6]。CA患者存在复苏后心肌功能障碍的同时,也常并存低血压和组织微循环低灌注状态,并将持续数天[7]。对复苏后患者进行严密的血流动力学监测和通过各种药物、器械等手段维持血流动力学稳定,是改善患者远期生存率的关键环节。ROSC后目标温度管理(targeted temperature management, TTM)是被临床证实能提高CA后昏迷患者的生存率,改善神经功能预后的措施[8]。TTM治疗期间低温对血流动力学的影响有其特殊的表现。笔者希望通过制定CPR后血流动力学管理专家共识,与国内同道共同维护CA患者的重要脏器组织灌注,改善患者预后。
1 CA-ROSC后血流动力学变化 1.1 复苏后心功能障碍CA患者复苏后早期就会出现心肌功能障碍,而这种暂时性心肌功能障碍是可逆的。患者CA-ROSC后24 h内心排指数出现下降,一般2~3 d开始恢复,但完全恢复可能需要更长的时间[9]。Laurent等[7]研究表明,在148例院外CA后心肌功能障碍患者中,有49%表现为心动过速与左心舒张期末压增高,复苏后6 h出现血压下降(平均动脉压 < 75 mmHg,1 mmHg=0.133 kPa)与心排血量减少[心脏指数 < 2.2 L/(min·m2),复苏后8 h心脏指数降至最低点]。与死亡患者相比,存活出院的患者在ROSC后24 h内的左室射血分数较高[10]。
有研究表明,在ROSC后24 h心肌功能即有明显改善,72 h几乎完全转为正常[7]。但也有研究发现,患者在ROSC后射血分数经历了一个比较缓慢的恢复过程(数周至数月不等)[11]。这可能与CA患者复苏持续的时间以及原发基础疾病等因素有关。CA的持续时间越长,期间的肾上腺素使用量越多,也会进一步加重复苏后心肌功能障碍[7]。应用正性肌力药物可以改善复苏后心肌功能障碍已经在临床和动物实验中得到验证[7, 11-12]。
推荐意见1:CA患者在ROSC后会出现的暂时性、可逆性的心肌功能障碍,可以选择应用正性肌力药物改善心功能。
1.2 复苏后低血压CA患者ROSC后血压变化个体差异很大,一般表现为一过性升高而后进行性下降的过程[13]。ROSC即刻心率加快与血压升高,可能与血清儿茶酚胺一过性升高有关。CA会导致机体应激反应,产生大量儿茶酚胺,但CA时机体血流基本停止,机体产生的儿茶酚胺不能进入血液循环,当ROSC后大量儿茶酚胺入血,会出现短时的血压心率升高[13]。而儿茶酚胺的半衰期很短,当合并复苏后心肌功能障碍时会进一步导致血压下降。有一研究表明,在入住ICU的8 736例成年CA患者中有47%的患者存在低血压(收缩压 < 90 mmHg),到达ICU后1 h内收缩压 < 90 mmHg的患者,存活出院的可能性较低,神经功能恢复也较差[14]。Kilgannon等[10]对CA患者复苏后的前6 h内每15 min进行无创血压测量,当对存活和死亡患者进行比较时,具有良好神经功能结局患者的时间加权平均动脉压阈值为(83±13)mmHg,显著高于具有不良神经功能结局的患者的(77±18)mmHg,差异有统计学意义(P=0.042)。这些数据揭示低血压与不良神经功能结局之间存在强烈的关联。
推荐意见2:CA-ROSC后低血压与患者远期不良预后密切相关,尽早积极纠正低血压可以改善预后。
1.3 复苏后微循环障碍微循环是微动脉与微静脉之间毛细血管中的血液循环, 是循环系统中最基本的结构和功能单位。微循环血流的充足灌注是机体细胞存活和组织器官维持正常功能的必要条件。微循环监测常常被用于危重患者,在脓毒症方面研究较广,但在CPR的研究中也得到了应用[15-16]。采用先进的正交极化光谱成像和侧流暗视野成像技术, 可床旁直接观察和分析复苏后微循环变化。Omar等[17]针对复苏后微循环进行评价,与健康人相比,CA-ROSC后患者舌下微循环血流指数明显下降,而且24 h微循环血流指数与神经功能预后明显相关。ROSC后由于大脑缺血缺氧损伤导致自我调节受损以及颅内压升高,需要通过升高平均动脉压来增加脑灌注。为了使平均动脉压保持在65 mmHg以上来维持脑和心脏灌注,血管活性药物常被过量应用[18]。然而有研究表明平均动脉压与微循环血流没有明显相关,应用血管升压药提升血压虽然可以得到较好的血流动力学参数,但并不改善甚至可能加重微循环灌注障碍[19-21]。所以,关注CA患者的平均动脉压的同时,也要关注微循环血流的变化。
推荐意见3:ROSC后存在微循环障碍,在关注CA患者血压的同时,也要关注微循环血流的变化。
2 CA-ROSC后血流动力学监测CA患者进入ICU后,在开始的3 d内由于复苏后心肌功能障碍导致的心血管系统衰竭是导致患者死亡的首要原因[3]。在ICU的CA患者,连续有创动脉压监测和中心静脉通路是必不可少的。应根据血流动力学的不稳定程度和对应用的正性肌力药和血管活性药的需求来考虑是否需要更高级的血流动力学监测。所有CA患者都应接受复苏后的心肌功能障碍筛查。最好在入院早期就进行超声心动图检测,以检测和量化心肌功能障碍的程度[22]。由于复苏后心肌功能障碍的发作可能会延迟几个小时,所以对于血流动力学不稳定的患者,需要在开始数小时后或数天重复进行超声心动图检测,并严密监测血压、心率、心排血量、尿量、血浆乳酸清除率和中心静脉血氧饱和度等[23]。特别是对心排血量的连续监测是指导治疗复苏后心功能障碍的重要手段[24]。但并没有充分的证据表明使用肺动脉导管或无创心排血量监测可以改善CA患者的远期预后[2]。如有条件还可以进行舌下黏膜微循环血流监测。
对于CA后昏迷患者,TTM开始越早越好。然而对于院前是否开始低温治疗还有争议。尤其大量快速地输注冷盐水降温,可能增加肺水肿的发生,导致血氧下降,心脏负荷加重,最终增加再发CA的概率[25]。因此对于院前进行冷盐水灌注降温的CA患者,在入院时应筛查患者的肺循环负荷。肺部超声检测可以在急诊科或ICU中迅速进行,来可靠地检测肺水肿的状况。胸部X片也可以作为评价方法。
推荐意见4:所有CA患者都应做超声心动图,以评估复苏后的心肌功能状态;对于血流动力学不稳定的CA患者需要反复评估超声心动图,还应进行连续心排血量监测。
3 CA-ROSC后血流动力学管理 3.1 冠脉介入治疗在CA患者中的应用急性冠脉综合征见于多数院外心脏骤停患者,而急性心肌梗死又是心源性猝死最常见的病因之一。研究表明急性心肌梗死约占院外发生CA原因的50%[26],而约占院内发生CA的11%[27]。CA-CPR救治过程中的心肌损伤导致ROSC后识别急性心肌梗死的心脏标志物特异性下降。复苏过程中测定血肌钙蛋白T的升高提示发生院外CA的原因是急性冠脉综合征的患者比例约为40%[28]。
对于发生急性心肌梗死的CA患者,如果不能尽早开通冠脉,ROSC后很容易出现复苏后心功能障碍和各种恶性心律失常,甚至出现心源性休克(cardiogenic shock, CS)。所以对于心电图显示存在ST段抬高心肌梗死的CA患者应ROSC后立即行冠脉造影,根据相应指征行经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)[2]。Knafelj等[29]研究认为此方法可以使ST段抬高性心肌梗死的CA患者的住院病死率由66%降至25%。如果没有条件做PCI,可以对ST段抬高的急性心肌梗死患者进行溶栓治疗[30]。此外基于院外CA患者中急性心肌梗死的高发生率及心电图、心脏标志物的局限性,因此对于所有怀疑可能由急性冠脉综合征导致的CA患者也应当立即进行冠脉造影[2]。
推荐意见5:所有CA患者,如果心电图显示ST抬高心肌梗死,ROSC后应立即进行冠脉造影和相应指征的PCI治疗;院外CA患者,当怀疑可能存在急性冠脉综合征,即使没有典型的心电图证据也建议在ROSC后进行冠脉造影。
3.2 复苏后目标血压目前尚无前瞻性研究确定CA后的最佳平均动脉压,但是建议CA患者维持平均动脉压 > 65 mmHg,收缩压 > 90 mmHg[8, 31]。在一项前瞻性单中心观察研究中,发现时间加权平均动脉压≥70 mmHg与良好神经功能结局之间存在关联[10]。也有研究表明,平均动脉压维持在65~90(或100)mmHg的情况下,院外CA住院患者可获得良好的转归[26]。相反,一项对8 736例患者进行的大型多中心回顾性观察研究发现,ROSC后收缩压 > 80 mmHg与病死率或出院时的神经功能结局无关[32]。由于CA后综合征患者大部分存在脑血管自身调节功能受损和复苏后心功能障碍,而平均动脉压既是影响脑组织灌注(脑灌注压=平均动脉压-颅内压)的关键因素,也是影响心功能的重要参数。所以,最佳平均动脉压应保证大脑灌注,而又不会使受损的心肌处于后负荷过量的状态。在没有明确数据支持的情况下,应把良好的组织灌注作为反映最佳目标平均动脉血压的间接指标,例如实现患者有充足的尿量[1 mL/(kg·h)]、正常或较低的血浆乳酸值,同时也要考虑患者平时的正常血压、CA原因以及心肌功能障碍的严重程度[2]。
推荐意见6:ROSC后维持平均动脉压 > 65 mmHg,收缩压 > 90 mmHg。
3.3 液体复苏低血压(平均动脉压 < 65 mmHg或收缩压 < 90 mmHg)的首选干预措施是充分补液[2]。中心静脉压(central venous pressure, CVP)一般控制8~12 mmHg为宜[2]。但要考虑到导致或促发CA的持续存在病理状况(例如心包填塞、急性右心心肌梗死、肺动脉栓塞、张力性气胸,以及其他导致心肌顺应性降低的疾病)对中心静脉压的影响。CA后综合征患者输液量相对较大,耐受性也相对良好[32]。已有研究发现,在院外发生CA-ROSC后的首个24 h内需要3.5~6.5 L的静脉晶体溶液,以维持右心房压在8~13 mmHg的水平[7]。另有研究报道,院外CA患者为了达到积极的体液平衡状态和CVP 8~12 mmHg的目标,在24 h内使用了(3.5±1.6)L的液体[26]。但液体复苏时选择晶体液和胶体液孰优孰劣尚无充分证据。
推荐意见7:充分补液是纠正低血压第一步。一般控制中心静脉压在8~12 mmHg。
3.4 血管活性药物和正性肌力药物如果充分补液增加前负荷(CVP 8~12 mmHg)仍无法达到目标血压,就应考虑应用血管活性药物[2]。研究显示院外CA患者复苏后充分补液优化前负荷情况下,对血管活性药物的依赖性仍持续达72 h[7]。复苏后心肌功能障碍也可以通过正性肌力药物得到改善[11]。一些指标和检测方法对于正性肌力药或血管活性药物的应用有指导作用,包括血压、心率、心排血量、尿量、乳酸清除率、中心静脉血氧饱和度、超声心动图等[31]。
多巴酚丁胺是复苏后心肌功能障碍最常用的正性肌力药物[9]。然而ROSC后的全身炎症反应综合征可导致严重的血管舒张和毛细血管渗漏,诱发持续的低血压状态[7]。去甲肾上腺素单独使用或与多巴酚丁胺联合使用是比较常用的治疗方法[23]。
左西孟旦是多巴酚丁胺的一种可行替代品。这种钙离子增敏剂通过与肌钙蛋白C结合,增加肌细胞对钙的敏感性从而产生正性肌力作用[33]。这种替代性的正性变力机制可以增强肌肉收缩力,而不引起细胞内环磷酸腺苷和钙的增加。米力农是一种磷酸二酯酶抑制剂,也被认为是一种多巴酚丁胺的替代药物,它可以增加心肌收缩力和舒张血管平滑肌,但在血压较低时要慎用[29]。但这两种药物仍需要大规模的研究来评估其潜在的临床价值,多巴酚丁胺仍是复苏后心肌功能障碍首选药物。
尽管正性肌力药和血管活性药对血流动力学参数有改善作用,但对CA患者远期存活的影响尚没有统一的结论[31]。此外,在存在急性冠状动脉综合征和冠状动脉疾病的情况下,正性肌力药有可能加剧或诱导局部心肌缺血。根据目前证据,在CA患者心血管功能障碍治疗中无法得出哪种药物单独使用或联合使用是最好的。
推荐意见8:充分补液后仍无法达到目标血压时可以选择应用去甲肾上腺素;多巴酚丁胺是治疗复苏后心肌功能障碍常用的正性肌力药物。
3.5 机械方法改善心功能如果扩容、血管活性药物、正性肌力药不能恢复足够的组织器官灌注,就需要考虑使用辅助循环装置[34]。在ROSC后24~48 h心功能障碍最为严重,此时机械方法辅助循环对循环系统可起到支持作用[7]。主动脉内球囊反搏可作为ROSC后改善心功能的一种手段[35];其他一些方法还包括经皮心肺分流术、体外膜肺氧合(extracorporeal membrane oxygenation, ECMO)及经胸心室辅助装置等[36]。但在ROSC之后启动这些心血管支持性干预措施的临床价值尚待进一步研究。
推荐意见9:如果扩容、血管活性药和正性肌力药治疗仍不能恢复足够的器官灌注,可以考虑使用机械辅助循环装置。
3.6 ECMO在CA患者中的应用ECMO是通过泵(其作用类似人工心脏)将静脉血液从体内引至体外,经膜式氧合器(其作用类似人工肺,简称膜肺)进行气体交换,使静脉血成为富含氧气的动脉血之后再将血回输入体内,可用于部分或完全替代患者心肺功能,使其得以充分休息,从而为原发病的诊治争取时间。ECMO是一项体外生命支持技术,它可以对各种原因引起CA、急性严重心功能衰竭、急性严重呼吸功能衰竭以及各种严重威胁呼吸循环功能的患者进行暂时代替支持,为危重症的抢救赢得宝贵的时间[37]。
越来越多的研究结果表明ECMO能够提高CA患者的存活出院率。所以体外辅助心肺复苏(extracorporeal cardiopulmonary resuscitation, ECPR)已经成为ECMO循环辅助的一个主要临床适应证。中国2018《成人体外膜氧合循环辅助专家共识》推荐,院内CA患者,常规CPR抢救持续10 min仍未恢复自主循环,且无ECMO禁忌证时,应立即启动ECPR辅助治疗[37]。
CA患者ROSC后存在心功能障碍,严重者出现CS,如果经过积极液体复苏,血管活性药物应用,呼吸机支持等治疗仍不能纠正CS,建议尽早启动ECMO辅助支持治疗[37]。虽然还没有充分的循证医学证据指出难治性CS患者启动ECMO辅助治疗的合适时机,但已有研究表明大剂量应用血管活性药物和正性肌力药物的CS患者预后更差[38]。
推荐意见10:院内CA患者,常规CPR抢救持续10 min仍未恢复自主循环,且无ECMO禁忌证时,立即启动ECPR辅助治疗。CA患者ROSC后出现难治性CS状态时,建议尽早开始ECMO辅助治疗。
4 复苏后TTM对血流动力学的影响CA后TTM即应用物理方法把体温快速降到既定目标水平,并维持在恒定的温度一段时间后缓慢恢复至基础体温,并且避免体温反弹的过程。无论是否心源性原因导致的成人CA,ROSC后仍然昏迷,建议尽早开始TTM。目标温度控制在32~36℃之间的一个恒定值,维持至少24 h,复温的速度应该控制在每小时0.25~0.5℃,复温后积极预防发热的发生。目前临床上常用的TTM降温方法包括血管内低温和体表低温两种。
TTM期间低温本身对心肌功能和收缩力有直接和间接的影响[39]。在正常情况下,当核心温度降至35.5℃以下时,会引发窦性心动过缓,随着温度的进一步降低,心率也逐渐降低。尽管存在着个体差异,在TTM低温治疗期间心率可降至45~55次/min,甚至有13%的接受诱导低温治疗的患者心率低于40次/min[40]。一项针对234例持续休克的院外CA患者的回顾性研究发现,在33℃低温治疗期间,有心动过缓(< 50次/min)的患者180 d病死率为17%,而无心动过缓的患者病死率为38%(P < 0.01)[41]。另一项回顾性研究也发现,TTM期间心动过缓与良好结局存在关联[42]。相反,尝试加快心率,特别是通过右心室起搏增加心率,都将通过减少心动周期的舒张期时间而进一步损害心脏灌注和心脏的舒张功能[43]。所以,TTM期间心动过缓可被看作是短期有利结局的早期标志,而不是发生血流动力学损害时的典型心律失常。如果平均动脉压、乳酸清除率和尿量等指标保持在可接受的水平,心动过缓(即使 < 40次/min)在这段时间内可以先不予治疗[23, 42]。
低温治疗对心肌收缩力的影响很大程度上取决于患者的心率;如果心率可以随温度的降低而进一步降低,大多数患者的心肌收缩力和左心室功能将得到改善,但也可能出现轻度的舒张功能障碍[39]。由于低温治疗导致的心率降低,心排血量通常在32~34℃的低温治疗期间减少25%~40%;然而,与此同时患者代谢率和代谢需求也下降相同或更大的百分比(每摄氏度7%~10%,32℃时为35%~50%),最终的供需平衡得以保持或改善[39]。低温治疗期间,血压将保持稳定或略有增加[39]。低温能通过增加静脉回流、激活心房利尿钠肽、降低抗利尿激素和肾脏的抗利尿激素受体水平以及肾小管功能障碍而引起“冷利尿”,导致低血容量[44]。所以,TTM期间应当关注尿量变化,维持有效循环血容量平衡。
一项临床研究表明复苏后给予低温治疗12 h,与复温后相比低温时舌下微循环血流明显下降[45]。但早期的微循环血流下降是否单纯由于低温作用还是ROSC后本身的病理生理改变不得而知。一项在健康羊上进行的低温研究证实了低温减少舌下微循环血流[46]。脑组织是人体重要器官之一,微循环丰富。近期国内一项动物实验研究采用侧流暗视野成像技术观察颅内微循环变化,发现CA-ROSC后脑的微循环血流明显下降;与非低温治疗相比,血管内低温治疗进一步减少微小血管(直径 < 20 μm)的血流,但是这一减少随着复温后可以明显改善甚至好于前者[47]。然而有两项相反结论的研究,他们通过应用体表低温方法证明低温治疗改善脑微循环血流[48-49]。其中一项研究,制作大鼠CA-ROSC模型,降低核心温度的方式是联合应用冰袋、电风扇和降温毯[48]。另一项研究中的低温方法是在家兔躯体周围应用冰袋降温[49]。可见低温治疗可能降低外周血管微循环血流,对脑微循环血流的影响尚无统一结论。
推荐意见11:ROSC后仍然昏迷的患者,建议尽早开始TTM。TTM期间,心动过缓是正常的生理反应,如果平均动脉压、乳酸清除率和尿量等指标保持稳定,不建议尝试加快心率;心排血量虽然可能下降,但全身代谢需求也下降了相同或更大的百分比,最终的供需平衡是供大于求;应当关注尿量变化,维持有效循环血容量。
5 CA-ROSC后循环管理流程CA-ROSC后循环管理流程见图 1。
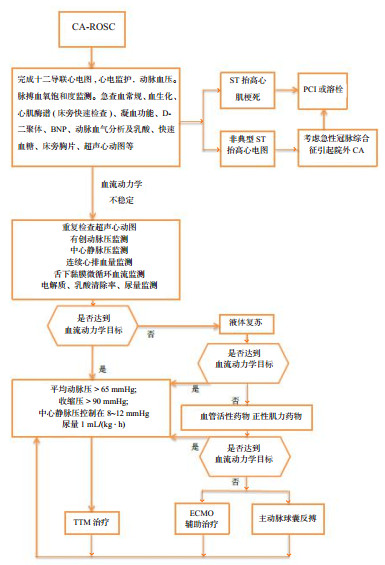
|
| 图 1 CA-ROSC后循环管理流程图 |
|
|
复苏后心肌功能障碍、低血压、微循环障碍较为常见。所以,CA患者都应行超声心动图检测以筛查复苏后的心肌功能障碍。血流动力学不稳定的患者需要进一步连续监测心排血量,有创动脉压和微循环血流监测。CA后的心肌功能障碍通常是可逆的,且对正性肌力药物有反应。尽管理想的动脉压尚不清楚,应积极维持平均动脉压 > 65 mmHg,收缩压 > 90 mmHg。并按个体化需求提供适当的液体复苏和(或)血管活性药支持和(或)正性肌力药支持,必要时可以考虑机械辅助循环装置。多巴酚丁胺是治疗复苏后心肌功能障碍的首选正性肌力药物,当合并严重低血压时通常应用去甲肾上腺素。ROSC后存在微循环障碍,关注血压同时也要关注微循环血流。ROSC后仍然昏迷的患者,建议尽早开始TTM。TTM期间,心动过缓是正常的生理反应,如果平均动脉压、乳酸清除率和尿量等指标保持稳定,不建议尝试加快心率;心排血量虽然可能下降,但全身代谢需求也下降了相同或更大的百分比,最终的供需平衡是供大于求;应当关注尿量变化,维持有效循环血容量。
目前临床上CA的救治效果仍不理想,病死率和致残率很高。笔者希望通过制定本专家共识,加强对CA患者的血流动力学管理,有利于提高重要脏器的组织灌注,从而改善患者的远期预后。
执笔: 赵燊、武军元
| [1] | Shao F, Li CS, Liang LR, et al. Outcome of out-of-hospital cardiac arrests in Beijing, China[J]. Resuscitation, 2014, 85(11): 1411-1417. DOI:10.1016//j.resuscitation.2014.08.008 |
| [2] | Nolan JP, Neumar RW, Adrie C, et al. Post-cardiac arrest syndrome: epidemiology, pathophysiology, treatment, and prognostication. A Scientific Statement from the International Liaison Committee on Resuscitation; the American Heart Association Emergency Cardiovascular Care Committee; the Council on Cardiovascular Surgery and Anesthesia; the Council on Cardiopulmonary, Perioperative, and Critical Care; the Council on Clinical Cardiology; the Council on Stroke[J]. Resuscitation, 2008, 79(3): 350-379. DOI:10.1016//j.resuscitation.2008.09.017 |
| [3] | Dragancea I, Rundgren M, Englund E, et al. The influence of induced hypothermia and delayed prognostication on the mode of death after cardiac arrest[J]. Resuscitation, 2013, 84(3): 337-342. DOI:10.1016//j.resuscitation.2012.09.015 |
| [4] | Lemiale V, Dumas F, Mongardon N, et al. Intensive care unit mortality after cardiac arrest: the relative contribution of shock and brain injury in a large cohort[J]. Intensive Care Med, 2013, 39(11): 1972-1980. DOI:10.1007//s00134-013-3043-4 |
| [5] | Gazmuri RJ, Weil MH, Bisera J, et al. Myocardial dysfunction after successful resuscitation from cardiac arrest[J]. Crit Care Med, 1996, 24(6): 992-1000. DOI:10.1097//00003246-199606000-00020 |
| [6] | Bro-Jeppesen J, Annborn M, Hassager C, et al. Hemodynamics and vasopressor support during targeted temperature management at 33℃ versus 36℃ after out-of-hospital cardiac arrest[J]. Crit Care Med, 2015, 43(2): 318-327. DOI:10.1097//ccm.0000000000000691 |
| [7] | Laurent I, Monchi M, Chiche JD, et al. Reversible myocardial dysfunction in survivors of out-of-hospital cardiac arrest[J]. J Am Coll Cardiol, 2002, 40(12): 2110-2116. DOI:10.1016//s0735-1097(02)02594-9 |
| [8] | Callaway CW, Donnino MW, Fink EL, et al. Part 8: Post-Cardiac Arrest Care: 2015 American Heart Association Guidelines Update for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care[J]. Circulation, 2015, 132(18 Suppl 2): S465-482. DOI:10.1161//CIR.0000000000000262 |
| [9] | Kern KB, Hilwig RW, Rhee KH, et al. Myocardial dysfunction after resuscitation from cardiac arrest: An example of global myocardial stunning[J]. J Am Coll Cardiol, 1996, 28(1): 232-240. DOI:10.1016//0735-1097(96)00130-1 |
| [10] | Kilgannon JH, Roberts BW, Jones AE, et al. Arterial blood pressure and neurologic outcome after resuscitation from cardiac arrest[J]. Crit Care Med, 2014, 42(9): 2083-2091. DOI:10.1097//ccm.0000000000000406 |
| [11] | Ruiz-Bailén M, de Hoyos EA, Ruiz-Navarro S, et al. Reversible myocardial dysfunction after cardiopulmonary resuscitation[J]. Resuscitation, 2005, 66(2): 175-181. DOI:10.1016//j.resuscitation.2005.01.012 |
| [12] | Huang CH, Hsu CY, Chen HW, et al. Erythropoietin improves the postresuscitation myocardial dysfunction and survival in the asphyxia-induced cardiac arrest model[J]. Shock, 2007, 28(1): 53-58. DOI:10.1097//shk.0b013e31802f0218 |
| [13] | Wu JY, Wang S, Li CS. Hemodynamic and catecholamine changes after recurrent ventricular fibrillation[J]. J Emerg Med, 2013, 44(2): 543-549. DOI:10.1016//j.jemermed.2012.06.022 |
| [14] | Trzeciak S, Jones AE, Kilgannon JH, et al. Significance of arterial hypotension after resuscitation from cardiac arrest[J]. Crit Care Med, 2009, 37(11): 2895-2903. DOI:10.1097//ccm.0b013e3181b01d8c |
| [15] | Wu JY, Li CS, Yuan W. Effects of Shenfu injection on macrocirculation and microcirculation during cardiopulmonary resuscitation[J]. J Ethnopharmacol, 2016, 180: 97-103. DOI:10.1016//j.jep.2016.01.027 |
| [16] | Wu JY, Li CS, Yuan W. Phosphodiesterase-5 inhibition improves macrocirculation and microcirculation during cardiopulmonary resuscitation[J]. Am J Emerg Med, 2016, 34(2): 162-166. DOI:10.1016//j.ajem.2015.09.033 |
| [17] | Omar YG, Massey M, Andersen LW, et al. Sublingual microcirculation is impaired in post-cardiac arrest patients[J]. Resuscitation, 2013, 84(12): 1717-1722. DOI:10.1016//j.resuscitation.2013.07.012 |
| [18] | Subramanian S, Yilmaz M, Rehman A, et al. Liberal vs. conservative vasopressor use to maintain mean arterial blood pressure during resuscitation of septic shock: an observational study[J]. Intensive Care Med, 2008, 34(1): 157-162. DOI:10.1007//s00134-007-0862-1 |
| [19] | Dubin A, Pozo MO, Casabella CA, et al. Increasing arterial blood pressure with norepinephrine does not improve microcirculatory blood flow: a prospective study[J]. Crit Care, 2009, 13(3): R92. DOI:10.1186//cc7922 |
| [20] | Lima A, van Bommel J, Jansen TC, et al. Low tissue oxygen saturation at the end of early goal-directed therapy is associated with worse outcome in critically ill patients[J]. Crit Care, 2009, 13(Suppl 5): S13. DOI:10.1186//cc8011 |
| [21] | Lima A, van Bommel J, Sikorska K, et al. The relation of near-infrared spectroscopy with changes in peripheral circulation in critically ill patients[J]. Crit Care Med, 2011, 39(7): 1649-1654. DOI:10.1097//ccm.0b013e3182186675 |
| [22] | Chang WT, Ma MHM, Chien KL, et al. Postresuscitation myocardial dysfunction: correlated factors and prognostic implications[J]. Intensive Care Med, 2007, 33(1): 88-95. DOI:10.1007//s00134-006-0442-9 |
| [23] | Pellis T, Sanfilippo F, Ristagno G. The optimal hemodynamics management of post-cardiac arrest shock[J]. Best Pract Res Clin Anaesthesiol, 2015, 29(4): 485-495. DOI:10.1016//j.bpa.2015.10.002 |
| [24] | Oksanen T, Skrifvars M, Wilkman E, et al. Postresuscitation hemodynamics during therapeutic hypothermia after out-of-hospital cardiac arrest with ventricular fibrillation: A retrospective study[J]. Resuscitation, 2014, 85(8): 1018-1024. DOI:10.1016//j.resuscitation.2014.04.026 |
| [25] | Kim F, Nichol G, Maynard C, et al. Effect of prehospital induction of mild hypothermia on survival and neurological status among adults with cardiac arrest[J]. JAMA, 2014, 311(1): 45-52. DOI:10.1001//jama.2013.282173 |
| [26] | Sunde K, Pytte M, Jacobsen D, et al. Implementation of a standardised treatment protocol for post resuscitation care after out-of-hospital cardiac arrest[J]. Resuscitation, 2007, 73(1): 29-39. DOI:10.1016//j.resuscitation.2006.08.016 |
| [27] | Nadkarni VM, Larkin GL, Peberdy MA, et al. First documented rhythm and clinical outcome from in-hospital cardiac arrest among children and adults[J]. JAMA, 2006, 295(1): 50-57. DOI:10.1001//jama.295.1.50 |
| [28] | Lai CS, Hostler D, D'Cruz BJ, et al. Prevalence of troponin-T elevation during out-of-hospital cardiac arrest[J]. Am J Cardiol, 2004, 93(6): 754-756. DOI:10.1016//j.amjcard.2003.11.068 |
| [29] | Knafelj R, Radsel P, Ploj T, et al. Primary percutaneous coronary intervention and mild induced hypothermia in comatose survivors of ventricular fibrillation with ST-elevation acute myocardial infarction[J]. Resuscitation, 2007, 74(2): 227-234. DOI:10.1016//j.resuscitation.2007.01.016 |
| [30] | Richling N, Herkner H, Holzer M, et al. Thrombolytic therapy vs primary percutaneous intervention after ventricular fibrillation cardiac arrest due to acute ST-segment elevation myocardial infarction and its effect on outcome[J]. Am J Emerg Med, 2007, 25(5): 545-550. DOI:10.1016//j.ajem.2006.10.014 |
| [31] | Deakin CD, Nolan JP, Sunde K, et al. European Resuscitation Council Guidelines for Resuscitation 2010 Section 3. Electrical therapies: Automated external defibrillators, defibrillation, cardioversion and pacing[J]. Resuscitation, 2010, 81(10): 1293-1304. DOI:10.1016//j.resuscitation.2010.08.008 |
| [32] | Gaieski DF, Band RA, Abella BS, et al. Early goal-directed hemodynamic optimization combined with therapeutic hypothermia in comatose survivors of out-of-hospital cardiac arrest[J]. Resuscitation, 2009, 80(4): 418-424. DOI:10.1016//j.resuscitation.2008.12.015 |
| [33] | Levijoki J, Pollesello P, Kaivola J, et al. Further evidence for the cardiac troponin C mediated calcium sensitization by levosimendan: structure-response and binding analysis with analogs of levosimendan[J]. J Mol Cell Cardiol, 2000, 32(3): 479-491. DOI:10.1006//jmcc.1999.1093 |
| [34] | Massetti M, Tasle M, Le Page O, et al. Back from irreversibility: extracorporeal life support for prolonged cardiac arrest[J]. Ann Thorac Surg, 2005, 79(1): 178-183. DOI:10.1016//j.athoracsur.2004.06.095 |
| [35] | Hovdenes J, Laake JH, Aaberge L, et al. Therapeutic hypothermia after out-of-hospital cardiac arrest: experiences with patients treated with percutaneous coronary intervention and cardiogenic shock[J]. Acta Anaesthesiol Scand, 2007, 51(2): 137-142. DOI:10.1111//j.1399-6576.2006.01209.x |
| [36] | Nichol G, Karmy-Jones R, Salerno C, et al. Systematic review of percutaneous cardiopulmonary bypass for cardiac arrest or cardiogenic shock states[J]. Resuscitation, 2006, 70(3): 381-394. DOI:10.1016//j.resuscitation.2006.01.018 |
| [37] | 中国医师协会体外生命支持专业委员会. 成人体外膜氧合循环辅助专家共识[J]. 中华医学杂志, 2018, 98(12): 886-894. DOI:10.3760//cma.j.issn.0376-2491.2018.12.003 |
| [38] | Tarvasmaki T, Lassus J, Varpula M, et al. Current real-life use of vasopressors and inotropes in cardiogenic shock - adrenaline use is associated with excess organ injury and mortality[J]. Crit Care, 2016, 20(1): 208. DOI:10.1186//s13054-016-1387-1 |
| [39] | Polderman KH, Herold I. Therapeutic hypothermia and controlled normothermia in the intensive care unit: Practical considerations, side effects, and cooling methods[J]. Crit Care Med, 2009, 37(3): 1101-1120. DOI:10.1097//ccm.0b013e3181962ad5 |
| [40] | Nielsen N, Hovdenes J, Nilsson F, et al. Outcome, timing and adverse events in therapeutic hypothermia after out-of-hospital cardiac arrest[J]. Acta Anaesthesiol Scand, 2009, 53(7): 926-934. DOI:10.1111//j.1399-6576.2009.02021.x |
| [41] | Thomsen JH, Hassager C, Bro-Jeppesen J, et al. Sinus bradycardia during hypothermia in comatose survivors of out-of-hospital cardiac arrest – A new early marker of favorable outcome?[J]. Resuscitation, 2015, 89: 36-42. DOI:10.1016//j.resuscitation.2014.12.031 |
| [42] | Stær-Jensen H, Sunde K, Olasveengen TM, et al. Bradycardia during therapeutic hypothermia is associated with good neurologic outcome in comatose survivors of out-of-hospital cardiac arrest[J]. Crit Care Med, 2014, 42(11): 2401-2408. DOI:10.1097//ccm.0000000000000515 |
| [43] | Post H, Schmitto JD, Steendijk P, et al. Cardiac function during mild hypothermia in pigs: increased inotropy at the expense of diastolic dysfunction[J]. Acta Physiol, 2010, 199(1): 43-52. DOI:10.1111//j.1748-1716.2010.02083.x |
| [44] | BW Roberts, JH Kilgannon, ME Chansky, et al. Therapeutic hypothermia and vasopressor dependency after cardiac arrest[J]. Ann Emerg Med, 2011, 58(4): S283-284. DOI:10.1016//j.annemergmed.2011.06.346 |
| [45] | Donadello K, Favory R, Salgado-Ribeiro D, et al. Sublingual and muscular microcirculatory alterations after cardiac arrest: A pilot study[J]. Resuscitation, 2011, 82(6): 690-695. DOI:10.1016//j.resuscitation.2011.02.018 |
| [46] | He XR, Su FH, Taccone FS, et al. Cardiovascular and microvascular responses to mild hypothermia in an ovine model[J]. Resuscitation, 2012, 83(6): 760-766. DOI:10.1016//j.resuscitation.2011.11.031 |
| [47] | Wu JY, Yuan W, Li JB, et al. Effects of mild hypothermia on cerebral large and small microvessels blood flow in a porcine model of cardiac arrest[J]. Neurocrit Care, 2017, 27(2): 297-303. DOI:10.1007//s12028-017-0395-6 |
| [48] | Gong P, Zhao S, Wang JG, et al. Mild hypothermia preserves cerebral cortex microcirculation after resuscitation in a rat model of cardiac arrest[J]. Resuscitation, 2015, 97: 109-114. DOI:10.1016//j.resuscitation.2015.10.003 |
| [49] | Hu CL, Wen J, Liao XX, et al. Effects of therapeutic hypothermia on coagulopathy and microcirculation after cardiopulmonary resuscitation in rabbits[J]. Am J Emerg Med, 2011, 29(9): 1103-1110. DOI:10.1016//j.ajem.2010.07.016 |
 2019, Vol. 28
2019, Vol. 28




