脓毒症(sepsis)以病死率高、致病病原体确定困难以及抗感染治疗的不确定性为特征[1]。既往研究认为:脓毒症患者最常见的死因是经受全身性炎症反应综合征(systemic inflammatory response syndrome, SIRS)后导致患者出现的多器官功能障碍综合征(multiple organ dysfunction syndrome, MODS)。然而,近年来越来越多的研究报道,随着炎症风暴的消退,患者出现继发的代偿性抗炎症反应综合征(compensatory anti-inflammatory response syndrome, CARS),并且引起了以免疫麻痹为主要原因的继发(二重)感染等一系列严重后果[19]。继发性感染的病原体包括多重耐药细菌、真菌和病毒。人疱疹病毒(human herpes virus,HHV)也是继发感染的常见病原体之一[2]。
人疱疹病毒是一类有包膜的双链DNA病毒,目前已发现以HSV-1为代表的α疱疹病毒、以巨细胞病毒(human cytomegalovirus,CMV,HHV-5)为代表的β疱疹病毒以及EB病毒(Epstein-Barr virus,EBV,HHV-4)为代表的γ疱疹病毒共3个亚科8个种类。当人体免疫功能下降时,潜伏的HHV可以被释放入血导致显性感染[3]。Walton等[4]利用聚合酶链式反应(PCR)发现,ICU危重患者尤其是脓毒症患者,可以合并感染多种病毒,包括常见的HSV-1, HHV-4和HHV-5等。但脓毒症患者检出HHV病原体DNA对患者病情程度和预后的影响以及其可能存在的机制尚不完全明确。随着第二代高通量基因测序技术的发展,病原与基因检测的效率与临床获益逐渐上升[5]。本研究基于微生物组测序技术,探讨脓毒症患者二代测序检出人疱疹病毒DNA对患者病情程度和预后的影响以及人体免疫功能状态对检出结果的影响。
1 资料与方法 1.1 一般资料收集2017年7月至2019年1月入住复旦大学附属中山医院急诊科150例脓毒症患者的血标本和临床资料,同时收集所有入组患者病原体二代测序当天的急性生理和慢性健康评分Ⅱ(APACHE Ⅱ)和序贯器官衰竭评分(SOFA);血标本送中山医院检验科进行血常规、淋巴细胞计数、细胞因子和淋巴细胞免疫分类等检查。脓毒症诊断标准按照2016年国际脓毒症专家共识提出的Sepsis 3.0标准[1]。根据血微生物组学二代测序结果将所有患者分为HHV检出组(检出人疱疹病毒检出序列数≥1)和未检出组。本研究的排除标准为:①人免疫缺陷病毒I型(HIV-1)感染患者;②孕妇、精神病患者;③未满18周岁的患者;④患有自身免疫性疾病、长期服用免疫抑制剂、肿瘤放化疗等免疫抑制宿主。此研究已获得复旦大学附属中山医院伦理委员会批准(NO: 2006-23)。
1.2 病原微生物组二代基因测序本实验采用基于国产BGISEQ-50平台进行检测测序。取血样本后,提取核酸,建库及测序,最后利用微生物组学数据库进行数据分析[6]。
1.3 细胞因子和淋巴细胞分类的检测方法细胞因子的测定:采用IMMULITE/IMMULIE 1000分析仪,采用固相、夹心以及化学发光法对血清中细胞因子(TNF-α、IL-2R、IL-6、IL-8、IL-10)进行检测。化学发光法试剂盒来自德国SIEMENS公司。按照厂家说明书的操作流程将处理后的标本送入分析仪进行检测,并记录相应的细胞因子浓度。
淋巴细胞分类以及计数检测:采用美国Thermo Fisher全自动流式细胞仪对淋巴细胞进行分类,分为白细胞总数、中性粒细胞数、淋巴细胞总数、CD3+T细胞计数、CD4+T细胞计数、CD8+T细胞计数、CD19+B细胞以及CD56+NK/T细胞计数。
1.4 统计学方法采用SPSS 23.0和Graphpad prism 7统计软件进行数据处理和分析。正态分布的数据以均数±标准差(Mean±SD)表示,并进行方差分析;非呈正态分布的数据则以四分位数或中位数进行表示,并进行秩和检验。Logistic回归分析探讨与疱疹病毒DNA检测阳性相关的危险因素。以P<0.05为差异有统计学意义。
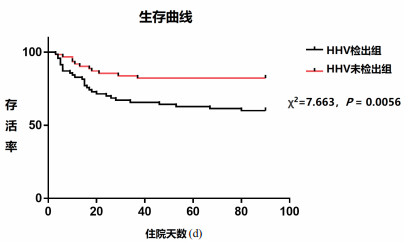
2 结果 2.1 入组患者的一般资料研究共入组150例脓毒症患者,男性104人,女性46人,平均年龄59.3岁,APACHE Ⅱ和SOFA评分的中位数分别为8分和3分。77例患者(51.3%)检出HHV DNA,检出HHV的中位序列数为17(1-23642)。检出组和未检出组的年龄和14 d病死率差异无统计学意义,但性别、28 d病死率、90 d病死率以及APACHE Ⅱ和SOFA评分差异有统计学意义,HHV检出组患者APACHE Ⅱ和SOFA评分明显高于未检出组,28 d和90 d病死率也明显高于未检出组。采用log-rank法对检出组和未检出组进行生存曲线分析,结果提示差异有统计学意义。具体见表 1和图 1。
| 指标 | HHV检出组 | HHV未检出组 | P值 |
| 性别(男) | 60 | 44 | 0.019 |
| 性别(女) | 17 | 29 | |
| 年龄(岁) | 60.70 ± 14.37 | 57.24 ± 14.4 | 0.252 |
| 14 d病死率 | 18.2% | 11.3% | 0.237 |
| 28 d病死率 | 32.1% | 15.7% | 0.021 |
| 90 d病死率 | 37.1% | 20.5% | 0.032 |
| APACHE Ⅱ评分 | 10.85 (2-34) | 6.32 (1-24) | 0.006 |
| SOFA评分 | 4.62 (2-11) | 3.10 (2-10) | 0.003 |
|
| 图 1 HHV检出组和未检出组脓毒症患者的生存曲线 Fig 1 The survival curve of HHV-detected and HHV-undetected groups |
|
|
为明确脓毒症患者HHV DNA检出率是否与患者病情严重程度有关,按照SOFA评分值将患者分为3组,分别为2~4分组、5~8分组和9分及以上组。采用交叉表进行χ2分析,并使用Fisher精确检验对结果进行校正。结果显示HHV DNA检出率与脓毒症患者病情严重程度呈正相关,SOFA评分越高,DNA检出率越高。见表 2。
| 是否检出 | SOFA评分 | |||
| 2~4分 | 5~8分 | ≥9分 | p值 | |
| 检出 | 46(45.1%) | 16(48.5%) | 15 (100%) | P<0.01 |
| 未检出 | 56 | 17 | 0 | |
为确定人疱疹病毒检出序列数的量对脓毒症合并人疱疹病毒DNA血症预后的影响,采用单因素分析检验。检验中,自变量(检出序列数)分为0、1~9、10~99、100~999以及≥1 000共五组,因变量为该组的90 d病死率。单因素ANOVA检验提示方差不齐,改用Tamhane法进行组间两两检验,其中,检出序列数为0、1-9、10-99三组检验差异无统计学意义,但检出序列数≥100(即100-999、≥1 000两组)与检出序列数为0、1-9以及10-99差异有统计学意义。见表 3和表 4。
| 序列 | 病例数 | 病死率 | 标准差 | 标准误 | 95%置信区间 | |
| 下限 | 上限 | |||||
| 0 | 73 | 0.1644 | 0.37319 | 0.04368 | 0.0773 | 0.2515 |
| 1~9 | 32 | 0.3750 | 0.49187 | 0.08695 | 0.1977 | 0.5523 |
| 10~99 | 22 | 0.3182 | 0.47673 | 0.10164 | 0.1068 | 0.5296 |
| 100~999 | 10 | 0.5000 | 0.52705 | 0.16667 | 0.1230 | 0.8770 |
| 1000- | 13 | 0.8462 | 0.37553 | 0.10415 | 0.6192 | 1.0731 |
| 总计 | 150 | 0.3133 | 0.46540 | 0.03800 | 0.2382 | 0.3884 |
| 检出序列数 | 平均值差值 | 标准误 | P值 |
| 0 | |||
| 1~9 | -0.21062 | 0.09731 | 0.303 |
| 10~99 | -0.15380 | 0.11063 | 0.854 |
| 100~999 | -0.33562 | 0.17230 | 0.042 |
| 1000- | -0.68177 | 0.11294 | <0.001 |
| 1-9 | |||
| 0 | 0.21062 | 0.09731 | 0.303 |
| 10~99 | 0.05682 | 0.13376 | 1.000 |
| 100~999 | -0.12500 | 0.18798 | 0.009 |
| 1000- | -0.47115 | 0.13568 | 0.016 |
| 10-99 | |||
| 0 | 0.15380 | 0.11063 | 0.854 |
| 1~9 | -0.05682 | 0.13376 | 1.000 |
| 100~999 | -0.48182 | 0.19521 | 0.009 |
| 1000- | -0.52797 | 0.14553 | 0.010 |
| 100-999 | |||
| 0 | 0.33562 | 0.17230 | 0.042 |
| 1~9 | 0.12500 | 0.18798 | 0.009 |
| 10~99 | 0.48182 | 0.19521 | 0.009 |
| 1000- | -0.34615 | 0.19653 | 0.043 |
| 1000- | |||
| 0 | 0.68177 | 0.11294 | <0.001 |
| 1~9 | 0.47115 | 0.13568 | 0.016 |
| 10~99 | 0.52797 | 0.14553 | 0.010 |
| 100~999 | 0.34615 | 0.19653 | 0.043 |
为探讨脓毒症患者免疫功能状态与人疱疹病毒DNA检出阳性的相关性,本研究对脓毒症患者外周血细胞因子(TNF-α、IL-2R、IL-6、IL-8和IL-10)进行检测和分析。研究结果提示:HHV检出组的患者外周血TNF-α、IL-2R、IL-6、IL-8和IL-10的浓度明显高于未检出组,差异有统计学意义,见表 5。
| 细胞因子pg/mL | HHV未检出组 | HHV检出组 | P值 |
| TNF-α | 11.85 ± 3.76 | 18.93 ± 4.62 | <0.01 |
| IL-2R | 747.53 ± 193.42 | 1405 ± 200.08 | <0.01 |
| IL-6 | 29.6 ± 16.82 | 38.26 ± 14.54 | 0.009 |
| IL-8 | 42.06 ± 17.72 | 54.23 ± 15.50 | 0.003 |
| IL-10 | 11.62 ± 3.97 | 13.15 ± 4.11 | 0.021 |
另外,本研究收集病原微生物送检当日的血常规、细胞免疫检查以确定HHV检出组与未检出组白细胞、淋巴细胞和中性粒细胞总数的差异,结果见表 5。HHV检出组与未检出组白细胞总数与中性粒细胞计数差异无统计学意义,且淋巴细胞分类中CD4/CD8的比值差异也无统计学意义,但是检出组和未检出组之间淋巴细胞总数、CD19+B淋巴细胞、CD4+T细胞及CD8+T细胞、CD56+淋巴细胞(NK/T细胞)计数差异有统计学意义,表现为检出组淋巴细胞总数以及CD19+ B淋巴细胞、CD4+ T细胞及CD8+ T细胞、CD56+淋巴细胞平均数显著低于未检出组,见表 6。
| 细胞种类(cells/μl) | HHV未检出组 | HHV检出组 | P值 |
| CD19+B淋巴细胞 | 159.34 ± 36.31 | 26.05 ± 5.45 | <0.001 |
| 总T细胞 | 413.16 ± 120.49 | 190.32 ± 90.28 | <0.001 |
| CD4+T细胞 | 120.46 ± 32.81 | 89.07 ± 10.19 | <0.001 |
| CD8+T细胞 | 180.86 ± 43.33 | 140.26 ± 10.54 | <0.001 |
| CD4/CD8 | 0.6 ± 0.12 | 0.57 ± 0.20 | 0.305 |
| CD56+ NK/T细胞 | 121.24 ± 33.27 | 81.15 ± 26.73 | <0.001 |
| 总淋巴细胞计数 | 412.70 ± 140.30 | 355.92 ± 100.43 | 0.002 |
| 中性粒细胞计数 | 13055 ± 3053 | 12230 ± 3342 | 0.117 |
| 总白细胞计数 | 14425 ± 2992 | 13162 ± 2028 | 0.273 |
为进一步探讨脓毒症患者外周血HHV DNA检测阳性的相关危险因素,本研究利用Logistic多因素回归分析对收集到的患者信息与该患者是否检出HHV进行分析。去除混杂因素后结果显示,对检出HHV有意义的变量分别为:性别(男)、年龄、APACHE Ⅱ评分、SOFA评分、IL-2R、IL-10、CD19+ B淋巴细胞、T细胞计数、CD4+ T细胞计数以及淋巴细胞计数。其中IL-10、CD19+ B淋巴细胞、T细胞计数、CD4+ T细胞计数以及淋巴细胞总数对HHV的检出起到抑制作用,性别(男)、年龄、APACHE Ⅱ评分、SOFA评分、IL-2R对HHV的检出起到促进作用。具体数值见表 7。
| 因素 | b | SE(b) | Wald χ2 | P值 | OR | 95% CI |
| 性别(男) | 1.305 | 0.591 | 8.284 | 0.004 | 3.688 | 1.158~11.744 |
| 年龄(岁) | 0.865 | 0.382 | 7.271 | 0.007 | 2.375 | 1.123~5.021 |
| APACHE Ⅱ | 1.274 | 0.227 | 11.326 | <0.001 | 3.575 | 2.291~5.579 |
| SOFA | 0.818 | 0.363 | 6.036 | 0.014 | 2.266 | 1.112~4.616 |
| TNF-α | 0.203 | 1.582 | 3.470 | 0.625 | 1.225 | 0.055~27.214 |
| IL-2R | 2.445 | 0.712 | 5.501 | 0.019 | 11.535 | 2.856~46.550 |
| IL-6 | 0.462 | 1.423 | 0.794 | 0.373 | 1.587 | 0.098~25.818 |
| IL-8 | 1.807 | 1.265 | 1.247 | 0.264 | 6.092 | 0.510~72.704 |
| IL-10 | -0.787 | 0.276 | 6.464 | 0.011 | 0.455 | 0.265~0.782 |
| CD19+B cell | -1.362 | 0.333 | 9.549 | 0.002 | 0.256 | 0.133~0.492 |
| T cell | -0.846 | 0.391 | 11.756 | <0.001 | 0.429 | 0.199~0.923 |
| CD4+T cell | -0.904 | 0.457 | 12.192 | <0.001 | 0.448 | 0.165~0.992 |
| CD8+T cell | -0.681 | 0.483 | 0.664 | 0.415 | 0.506 | 0.196~1.304 |
| CD4/CD8 | 1.121 | 0.909 | 0.096 | 0.756 | 3.068 | 0.517~18.222 |
| CD56+ cell | -0.452 | 1.071 | 2.512 | 0.113 | 0.636 | 0.078~5.192 |
| 淋巴细胞总数 | -0.764 | 0.572 | 14.045 | <0.001 | 0.466 | 0.152~1.429 |
| 中性粒细胞数 | 0.224 | 0.469 | 0.583 | 0.445 | 1.251 | 0.499~3.137 |
| 白细胞总数 | 0.012 | 0.333 | 0.181 | 0.671 | 1.012 | 0.527~1.944 |
本研究首次利用微生物组学二代基因测序技术对脓毒症患者外周血HHV DNA进行了检测以及相关危险因素分析探讨。研究发现:在脓毒症患者血标本中HHV的检出率达到了51.3%,且脓毒症合并HHV DNA血症对患者是一个不良的预后因素,HHV检出序列数大于100/样本具有显著的统计学意义,能够预测患者的预后。同时,检出序列数的值与脓毒症患者的病死率呈正相关。进一步研究发现脓毒症患者HHV检出组和未检出组的淋巴细胞总数、CD19+B淋巴细胞、T细胞计数、CD4+T细胞计数和细胞因子IL-2R和IL-10存在着显著的差异性,研究结果表明HHV的检出与脓毒症患者的免疫状态有一定的相关性。
HHV通常在人体中是潜伏性的感染或者定植在神经节细胞或者淋巴细胞等细胞内。脓毒症患者SIRS消退后通常过渡至严重的免疫抑制[7-9],这种易感状态正是HHV入血和(或)并发HHV感染的重要前提。有研究[2, 9]发现,很多情况下HHV在体内是定植或者潜伏,脓毒症患者免疫功能发生了很大的变化,导致了HHV复燃。有文献[10-11]报道,有患者在经历肺炎引起的脓毒症后出现了HSV-1导致的病毒性脑炎。可以看出,当免疫功能受损/免疫麻痹时,潜伏在唾液腺、神经节、白细胞等组织或细胞内的病毒会再激活并释放入血[4],造成显性感染[11-13],这或许可以解释脓毒症患者血液中能够检出人疱疹病毒的原因。
有研究发现,重症监护室危重病患者检出HHV-1的患者约有10%左右出现了HHV-1的继发感染[2, 10-11],即大多数患者无特异性症状和临床表现。而以CMV为代表的β疱疹病毒血症则有较大可能由潜伏感染转为显性感染,可导致以间质性肺炎为主的疾病[14]。至于EB病毒,其致病机制为感染淋巴细胞并主要造成淋巴瘤等恶性肿瘤,其造成脓毒症患者带有显著临床症状的急性感染的概率较低[15]。而针对HHV的抗病毒治疗,目前缺乏循证医学的依据[16]。本试验发现HHV感染患者检出序列数>100与脓毒症患者的病死率显著相关,但是检出序列数>100是否为抗病毒的指征有待进一步商榷。
值得注意的是,本次研究发现促炎因子(TNF-α、IL-2、IL-6)和抗炎因子(IL-10)在脓毒症患者HHV检出组均较未检出组增高。提示患者可能同时处于SIRS和CARS两种状态,即混合性拮抗反应综合征(Mixed Antagonistic Response Syndrome, MARS)。当SIRS和CARS同时并存,参与的炎症细胞和炎症因子产生对抗,则产生一系列的恶性循环,并对机体造成更严重的损伤,导致炎症反应和免疫功能障碍更加明显[17-18]。但CARS和MARS的具体判断标准除了临床医务工作者的经验外,仍待进一步摸索。
本实验是一项回顾性的临床研究,而非前瞻性实验,同样具有很多局限之处。比如只在同一时间收集了一次患者的标本,未能对患者的免疫功能状态和相关指标进行动态分析。本实验利用二代测序技术,测定的是病原体DNA,即收集标本后将细胞裂解后进行测序。本实验真正测得的是病原的DNA,而不是分离到病原本身,病原的DNA不代表有致病作用,没有把DNA检测阳性与抗体/抗原的测定进行对比。样本中包含死亡的病原体释放的DNA,同样包含因采集样本操作不当导致的背景菌污染。因此,本实验能否证明第二代基因测序技术是否能够成为检测病原的金标准有待进一步讨论,并且判断是否为潜伏感染或显性感染仍然需要临床工作者的经验。但是鉴于第二代基因测序技术拥有较高的敏感度,其仍然可以作为检验病原的常用技术之一。
| [1] | Singer M, Deutschman CS, Seymour CW, et al. The third international consensus definitions for sepsis and septic shock (Sepsis-3)[J]. JAMA, 2016, 315(8): 801-810. DOI:10.1001/jama.2016.0287 |
| [2] | 许天琪, 张佳, 薛晓艳. ICU脓毒症患者潜伏性病毒携带状况分析[J]. 解放军医学院学报, 2018, 39(6): 515-519. DOI:10.3969/j.issn.2095-5227.2018.06.015 |
| [3] | 徐慧玲, 陈军刚, 何灿辉, 等. 人疱疹病毒感染及抗疱疹病毒感染药物研究进展[J]. 中国感染与化疗杂志, 2017, 17(6): 719-724. DOI:10.16718/j.1009-7708.2017.06.021 |
| [4] | Walton AH, Muenzer JT, Rasche D, et al. Reactivation of multiple viruses in patients with sepsis[J]. PLoS One, 2014, 9(6): e98819. DOI:10.1371/journal.pone.0098819 |
| [5] | 宏基因组分析和诊断技术在急危重症感染应用专家共识组. 宏基因组分析和诊断技术在急危重症感染应用的专家共识[J]. 中华急诊医学杂志, 2019, 28(2): 151-155. DOI:10.3760/cma.j.issn.1671-0282.2019.02.005 |
| [6] | Li H, Durbin R. Fast and accurate long-read alignment with Burrows–Wheeler transform[J]. Bioinformatics, 2010, 26(5): 589-595. DOI:10.1093/bioinformatics/btp698 |
| [7] | Boomer JS, To K, Chang KC, et al. Immunosuppression in patients who Die of sepsis and multiple organ failure[J]. JAMA, 2011, 306(23): 2594-2605. DOI:10.1001/jama.2011.1829 |
| [8] | 宋振举, 郦珊珊, 童朝阳, 等. 脓毒症患者血清促炎和抗炎细胞因子的变化[J]. 中华急诊医学杂志, 2008, 17(11): 1191-1194. DOI:10.3760/j.issn:1671-0282.2008.11.016 |
| [9] | 董智旻, 童朝阳, 姚晨玲, 等. 脓毒症患者细胞因子动态变化和免疫状态分型[J]. 中华急诊医学杂志, 2017, 26(2): 149-154. DOI:10.3760/cma.j.issn.1671-0282.2017.02.006 |
| [10] | Hao A, Hara M, Matsuda S, et al. A 64-year-old male with recurrence of herpes simplex encephalitis after suffering from severe pneumonia and sepsis[J]. Rinsho Shinkeigaku, 2018, 58(12): 771-774. DOI:10.5692/clinicalneurol.cn-001226 |
| [11] | Astuto M, Palermo CI, Costanzo CM, et al. Fatal pulmonary disease and encephalic complication in a man with HSV-1 Infection: A case report[J]. J Clin Virol, 2014, 59(1): 59-62. DOI:10.1016/j.jcv.2013.11.006 |
| [12] | Simoons-Smit AM, Kraan EM, Beishuizen A, et al. Herpes simplex virus type 1 and respiratory disease in critically-ill patients: real pathogen or innocent bystander?[J]. Clin Microbiol Infect, 2006, 12(11): 1050-1059. DOI:10.1111/j.1469-0691.2006.01475.x |
| [13] | Luyt CE, Combes A, Deback C, et al. Herpes simplex virus lung infection in patients undergoing prolonged mechanical ventilation[J]. Am J Respir Crit Care Med, 2007, 175(9): 935-942. DOI:10.1164/rccm.200609-1322oc |
| [14] | Griffiths P, Baraniak I, Reeves M. The pathogenesis of human cytomegalovirus[J]. J Pathol, 2015, 235(2): 288-297. DOI:10.1002/path.4437 |
| [15] | 赵林清, 钱渊. EB病毒感染及其相关疾病[J]. 中华儿科杂志, 2003, 41(10): 797-799. DOI:10.3760/j.issn:0578-1310.2003.10.031 |
| [16] | Behnes M, Bertsch T, Lepiorz D, et al. Diagnostic and prognostic utility of soluble CD 14 subtype (presepsin) for severe sepsis and septic shock during the first week of intensive care treatment[J]. Crit Care, 2014, 18(5): 507. DOI:10.1186/s13054-014-0507-z |
| [17] | Hotchkiss RS, Monneret G, Payen D. Sepsis-induced immunosuppression: from cellular dysfunctions to immunotherapy[J]. Nat Rev Immunol, 2013, 13(12): 862-874. DOI:10.1038/nri3552 |
| [18] | Kox WJ, Volk T, Kox SN, et al. Immunomodulatory therapies in sepsis[J]. Intensive Care Med, 2000, 26: S124-S128. DOI:10.1007/s001340051129 |
| [19] | Novotny AR, Reim D, Assfalg V, et al. Mixed antagonist response and sepsis severity-dependent dysbalance of pro- and anti-inflammatory responses at the onset of postoperative sepsis[J]. Immunobiology, 2012, 217(6): 616-621. DOI:10.1016/j.imbio.2011.10.019 |
 2019, Vol. 28
2019, Vol. 28




