2 南京大学医学院附属鼓楼医院 药学部
重症感染是导致重症患者死亡的首要原因,病死率达30%~50%[1-2]。万古霉素是治疗重症革兰阳性菌感染的一线选择,主要用于治疗危及生命的重症感染。万古霉素兼具浓度依赖性和时间依赖性抗菌药物双重特点,万古霉素血药浓度与细菌清除显著相关[3-4],目前指南推荐重症感染万古霉素目标浓度为15~20 mg/L[5]。2014年DALI研究大规模调查重症患者抗菌药物应用现状,结果显示,重症监护病房(ICU)万古霉素抗感染治疗达标率仅57%[6],肾脏高溶质清除是导致抗菌药物治疗不达标的危险因素[7],影响临床疗效。因此,本研究旨在探讨重症感染患者肾脏高溶质对万古霉素血清谷浓度和治疗达标率的影响。
1 资料与方法 1.1 一般资料病例入选标准:采用回顾性观察性研究方法,选择2013年2月至2017年1月ICU收治的经验性或目标性采用万古霉素静脉滴注治疗的重症感染患者。排除标准:入ICU前已开始万古霉素治疗;入院前30 d内及研究期间行肾脏替代治疗的患者;已知慢性肾脏病5期患者;年龄小于18周岁;ICU期间万古霉素治疗时间小于72 h患者;数据资料不完整。本研究所遵循的程序符合医学伦理学标准并得到医院伦理委员会的批准同意。
1.2 研究方法 1.2.1 分组根据万古霉素治疗前患者12 h-CLCR,将入选患者分为两组,高溶质清除组(ARC组)和非高溶质清除组(NARC组),ARC定义为12 h-CLCR > 130 mL/(min·1.73 m2)。
1.2.2 万古霉素血药浓度监测于万古霉素用药4或5个治疗剂量后,下一次用药前即刻抽血测血药浓度,即初始血清谷浓度(Cmin)。抽取外周静脉血1 mL,置于促凝管中,分离血清,采用荧光偏振免疫分析(TDx,美国Abbott公司)检测血药浓度。万古霉素治疗目标浓度为15~20 mg/L。
1.2.3 万古霉素使用方法选择万古霉素注射液间断静脉滴,负荷剂量为1 000 mg静脉滴注持续1 h,维持剂量由临床医生根据患者体质量和肾功能选择500~1000 mg静脉滴注,每6~12 h给药一次。若首次血药浓度未达标,则调整用药剂量,4或5个治疗剂量后再测血药浓度,直至达标为止。治疗过程中若连续6 h尿量减少或肾功能恶化则减量或停药。
1.2.4 肌酐清除率测定测定前患者素食、避免剧烈运动,经导尿管留取患者12 h尿液(当晚19:00时至第二日07:00)测定尿肌酐浓度,记录12 h尿量,同时抽血测血浆肌酐浓度。12 h-CLCR[mL/(min·1.73 m2)]=12 h尿肌酐浓度(μmol/L)×每分钟尿量(mL/min)/血浆肌酐浓度(μmol/L)×体表面积(m2)
1.3 统计学方法所有数据采用SPSS 20.0统计软件进行统计学处理,计量资料以均数±标准差(Mean±SD)表示,组间比较采用成组t检验;计数资料以频数/百分比描述,组间比较采用χ2检验;相关性分析采用散点图及Spearman′s相关系数。以P < 0.05为差异有统计学意义。
2 结果85例患者符合要求纳入研究(图 1),其中男性62例,女性23例;年龄(58.16±19.68)岁。ARC组(n=31,占36.47%),NARC组(n=54,占63.52%),两组患者在年龄、性别、体质量、APACHE Ⅱ评分及感染部位来源等差异均无统计学意义(P均 > 0.05), 见表 1。ARC组患者初始Cmin(9.30±6.06)mg/L明显低于NARC组(13.55±5.99)mg/L,差异具有统计学意义(P<0.05),见表 2。ARC组患者初始万古霉素血药浓度达标率(32.25%)低于NARC组(64.81%)。ARC组患者首次达标时间(8.20±6.11)d与NARC组(5.41±2.34)d比较明显延长,差异具有统计学意义(P<0.05)。
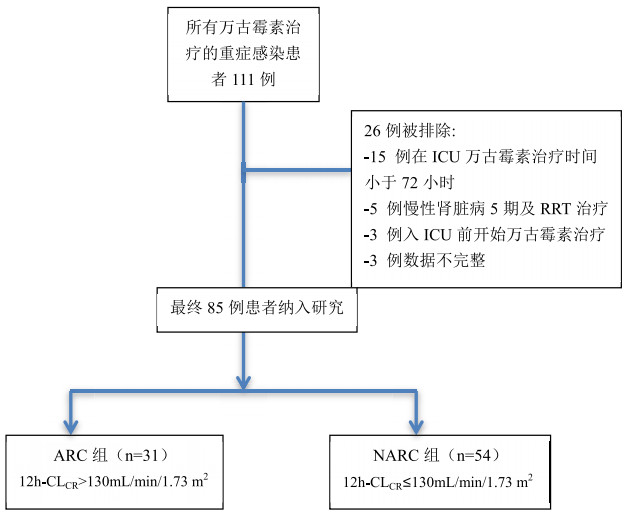
|
| 图 1 患者入选流程图 |
|
|
| 组别 | 例数(例) | 年龄(岁) | 体质量(kg) | APACHE Ⅱ评分 | 感染部位(例) | 基础疾病(例) | 休克(例) | |||||
| 呼吸 | 血/导管 | 腹腔 | 其他 | 高血压 | 糖尿病 | |||||||
| ARC组 | 31 | 53.61±20.32 | 66.42±9.08 | 14.58±7.31 | 7 | 10 | 1 | 13 | 5 | 2 | 3 | |
| NARC组 | 54 | 60.78±19.00 | 63.78±8.57 | 17.70±7.53 | 18 | 24 | 2 | 10 | 19 | 10 | 12 | |
| χ2/t值 | -1.632 | 1.338 | -1.860 | 1.097 | 1.219 | 0.000 | 4.989 | 3.529 | 1.475 | 2.133 | ||
| P值 | 0.107 | 0.185 | 0.066 | 0.295 | 0.270 | 1.000 | 0.026 | 0.060 | 0.225 | 0.144 | ||
| 组别 | 例数(例) | 初始万古霉素Cmin(mg/L) | 治疗达标例数(%) | 达标时间(d) |
| ARC组 | 31 | 9.30±6.06 | 10(32.25) | 8.20±6.11 |
| NARC组 | 54 | 13.55±5.99 | 35(64.81) | 5.41±2.34 |
| t值 | -2.577 | 8.379 | 2.21 | |
| P值 | 0.002 | 0.004 | 0.032 |
根据肌酐清除率不同进行分层,分为12 h-CLCR < 40, 40~70, 70~100, 100~130和≥130 mL/(min·1.73 m2)五组,五组患者万古霉素初始血药浓度均不相同,随12 h-CLCR升高,初始万古霉素浓度有降低趋势,并且12 h-CLCR 100~130和≥130 mL/(min·1.73 m2)组与 < 40 mL/(min·1.73 m2)组比较,血药浓度显著降低,差异具有统计学意义(P<0.05),见图 2。
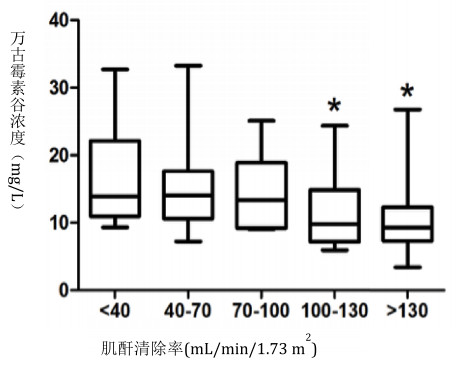
|
| 与12 h-CLCR < 40 mL/min/1.73 m2组比较, P < 0.05 图 2 不同肌酐清除率分层的万古霉素血药浓度比较; |
|
|
根据初始万古霉素血药浓度分为Cmin < 15 mg/L,15~20 mg/L和>20 mg/L三组,Cmin < 15 mg/L组ARC患者的比例(41.27%)较Cmin 15~20 mg/L组(10.10%)和Cmin>20 mg/L组(9.43%)显著增加,差异具有统计学意义(P<0.05,图 3)。将万古霉素初始血药浓度与12 h-CLCR行相关因素分析,结果二者呈负相关性,相关系数为0.104(P=0.003,图 4)。
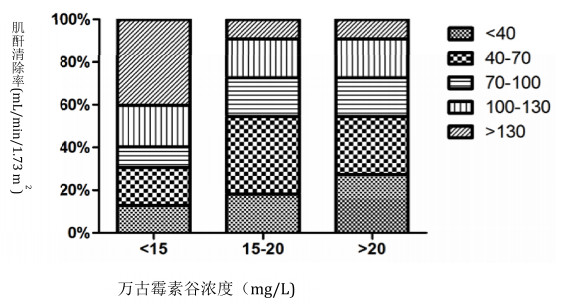
|
| 图 3 不同万古霉素血药浓度组肌酐清除率分布情况 |
|
|
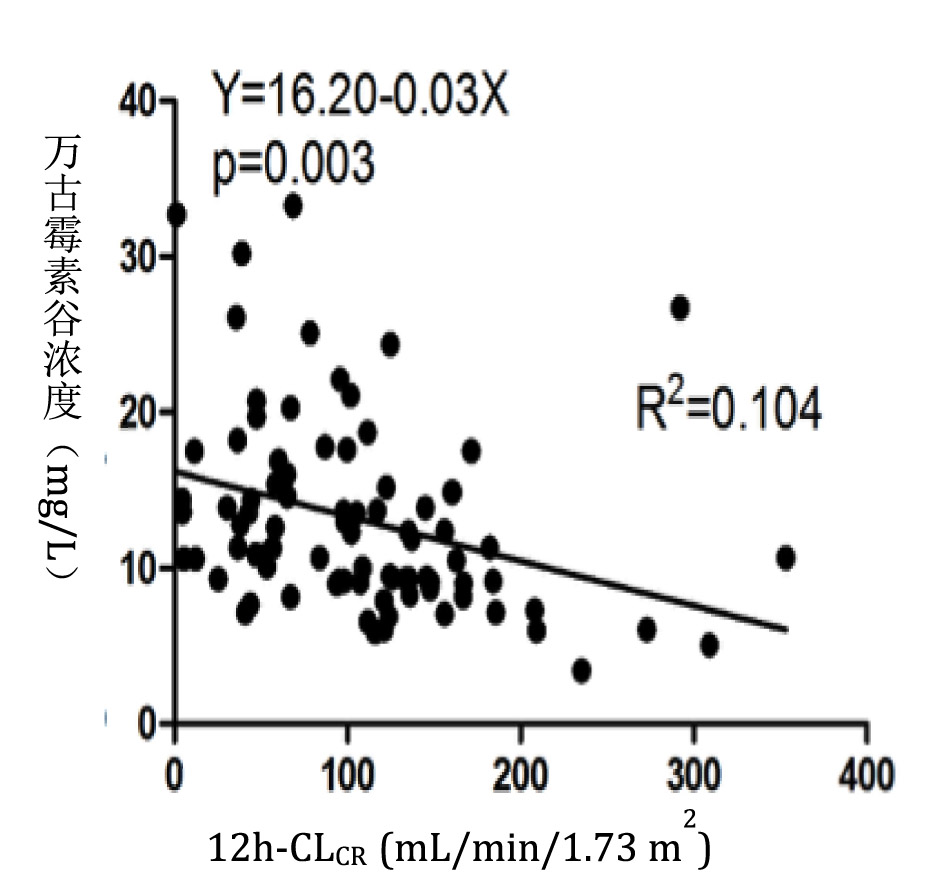
|
| 图 4 万古霉素血药浓度与肌酐清除率相关性分析 |
|
|
万古霉素是经肾脏清除的抗菌药物,肾脏高溶质清除是影响血药浓度的关键因素之一,因此本研究通过观察重症感染患者万古霉素治疗期间血药浓度及12 h-CLCR的变化,探讨肾脏高溶质清除对万古霉素血药浓度和治疗目标达成的影响。
肾脏高溶质清除在重症患者中发生的现象被日益关注[8],各研究报道ARC在ICU患者的发生率各不相同。本研究纳入重症感染患者,感染部位以血流、导管和肺部感染为主,入ICU时平均肌酐清除率为101.90 mL/(min·1.73 m2),36.47%患者诊断为ARC。一项89例重症患者的研究显示入ICU时患者ARC的发生率为17.9%,一周后ARC的发生率增加至30%[9]。De Waele等[10]则报道了1 081例成人ICU患者的调查数据显示,55.8%患者在ICU期间至少发生一次ARC。ARC发生率调查数据的差异与多种因素有关,包括患者来源的,疾病种类、CLCR测定时间和测定方法等[11-12]。
ARC是影响β内酰胺类和万古霉素等抗菌药物血药浓度不达标和治疗失败的重要因素[13-14]。ARC患者的哌拉西林清除率比健康志愿者增加至少1.5倍[15],万古霉素清除率则是非ARC患者的1.6倍[16]。Baptista等[17]观察脓毒症和脓毒性休克合并ARC患者万古霉素治疗后用药达标率第1天10.8%, 第3天也仅为51.6%,并且ARC与万古霉素治疗不达标显著相关。
国外有关万古霉素血药浓度研究数据以持续静脉输注方式为主,间断静脉滴注对血药浓度影响相关研究较少。本研究则采用间断静脉滴注的万古霉素用药方式,监测用药4至5个剂量后血药浓度,结果发现ARC患者初始万古霉素血药浓度平均为9.3 mg/L,仅32%患者治疗达标,目标达成时间为(8.20±6.11)d,比非ARC患者明显延长。患者肌酐清除率与万古霉素血药浓度呈显著负相关,12 h-CLCR越高,初始万古霉素浓度越低,尤其12 h-CLCR 100~130和≥130 mL/(min·1.73 m2)组,万古霉素需要浓度明显低于12 h-CLCR < 40 mL/(min·1.73 m2)组。首次万古霉素Cmin<15 mg/L的患者中ARC患者比例也明显高于Cmin15~20 mg/L和>20 mg/L患者。由此表明,ARC是导致重症感染患者万古霉素血药浓度不达标的重要因素,也提示ARC患者可能需要更高剂量以实现治疗目标。
本研究是单中心回顾性研究,样本量偏小,仅观察用药前肌酐清除率与万古霉素血药浓度之间的关系,可进一步分析用药期间肌酐清除率变化与血药浓度的相关性。对于具有浓度依赖性特点的抗菌药物,万古霉素用药剂量和输注方式也是影响药物浓度的关键因素,需要更多剂量相关的药代动力学研究给予探讨。
| [1] | 窦琳, 林竹, 路玲, 等. 重症监护室获得性耐甲氧西林金黄色葡萄球菌感染临床监测的多中心研究[J]. 中华急诊医学杂志, 2017, 26(3): 302-307. DOI:10.3760/cma.j.issn.1671-0282.2017.03.013 |
| [2] | Dellinger RP, Levy MM, Rhodes A, et al. Surviving sepsis campaign:international guidelines for management of severe sepsis and septic shock, 2012[J]. Intensive Care Med, 2013, 39(2): 165-228. DOI:10.1007/s00134-012-2769-8 |
| [3] | Sime FB, Udy AA, Roberts JA. Augmented renal clearance in critically ill patients:etiology, definition and implications for beta-lactam dose optimization[J]. Current Opinion in Pharmacology, 2015, 24: 1-6. DOI:10.1016/j.coph.2015.06.002 |
| [4] | 张烁, 熊辉, 汪波, 等. 万古霉素谷浓度水平与临床疗效的关系[J]. 中华急诊医学杂志, 2016, 25(6): 757-763. DOI:10.3760/cma.j.issn.1671-0282.2016.06.015 |
| [5] | Hanberger H, Walther S, Leone M, Barie PS, Rello J, Lipman J, Marshall JC, Anzueto A, Sakr Y, Pickkers P, Felleiter P, Engoren M, Vincent JL, EPIC Ⅱ, Group of Investigators. Increased mortality associated with methicillin-resistant Staphylococcus aureus (MRSA) infection in the intensive care unit:results from the EPIC Ⅱ study[J]. Int J Antimicrob Agents, 2011, 38: 331-335. DOI:10.1016/j.ijantimicag.2011.05.013 |
| [6] | Udy AA, Jarrett P, Stuart J, et al. Determining the mechanisms underlying augmented renal drug clearance in the critically ill:use of exogenous marker compounds[J]. Crit Care, 2014, 18(6): 657. DOI:10.1186/s13054-014-0657-z |
| [7] | Minkutė R, Briedis V, Steponavičiūtė R, et al. Augmented renal clearance-an evolving risk factor to consider during the treatment with vancomycin[J]. J Clin Pharm Ther, 2013, 38(6): 462-467. DOI:10.1111/jcpt.12088 |
| [8] | Loirat P, Rohan J, Baillet A, et al. Increased glomerular filtration rate in patients with major burns and its effect on the pharmacokinetics of tobramycin[J]. N Engl J Med, 1978, 299(17): 915-919. DOI:10.1056/NEJM197810262991703 |
| [9] | Fuster-Lluch O, Gerónimo-Pardo M, Peyró-García R, et al. Glomerular hyperfiltration and albuminuria in critically ill patients[J]. Anaesth Intensive Care, 2008, 36(5): 674-680. DOI:10.1177/0310057x0803600507 |
| [10] | De Waele JJ, Dumoulin A, Janssen A, et al. Epidemiology of augmented renal clearance in mixed ICU patients[J]. Minerva Anestesiol, 2015, 81(10): 1079-1085. |
| [11] | Udy AA, Roberts JA, Shorr AF, et al. Augmented renal clearance in septic and traumatized patients with normal plasma creatinine concentrations:identifying at-risk patients[J]. Crit Care, 2013, 17(1): R35. DOI:10.1186/cc12544 |
| [12] | Udy AA, Varghese JM, Altukroni M, et al. Subtherapeutic initial beta-lactam concentrations in select critically ill patients:association between augmented renal clearance and low trough drug concentrations[J]. Chest, 2012, 142(1): 30-39. DOI:10.1378/chest.11-1671 |
| [13] | Kumar A, Roberts D, Wood KE, et al. Duration of hypotension before initiation of effective antimicrobial therapy is the critical determinant of survival in human septic shock[J]. Crit Care Med, 2006, 34(6): 1589-1596. DOI:10.1097/01.ccm.0000217961.75225.e9 |
| [14] | Roberts JA, Paul SK, Akova M, et al. DALI:defining antibiotic levels in intensive care unit patients:are current B-lactam antibiotic doses sufficient for critically ill patients?[J]. Clin Infect Dis, 2014, 58(8): 1072-1083. DOI:10.1093/cid/ciu027 |
| [15] | Batra VK, Morrison JA, Lasseter KC, et al. Piperacillin kinetics[J]. Clin Pharmacol Ther, 1979, 26(1): 41-53. DOI:10.1002/cpt197926141 |
| [16] | Hirai K, IshⅡ H, Shimoshikiryo T, et al. Augmented renal clearance in patients with febrile neutropenia is associated with increased risk for subtherapeutic concentrations of vancomycin[J]. Ther Drug Monit, 2016, 38(6): 706-710. DOI:10.1097/ftd.0000000000000346 |
| [17] | Baptista JP, Sousa E, Martins PJ, et al. Augmented renal clearance in septic patients and implications for vancomycin optimization[J]. Int J Antimicrob Agents, 2012, 39(5): 420-423. DOI:10.1016/j.ijantimicag.2011.12.011 |
 2019, Vol. 28
2019, Vol. 28


