2 莆田学院附属医院 重症医学科, 莆田 351100;
3 广东省人民医院(广东省医学科学院)急诊科、广东省人民医院(广东省医学科学院)急危重症医学部, 广州 510080
2 Critical Care Medicine, Affiliated Hospital of Putian College, Putian 351100, China;
3 Department of Emergency and Critical Care Medicine, Guangdong Provincial People's Hospital, Guangdong Academy of Medical Sciences, Guangzhou 510080, China
急性A型主动脉夹层(acute type A aortic dissection,ATAAD)是一种极为凶险的大动脉疾病。起病急,病情进展迅速且复杂,由于累及的分支血管不同,病情表现多样,给临床诊断增添了难度,易因漏诊、误诊导致病死率升高[1]。且部分患者在转运途中或急诊室因未得到及时有效治疗干预而破裂死亡。相关研究显示ATAAD患者发病后48 h内病死率达每小时1%~2%,1周病死率达70%,2周病死率达80%[2-4]。而早期给予合理干预,尤其是及时行主动脉修复者,存活率高达90%[1]。有效评估病情及预测病程进展可协助医生对ATAAD患者做出合理的医疗决策,就可能出现的临床结果与患者及家属更好的沟通。所以临床上需要一种能快速评估其破裂风险的简易风险预测模型。CT血管造影(computed tomography angiography,CTA)作为ATAAD诊断的金标准,能清晰显示夹层的病变范围及程度,对早期评估破裂风险起到很大的作用。本研究以CTA影像学特征为基础,结合患者基本临床资料及辅助检查等全面分析ATAAD的破裂风险因素,建立有效而实用的ATAAD破裂风险评估模型。
1 资料与方法 1.1 一般资料回顾性收集2012年4月1日至2017年3月31日广东省人民医院急诊科确诊为急性A型主动脉夹层的患者共256例,排除入院后死于其他严重并发症的患者19例、放弃手术治疗自动出院的患者12例、其他临床资料不全的患者25例,仅纳入200例患者作为建模组。其中男性160例,女性40例,年龄(53.30±13.19)岁。既往史包括高血压155例(77.50%),糖尿病55例(27.50%),吸烟史132例(66.00%),马凡综合征6例(3.00%)。按检查CTA后72 h内夹层是否破裂为标准,分为破裂组(100例)和未破裂组(100例)。另前瞻性纳入2017年4月1日至2018年5月31日广东省人民医院急诊科确诊为急性A型主动脉夹层的患者80例,收集其临床资料作为验证组,其中男性57例,女性23例,年龄(54.00±13.68)岁。既往史包括高血压62例(77.50%),糖尿病22例(27.50%),吸烟史51例(63.70%),马凡综合征2例(2.50%)。验证组中破裂者53例,未破裂者27例。患者按照2010年美国心脏病学会基金会/美国心脏协会(ACCF/AHA)等组织联合发布的《胸主动脉疾病的诊断和治疗指南》及2014年欧洲心脏病学会公布的《主动脉疾病诊断和治疗指南》,入院期间均予个体化干预治疗,即控制收缩压在110~120 mmHg(1mmHg=0.133Kpa),心率≤60次/min,充分镇痛,适当镇静,降低血压和心肌收缩力以减少主动脉病变部位的剪切力,尽量消除以上因素对病程进展的影响。收集患者入急诊室时的资料,包括病史、临床表现、一般情况、既往史、合并症、影像学特征、彩超结果、实验室检查和临床结果。
1.2 终点指标、破裂定义及诊断标准、纳入排除标准终点指标:以查CTA后72 h内夹层破裂死亡为终点指标。破裂定义:主动脉夹层破入心包,大量心包积液致患者心包压塞后死亡;或夹层破入纵隔、胸腹腔等,引起失血性休克致死亡。诊断标准:患者出现撕裂性胸痛、面色苍白、大汗淋漓、心率增快、血压进行性下降,予行床边彩超检查示心包、纵隔或胸腹腔大量积液。纳入标准:(1)年龄≥18岁,CTA确诊为A型主动脉夹层;(2)发病时间≤14 d;(3)积极治疗的患者。排除标准:(1)因其他严重并发症死亡的ATAAD患者;(2)夹层已行介入或外科手术治疗的患者;(3)B型主动脉夹层、主动脉壁间血肿、穿透性粥样硬化性主动脉溃疡及主动脉瘤患者;(4)医源性或创伤性主动脉夹层患者;(5)无相关临床检验和影像检查资料的主动脉夹层患者;(6)年龄<18岁的主动脉夹层患者;(7)既往有其他系统严重疾病的患者;(8)拒绝积极治疗的主动脉夹层患者。
1.3 破裂风险预测评分模型的建立对建模组200例夹层患者的相关破裂危险因素进行多因素二分类Logistic回归分析,待风险预测模型确定后,依据回归模型,计算相关危险因素β值,将最小β值赋值为1,分别将各因素β值与最小β值进行比值,四舍五入取整后赋值,建立ATAAD破裂风险评分模型。
1.4 破裂风险预测评分模型的效能评判和风险分层预测评分体系的区分度,是通过受试者工作特征(receiver operating characteristic,ROC)曲线下面积(area under the curve,AUC)来反映。一般认为AUC﹥0.7时具有较好的区分度,有临床预测价值。预测的校准度即预测的符合程度采用Hosmer-Lemeshow拟合优度检验法, P﹥0.05时认为模型校准度好。风险评分为连续型数学得分,根据其ROC曲线最佳界值并取整数,对评分进行了危险分层(破裂低危和破裂高危),并计算分层体系的准确性(敏感度和特异度)及检验效能。
1.5 破裂风险预测评分模型前瞻性验证本研究通过前瞻性纳入验证组对模型进行验证,判断模型对其他人群是否也具有较高的预测和判别性能。主要过程是在验证组中计算已建立评分模型的区分度、准确性和一致性等,然后与建模组中的参数进行比对。
1.6 统计学方法运用SPSS22.0软件对所有数据进行统计分析。计量资料采用Shapiro-Wilk检验进行正态性分析,符合正态分布结果用均数±标准差(mean±SD)表示,两组均数间采用方差分析(LSD-t检验)做比较;非正态分布资料采用中位数(M)及四分位数间距(P25, P75)表示,两组间比较采用两独立样本秩和检验。其中计量资料均采用ROC曲线获得其最佳界值,以最佳界值为分界点将连续型变量转换为二分类变量。所有计数资料以例数(百分数)表示,两组间比较采用χ2检验或Fisher精确检验法, 以P﹤0.05为差异具有统计学意义。针对破裂预警因素采用单因素分析后,选取P﹤0.20的因素进行二分类Logistic回归,以探讨导致夹层破裂的独立危险因素。性别强制纳入模型。建模后通过ROC曲线的AUC值来预测其区分度,AUC﹥0.7时具有较好的区分度,有临床预测价值。通过Hosmer-Lemeshow拟合优度检验法预测其校准度,以P﹥0.05认为模型校准度好。
2 结果 2.1 夹层破裂的单因素预测因子患者合并糖尿病、起病到该院就诊时间、起病到该院就诊时间≤20 h、晕厥、精神症状、休克、腹腔干血管缺血表现、肠系膜上血管缺血表现、呼吸机辅助通气、天冬氨酸氨基转移酶(AST)>80 U/L、pH≤7.40、乳酸(Lac)>1.9 mmol/L、白细胞数(WBC)>14.2×109个/L、中性粒细胞计数(NEUT)>9.4×109个/L、血小板计数(PLT)≤195×109个/L、心肌肌钙蛋白T(cTnT)>82.5 pg/mL、N-末端脑钠肽(NT-proBNP)>332 pg/mL、肌酐(Cr)>127 μmol/L、纤维蛋白原(FIB)>3.69 g/L、D-二聚体>18 770 μg/L与夹层破裂相关,两组间差异具有统计学意义(P<0.05),见表 1。两组患者的影像学特征中,重度主动脉瓣反流、心包中大量积液、头臂血管受累、分支受累数目分组>3支、假腔内无血栓、主动脉窦重度受累、主动脉窦直径>41 mm、窦管结合部直径>38 mm、升主动脉最宽直径>48 mm、升主最宽直径横截面假腔弧长>119 mm、升主最宽直径横截面假腔面积>11.85 cm2、假腔面积/真腔面积比值>2.12差异具有统计学意义(P<0.05),见表 2。两组患者在年龄>63岁、性别、高血压病史、吸烟史、马凡综合征、肢体缺血、EF值≤67%、冠状动脉受累、腹腔脏器血管受累、肾脏血管受累、下肢血管受累、内膜片无扭曲、破口数量仅1个、主动脉累及长度≤534 mm、升主最宽直径横截面假腔弧度>4.42 rad差异无统计学意义(P>0.05)。
| 项目 | 破裂组 (n=100) |
未破裂组 (n=100) |
χ2/Z值 | P值 |
| 年龄>63岁 | 28(28.0) | 17(17.0) | 3.470 | 0.063 |
| 女性 | 23(23.0) | 17(17.0) | 1.125 | 0.289 |
| 高血压病史 | 73(73.0) | 82(82.0) | 2.323 | 0.128 |
| 吸烟史 | 69(69.0) | 63(63.0) | 0.802 | 0.370 |
| 糖尿病 | 36(36.0) | 19(19.0) | 7.248 | 0.007 |
| 马凡综合征 | 5(5.0) | 1(1.0) | - | 0.212a |
| 起病到院就诊时间≤20 h | 59(59.0) | 36(36.0) | 10.607 | <0.01 |
| 起病到本院就诊时间(h)b | 14.5(7.5, 24.0) | 24.0(12.0, 72.0) | -3.614 | <0.01 |
| 晕厥 | 12(12.0) | 3(3.0) | 5.838 | 0.016 |
| 精神症状 | 19(19.0) | 9(9.0) | 4.153 | 0.042 |
| 肢体缺血 | 11(11.0) | 4(4.0) | 3.532 | 0.060 |
| 休克 | 18(18.0) | 5(5.0) | 8.303 | 0.004 |
| 腹腔干血管缺血表现 | 18(18.0) | 6(6.0) | 6.818 | 0.009 |
| 肠系膜上血管缺血表现 | 17(17.0) | 5(5.0) | 7.354 | 0.007 |
| 呼吸机辅助通气 | 25(25.0) | 4(4.0) | 17.786 | <0.01 |
| AST>80 U/Lc | 20(20.0) | 6(6.0) | 8.665 | 0.003 |
| EF值≤67% | 80(80.0) | 70(70.0) | 2.667 | 0.102 |
| PH≤7.40 | 74(74.0) | 23(23.0) | 52.067 | <0.01 |
| Lac>1.9 mmol/L | 54(54.0) | 12(12.0) | 39.891 | <0.01 |
| WBC>14.2×109 /L | 56(56.0) | 26(26.0) | 18.603 | <0.01 |
| NEUT>9.4×109/L | 76(76.0) | 47(47.0) | 17.759 | <0.01 |
| PLT≤195×109/L | 73(73.0) | 54(54.0) | 7.788 | 0.005 |
| cTnT>82.5 pg/mL | 49(49.0) | 16(16.0) | 24.821 | <0.01 |
| NT-proBNP>332 pg/mL | 79(79.0) | 52(52.0) | 16.130 | <0.01 |
| Cr>127 μmol/L | 47(47.0) | 21(21.0) | 15.062 | <0.01 |
| FIB>3.69 g/L | 68(68.0) | 43(43.0) | 12.653 | <0.01 |
| D-dimer>18770 μg/L | 42(42.0) | 23(23.0) | 8.228 | 0.004 |
| 注:a为Fisher精确检验,余为χ2检验;b为M (P25, P75);c为AST按实际临床工作中转氨酶超高正常高限2倍(80 U/L)有意义为界,将其转换为二分类变量。其余定量资料均按其ROC曲线最佳界值为界转换为二分类变量 | ||||
| 项目 | 破裂组 (n=100) |
未破裂组 (n=100) |
χ2值 | P值 |
| 重度主动脉瓣反流 | 36(36.0) | 20(20.0) | 6.349 | 0.012 |
| 心包中大量积液 | 16(16.0) | 6(6.0) | 5.107 | 0.024 |
| 冠状动脉受累 | 14(14.0) | 10(10.0) | 0.758 | 0.384 |
| 头臂血管受累 | 75(75.0) | 56(56.0) | 7.988 | 0.005 |
| 腹腔脏器血管受累 | 54(54.0) | 41(41.0) | 3.388 | 0.066 |
| 肾脏血管受累 | 67(67.0) | 56(56.0) | 2.555 | 0.110 |
| 下肢血管受累 | 63(63.0) | 54(54.0) | 1.668 | 0.196 |
| 分支受累数目分组>3支 | 63(63.0) | 44(44.0) | 7.256 | 0.007 |
| 假腔内无血栓 | 71(71.0) | 51(51.0) | 8.407 | 0.004 |
| 内膜片无扭曲a | 76(76.0) | 64(64.0) | 3.429 | 0.064 |
| 破口数量仅1个 | 83(83.0) | 80(80.0) | 0.298 | 0.585 |
| 主动脉窦重度受累 | 46(46.0) | 24(24.0) | 10.637 | 0.001 |
| 主动脉累及长度≤534 mm | 53(53.0) | 46(46.0) | 0.980 | 0.322 |
| 主动脉窦直径>41 mm | 43(43.0) | 24(24.0) | 8.102 | 0.004 |
| 窦管结合部直径>38 mm | 62(62.0) | 38(38.0) | 11.520 | 0.001 |
| 升主动脉最宽直径>48 mm | 67(67.0) | 34(34.0) | 21.782 | <0.01 |
| 升主最宽直径横截面假腔弧长>119 mm | 56(56.0) | 31(31.0) | 12.715 | <0.01 |
| 升主最宽直径横截面假腔弧度>4.42 rad | 71(71.0) | 58(58.0) | 3.690 | 0.055 |
| 升主最宽直径横截面假腔面积>11.85 cm2 | 80(80.0) | 44(44.0) | 27.504 | <0.01 |
| 假腔面积/真腔面积比值b>2.12 | 79(79.0) | 47(47.0) | 21.965 | <0.01 |
| 注:a指内膜片顺时针或逆时针旋转≤90º;b指在升主动脉最宽直径横截面上测量 | ||||
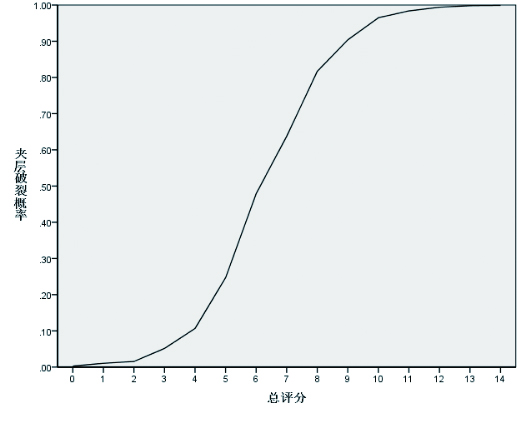
ATAAD患者查CTA后72 h内夹层破裂危险因素的多因素二分类Logistic回归分析结果及风险预测评分标准见表 3。主动脉窦直径>41 mm的β值最小,为0.927,将各危险因素的权重系数β值除以最小β值0.927后,按四舍五入原则对其风险权重赋值取整。风险预测评分标准为:每项按是否符合该项危险因素标准进行评分,符合则取其对应分数,不符合则给0分,对10项得分进行求和,计算总得分。各项最低分1分,最高分3分,总分0 ~19分。绘制总评分与夹层破裂概率的折线图见图 1。
| 危险因素 | 回归系数(β) | Wald χ2 | P值 | OR值 | 95% CI | 评分 |
| 年龄>63岁 | 1.687 | 8.487 | 0.004 | 5.403 | 1.737~16.810 | 2 |
| 女性 | 1.769 | 10.131 | 0.001 | 5.865 | 1.973~17.432 | 2 |
| 呼吸机辅助通气 | 3.052 | 14.203 | <0.01 | 21.156 | 4.326~4.326 | 3 |
| AST>80 U/L | 1.594 | 5.156 | 0.023 | 4.926 | 1.244~19.506 | 2 |
| 内膜片无扭曲 | 1.571 | 9.685 | 0.002 | 4.811 | 1.789~12.940 | 2 |
| 主动脉窦直径>41 mm | 0.927 | 3.790 | 0.052 | 2.527 | 0.994~6.426 | 1 |
| 升主动脉最宽直径>48 mm | 1.320 | 8.751 | 0.003 | 3.745 | 1.561~8.982 | 1 |
| 假腔面积/真腔面积比值>2.12 | 1.935 | 13.336 | <0.01 | 6.927 | 2.451~19.574 | 2 |
| Lac>1.9 mmol/L | 2.281 | 20.955 | <0.01 | 9.782 | 3.684~25.973 | 3 |
| WBC>14.2×109个/L | 1.225 | 7.672 | 0.006 | 3.404 | 1.431~8.101 | 1 |
| 常数 | -5.822 | 38.865 | <0.01 | 0.003 | - | - |
| 注:总分:0~19分;分层:破裂低危0~6分,破裂高危7~19分;“-”表示无相关数据 | ||||||
|
| 图 1 急性A型主动脉夹层查CTA后72 h内夹层破裂风险评分模型 Fig 1 Risk score model of dissection rupture within 72 hours after CTA in acute type A aortic dissection |
|
|
对评分模型的预测性能进行检验,在建模组中,破裂风险评分的ROC AUC为0.908(95%CI: 0.868 ~ 0.947,P﹤0.01),Hosmer-Lemeshow检验χ2 =3.377,P=0.909。
为进一步简化破裂风险评估模型,建模组根据评分模型ROC曲线中最佳界值6.5取整,将上述评分模型分为两层,即破裂低危(0~6分)和破裂高危(7~19分)。以实际是否破裂为准,该破裂风险分层模型的敏感度为83.0%,特异度为86.0%,见表 4。
| 实际观测值 | 夹层破裂风险分层 | 合计 | |
| 高危 | 低危 | ||
| ≤72 h内破裂 | a=83 | c=17 | a+c=100 |
| >72 h未破裂 | b=14 | d=86 | b+d=100 |
| 合计 | a+b=97 | c+d=103 | N=200 |
| 注:灵敏度Se=a/(a+c)×100%=83/100×100%=83.0%;特异度Sp=d/(b+d)×100%=86/100×100%=86.0% | |||
验证组80例ATAAD患者查CTA后72 h内实际破裂53例,未破裂27例,根据已建立的模型计算验证组中各患者得分,分为破裂低危和破裂高危,见表 5;其ROC AUC为0.928(95% CI:0.872 ~ 0.984,P﹤0.01),破裂风险分层模型的敏感度为81.13%,特异度为92.59%,Hosmer-Lemeshow检验χ2 = 8.331,P= 0.402。对两组数据进行比对,该评分体系在建模组和验证组中, 其预测的校准度和鉴别效度均较好, 见表 6。
| 实际观测值 | 夹层破裂风险分层 | 合计 | |
| 高危 | 低危 | ||
| ≤72 h破裂 | a=43 | c=10 | a+c=53 |
| >72 h未破裂 | b=2 | d=25 | b+d=27 |
| 合计 | a+b=45 | c+d=35 | n=80 |
| 注:灵敏度Se=a/(a+c)×100%=43/53×100%=81.13%;特异度Sp=d/(b+d)×100%=25/27×100%=92.59% | |||
| 组别 | AUC | 敏感度(%) | 特异度(%) | H-L检验χ2值 | P值 |
| 建模组 | 0.908 | 83.00 | 86.00 | 3.377 | 0.909 |
| 验证组 | 0.928 | 81.13 | 92.59 | 8.331 | 0.402 |
ATAAD是紧急的心血管系统外科疾病,是由于主动脉管壁中膜弹力纤维发育不良或受损断裂、平滑肌退行性改变、感染、外伤以及先天性因素等导致主动脉内膜撕裂,血液通过内膜破口进入中膜而形成真、假两个管腔,患者在短期内可因主动脉破裂而死亡,或分支血管受累致重要脏器缺血引起严重并发症。ATAAD因累及升主动脉及主动脉弓,血流对血管壁的冲击力、剪切力强,夹层更易破裂,危险性更高[5]。因累及不同分支血管,临床表现各异,其治疗方法和预后各不相同。本研究确认了与ATAAD破裂明显相关的临床表现、影像和实验室检查等变量,通过建立简易的破裂风险预测评分工具,协助医师对ATAAD患者做出及时、合理的治疗方案。
ATAAD发病急,病情进展迅速,其病死率随着时间延长而急剧上升[6]。有研究显示[7],如果仅行药物保守治疗,A型主动脉夹层的病死率可达58%,ATAAD院内死亡的患者中,70.27%发生于术前药物治疗期间。因此通过建立简易的破裂风险评分模型,急诊科及外科医师可迅速进行术前风险评估,合理安排夹层破裂风险值较大患者的手术时间,更有效地救治ATAAD患者。评分模型也可快速有效评估患者病情及预后,便于医师就可能出现的临床结果更好地与患者及家属沟通。李延等[8]研究发现,女性为主动脉夹层破裂死亡的危险因素,其认为:①女性对疼痛的耐受力强, 从而延误就诊时机;②女性比男性更易累及心包、心脏瓣膜, 发生心脏并发症;③部分女性患者妊娠可致主动脉壁结构发生改变,导致其易于破裂。本研究中破裂组女性比例(23%)较未破裂组(17%)高;且合并心包积液在女性患者中占52.5%,在男性患者中占39.4%,与该报道一致。但女性患者中主动脉窦重度受累的比例较男性低,有待进一步探究。随着年龄的增加, ATAAD的破裂风险相应上升,本研究发现年龄>63岁是破裂的独立危险因素。考虑随着年龄的增长,高血压、动脉粥样硬化等心血管疾病的发病率相应升高,引起主动脉壁内切压力上升,管壁弹力纤维断裂及僵硬度增加,血管壁易撕裂导致夹层破裂。
主动脉夹层由于中膜退变,激活了全身炎性反应,分泌大量的炎症介质降解细胞外基质,导致主动脉管壁薄弱,随着血流的不断冲击,最终导致内膜扩张进而破裂,诱发夹层的发生。研究发现,诸多生物标记物在急性主动脉夹层发病的不同时段呈动态变化过程,与夹层的发展及预后密切相关[9-12]。本研究中WBC、FIB、D-二聚物和NEUT等都是已知在主动脉夹层中上升的因子,反映了病情的严重程度,其中WBC>14.2×109个/L为ATAAD破裂的独立危险因素,对ATAAD患者夹层破裂的预测具有高敏感性。主动脉夹层发生后,白细胞水平急剧升高,不仅是全身炎症反应的结果,而且很可能加剧了组织损伤,可能是夹层除脏器缺血以外的另一个损伤机制,如夹层急性期合并肺损伤,造成氧合指数的下降。Kurabayashi等[13]认为, 主动脉夹层的撕裂面积是肺氧合功能损伤的独立危险因素, 可能跟激活炎症反应的强弱有关。Standford A型主动脉夹层内膜撕裂范围较Standford B型范围更大,故A型夹层比B型更容易发生肺损伤。本研究显示呼吸机辅助呼吸为夹层破裂的独立危险因素,进一步证实相关报道。
目前ATAAD确诊主要依赖于主动脉磁共振成像(MRI)、数字减影血管造影(DSA)、经食管超声心动图(TEE)、经胸超声心动图(TTE)和主动脉全程CTA等检查。其中CTA可“一站式”鉴别主动脉夹层、急性冠脉综合征及急性肺栓塞等,对主动脉夹层的诊断、治疗和随访具有重要价值,近年来已逐渐取代DSA成为诊断主动脉夹层的新金标准。CTA为无创性检查,显示ATAAD的敏感性和特异性高,扫描速度快,操作简单安全,能清晰显示夹层病变的真假腔、假腔内血栓、内膜瓣及其走行、破口位置及数量等,采用横轴位、矢状位、冠状位及任意解剖角度的图像相结合,运用多种图像后处理方法,可从不同角度、方位更好地显示主动脉各大分支及受累情况;且回顾性心电门控扫描对ATAAD内膜瓣的运动状态及冠状动脉的动态受累显示清晰,有利于精确的诊断及病情的早期预判,所以CTA已成为ATAAD确诊和评估预后的首选检查方法。
文献报道,主动脉最大直径、假腔面积或体积、假腔血栓形成状态等形态学参数和急性主动脉夹层患者预后有明显相关性[14-16]。Lavall等[17]研究发现升主动脉瘤直径是内膜撕裂、动脉瘤破裂的危险因素,与瘤体直径50~59 mm相比,瘤体直径≥60 mm时动脉瘤破裂、内膜撕裂的风险约增加6.9%,并发症增加50%,病死率增加11.8%。本研究显示,升主动脉最宽直径>48 mm、主动脉窦直径>41 mm为AD破裂的独立危险因素;破裂组中夹层最宽直径≥60 mm的比例占17%,比未破裂组(10%)高,与相关报道一致。有研究指出,假腔面积/真腔面积比值与休克指数呈正相关[18]。可能是由于明显增大的假腔使真腔受压变形,有效循环血量减少所致,也可能是由于假腔增大,血管壁张力增大,致使夹层破裂,可成为预测预后的因素。与以往文献报道相同,本研究发现,假腔面积/真腔面积比值>2.12为夹层破裂的独立危险因素。以上相同结论也再次证明了这些因素对夹层破裂风险的影响以及在本评分模型中的意义。本研究发现,内膜片无扭曲为夹层破裂的独立危险因素。考虑内膜片扭曲后,假腔内血管壁的张力下降,破裂的风险降低,所以内膜片无扭曲的夹层更易破裂。主动脉夹层假腔内血栓化后腔内血流速度逐渐缓慢,对血管壁的剪切力减弱,假腔逐渐萎缩,破裂风险逐渐降低,因此假腔血栓化被认为是主动夹层的保护性因素。本研究中破裂组假腔内无血栓比例较未破裂组高,两组差异具有统计学意义(P﹤0.05),与已有报道一致。主动脉夹层发生时,内膜撕裂形成“双腔征”,分支血管出现不同程度的受累。分支受累缺血情况可分为2种[19-20]:动力型指分支血管开口于真腔,随着假腔内压力逐渐增高,内膜瓣偏移至分支血管开口处,遮蔽了分支开口,导致其血流部分或完全阻断;静止型是指内膜瓣撕入分支,分支内无继发破口,分支血管由真假腔共同供血,致使真腔受压变窄甚至闭塞。分支受累可造成相应供血器官出现缺血性功能障碍,如脑梗、谵妄、昏迷、心梗、消化道功能障碍、肠系膜缺血、肾缺血、截瘫、下肢缺血、肢体运动障碍等,这些并发症是夹层预后不良的重要原因。本研究中, AST>80 U/L为夹层破裂的独立危险因素,考虑腹腔干、肝总动脉受累所致。本研究发现Lac>1.9 mmol/L为夹层破裂的独立危险因素,可能为腹腔干、肠系膜上动脉、双侧肾动脉等分支血管受累致使相应重要脏器缺血或夹层破裂导致循环血量不足,使患者体内乳酸堆积所致。本研究显示主动脉窦直径>41 mm是夹层破裂的独立危险因素,考虑主动脉窦部严重受损,夹层易撕入心包,大量心包积液可致患者心包压塞、死亡;同时主动脉窦部受损易致急性左心衰,若累及左右冠状动脉,可出现心肌梗死等并发症,进一步加重病情。
| [1] | 杜庆霞, 王宇, 丁宁, 等. 影响急性主动脉夹层急诊诊断时间的相关危险因素分析[J]. 中华急诊医学杂志, 2015, 24(2): 206-207. DOI:10.3760/cma.j.issn.1671-0282.2015.02.022 |
| [2] | Mészáros I, Mórocz J, Szlávi J, et al. Epidemiology and clinicopathology of aortic dissection[J]. Chest, 2000, 117(5): 1271-1278. DOI:10.1378/chest.117.5.1271 |
| [3] | Pitt MP, Bonser RS. The natural history of thoracic aortic aneurysm disease:an overview[J]. J Card Surg, 1997, 12(2 Suppl): 270-278. DOI:10.1111/j.1540-8191.1997.tb00108.x |
| [4] | Tsai TT, Trimarchi S, Nienaber CA. Acute aortic dissection:perspectives from the international registry of acute aortic dissection (IRAD)[J]. Eur J Vasc Ensovasc Surg, 2009, 37(2): 149-159. DOI:10.1016/j.ejvs.2008.11.032 |
| [5] | 宋剑平, 胡新宇, 金静芬, 等. 急性Stanford A型主动脉夹层术后短期死亡影响因素分析[J]. 中华急诊医学杂志, 2017, 26(6): 706-709. DOI:10.3760/cma.j.issn.1671-0282.2017.06.022 |
| [6] | 张力, 王平凡, 梁志强, 等. 杂交技术在急性Stanford A型主动脉夹层外科治疗的临床应用[J]. 中华急诊医学杂志, 2013, 22(3): 302-304. DOI:10.3760/cma.j.issn.1671-0282.2013.03.018 |
| [7] | 王德, 丘俊涛, 于存涛, 等. Stanford A型主动脉夹层院内死亡风险的简易床旁评估模型[J]. 中国胸心血管外科临床杂志, 2018, 25(6): 500-506. DOI:10.7507/1007-4848.2018.02.010 |
| [8] | 李延, 张菲, 唐亚楠, 等. 中国人群主动脉夹层死亡危险因素meta分析[J]. 中国卫生统计, 2018, 35(2): 262-266. |
| [9] | Wen D, Zhou XL, Li JJ, et al. Biomarkers in aortic dissection[J]. Clin Chim Acta, 2011, 412(9/10): 688-695. DOI:10.1016/j.cca.2010.12.039 |
| [10] | Sakakura K, Kubo N, Ako J, et al. Peak C-reactive protein level predicts long-term outcomes in type B acute aortic dissection[J]. Hypertension, 2010, 55(2): 422-429. DOI:10.1161/hypertensionaha.109.143131 |
| [11] | Du R, Li D, Yu J, et al. Association of platelet to lymphocyte ratio and risk of in-hospital mortality in patients with type B acute aortic dissection[J]. Am J Emerg Med, 2017, 35(2): 368-370. DOI:10.1016/j.ajem.2016.11.003 |
| [12] | 刘琴, 蒋媛媛, 丁思意, 等. D-二聚体、N-末端B型钠尿肽前体、心肌肌钙蛋白T及降钙素原联合检测对急性主动脉夹层预后判断的价值[J]. 临床检验杂志, 2014, 32(9): 667-669. DOI:10.13602/j.cnki.jcls.2014.09.07 |
| [13] | Kurabayashi M, Okishige K, Azegami K, et al. Reduction of the PaO2/FiO2 ratio in acute aortic dissection relationship between the extent of dissection and inflammation[J]. Circ J, 2010, 74(10): 2066-2073. DOI:10.1253/circj.CJ-10-0336 |
| [14] | Tolenaar JL, Froehlich W, Jonker FH, et al. Predicting in-hospital mortality in acute type B aortic dissection:evidence from International Registry of Acute Aortic Dissection[J]. Circulation, 2014, 130(11 Suppl 1): S45-50. DOI:10.1161/CIRCULATIONAHA.113.007117 |
| [15] | Chang CP, Liu JC, Liou YM, et al. The role of false lumen size in prediction of in-hospital complications after acute type B aortic dissection[J]. J Am Coll Cardiol, 2008, 52(14): 1170-1176. DOI:10.1016/j.jacc.2008.06.034 |
| [16] | Li D, Ye L, He Y, et al. False lumen status in patients with acute aortic dissection:a systematic review and meta-analysis[J]. J Am Heart Assoc, 2016, 5(5): e003172. DOI:10.1161/JAHA.115.003172 |
| [17] | Lavall D, Schäfers HJ, Böhm M, et al. Aneurysms of the ascending aorta[J]. Dtsch Arztebl Int, 2012, 109(13): 227-233. DOI:10.3238/arztebl.2012.0227 |
| [18] | Guo ZJ, Lin Q, Zi XR, et al. Correlation of computed tomography angiography parameters and shock index to assess the transportation risk in aortic dissection patients[J]. Radiol Med, 2015, 120(4): 386-392. DOI:10.1007/s11547-014-0463-3 |
| [19] | Narita K, Akutsu K, Yamamoto T, et al. Simultaneous fenestration with stent implantation for acute limb ischemia due to type B acute aortic dissection complicated with both static and dynamic obstructions[J]. Ann Thorac Cardiavasc Surg, 2012, 18(2): 158-161. DOI:10.5761/atcs.cr.11.01712 |
| [20] | Williams DM, Lee DY, Hamilton BH, et al. The dissected aorta:part Ⅲ. Anatomy and radiologic diagnosis of branch-vessel compromise[J]. Radiology, 1997, 203(1): 37-44. DOI:10.1148/radiology.203.1.9122414 |
 2019, Vol. 28
2019, Vol. 28




