2 北京地坛医院 消化科, 100015
2 Gastroenterology Department of Beijing DiTan Hospital, Beijing 100015
急性肺损伤(ALI)及其最严重的形式—急性呼吸性综合征(ARDS),与多器官功能障碍综合征(MODS)的发展有关,其特点是低氧血症、肺部浸润,并且没有肺毛细血管楔压上升[1-2]。脓毒症是一种由严重感染引起的致命的全身炎症(全身性炎症反应综合征或SIRS)[3-4]。当感染的初始宿主反应被放大并对宿主造成损害时,脓毒症就会发展[5]。细菌的一些结构组分(病原体相关分子模式-PAMPs)被吞噬细胞和其他细胞类型中表达的模式识别受体(PRR)识别后[6],会进而启动脓毒症并且该过程可能导致NF-κB的激活和几种促炎基因的转录[6],包括TNF-α、IL-6和IL-1β。
一氧化氮(NO)是一种重要的内源性调节分子,与肺中的促炎和抗炎过程有关[7-9]。给予LPS可增加诱导型一氧化氮合酶(iNOS)的表达和活性,从而增加一氧化氮(NO)的产生[10]。环氧合酶(COX)参与包括肺损伤在内的多种炎症性疾病[11]。COX-2是催化花生四烯酸转化为前列腺素的诱导型酶。前列腺素(PG)E2是一种有效的炎症介质。COX-2的表达在炎症期间显著增加[12],其原因是受到各种促炎因子的刺激,如肿瘤坏死因子α(TNF-α),白细胞介素(IL)-1β,IL- 6,和LPS [13-14]。在LPS诱导的ALI中,内毒素处理通过诱导iNOS和COX-2导致肺泡毛细血管屏障破坏[15-16]。
核因子-κB(NF-κB)是调节iNOS,COX-2和各种促炎细胞因子(如TNF-α和IL-1β)表达的关键转录因子[17]。NF-κB是由p65(转录激活成分或p50)组成的二聚体。在未受到刺激的细胞中,NF-κB在细胞质中以非活性状态存在,与抑制蛋白IκB结合成为复合物。当细胞激活后,IκB经历磷酸化和降解,NF-κB易位到细胞核中,与DNA结合并发挥转录激活功能[18]。木犀草素属于黄酮类化合物,在自然界广泛存在[19-22],具有抗过氧化,抗炎和抗血管活性[23-25],以及抗癌活性[26]。研究拟探讨木犀草素对脓毒症诱导的ALI小鼠的保护作用。
1 材料与方法 1.1 实验动物50只成年(6周龄)SPF雌性C57BL/6小鼠从上海实验动物中心获得。所有动物饲养在温度为(24±1)℃,12 h光暗循环和相对湿度为40%-80%的房间中。动物自由饮水进食。所有实验方案均经过动物伦理委员会审批通过。
1.2 ALI模型构建小鼠随机(随机数字法)分成5组(每组10只小鼠):假手术组(对照组)中盲肠未结扎和穿刺,其余步骤均和实验组相同; 脓毒症小鼠(CLP组); 在脓毒症诱导48 h前,采用不同剂量木犀草素腹腔注射(20 mg/kg组,40 mg/kg组和80 mg/kg组)。木犀草素处理2 d后,戊巴比妥钠麻醉,按照之前报道[27],采用盲肠结扎后穿刺得方法构建脓毒症动物模型,存活率为50%。手术后,将动物放回笼中饲养,自由饮食进水。
1.3 组织样本获取造模第5天后,收集小鼠的肺组织,置于冰上,称重,并在预冷PBS中匀浆,4℃以8 000 g离心10 min,将上清液储存在-80℃。
1.4 BALF中细胞计数和蛋白浓度检测根据文献描述制备BALF [28],通过气管插管用无菌生理盐水冲洗肺3次。离心后,将上清液储存在-20℃。将沉淀的细胞重悬于盐水中, 使用血细胞计数器测定总细胞数。使用Wright-Giemsa染色测定嗜中性粒细胞的百分比。使用BCA蛋白测定试剂盒(碧云天,江苏)测定BALF的蛋白浓度。
1.5 肺组织病理检查术后时间及依据造模第5天后,收集小鼠的肺组织,将右下肺叶浸入4%多聚甲醛固定48 h,然后包埋在石蜡中,并将组织块切成5 μm切片,HE染色,显微镜下观察肺叶形态学。采用以下标准肺损伤的程度:①渗出物;②充血;③肺泡内出血;④细胞浸润;⑤细胞增生[29]。每只小鼠由三位病理学家独立检查肺损伤严重程度。
1.6 肺干湿质量比收集小鼠右肺的上叶和中叶并立即称重,将样品在70℃的烘箱中干燥后称重,最后计算湿-干质量比。
1.7 MPO活性检测在脓毒症诱导24 h后,麻醉小鼠,取得肺组织,称重,匀浆。采用商业化试剂盒(南京建成生物工程研究所,南京,江苏)测定MPO活性。
1.8 BALF中的细胞因子测量采用ELISA试剂盒(R & D Systems; Minneapolis)测定BALF上清液中促炎细胞因子和趋化因子TNF-α,IL-1β,IL-6和MIP-2的浓度,操作步骤按照说明书进行。
1.9 Western blot用RIPA缓冲液裂解肺组织,在冰上超声处理,并在4℃以12 000 g离心15 min。然后进行SDS-PAGE分离蛋白样品,并转移至硝酸纤维素膜(Millipore,Billerica,MA,USA)。封闭硝酸纤维素膜后,在4℃下采用一抗孵育过夜,然后用HRP耦合的二抗常温孵育2 h。最后,用ECL试剂盒(GE Healthcare,Marlborough,MA,USA)检测蛋白条带。使用抗体如下:兔抗小鼠iNOS多克隆抗体(ab3523,Abcam),兔抗小鼠COX-2多克隆抗体(ab15191,Abcam),兔抗小鼠β-actin抗体(ab189073,Abcam),兔抗小鼠NF-κB p65多克隆抗体(ab16502,Abcam),兔抗小鼠IκBα多克隆抗体(ab32518,Abcam)。
1.10 细胞培养RAW264.7细胞用DMEM培养基培养,含有10%胎牛血清(FBS),青霉素(100单位/ mL)和链霉素(100 mg/mL)。在LPS(1μg/ mL)刺激之前,用不同浓度的木犀草素(10 μg/ mL,50 μg/ mL,100 μg/ mL)预处理细胞4 h。
1.11 NF-κB p65DNA结合活性测定使用TransAM NF-κB p65试剂盒(Active Motif; Carlsbad,CA,USA)测量NF-κB p65 DNA结合活性,操作步骤按照说明书进行。
计量资料以均数±标准差(Mean±SD)表示。使用SPSS 17.0进行方差分析,组间两两比较采用LSD-t检验,以P < 0.05为差异具有统计学意义。
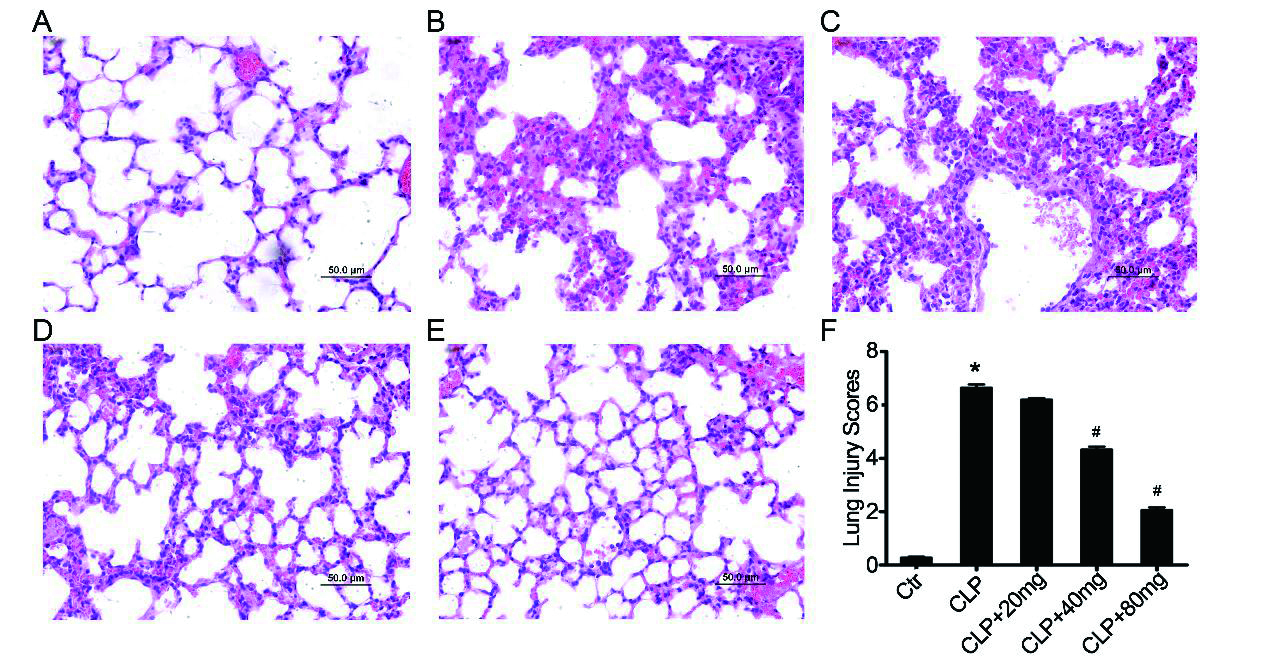
2 结果 2.1 木犀草素减轻ALI小鼠中脓毒症诱导的肺部炎症采用HE染色确定脓毒症小鼠的病理学变化,与未处理的假对照组(图 1A)相比,光学显微镜观察肺部的组织学评估显示,脓毒症引起严重的ALI,其特征为水肿、炎性细胞浸润、肺泡间隔增厚以及斑块内肺泡和间质出血(图 1B)。木犀草素预处理可以减轻肺组织的病理损伤,且呈现浓度梯度性(图 1C-E)。这些结果与肺损伤评分数据一致(图 1F)。总之,这些结果表明,木犀草素可以减轻脓毒症诱导的ALI中肺部炎症。
|
| 肺组织HE染色:对照组(A),脓毒症诱导的ALI组(B),木犀草素预处理脓毒症组(C-E)。(F)肺损伤评分。放大倍数200,n = 10 /组。与对照组相比,aP < 0.05;与脓毒症诱导的ALI组相比,bP < 0.05 图 1 木犀草素减弱体内脓毒症诱导的ALI Fig 1 Luteolin attenuates sepsis induced ALI in vivo |
|
|
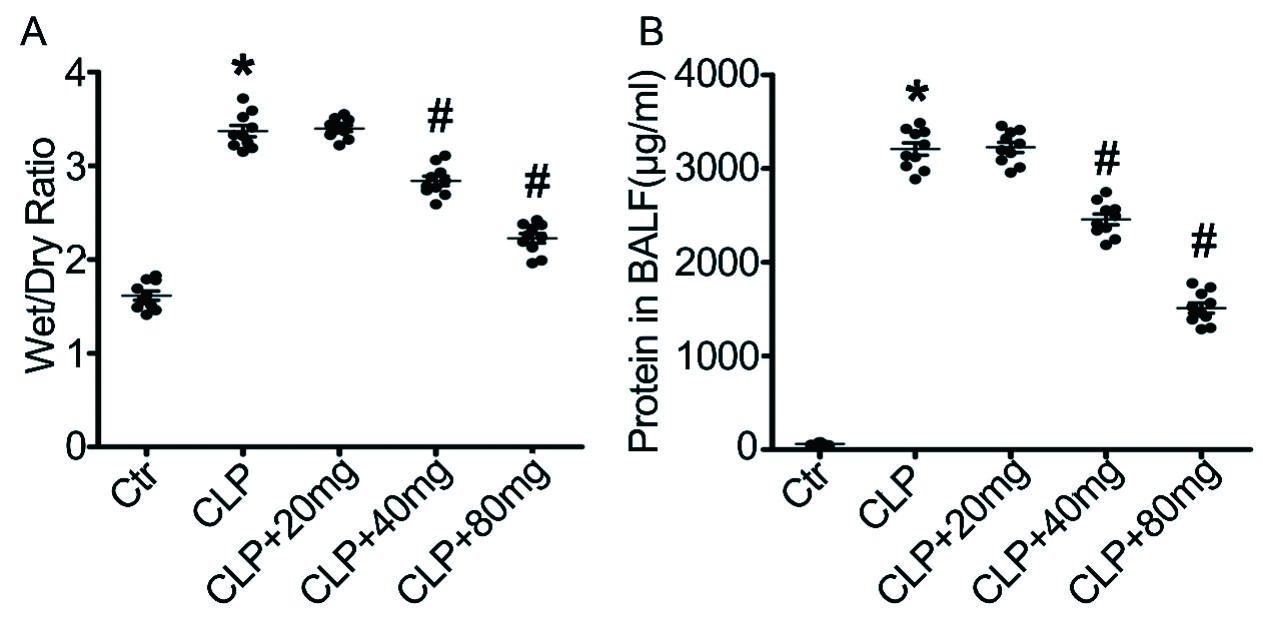
为进一步评价木犀草素对脓毒症引起的ALI的保护作用,检测了肺水肿(图 2A)和BALF中蛋白浓度(图 2B)。与对照组小鼠相比,脓毒症诱导的ALI小鼠中BALF蛋白浓度(图 2B)和肺湿-干比(图 2A)显著增加。然而,与脓毒症小鼠相比,木犀草素预处理以剂量依赖性方式显著降低脓毒症诱导肺水肿和BALF中蛋白浓度(图 2A和2B)。
|
| 肺干湿质量比(A)和支气管肺泡灌洗液(BALF)中的蛋白浓度(B)。n = 10 /组,与对照组相比,aP < 0.05;与脓毒症诱导的ALI组相比,bP < 0.05 图 2 木犀草素对LPS诱导的脓毒症小鼠BALF中肺湿质量比和蛋白浓度的影响 Fig 2 Effect of luteolin on lung wet/weight ratio and protein concentration in BALF in LPS-induced sepsis |
|
|
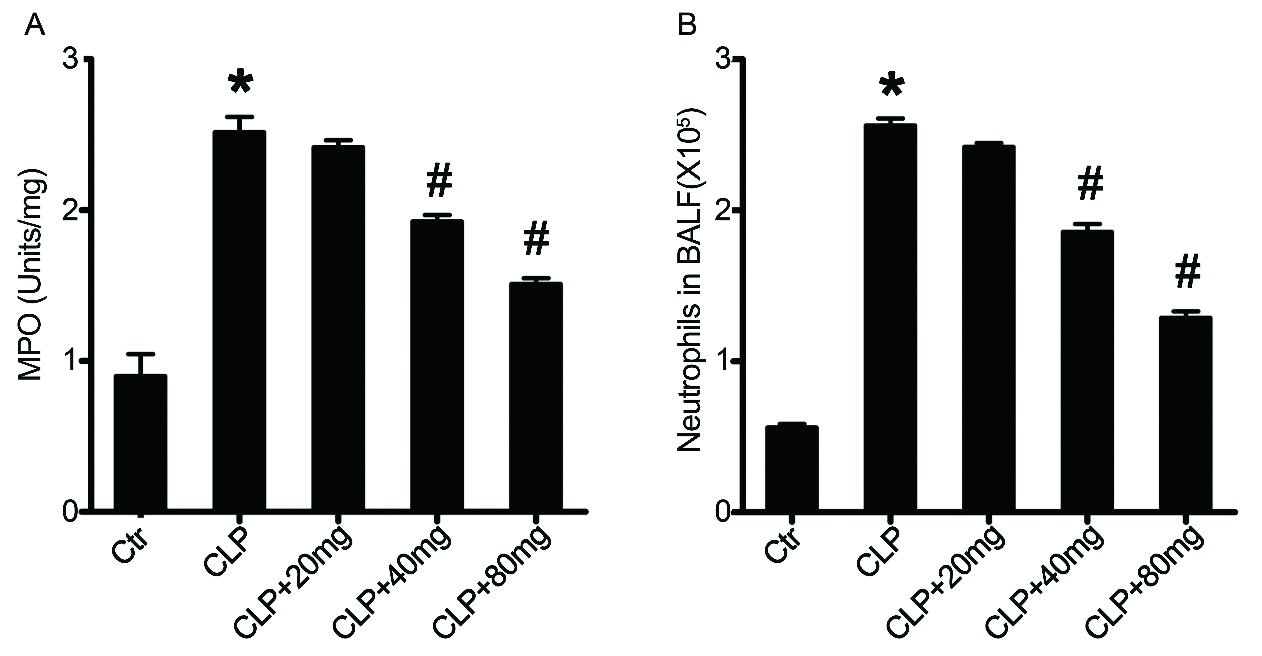
ALI与肺MPO活性有关,中性粒细胞外渗是受损肺组织炎症和免疫反应的主要标志[30-31]。此外,肺MPO活性也是肺中性粒细胞浸润的可靠标志[32]。因此,在脓毒症诱导后24 h测定了不同组中肺组织MPO活性和小鼠BALF中浸润的中性粒细胞的数量。
与假对照小鼠相比,脓毒症诱导显著增加肺MPO活性。相反,在木犀草素预处理的小鼠中肺部MPO活性显著低于脓毒症小鼠(图 3A)。
|
| A:肺髓过氧化物酶(MPO)活性。B:支气管肺泡灌洗液(BALF)中的浸润嗜中性粒细胞的数量。n= 10 /组,与对照组相比,aP < 0.05;与脓毒症诱导的ALI组相比,bP < 0.05 图 3 木犀草素对肺MPO活性和中性粒细胞浸润的影响 Fig 3 Effect of luteolin on lung MPO activity and neutrophil infiltration |
|
|
这些结果与BALF中嗜中性粒细胞浸润结果一致(图 3B)。
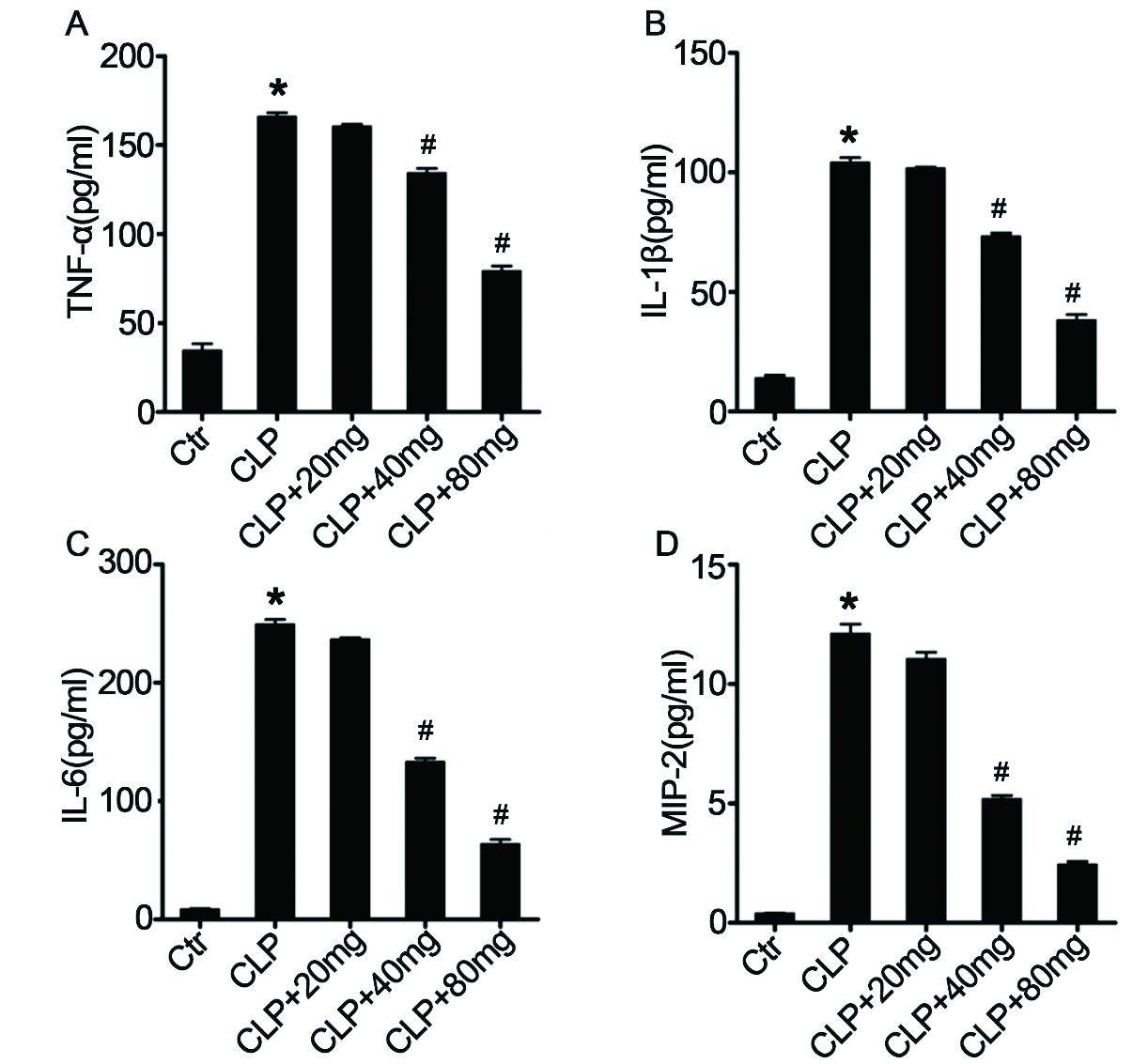
2.4 对脓毒症小鼠BALF炎症细胞因子的影响LPS是脓毒症中炎症和趋化细胞因子产生的主要刺激物,包括TNF-α、IL-1β、IL-6和MIP-2 [33-35]。为了分析木犀草素对脓毒症诱导的炎性细胞因子的影响,本研究使用ELISA测定了不同处理组BALF中TNF-α,IL-1β,IL-6和MIP-2的浓度。脓毒症诱导显著增加了BALF中TNF-α(图 4A),IL-1β(图 4B),IL-6(图 4C)和MIP-2(图 4D)的浓度,表明木犀草素可以抑制ALI小鼠中脓毒症诱导的炎症反应。
|
| ELISA测定肿瘤坏死因子α(TNF-α,A),白细胞介素(IL)1β(B),IL-6(C)和巨噬细胞炎症蛋白-2(MIP-2,D)的浓度。n= 10 /组,与对照组相比,aP < 0.05;与脓毒症诱导的ALI组相比,bP < 0.05 图 4 木犀草素对BALF中炎性细胞因子浓度的影响 Fig 4 Effect of luteolin on the concentration of inflammatory cytokinesin BALF |
|
|
iNOS和COX-2在ALI中发挥关键作用,抑制iNOS和COX-2表达可以减弱脓毒症[11, 36-39]。因此,为了研究木犀草素对脓毒症小鼠保护作用的可能机制,本研究测量了木犀草素对iNOS和COX-2表达的影响。在脓毒症小鼠中,肺组织中iNOS和COX-2表达显著增加,而木犀草素预处理可以显著抑制其表达(图 5A和5B)。
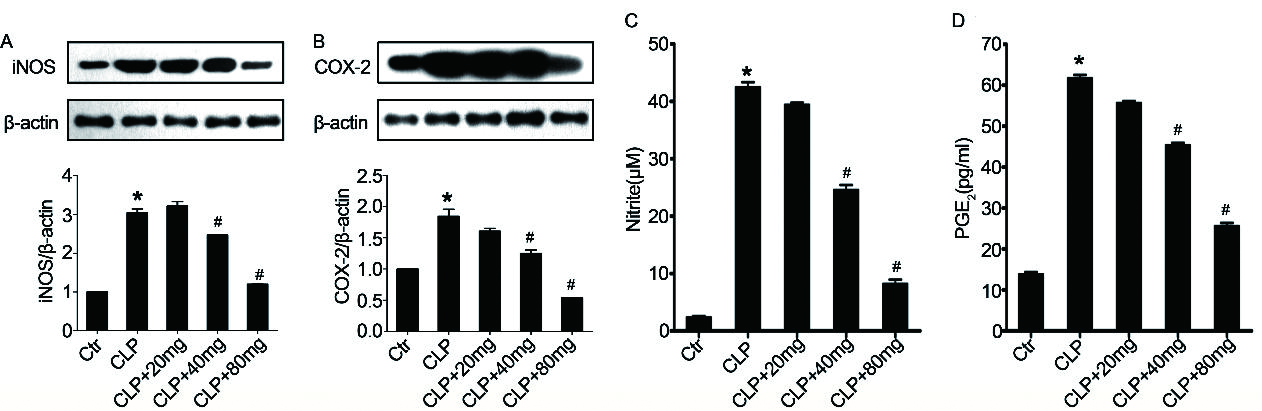
|
| A:肺组织中iNOS的蛋白水平。B:肺组织中COX-2的蛋白水平。C:肺匀浆中的亚硝酸盐水平。D:肺匀浆中前列腺素E2(PGE2)的水平。n= 10 /组,与对照组相比,aP < 0.05;与脓毒症诱导的ALI组相比,bP < 0.05 图 5 木犀草素对iNOS和COX-2表达的影响 Fig 5 Effect of luteolin on the expression of iNOS and COX-2 |
|
|
在脓毒症小鼠中,iNOS和COX-2分别通过NO和前列腺素介导炎症过程[11, 40-41]。如图 5C和5D所示,用木犀草素预处理能够以剂量依赖性的方式降低ALI小鼠肺组织中NO和PGE 2的水平。这些结果与木犀草素预处理的脓毒症小鼠中iNOS和COX-2表达的数据一致。
2.6 对脓毒症小鼠抗氧化酶和HO-1表达的影响抗氧化酶(AOEs),如超氧化物歧化酶(SOD)、过氧化氢酶和谷胱甘肽过氧化物酶(GPx),可以保护组织免受氧化损伤[42]。因此,检测了脓毒症小鼠中某些AOEs的表达。脓毒症小鼠肺组织中抗氧化酶表达下降,而木犀草素显著增加这些抗氧化酶的表达(图 6A)。HO-1是一种可以改善脓毒症诱导ALI的抗氧化蛋白[43]。与对照组相比,脓毒症小鼠肺组织中HO-1的表达下降(图 6B)。木犀草素以浓度依赖性方式增加HO-1表达(图 6B)。这些结果表明,木犀草素可通过AOEs和HO-1减少脓毒症诱导的肺组织氧化损伤。
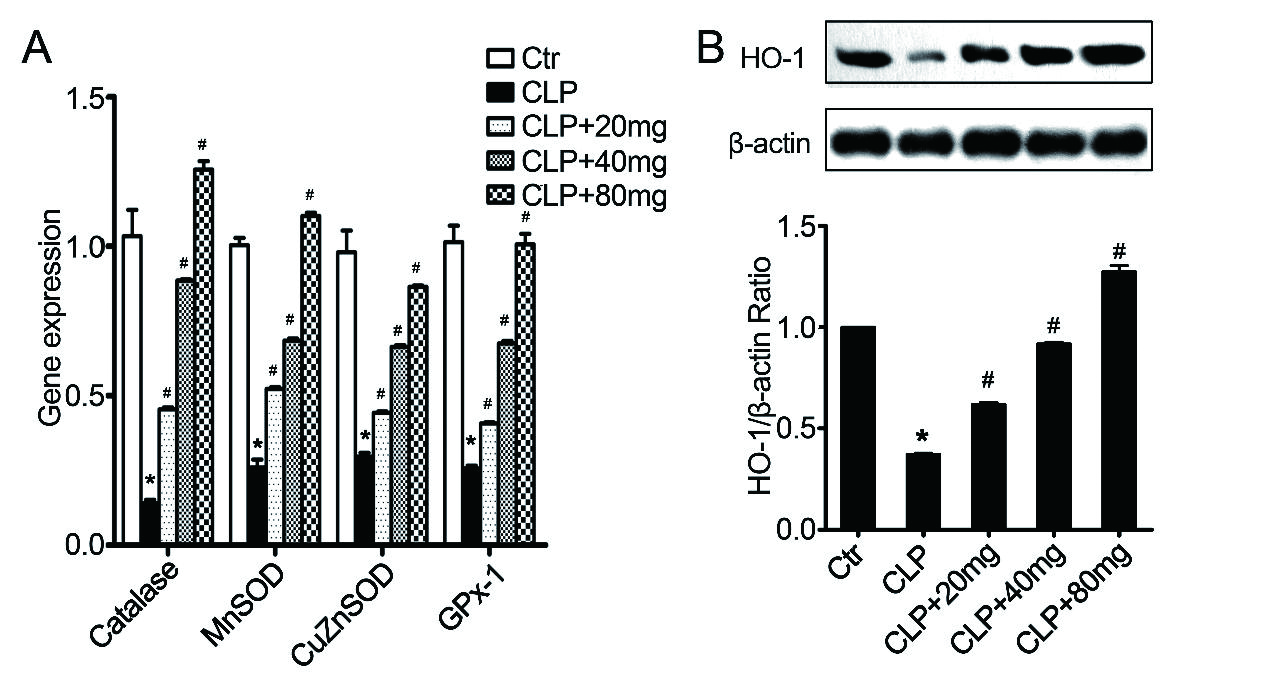
|
| A:抗氧化酶(AOEs)的mRNA水平。B:肺组织中血红素加氧酶1(HO-1)的蛋白水平。n= 10 /组,与对照组相比,aP < 0.05;与脓毒症诱导的ALI组相比,bP < 0.05 图 6 木犀草素对小鼠肺组织中抗氧化酶表达的影响 Fig 6 Effect of luteolin on the expression of antioxidant enzymes in lung tissue |
|
|
天然免疫的激活可以有效对抗感染,但不受控制的炎症可导致组织损伤[44]。NF-κB通路调节多种促炎介质(如TNF-α,iNOS和COX-2 [45])的转录,参与引发肺部炎症。脓毒症诱导可以增加NF-κBp65的水平(图 7)。木犀草素处理则抑制脓毒症小鼠肺组织中NF-κBp65的表达(图 7A)。另外,木犀草素是否可以抑制IκB-α磷酸化来抑制脓毒症诱导的NF-κB活化(图 7B)。与脓毒症小鼠相比,木犀草素预处理显著抑制IκB-α磷酸化。这些结果表明,木犀草素的抗炎活性可能与抑制体内NF-κB通路的激活有关。
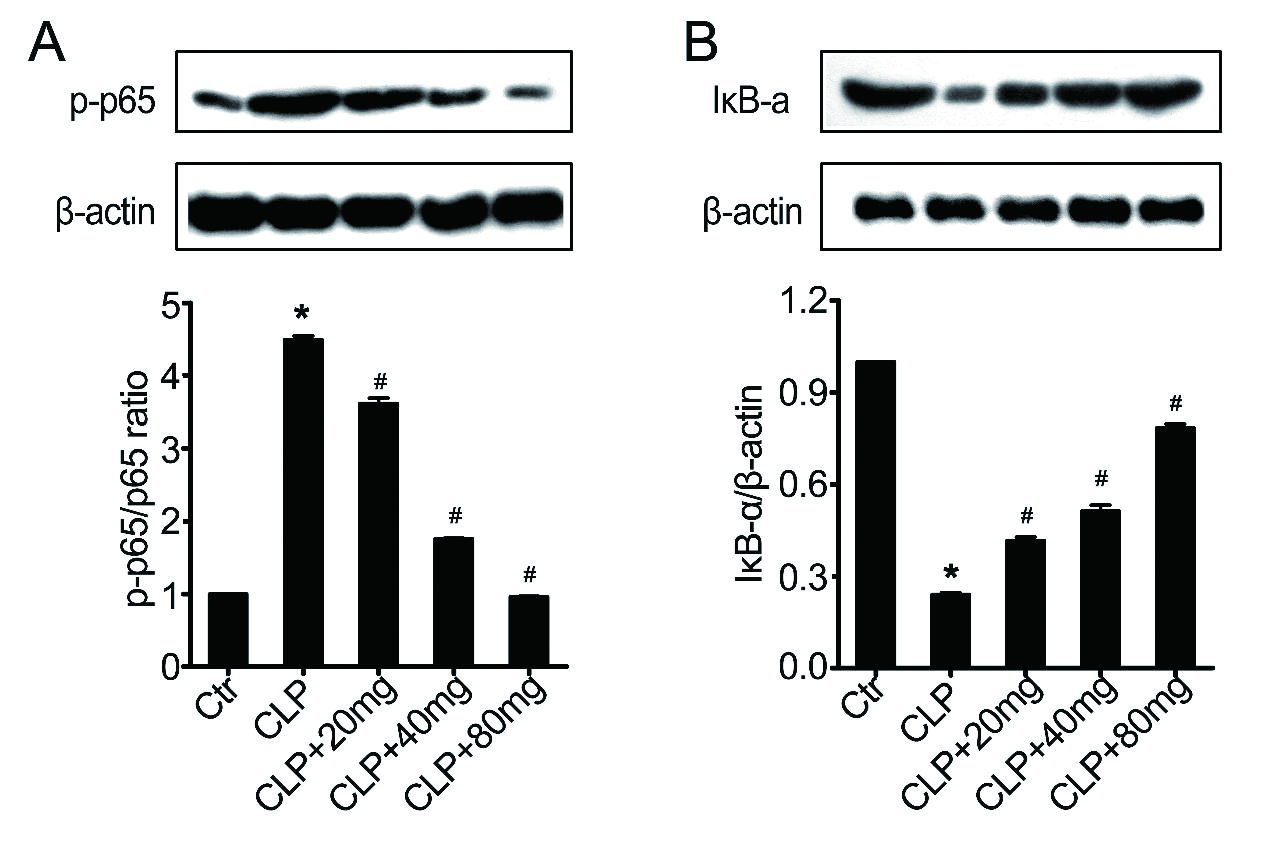
|
| A:NF-κB p65表达。B:IκB-α的磷酸化。n= 10 /组,与与对照组相比,aP < 0.05;与脓毒症诱导的ALI组相比,bP < 0.05 图 7 木犀草素对脓毒症小鼠中NF-κB途径活化的影响 Fig 7 Effect of luteolin on activation of NF-κB pathway in septic mice |
|
|
NF-κB信号通路对脓毒症诱导的炎症反应至关重要[46]。为了进一步研究木犀草素对体外NF-κB活化的影响,使用RAW264.7细胞研究了木犀草素对体外NF-κB p65 DNA结合活性的影响。MTT检测表明,木犀草素在100 μg的浓度下对细胞增殖没有影响(图 8A)。木犀草素预处理显著抑制LPS诱导的NF-κB p65的DNA结合活性。这些数据表明,木犀草素可能通过抑制NF-κB p65的DNA结合活性来抑制LPS诱导的肺组织炎症损伤。
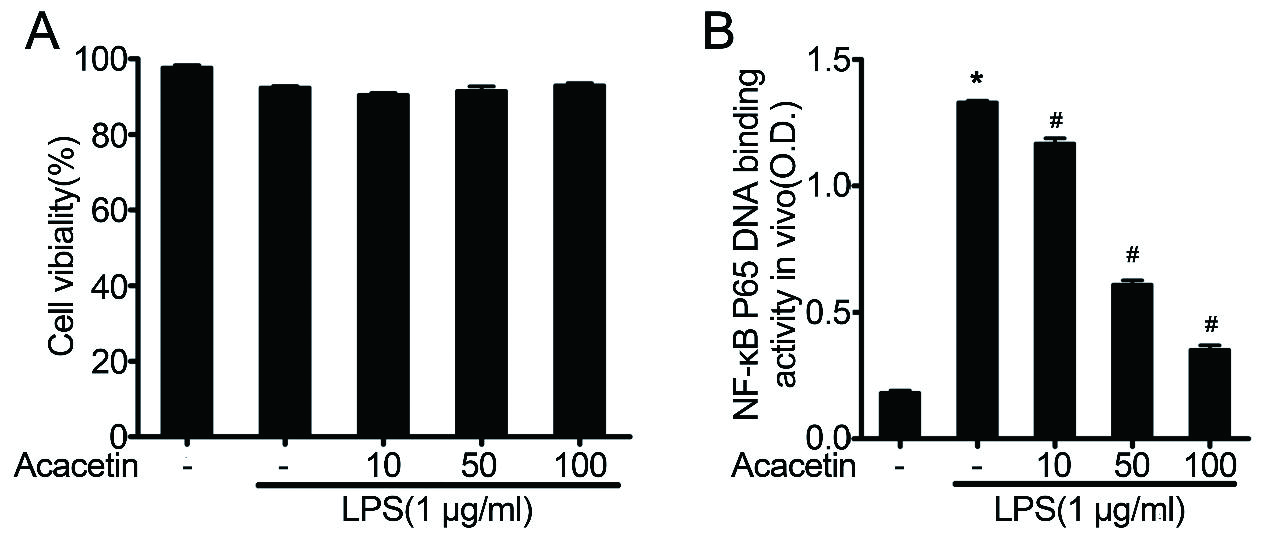
|
| A:木犀草素对LPS诱导的RAW264.7细胞活力的影响。B:木犀草素对LPS诱导的RAW264.7细胞中NF-κB的DNA结合活性的影响。与对照组相比,aP < 0.05;与脓毒症诱导的ALI组相比,bP < 0.05 图 8 8木犀草素对体外NF-κB的DNA结合活性的影响 Fig 8 Effect of luteolin on DNA binding activity of NF-κB |
|
|
本研究表明,木犀草素可以显著抑制脓毒症诱导的ALI,以及iNOS和COX-2的表达,且随着浓度升高,木犀草素的保护作用愈加明显。此外,本研究表明木犀草素可能通过抗氧化抗炎活性、增强AOEs的表达、介导体内NF-κB信号传导途径的失活,发挥对脓毒症诱导的ALI的保护作用。肺泡-毛细血管屏障的破坏导致ALI中肺气体交换的阻塞。中性粒细胞活化增加脓毒症诱导的肺泡-毛细血管屏障通透性并导致活性氧(ROS)的产生,是屏障破坏的潜在机制之一。此外,脓毒症可以诱导肺部ROS产生,并且ROS可以增加局部炎症,从而导致肺组织损伤[47]。虽然天然免疫系统需要适量的ROS来杀死病原体,但过量的ROS会引起有害影响,包括肺组织损伤、细胞凋亡和坏死[15]。因此,注射SOD可以保护小鼠免受病毒感染或脓毒症诱导的ALI [48]。本研究证明了木犀草素可以显著减轻了脓毒症诱导的小鼠肺损伤病理变化,湿-干质量比,BALF中的蛋白浓度,ALI小鼠肺中的MPO活性,炎性细胞浸润和促炎细胞因子产生。这些结果表明,木犀草素可能在脓毒症诱导的ALI中具有潜在的治疗功效。
不受控制的氧化应激在脓毒症诱导的ALI中起重要作用[49],木犀草素可以降低iNOS和COX-2的表达,并增加了HO-1和AOEs的表达,通过发挥其抗氧化活性减轻脓毒症诱导的ALI。
抑制肺部炎症对于治疗脓毒症诱导的肺损伤至关重要。肺部炎症反应和水肿与肺功能正相关,包括气道压力和氧合指数。此外,TNF-α,IL-1β,IL-6和MIP-2是有效的促炎因子,在ALI期间在炎症反应的起始和扩增中起作用[50]。如本研究所示,抑制促炎因子的产生可减少脓毒症诱导的ALI小鼠模型中的肺损伤。NF-κB是一种重要的转录因子,它介导炎症细胞分泌促炎因子,如TNF-α和IL-6。此外,已证实NF-κB的核内阻断可抑制iNOS [51]和COX-2的表达[52]。因此,目前几种抗炎疗法靶向NF-κB活性。在本研究中,木犀草素在体内和体外显著阻断了LPS刺激的NF-κB活化。
| [1] | Matthay MA, Zemans RL. The acute respiratory distress syndrome:pathogenesis and treatment[J]. Annu Rev Pathol, 2011, 6: 147-163. DOI:10.1146/annurev-pathol-011110-130158 |
| [2] | Matthay MA, Ware LB, Zimmerman GA. The acute respiratory distress syndrome[J]. J Clin Invest, 2012, 122(8): 2731-2740. DOI:10.1001/jama.2012.6761 |
| [3] | Levy MM, Fink MP, Marshall JC, et al. 2001 SCCM/ESICM/ACCP/ATS/SIS International Sepsis Definitions Conference[J]. Crit Care Med, 2003, 31(4): 1250-1256. DOI:10.1097/01.CCM.0000050454.01978.3B |
| [4] | Bone RC, Balk RA, Cerra FB, et al. Definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis. The ACCP/SCCM Consensus Conference Committee. American College of Chest Physicians/Society of Critical Care Medicine[J]. Chest, 1992, 101(6): 1644-1655. DOI:10.1378/chest.101.6.1644 |
| [5] | Weber GF, Swirski FK. Immunopathogenesis of abdominal sepsis[J]. Langenbecks Arch Surg, 2014, 399(1): 1-9. DOI:10.1007/s00423-013-1129-7 |
| [6] | Hargreaves DC, Medzhitov R. Innate sensors of microbial infection[J]. J Clin Immunol, 2005, 25(6): 503-510. DOI:10.1007/s10875-005-8065-4 |
| [7] | Hamza M, Wang XM, Wu T, et al. Nitric oxide is negatively correlated to pain during acute inflammation[J]. Mol Pain, 2010, 6: 55. DOI:10.1186/1744-8069-6-55 |
| [8] | Hossain M, Qadri SM, Liu L. Inhibition of nitric oxide synthesis enhances leukocyte rolling and adhesion in human microvasculature[J]. J Inflamm (Lond), 2012, 9(1): 28. DOI:10.1186/1476-9255-9-28 |
| [9] | Sharma JN, Al-Omran A, Parvathy SS. Role of nitric oxide in inflammatory diseases[J]. Inflammopharmacology, 2007, 15(6): 252-259. DOI:10.1007/s10787-007-0013-x |
| [10] | Parratt JR. Nitric oxide. A key mediator in sepsis and endotoxaemia?[J]. J Physiol Pharmacol, 1997, 48(4): 493-506. |
| [11] | Fukunaga K, Kohli P, Bonnans C, et al. Cyclooxygenase 2 plays a pivotal role in the resolution of acute lung injury[J]. J Immunol, 2005, 174(8): 5033-5039. DOI:10.4049/jimmunol.174.8.5033 |
| [12] | Zhang LN, Zheng JJ, Zhang L, et al. Protective effects of asiaticoside on septic lung injury in mice[J]. Exp Toxicol Pathol, 2011, 63(6): 519-525. DOI:10.1016/j.etp.2010.04.002 |
| [13] | Huang ZF, Massey JB, Via DP. Differential regulation of cyclooxygenase-2 (COX-2) mRNA stability by interleukin-1 beta (IL-1 beta) and tumor necrosis factor-alpha (TNF-alpha) in human in vitro differentiated macrophages[J]. Biochem Pharmacol, 2000, 59(2): 187-194. |
| [14] | Serou MJ, DeCoster MA, Bazan NG. Interleukin-1 beta activates expression of cyclooxygenase-2 and inducible nitric oxide synthase in primary hippocampal neuronal culture:platelet-activating factor as a preferential mediator of cyclooxygenase-2 expression[J]. J Neurosci Res, 1999, 58(4): 593-598. DOI:10.1002/(SICI)1097-4547(19991115)58:4<>1.0.CO;2-# |
| [15] | Grommes J, Soehnlein O. Contribution of neutrophils to acute lung injury[J]. Mol Med, 2011, 17(3/4): 293-307. DOI:10.2119/molmed.2010.00138 |
| [16] | Mann JR, Backlund MG, DuBois RN. Mechanisms of disease:Inflammatory mediators and cancer prevention[J]. Nat Clin Pract Oncol, 2005, 2(4): 202-210. DOI:10.1038/ncponc0140 |
| [17] | Tak PP, Firestein GS. NF-kappaB:a key role in inflammatory diseases[J]. J Clin Invest, 2001, 107(1): 7-11. |
| [18] | Kretz-Remy C, Arrigo AP. Selenium:a key element that controls NF-kappa B activation and I kappa B alpha half life[J]. Biofactors, 2001, 14(1-4): 117-125. DOI:10.1002/biof.v14:1/4 |
| [19] | Nabavi SF, Braidy N, Gortzi O, et al. Luteolin as an anti-inflammatory and neuroprotective agent:A brief review[J]. Brain Research Bulletin, 2015, 119(PtA): 1-11. DOI:10.1016/j.brainresbull.2015.09.002 |
| [20] | Lin Y, Shi R, Wang X, et al. Luteolin, a flavonoid with potentials for cancer prevention and therapy[J]. Curr Cancer Drug Targets, 2008, 8(7): 634-646. DOI:10.2174/156800908786241050 |
| [21] | Jang S, Kelley KW, Johnson RW. Luteolin Reduces IL-6 Production in Microglia by Inhibiting JNK Phosphorylation and Activation of AP-1[J]. Proc Natl Acad Sci U S A, 2008, 105(21): 7534-7539. DOI:10.1073/pnas.0802865105 |
| [22] | Kimata M, Shichijo M, Miura T, et al. Effects of luteolin, quercetin and baicalein on immunoglobulin E-mediated mediator release from human cultured mast cells[J]. Clin Exp Allergy, 2000, 30(4): 501-508. DOI:10.1046/j.1365-2222.2000.00768.x |
| [23] | Seelinger G, Merfort I, Wölfle U, et al. Anti-carcinogenic effects of the flavonoid luteolin[J]. Molecules, 2008, 13(10): 2628-2651. DOI:10.3390/molecules13102628 |
| [24] | Ko WG, Kang TH, Lee SJ, et al. Effects of luteolin on the inhibition of proliferation and induction of apoptosis in human myeloid leukaemia cells[J]. Phytother Res, 2002, 16(3): 295-298. DOI:10.1002/ptr.871 |
| [25] | Chen CY, Peng WH, Tsai KD, et al. Luteolin suppresses inflammation-associated gene expression by blocking NF-κB and AP-1 activation pathway in mouse alveolar macrophages[J]. Life Sci, 2007, 81(23/24): 1602-1614. DOI:10.1016/j.lfs.2007.09.028 |
| [26] | Xagorari A, Roussos C, Papapetropoulos A. Inhibition of LPS-stimulated pathways in macrophages by the flavonoid luteolin[J]. Br J Pharmacol, 2002, 136(7): 1058-1064. DOI:10.1038/sj.bjp.0704803 |
| [27] | Rittirsch D, Huber-Lang MS, Flierl MA, et al. Immunodesign of experimental sepsis by cecal ligation and puncture[J]. Nat Protoc, 2009, 4(1): 31-36. DOI:10.1038/nprot.2008.214 |
| [28] | Kuo MY, Liao MF, Chen FL, et al. Luteolin attenuates the pulmonary inflammatory response involves abilities of antioxidation and inhibition of MAPK and NFkappaB pathways in mice with endotoxin-induced acute lung injury[J]. Food Chem Toxicol, 2011, 49(10): 2660-2666. DOI:10.1016/j.fct.2011.07.012 |
| [29] | Nishina K, Mikawa K, Takao Y. ONO-5046, an elastase inhibitor, attenuates endotoxin-induced acute lung injury in rabbits[J]. Anesth Analg, 1997, 84(5): 1097-1103. DOI:10.1213/00000539-199705000-00026 |
| [30] | Abraham E. Neutrophils and acute lung injury[J]. Crit Care Med, 2003, 31(4 Suppl): S195-199. DOI:10.1097/01.CCM.0000057843.47705.E8 |
| [31] | Zhou X, Dai Q, Huang X. Neutrophils in acute lung injury[J]. Front Biosci (Landmark Ed), 2012, 17: 2278-2283. https://www.ncbi.nlm.nih.gov/pubmed/22652778 |
| [32] | McCabe AJ, Dowhy M, Holm BA, et al. Myeloperoxidase activity as a lung injury marker in the lamb model of congenital diaphragmatic hernia[J]. J Pediatr Surg, 2001, 36(2): 334-337. DOI:10.1053/jpsu.2001.20709 |
| [33] | Bhatia M, Moochhala S. Role of inflammatory mediators in the pathophysiology of acute respiratory distress syndrome[J]. J Pathol, 2004, 202(2): 145-156. DOI:10.1002/path.1491 |
| [34] | Cribbs SK, Matthay MA, Martin GS. Stem cells in sepsis and acute lung injury[J]. Crit Care Med, 2010, 38(12): 2379-2385. DOI:10.1097/CCM.0b013e3181f96f5f |
| [35] | Goodman RB, Pugin J, Lee JS, et al. Cytokine-mediated inflammation in acute lung injury[J]. Cytokine Growth Factor Rev, 2003, 14(6): 523-535. DOI:10.1016/S1359-6101(03)00059-5 |
| [36] | Jinzhou Z, Tao H, Wensheng C, et al. Cyclooxygenase-2 suppresses polymorphonuclear neutrophil apoptosis after acute lung injury[J]. J Trauma, 2008, 64(4): 1055-1060. DOI:10.1097/TA.0b013e318047c07c |
| [37] | Kung CW, Lee YM, Cheng PY, et al. Ethyl pyruvate reduces acute lung injury via regulation of iNOS and HO-1 expression in endotoxemic rats[J]. J Surg Res, 2011, 167(2): e323-331. DOI:10.1016/j.jss.2011.01.006 |
| [38] | Peng X, Abdulnour RE, Sammani S, et al. Inducible nitric oxide synthase contributes to ventilator-induced lung injury[J]. Am J Respir Crit Care Med, 2005, 172(4): 470-479. DOI:10.1164/rccm.200411-1547OC |
| [39] | Speyer CL, Neff TA, Warner RL, et al. Regulatory effects of iNOS on acute lung inflammatory responses in mice[J]. Am J Pathol, 2003, 163(6): 2319-2328. DOI:10.1016/S0002-9440(10)63588-2 |
| [40] | FitzGerald GA. COX-2 and beyond:Approaches to prostaglandin inhibition in human disease[J]. Nat Rev Drug Discov, 2003, 2(11): 879-890. DOI:10.1038/nrd1225 |
| [41] | Wilgus TA, Ross MS, Parrett ML, et al. Topical application of a selective cyclooxygenase inhibitor suppresses UVB mediated cutaneous inflammation[J]. Prostaglandins Other Lipid Mediat, 2000, 62(4): 367-384. DOI:10.1016/S0090-6980(00)00089-7 |
| [42] | Bhaskaran N, Srivastava JK, Shukla S, et al. Chamomile confers protection against hydrogen peroxide-induced toxicity through activation of Nrf2-mediated defense response[J]. Phytother Res, 2013, 27(1): 118-125. DOI:10.1002/ptr.4701 |
| [43] | Gong Q, Yin H, Fang M, et al. Heme oxygenase-1 upregulation significantly inhibits TNF-alpha and Hmgb1 releasing and attenuates lipopolysaccharide-induced acute lung injury in mice[J]. Int Immunopharmacol, 2008, 8(6): 792-798. DOI:10.1016/j.intimp.2008.01.026 |
| [44] | Wallach D, Kang TB, Kovalenko A. Concepts of tissue injury and cell death in inflammation:a historical perspective[J]. Nat Rev Immunol, 2014, 14(1): 51-59. DOI:10.1038/nri3561 |
| [45] | Surh YJ, Chun KS, Cha HH, et al. Molecular mechanisms underlying chemopreventive activities of anti-inflammatory phytochemicals:down-regulation of COX-2 and iNOS through suppression of NF-kappa B activation[J]. Mutat Res, 2001, 480-481: 243-268. DOI:10.1016/S0027-5107(01)00183-X |
| [46] | Liao Z, Dong J, Wu W, et al. Resolvin D1 attenuates inflammation in lipopolysaccharide-induced acute lung injury through a process involving the PPARgamma/NF-kappaB pathway[J]. Respir Res, 2012, 13: 110. DOI:10.1186/1465-9921-13-110 |
| [47] | Geerts L, Jorens PG, Willems J, et al. Natural inhibitors of neutrophil function in acute respiratory distress syndrome[J]. Crit Care Med, 2001, 29(10): 1920-1924. DOI:10.1097/00003246-200110000-00012 |
| [48] | Maeda H, Akaike T. Oxygen free radicals as pathogenic molecules in viral diseases[J]. Proc Soc Exp Biol Med, 1991, 198(2): 721-727. DOI:10.3181/00379727-198-43309C |
| [49] | Shah NR, Iqbal MB, Barlow A, et al. Severe physical exertion, oxidative stress, and acute lung injury[J]. Clin J Sport Med, 2011, 21(6): 537-538. DOI:10.1097/JSM.0b013e318235151e |
| [50] | Cannizzaro V, Hantos Z, Sly PD, et al. Linking lung function and inflammatory responses in ventilator-induced lung injury[J]. Am J Physiol Lung Cell Mol Physiol, 2011, 300(1): L112-120. DOI:10.1152/ajplung.00158.2010 |
| [51] | Hatano E, Bennett BL, Manning AM, et al. NF-kappaB stimulates inducible nitric oxide synthase to protect mouse hepatocytes from TNF-alpha-and Fas-mediated apoptosis[J]. Gastroenterology, 2001, 120(5): 1251-1262. DOI:10.1053/gast.2001.23239 |
| [52] | Ke J, Long X, Liu Y, et al. Role of NF-kappaB in TNF-alpha-induced COX-2 expression in synovial fibroblasts from human TMJ[J]. J Dent Res, 2007, 86(4): 363-367. DOI:10.1177/154405910708600412 |
 2019, Vol. 28
2019, Vol. 28




