2 南京医科大学第一附属医院神经内科 210029;
3 南京医科大学公共卫生学院卫生毒理系,现代毒理学教育部重点实验室 211166
2 Department of Neurology, the First Affiliated Hospital of Nanjing Medical University, Nanjing 210029, China;
3 Key Lab of Modern Toxicology (NJMU), Ministry of Education, Department of Toxicology, School of Public Health, Nanjing Medical University, Nanjing 211166, China
百草枯(paraquat,PQ)是一种对人类等哺乳动物有剧毒的化合物,我国尽管已经限制了PQ液体剂型的销售,但仍存在已售农药的中毒问题以及PQ与其他农药混配导致的中毒情况[1]。已知PQ摄入人体后,主要在肺中聚集,引起急性肺损伤和快速肺纤维化,病死率极高[2]。研究发现,上皮间充质细胞转分化(epithelial-mesenchymal transition,EMT)过程中参与了PQ引起的肺纤维化,表现为小鼠肺组织内肺泡上皮细胞标记物SPC与间充质细胞标记物α-SMA共表达,可能是PQ致快速肺纤维化的机制之一[3]。N-乙酰半胱氨酸(N-Acetyl-cysteine,NAC)具有清除自由基的特性,是临床上常用的抗氧化剂,被认为是一种安全且耐受良好的辅助药物[4]。NAC是体内还原型谷胱甘肽(glutathione,GSH)的前体,具有抗氧化和强效抗炎作用[5]。在肾、肝、肾上腺、肺、脑组织中,NAC通过半胱氨酸载体介导机制实现主动转运[6]。NAC在修复过程中具有增强细胞增殖、促进细胞迁移和创面愈合等多种功能[7]。在大鼠肾上腺嗜铬细胞瘤细胞(PC-12)中,NAC可以通过抗氧化和增强线粒体功能减轻PQ引起的细胞自噬[8]。另外,NAC可通过激活Wnt信号通路减轻PQ所致的神经毒性[9]。中国专家共识[10]和韩国指南[11]均建议PQ中毒患者使用NAC治疗。然而,NAC在PQ所致肺损伤及肺纤维化中的保护机制尚未完全阐明。本研究通过体外细胞实验,观察TGF-β1, EMT相关指标E-cad和α-SMA在PQ致A549细胞转分化过程中的改变和NAC在此过程中的保护作用,进而为临床PQ中毒致肺纤维化的治疗提供理论依据和潜在治疗靶点。
1 材料与方法 1.1 A549细胞EMT模型的建立人非小细胞肺癌细胞(A549)购于中国科学院细胞库,A549细胞在培养箱(37 ℃、含5% CO2)中,按2×103/mL的密度接种,培养在含10%胎牛血清(Sciencell,美国)的1640培养基(Gibco,美国)中,待细胞贴壁后,用不同浓度(10、30、50 μmol/L)PQ持续刺激A549细胞0、2、4和6 d。实验中所用A549细胞均为生长状态良好的对数生长期细胞。
1.2 NAC对于A549细胞的预处理A549细胞按8×103/mL的密度接种,24 h后,10 mmol/L NAC孵育2 h,应用30 μmol/L PQ刺激A549细胞4 d。
1.3 A549细胞形态学检测待造模完成后,将培养皿置于光学显微镜(Nikon DS-U3)下观察不同条件下A549细胞形态学改变,NIS-Elements软件拍照。
1.4 A549细胞RT-q PCR在A549细胞中加入1 mL RNAiso Plus(TaKara,日本),加入200 μL氯仿充分震荡后,室温静置5 min,离心(12 000 g,4℃,15 min)取上清,在上清中加入等体积异丙醇,混匀后室温静置10 min,离心(12 000 g,4℃,15 min)弃上清,加入75 %乙醇,轻微震荡后离心(7 500 g,4 ℃,5 min)弃上清,静置10 min待乙醇挥发后加入适量DEPC水溶解RNA。按照PrimeScriptTM RTMaster Mix(TaKara,日本)试剂盒说明书进行逆转录,按照SYBR® Premix Ex TaqTM Ⅱ(TaKara,日本)试剂盒说明书进行RT-qPCR。RT-qPCR过程中所有引物均由上海捷瑞公司设计,由南京擎科生物科技有限公司合成(表 1)。根据溶解曲线和扩增曲线得知引物特异性和扩增效率。结果计算和分析以GAPDH作为内参基因采用2-ΔΔCT法。
| 种属 | 检测指标 | 正向引物序列(5’-3’) | 反向引物序列(5’-3’) | |
| 人 | E-cadherin | ATGCTGATGCCCCCAATACC | GCTGCTTGGCCTCAAAATCC | |
| 人 | α-SMA | GACGCCTGCTCCAAGAATTG | GTCAAGCCGGACACAACGAT | |
| 人 | GAPDH | GGACCTGACCTGCCGTCTAG | GTAGCCCAGGATGCCCTTGA | |
在A549细胞中加入适量ripa(sigma,美国)充分裂解20 min后离心(12 000 r/min,4 ℃,10 min),取上清,测定蛋白浓度(BCA法),加入1/4(v/v)的上样缓冲液,混匀后充分变性蛋白(100 ℃,5 min)。后将含有20 μg总蛋白的蛋白样品加入至加样孔中进行SDS-PAGE电泳。当溴酚蓝到达胶的底端处附近时结束电泳,使用Bio-Rad标准湿式转膜装置转膜(300 mA,60 min,冰浴)至0.2 μM的PVDF微孔膜(Millipore,美国)。转模结束后,将PVDF膜放置在TBST中,漂洗2 min,后用封闭液(含5 %脱脂奶粉的TBST)室温封闭1 h。封闭结束后,按照相应比例用稀释液(含5 %脱脂奶粉的TBST)稀释一抗(E-cadherin,CST #14472,1:1 000;α-SMA,Bioss bs-10196R,1:5 000;TGF-β,CST #3711,1:1 000;β-tubulin,Selleck A5032,1:1 000),4 ℃轻微摇晃孵育过夜。用TBST洗涤PVDF膜(5 min×3次)。后用封闭液稀释二抗HRP Goat Anti-Rabbit IgG(Jacksonimmuno,美国),室温轻微振荡孵育1 h,用TBST洗涤PVDF膜(5 min×3次)。将发光液均匀滴到PVDF膜上,置于Bio-rad凝胶成像系统成像,成像结果使用Image J软件扫描分析灰度值。
1.6 统计学方法运用Graphpad Prime 6软件进行数据统计分析。本实验数据经收集整理后以均数±标准差(Mean±SD)表示,多组数据比较选择单因素方差分析(One-Way ANOVA)检验,以P<0.05差异具有统计学意义。
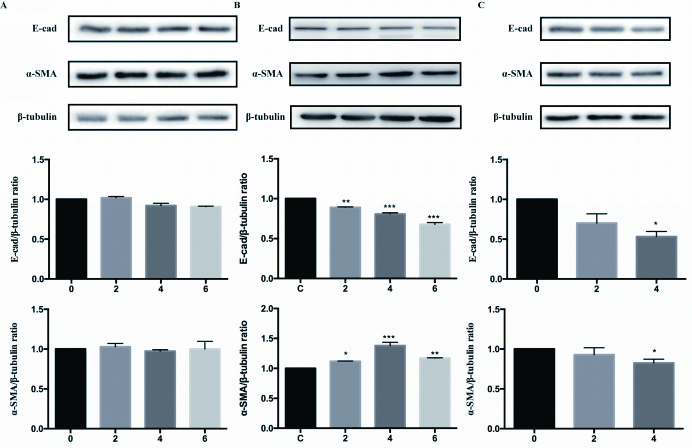
2 结果 2.1 时间梯度及浓度梯度下PQ诱导A549细胞EMT模型的建立分别应用10、30、50 μmol/L PQ持续刺激A549细胞2、4、6 d。收获细胞,检测EMT指标E-cadherin和α-SMA的蛋白表达水平。如图 1所示,10 μmol/L PQ时,E-cadherin和α-SMA的蛋白表达水平均差异无统计学意义。30 μmol/L PQ时,与对照组相比,α-SMA的蛋白水平表达在4 d时显著升高,E-cadherin的蛋白水平表达显著下降,证明A549细胞发生了EMT。50 μmol/L PQ时,A549细胞在PQ刺激6 d时死亡,故无法检测。但检测2 d和4 d的蛋白时,发现E-cadherin和α-SMA的蛋白表达水平在2 d时差异无统计学意义,在4 d时都显著下降。因此,本实验选择30 μmol/L PQ刺激A549细胞4 d建立EMT模型。
|
| A:10 μmol/L PQ分别暴露A549细胞2、4、6 d E-cadherin和α-SMA蛋白表达结果及统计图;B:30 μmol/L PQ分别暴露A549细胞2、4、6 d E-cadherin和α-SMA蛋白表达结果及统计图;C:50 μmol/L PQ分别暴露A549细胞2,4 d E-cadherin和α-SMA蛋白表达结果及统计图;与对照组比较,aP < 0.05,bP < 0.01 图 1 PQ浓度梯度和时间梯度暴露对A549细胞E-cadherin,α-SMA蛋白水平的影响 Fig 1 E-cadherin and α-SMA protein expression mediated by dose-dependent and time-dependent manner of PQ |
|
|
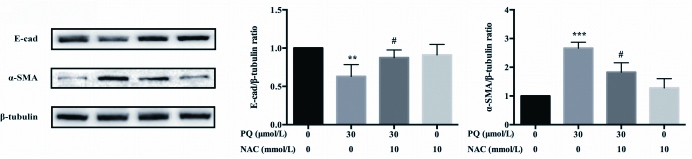
如图 2所示,预孵10 mM NAC 2 h后,与PQ组相比,NAC+PQ组的E-cadherin蛋白水平表达显著升高,α-SMA的蛋白水平表达显著下降。提示NAC可以有效逆转PQ刺激A549细胞产生的EMT。
|
| 10 mmol/L NAC预孵育2 h对PQ暴露A549细胞E-cadherin和α-SMA蛋白表达结果及统计图;与对照组比较,aP < 0.05,bP < 0.01;与PQ组比较,cP < 0.05,dP < 0.01 图 2 2 NAC预处理对PQ诱导A549细胞EMT过程的影响 Fig 2 Changes of NAC pretreatment in the process of PQ-induced EMT in A549 cells |
|
|
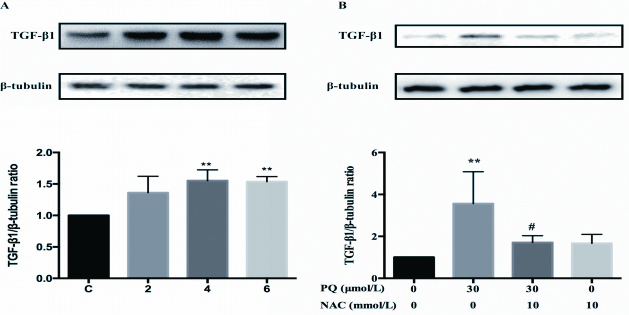
如图 3所示,与对照组相比,TGF-β1的蛋白水平表达在4 d时显著升高。预孵10 mmol/L NAC 2 h后,PQ染毒4 d,与PQ组相比,TGF-β1的蛋白水平表达显著下降,提示NAC通过抑制TGF-β1的表达抑制了PQ刺激A549细胞产生的EMT。
|
| A:30 μmol/L PQ在不同时间点暴露于A549细胞TGF-β1蛋白水平的表达趋势; B:10 m mol/L NAC预孵2 h,30 μmol/L PQ刺激A549细胞4 d TGF-β1蛋白水平的表达趋势; 与对照组比较,aP < 0.05,bP < 0.01;与PQ组比较,cP < 0.05,dP < 0.01 图 3 TGF-β1蛋白水平的表达趋势 Fig 3 TGF-β1 protein expression |
|
|
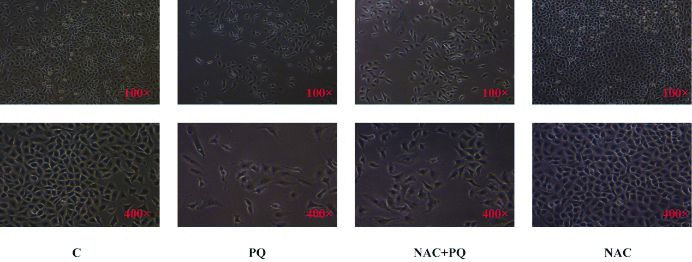
光镜下形态学结果表明,对照组A549细胞表现出鹅卵石样的上皮细胞外观特征,PQ组A549细胞表现出纺锤形的间质细胞样外观特征,也证明A549细胞发生了EMT。与PQ组相比,NAC+PQ组的细胞形态仍保持上皮细胞鹅卵石样的形态,纺锤形的间质样细胞形态的数量明显减少,表明PQ引起的EMT被部分逆转。提示NAC能够有效逆转在PQ刺激A549细胞引起的EMT, 见图 4。
|
| 图 4 A549细胞形态学改变 Fig 4 morphological changes of A549 cells |
|
|
本研究结果表明,PQ作用于A549细胞可以引起EMT。TGF-β1参与了A549细胞暴露于PQ产生的EMT,NAC的应用可以逆转EMT。PQ可以诱导A549细胞EMT的发生。本研究表明30μmol/L PQ持续刺激A549细胞4 d诱导细胞发生EMT。6 d时,EMT的两个主要标记蛋白——E-cadherin和α-SMA同时下降,意味着细胞在PQ的持续刺激过程中,由于PQ的毒性作用细胞死亡[2]。同时,形态学显示PQ暴露4 d,A549细胞数量有所减少,这可能是由于EMT过程中细胞周期进程的短暂衰减所致[12-13]。
PQ被人体摄入后,通过氧化应激机制产生毒性作用,主要引起呼吸衰竭而死亡[1-2]。临床上对PQ中毒的创新治疗主要体现在抗氧化剂的应用上[11]。PQ主要在肺部积聚,尤其是在人支气管上皮细胞以及肺泡I型和Ⅱ型上皮细胞中,导致急性肺损伤和肺纤维化[14]。多项研究表明,TGF-β可以诱导细胞产生EMT[15]。本实验结果进一步证明PQ诱导TGF-β1的过表达引起了A549细胞EMT的发生。
谷胱甘肽是一种重要的抗氧化剂,是活细胞中最丰富的非蛋白硫醇,其水平通常被用作判断细胞抗氧化能力的指标[16]。研究表明,在PQ处理的大鼠肺组织中,谷胱甘肽的水平显著降低[17]。谷胱甘肽的水平与体内抗氧化作用密切相关。而且,在谷胱甘肽过氧化物酶转移酶敲除的大鼠中发现,PQ对该敲除鼠的毒性较野生型大鼠显著增加,但谷胱甘肽过氧化物酶可以有效抑制PQ对该敲除大鼠产生的毒性作用,表明谷胱甘肽过氧化物酶在PQ中毒的保护中起到关键性作用[11]。
急性PQ中毒后立即产生大量的活性氧,因此应静脉注射抗氧化剂,乙酰半胱氨酸和谷胱甘肽作为常用的抗氧化剂,由于缺乏药代动力学数据,乙酰半胱氨酸抑制活性氧的最佳浓度仍未可知。根据经验,50~70 mg/kg乙酰半胱氨酸静脉注射是安全的。在体外实验中发现,乙酰半胱氨酸抑制活性氧呈现明显的剂量依赖性,10 μM的乙酰半胱氨酸可以抑制约50 %由PQ引起的活性氧[11]。
NAC可以影响与氧化还原相关的细胞信号和转录通路,如PI3K/Akt,NF-κB,MAPK通路。氧化应激诱导的损伤通过激活信号通路导致生长停滞和细胞凋亡,NAC可以有效抑制此过程从而促进细胞的生长和存活,并能够减少细胞促炎因子的释放。而且,NAC作为一种黏液溶解剂可以降低痰液的黏度,使痰液液化,更容易咳出。这些作用可能在NAC的保护机制中发挥了重要的作用。本研究证明NAC可以显著抑制PQ暴露引起的EMT。
细胞抗氧化的主要机制是由过氧化物歧化酶,过氧化氢酶和谷胱甘肽过氧化物酶提供的酶,但目前尚无有效方法提高这些酶的活性。尽管在循环中可以检测到自由基,但是PQ中毒导致活性氧的产生是在细胞内,而不是细胞外[16]。例如羟自由基最初在细胞内生成,透过细胞膜扩散到细胞外。因此,最理想的抗氧化剂应可以透过细胞膜进入细胞内,但是,大部分抗氧化剂对细胞膜的通透性较低,如蛋白巯基,抗坏血酸和维生素E等。生理状态下,NAC可以透过细胞膜[6]。氧化还原循环,即肺部被供给大量电子和氧,这个过程是持续的。因此理论上不应该停止应用最佳剂量的抗氧化剂,直到氧化还原中断。然而,临床上确定抗氧化剂的最佳剂量,且持续应用高剂量的抗氧化剂相对困难[11]。动物实验可能可以进一步认证抗氧化剂的有效剂量。
| [1] | 孙宝迪, 袁雪丰, 聂时南. 临床需警惕与敌草快中毒伴随的百草枯中毒(附二例报告)[J]. 临床误诊误治, 2018, 31(4): 64-66. DOI:10.3969/j.issn.1002-3429.2018.04.020 |
| [2] | Yamada A, Aki T, Unuma K, et al. Paraquat induces epithelial-mesenchymal transition-like cellular response resulting in fibrogenesis and the prevention of apoptosis in human pulmonary epithelial cells[J]. PLoS One, 2015, 10(3): e0120192. DOI:10.1371/journal.pone.0120192 |
| [3] | Sun H, Chen J, Qian W, et al. Integrated long non-coding RNA analyses identify novel regulators of epithelial-mesenchymal transition in the mouse model of pulmonary fibrosis[J]. J Cell Mol Med, 2016, 20(7): 1234-1246. DOI:10.1111/jcmm.12783 |
| [4] | Yu CH, Jiang L, Wang Y, et al. Inhibition of erythroid differentiation of human leukemia K562 cells by n-acetylcysteine and ascorbic acid through downregulation of ROS[J]. Biomed Environ Sci, 2018, 31(3): 247-251. DOI:10.3967/bes2018.032 |
| [5] | Pirabbasi E, Shahar S, Manaf ZA, et al. Efficacy of ascorbic acid (vitamin C) and/N-Acetylcysteine (NAC) supplementation on nutritional and antioxidant status of male chronic obstructive pulmonary disease (COPD) patients[J]. J Nutr Sci Vitaminol (Tokyo), 2016, 62(1): 54-61. DOI:10.3177/jnsv.62.54 |
| [6] | Ortiz MS, Forti KM, Suarez Martinez EB, et al. Effects of antioxidant N-acetylcysteine against paraquat-induced oxidative stress in vital tissues of mice[J]. Int J Sci Basic Appl Res, 2016, 26(1): 26-46. |
| [7] | Tsai ML, Huang HP, Hsu JD, et al. Topical N-acetylcysteine accelerates wound healing in vitro and in vivo via the PKC/Stat3 pathway[J]. Int J Mol Sci, 2014, 15(5): 7563-7578. DOI:10.3390/ijms15057563 |
| [8] | Zhou Q, Zhang H, Wu Q, et al. Pharmacological manipulations of autophagy modulate paraquat-induced cytotoxicity in PC12 cells[J]. Int J Biochem Mol Biol, 2017, 8(2): 13-22. |
| [9] | Zhao L, Yan M, Wang X, et al. Modification of Wnt signaling pathway on paraquat-induced inhibition of neural progenitor cell proliferation[J]. Food Chem Toxicol, 2018, 121: 311-325. DOI:10.1016/j.fct.2018.08.064 |
| [10] | 中国医师协会急诊医师分会. 急性百草枯中毒诊治专家共识(2013)[J]. 中国急救医学, 2013, 33(6): 484-489. DOI:10.3969/j.issn.1002-1949.2013.6.002 |
| [11] | HW G, JR H, SH J, et al. Diagnostic and therapeutic approach for acute paraquat intoxication[J]. J Korean Me Sci, 2014, 29(11): 1441-1449. DOI:10.3346/jkms.2014.29.11.1441 |
| [12] | Mejlvang J, Kriajevska M, Vandewalle C, et al. Direct repression of cyclin D1 by SIP1 attenuates cell cycle progression in cells undergoing an epithelial mesenchymal transition[J]. Mol Biol Cell, 2007, 18(11): 4615-4624. DOI:10.1091/mbc.e07-05-0406 |
| [13] | Vega S, Morales AV, Ocana OH, et al. Snail blocks the cell cycle and confers resistance to cell death[J]. Genes Dev, 2004, 18(10): 1131-1143. DOI:10.1101/gad.294104 |
| [14] | Li G, Yuzhen L, Yi C, et al. DNaseI protects against Paraquat-induced acute lung injury and pulmonary fibrosis mediated by mitochondrial DNA[J]. Biomed Res Int, 2015: 386952. DOI:10.1155/2015/386952 |
| [15] | Matsuno K, Harada N, Harada S, et al. Combination of TWEAK and TGF-beta1 induces the production of TSLP, RANTES, and TARC in BEAS-2B human bronchial epithelial cells during epithelial-mesenchymal transition[J]. Exp Lung Res, 2019: 1-12. DOI:10.1080/01902148.2018.1522558 |
| [16] | Mitsopoulos P, Suntres ZE. Protective effects of liposomal N-acetylcysteine against paraquat-induced cytotoxicity and gene expression[J]. J Toxicol, 2011: 808967. DOI:10.1155/2011/808967 |
 2019, Vol. 28
2019, Vol. 28




