2 郑州大学生命科学院 450000;
3 郑州大学第一附属医院 ICU 450052
2 College of Life Sciences, Zhengzhou University, Zhengzhou 450000, China;
3 Intensive Care Unit, the First Affiliated Hospital of Zhengzhou University, Zhengzhou 450052, China
脑外伤发生率高,脑外伤后遗留的认知功能障碍仍会给家庭和社会带来沉重的经济负担和精神负担[1],目前尚无有效的治疗方法[2]。因此如何促进脑损伤后的认知功能恢复成为当今研究的难点和热点[3]。
表儿茶酸是黄烷醇的一种,广泛存在于红酒、茶、水果和蔬菜中,具有抗氧化、抗癌、改善神经功能障碍、心血管保护等作用,能激活机体氧化防御系统,具有神经保护的功能[4],能减轻缺血-再灌注大鼠的脑损伤[5]。神经细胞曾被认为是终末分化细胞,不具有再生能力。应用5-溴脱氧尿苷(5-bromo-2'-deoxyuridine,BrdU)标记,发现成人脑中也存在神经元细胞再生,此后,神经再生成为神经科学研究的热点[6]。在动物脑内的神经元再生,主要来自侧脑室的室管膜下层(subventricular zone of the dentate gyrus, SVZ)以及海马体齿状回颗粒下层(subgranular zone of the lateral ventricles, SGZ)。新生的神经元是由神经干/神经祖细胞(neural stem/progenitor cells,NPCs)分化而来[7]。SGZ内产生的新生神经元在分化的同时会逐渐迁移至临近的海马齿状回颗粒细胞层。成熟神经元变成齿状颗粒细胞成为兴奋性神经元,调控机体认知功能,因此促进脑损伤后SGZ区神经再生可改善机体认知功能[8]。本研究旨在观察表儿茶酸对脑损伤的治疗效果,并探究其可能的作用机制。
1 材料与方法 1.1 实验动物、材料及仪器实验用雄性C57BL/6小鼠购于北京维通利华实验动物技术有限公司[许可证号:SYXK(京)2006-0024],每组24只。TNF-α和IL-1β ELISA试剂盒(南京建成生物工程研究所),RNA提取试剂盒、反转录及实时定量PCR试剂盒(TaKaRa公司),EdU试剂盒(广州锐博生物科技有限公司),兔抗NeuN单克隆抗体(Cell Signal Technology公司),荧光二抗CY3(上海生工生物有限公司),PI(美国Sigma公司)。立体定位仪及颅脑打击器(深圳RWD公司),实时定量PCR仪(瑞士Roche公司),荧光显微镜(Leica公司),冰冻切片机(Leica公司)。
1.2 TBI模型的建立及分组采用自由落体打击法建立脑外伤动物模型。腹腔注射10%的水合氯醛(3 mL/kg)麻醉小鼠,麻醉后使用推毛器备皮,碘伏消毒,使用医用手术刀沿头皮中线纵切一长3 cm左右的切口,暴露右侧颅骨,前囟下1.5 mm、中线右1.5 mm处,使用环形钻暴露出一个直径3 mm左右的圆形骨窗,保证硬脑膜完整。把小鼠固定到立体定位仪上,打击头直径3 mm,速度6 m/s,深2 mm。医用棉签止血,骨蜡闭合骨窗后缝合。将实验小鼠随机(随机数字法)分为生理盐水处理脑损伤组(Vechile,Veh组)和EC治疗组(EC组)。脑损伤小鼠分为短期和长期观察,短期观察炎症因子TNF-α和IL-1β、神经营养因子和损伤部位细胞坏死情况,长期观察神经再生和神经认知功能。短期观察时,术后3 h EC组灌胃给予15 mg/kg EC的治疗,每天1次,连续3 d,长期观察连续7 d,Veh组给予等量生理盐水。
1.3 水迷宫实验(Morris water maze test,MWM)观察动物的学习记忆功能TBI后第24~28天利用Morris水迷宫检测小鼠的空间学习记忆能力[9]。水迷宫装置由一台轨迹跟踪摄像机、摄像机相联的计算机和一个圆形水池(直径1.2 m,深度0.6 m),在相对密闭,光照恒定的环境中进行实验。圆形水池内水温控制在22 ℃左右,水深0.5 m,水中混入牛奶,模糊小鼠视线。圆形水池平均分为Ⅰ、Ⅱ、Ⅲ、Ⅳ四个象限,平台直径15 cm,在第Ⅰ象限水下2 cm处。将小鼠面向池壁分别从4个不同象限中间的入水点放入水池,观察其90 s内能否到达平台,如果不能,则帮助其找到平台,让小鼠熟悉记忆平台位置。记录小鼠从四个入水点到达平台的平均时间和在平台象限停留的时间和总时间的比例,以此比较各组小鼠的学习记忆能力。
1.4 ELISA检测炎症因子使用ELISA试剂盒检测小鼠血清中炎症相关因子TNF-α和IL-1β的表达情况。TBI后第3天,麻醉小鼠后心脏取血,处死小鼠后取出小鼠脑组织,放入液氮中迅速冷冻备用。取出的血液室温静置过夜后离心吸取上清,按照ELISA试剂盒说明书操作步骤进行实验,每组3个重复。
1.5 神经营养因子的检测取TBI后3 d放置在液氮中的小鼠脑组织,切取部分损伤部位组织,使用RNA提取试剂盒提取RNA,反转录为cDNA,再根据qRT-PCR试剂盒说明书完成对脑源性神经营养因子(brain derived neurotrophic factor, BDNF)和神经生长因子(nerve growth factor,NGF)的检测,实验结果采用2-ΔΔCT进行计算。引物,BDNF:正向CATAGACAAAAGGCACTGGAACTC, 反向TAAGGGCCCCGAACATACGAT; NGF:正向TACAGGCAGAACCGTACACAGATAG, 反向CAGTGGGCTTCAGGGACAGA; 内参GAPDH:正向GGTGAAGGTCGGTGTGAAC, 反向CCTTGACTGTGCCGTTGAA。
1.6 细胞坏死的检测使用PI染色检测小鼠脑损伤部位坏死细胞数量[10]。脑损伤3 d后,在小鼠处死前1 h,给予小鼠腹腔注射0.4 mg/kg的PI。1 h后麻醉心脏取血,处死后取脑组织固定脱水,包埋后冰冻切片机切片,荧光显微镜下观察并拍照。
1.7 免疫荧光染色TBI后28 d,麻醉小鼠,预冷的磷酸盐缓冲液(PBS)和4%的多聚甲醛灌注后取脑组织,固定和脱水后,冰冻切片机切片。对切片进行免疫荧光染色,PBS洗片后转入含有0.05%吐温20的柠檬酸溶液中90 ℃孵育20 min,静置15 min恢复至室温,PBST(PBS+0.1% Triton 100)清洗3次,使用含有3%牛奶和5%山羊血清的PBST室温封闭2 h,孵育一抗(NeuN 1:200),37 ℃下2 h或者4 ℃过夜,PBST清洗3次,孵育荧光二抗(CY3 1:500)37 ℃下2 h,PBST清洗后中性树胶封片,荧光显微镜下观察并拍照。
1.8 EdU染色在TBI后24 h,给予小鼠腹腔注射EdU(50 mg/kg)[11],每天1次,连续3 d,第3次注射后4 h处死小鼠。取出脑组织,放入4%的多聚甲醛中固定过夜,再转移到25%和30%的蔗糖溶液中梯度脱水48 h,直到组织沉入试管底部。取出脑组织用OCT包埋,冰冻切片机切片,按照EdU显色试剂盒说明书步骤操作,然后用4', 6-diamidino-2-phenylindole (DAPI)染色显示细胞核,荧光显微镜观察拍照。
1.9 统计学方法所有数据均使用SPSS 21.0软件行统计分析,数据用均数±标准差(Mean±SD)表示。组间比较采用t检验,以P < 0.05为差异具有统计学意义。
2 结果本研究共使用C57BL/6小鼠50只,每组24只,所有小鼠中死亡2只,其中EC组1只,Veh组1只,死亡小鼠及时取出并造模补足。
2.1 EC能改善TBI小鼠的学习记忆能力通过统计小鼠在平台象限停留时间(表 1)和逃逸潜伏期(表 2)来评价小鼠的学习记忆能力。在TBI后第27、28天,EC治疗组中小鼠在正确象限的时间明显高于Veh组(F=23.60,P < 0.05)。此外,经EC治疗后,小鼠在TBI后27 d和28 d中找到平台所需的时间明显低于Veh组(F=29.52,P < 0.05)。
| 组别 | 24 d | 25 d | 26 d | 27 d | 28 d |
| Veh组(n=6) | 26.583±5.802 | 29.767±3.347 | 32.800±8.145 | 35.267±6.748 | 41.116±6.467 |
| EC组(n=6) | 26.333±5.037 | 33.300±4.724 | 41.017±7.246 | 48.017±7.424a | 51.617±9.017a |
| 注:与Veh组比较,aP < 0.05 | |||||
| 组别 | 24 d | 25 d | 26 d | 27 d | 28 d |
| Veh组(n=6) | 63.917±7.027 | 57.217±13.085 | 50.133±11.039 | 44.533±7.181 | 37.567±5.974 |
| EC组(n=6) | 62.967±5.494 | 50.533±10.305 | 40.333±10.526 | 28.717±4.137a | 21.950±6.889a |
| 注:与Veh组比较,aP < 0.05 | |||||
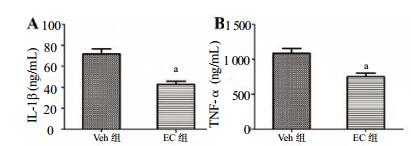
TBI后3 d检测小鼠血清中炎症因子IL-1β和TNF-α的表达情况。结果表明,与Veh组相比,EC治疗组IL-1β(图 1A)和TNF-α(图 1B)表达量[(42.690±3.057) ng/mL和(750.167±51.941) ng/mL]均明显低于Veh组[(71.670±4.996) ng/mL和(1 085.167±68.535) ng/mL],差异具有统计学意义(n=6,t=4.947和3.896,P=0.000 6和0.003)。表明TBI后EC能减轻TBI小鼠的炎症反应。
|
| 与Veh组比较,aP < 0.05 图 1 各组小鼠炎症因子的表达(n=6, Mean±SD) Fig 1 Expression of inflammatory factor in each group (n=6, Mean±SD) |
|
|
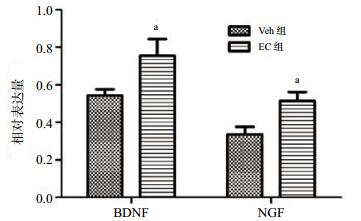
通过qRT-PCR检测TBI小鼠脑组织损伤部位神经营养因子的表达(图 2)。结果显示,与Veh组相比,TBI后通过EC治疗能增加神经营养因子BDNF(0.756±0.088 vs 0.543±0.033)和神经生长因子NGF(0.514±0.047 vs 0.334±0.041)的表达,差异有统计学意义(n=6,t=2.258和2.853,P=0.048和0.017)。EC能在小鼠TBI后增加BDNF和NGF的表达。
|
| 与Veh组比较,aP < 0.05 图 2 各组小鼠神经营养因子的表达(n=6, Mean±SD) Fig 2 Expression of neurotrophic factor in each group (n=6, Mean±SD) |
|
|
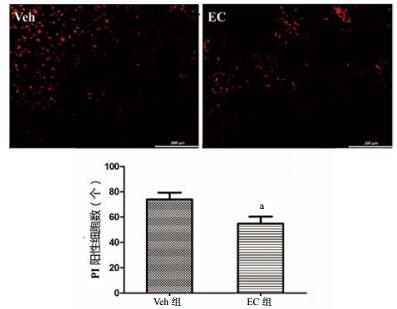
TBI及其继发性性损伤会导致细胞变性坏死,PI染色被用于检测损伤部位细胞坏死情况,计算损伤部位坏死细胞个数。结果显示,EC治疗组细胞坏死数量明显低于Veh治疗组[(54.833±5.486)个vs (74.000±5.323)个],差异有统计学意义(n=6,t=2.507,P=0.031)。见图 3。
|
| 与Veh组比较,aP < 0.05 图 3 各组损伤部位细胞坏死的表达(PI×200) Fig 3 Expression of necrotic cellsin each group (PI×200) |
|
|
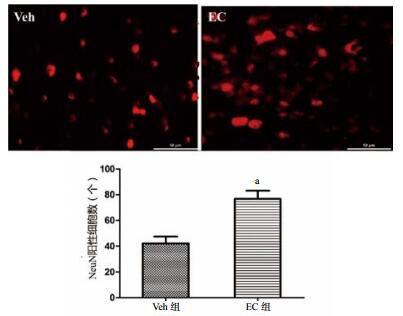
TBI后28 d,免疫荧光染色观察TBI后小鼠神经元NeuN的存活情况(图 4)。结果显示,与Veh组相比,通过EC治疗神经元的数量明显升高[(76.667±6.386)个vs (42.167±5.237)个],差异有统计学意义(n=6,t=4.177,P=0.002),EC能增加TBI后神经元的存活。
|
| 与Veh组比较,aP < 0.05 图 4 各组神经元细胞的表达(免疫荧光染色×400) Fig 4 Expression of neuron cells in each group (免疫荧光染色×400) |
|
|
TBI后3 d,小鼠注射EdU后,SGZ区神经元细胞增殖情况(图 5)。图 5A为EdU染色,DAPI染色和Merge图像。统计结果显示EC治疗组和Veh组损伤侧SGZ区EdU阳性细胞个数的比较。经EC治疗后,EC治疗组中小鼠SGZ区阳性细胞数明显多于Veh治疗组[(12.667±0.760)个vs (7.500±1.258)个],差异有统计学意义(n=6,t=2.507,P=0.031)。
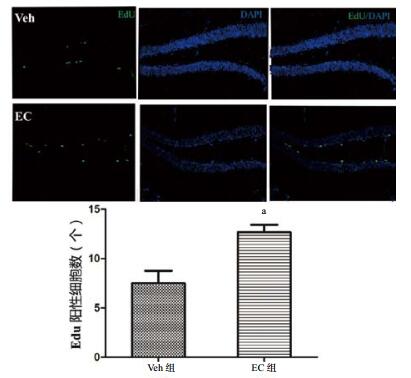
|
| 与Veh组比较,aP < 0.05 图 5 各组SGZ区细胞增殖的检测(200×) Fig 5 Detection of cell proliferation in SGZ of each group (200×) |
|
|
研究发现,红酒、茶、水果和蔬菜中含有大量的黄酮类物质可激活大脑中内源性的神经保护通路[12]。黄酮类的EC能从食物中大量获取,可以通过血脑屏障发挥作用[13]。而在此项研究中,笔者用EC治疗小鼠脑损伤。在此之前,笔者已发现EC可以增加细胞核中Nrf2蛋白的表达,激活Nrf2/ARE通路,减轻损伤部位的氧化应激以及减少有害代谢产物的积累,促进小鼠TBI后运动功能恢复。而在此项研究中发现:(1)EC可以改善脑损伤后小鼠的运动功能,空间学习和记忆能力;(2)EC减少脑损后的炎症反应,增加神经营养因子的表达;(3)EC减少损伤周围细胞坏死,增加神经元存活;(4)EC促进海马SGZ区神经元细胞增殖。
Morris水迷宫实验是一种强迫实验动物游泳,学习寻找隐藏在水中平台的实验,主要用于测试实验动物对空间定位的学习记忆能力[14]。动物的识别能力与海马和嗅周皮层等大脑区域功能有关,而空间学习记忆能力与大脑海马区、小脑和基底前脑等功能区相关[15]。由于海马区位置比较表浅,TBI后,更容易受损,同时海马是调控机体情绪和学习记忆的重要部位,因此海马受损后将会带来一系列长期并且严重的后果[16]。研究证实,脑外伤可直接损伤海马区成熟和未成熟神经元细胞,尤其在中至重度脑损伤中,大约有80%的未成熟神经元细胞缺失[17]。因此,海马区损伤后的神经再生成为近年来研究的热点[18]。在此项实验中,笔者证实,脑损伤后,EC可以改善小鼠的识别能力,空间学习记忆能力。同时也发现,应用EC可以促进NPCs的增殖。
神经营养因子是广泛分布于中枢神经系统的一类蛋白质,在脑内合成,对神经元的存活、分化和生长发育起重要作用[19],同时可改善机体的认知功能[20]。有研究指出,神经营养因子是介导海马神经细胞再生和学习记忆功能的一个重要中间变量,它直接参与并调控海马的可塑性,是影响机体学习记忆能力的重要活性因子[21-22]。脑外伤后,EC治疗可增加BDNF等多种神经营养因子表达,而BDNF的增加,可改善小鼠记忆能力,促进神经保护功能。脑损伤会导致持续性的炎症反应,炎症因子可以调节JAK/STAT和JNK等细胞信号通路,导致神经元凋亡和坏死,EC治疗能减少炎症因子,减轻炎症反应,同时减少损伤部位细胞的坏死,EC治疗后存活的神经元数量明显增多,由此证实,EC的神经保护作用,而神经元的增多也可能是因为新生神经元的产生,所以在接下来的研究中,笔者将进一步研究NPCs的分化。
笔者应用EdU标记增殖的神经元[23],结果显示,EC治疗脑外伤可增加SGZ区神经元细胞的增殖。现在的已有实验结果已证实了TBI后,EC具有神经保护功能和促进神经再生作用,可能是TBI治疗的潜在药物替代物,为TBI后的治疗奠定基础。
| [1] | Fenn AM, Gensel JC, Huang Y, et al. Immune activation promotes depression 1 month after diffuse brain injury: a role for primed microglia[J]. Biol Psychiatry, 2014, 76(7): 575-584. DOI:10.1016/j.biopsych.2013.10.014 |
| [2] | Semple BD, Noble-Haeusslein LJ, Gooyit M, et al. Early gelatinase activity is not a determinant of long-term recovery after traumatic brain injury in the immature mouse[J]. PLoS One, 2015, 10(11): e0143386. DOI:10.1371/journal.pone.0143386 |
| [3] | Yeung ST, Myczek K, Kang AP, et al. Impact of hippocampal neuronal ablation on neurogenesis and cognition in the aged brain[J]. Neuroscience, 2014, 259: 214-222. DOI:10.1016/j.neuroscience.2013.11.054 |
| [4] | Sokolov AN, Pavlova MA, Klosterhalfen S, et al. Chocolate and the brain: neurobiological impact of cocoa flavanols on cognition and behavior[J]. Neurosci Biobehav Rev, 2013, 37(10 Pt 2): 2445-2453. DOI:10.1016/j.neubiorev.2013.06.013 |
| [5] | Chang CF, Cho S, Wang J. (-)-Epicatechin protects hemorrhagic brain via synergistic Nrf2 pathways[J]. Ann Clin Transl Neurol, 2014, 1(4): 258-271. DOI:10.1002/acn3.54 |
| [6] | Bond AM, Ming GL, Song H. Adult mammalian neural stem cells and neurogenesis: five decades later[J]. Cell Stem Cell, 2015, 17(4): 385-395. DOI:10.1016/j.stem.2015.09.003 |
| [7] | Ahmed AI, Shtaya AB, Zaben MJ, et al. Endogenous GFAP-positive neural stem/progenitor cells in the postnatal mouse cortex are activated following traumatic brain injury[J]. J Neurotrauma, 2012, 29(5): 828-842. DOI:10.1089/neu.2011.1923 |
| [8] | Wu MV, Hen R. The young and the restless: regulation of adult neurogenesis by Wnt signaling[J]. Cell Stem Cell, 2013, 12(2): 139-140. DOI:10.1016/j.stem.2013.01.013 |
| [9] | Xuan W, Vatansever F, Huang L, et al. Transcranial low-level laser therapy enhances learning, memory, and neuroprogenitor cells after traumatic brain injury in mice[J]. J Biomed Opt, 2014, 19(10): 108003. DOI:10.1117/1.JBO.19.10.108003 |
| [10] | Newbold A, Martin BP, Cullinane C, et al. Detection of apoptotic cells using propidium iodide staining[J]. Cold Spring Harb Protoc, 2014, 2014(11): 1202-1206. DOI:10.1101/pdb.prot082545 |
| [11] | Pillat MM, Cheffer A, de Andrade CM, et al. Bradykinin-induced inhibition of proliferation rate during neurosphere differentiation: consequence or cause of neuronal enrichment?[J]. Cytometry A, 2015, 87(10): 929-935. DOI:10.1002/cyto.a.22705 |
| [12] | Nehlig A. The neuroprotective effects of cocoa flavanol and its influence on cognitive performance[J]. Br J Clin Pharmacol, 2013, 75(3): 716-727. DOI:10.1111/j.1365-2125.2012.04378.x |
| [13] | Neveu V, Perez-Jimenez J, Vos F, et al. Phenol-Explorer: an online comprehensive database on polyphenol contents in foods[J]. Database (Oxford), 2010(Oxford): 2010;2010:bap024. DOI:10.1093/database/bap024 |
| [14] | Eakin K, Baratz-Goldstein R, Pick CG, et al. Efficacy of N-acetyl cysteine in traumatic brain injury[J]. PLoS One, 2014, 9(4): e90617. DOI:10.1371/journal.pone.0090617 |
| [15] | Zhang Y, Chopp M, Meng Y, et al. Effect of exosomes derived from multipluripotent mesenchymal stromal cells on functional recovery and neurovascular plasticity in rats after traumatic brain injury[J]. J Neurosurg, 2015, 122(4): 856-867. DOI:10.3171/2014.11.JNS14770 |
| [16] | Arumugam SK, Mudali I, Strandvik G, et al. Risk factors for ventilator-associated pneumonia in trauma patients: A descriptive analysis[J]. World J Emerg Med, 2018, 9(3): 203-210. DOI:10.5847/wjem.j.1920-8642.2018.03.007 |
| [17] | Zhao Y, Gibb SL, Zhao J, et al. Wnt3a, a protein secreted by mesenchymal stem cells is neuroprotective and promotes neurocognitive recovery following traumatic brain injury[J]. Stem Cells, 2016, 34(5): 1263-1272. DOI:10.1002/stem.2310 |
| [18] | Taylor V. Hippocampal stem cells: so they are multipotent![J]. J Mol Cell Biol, 2011, 3(5): 270-272. DOI:10.1093/jmcb/mjr022 |
| [19] | Lu B, Nagappan G, Lu Y. BDNF and synaptic plasticity, cognitive function, and dysfunction[J]. Handb Exp Pharmacol, 2014, 220: 223-250. DOI:10.1007/978-3-642-45106-5_9 |
| [20] | Shen X, Li A, Zhang Y, et al. The effect of different intensities of treadmill exercise on cognitive function deficit following a severe controlled cortical impact in rats[J]. Int J Mol Sci, 2013, 14(11): 21598-21612. DOI:10.3390/ijms141121598 |
| [21] | Xu Q, Ji XF, Chi TY, et al. Sigma 1 receptor activation regulates brain-derived neurotrophic factor through NR2A-CaMKIV-TORC1 pathway to rescue the impairment of learning and memory induced by brain ischaemia/reperfusion[J]. Psychopharmacology (Berl), 2015, 232(10): 1779-1791. DOI:10.1007/s00213-014-3809-6 |
| [22] | Chen L, Gao X, Zhao S, et al. The small-molecule TrkB agonist 7, 8-Dihydroxyflavone decreases hippocampal newborn neuron death after traumatic brain injury[J]. J Neuropathol Exp Neurol, 2015, 74(6): 557-567. DOI:10.1097/NEN.0000000000000199 |
| [23] | Salic A, Mitchison TJ. A chemical method for fast and sensitive detection of DNA synthesis in vivo[J]. Proc Natl Acad Sci U S A, 2008, 105(7): 2415-2420. DOI:10.1073/pnas.0712168105 |
 2019, Vol. 28
2019, Vol. 28




